Неорганические материалы, 2020, T. 56, № 1, стр. 59-64
Влияние механической активации на взаимодействие бемита с карбонатом лития
В. П. Исупов 1, *, И. А. Бородулина 1, К. Б. Герасимов 1, Н. В. Булина 1
1 Институт химии твердого тела и механохимии СО Российской академии наук
630128 Новосибирск, ул. Кутателадзе, 18, Россия
* E-mail: isupov@solid.nsc.ru
Поступила в редакцию 11.12.2018
После доработки 08.05.2019
Принята к публикации 06.06.2019
Аннотация
Исследовано влияние механической активации смеси бемита и карбоната лития в планетарном активаторе АГО-2 на фазовые превращения, протекающие при термической обработке на воздухе. Показано, что при термической обработке исходной смеси бемита и карбоната лития в качестве промежуточной фазы образуется γ-Al2O3, реагирующий с карбонатом лития с образованием α-LiAlO2. При термической обработке активированной смеси, наряду с гамма-оксидом алюминия, образуется неизвестная промежуточная фаза, предположительно метастабильный алюминат лития, при температуре выше 500°С переходящий в α-LiAlO2. Предложен возможный механизм образования этой фазы, связанный с обменом протонов водорода в бемите на катионы лития, с последующим выделением воды и диоксида углерода.
ВВЕДЕНИЕ
Высокодисперсные моноалюминаты лития (α-LiAlO2, γ-LiAlO2) применяются для получения материалов матричного электролита карбонатрасплавленных топливных элементов [1, 2], производства трития [3], модифицирования свойств литийсодержащих электролитов [4], получения керамических мембран [5], а также в тепловых литиевых батареях.
Среди существующих методов синтеза этих соединений интерес представляет механохимический метод, основанный на термической обработке предварительно активированной смеси гиббсита и карбоната лития. В работах [6–8] было исследовано влияние условий механической обработки (тип активатора, режимы активации) смеси гиббсита и карбоната лития и последующей термической обработки (температура, время процесса, состав газовой фазы) смеси на фазовые превращения, протекающие при образовании алюминатов лития. На основании полученных данных были определены условия проведения механохимического синтеза, позволяющие получать из гиббсита и карбоната лития однофазные моноалюминаты лития (α-LiAlO2, γ-LiAlO2) с высокой удельной поверхностью для матричных электролитов топливных элементов.
Несмотря на привлекательность применения гиббсита в качестве алюмосодержащего реагента для синтеза алюминатов лития, у него есть существенный недостаток, связанный с наличием значительной примеси Na2O, содержание которого может достигать 0.5%. Поэтому представляет интерес исследование возможности применения для механохимического синтеза алюминатов лития бемита, который может быть получен при гидротермальной обработке гиббсита и обладает более высокой чистотой по натрию.
Исследования по синтезу алюминатов лития из бемита и карбоната лития ограничены работой [9], в которой отмечается, что нагревание смеси кристаллического бемита и карбоната лития при 600°С в течение 30 ч приводит к образованию α-LiAlO2 с удельной поверхностью около 5 м2/г. Влияние механической активации на взаимодействие бемита и карбоната лития ранее не изучалось.
Целью настоящей работы явилось исследование процессов, протекающих при механохимическом синтезе моноалюминатов лития из бемита и карбоната лития.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали бемит, синтезированный при гидротермальной обработке гиббсита квалификации “ч. д. а.” в стальном автоклаве с тефлоновыми вкладышами при 200°С в течение 6 ч, а также карбонат лития “х. ч.”. Согласно данным рентгенофазового анализа, полученный образец представляет собой хорошо окристаллизованный бемит с параметрами: a = 2.8675(1) Å, b = = 12.2199(6) Å, c = 3.6983(1) Å и размерами кристаллитов около 200 нм.
Механическую обработку смеси бемита и карбоната лития, взятых в соотношении, необходимом для синтеза моноалюмината лития, осуществляли на воздухе в планетарной центробежной мельнице АГО-2 в стальных барабанах объемом 100 мл при ускорении 40 g в интервале времени от 1 до 10 мин. Для активации использовали стальные шары с диаметром 5 мм, отношение массы вещества к массе шаровой загрузки составляло 1 : 20, масса шаровой загрузки – 200 г масса образца – 10 г.
Для определения количества примеси железа, образующегося за счет натира со стенок барабанов и шаров, использовали метод атомной адсорбционной спектрометрии.
Для фазового анализа механически активированных образцов смеси применяли дифрактометр D8 Advance (CuKα-излучение), диапазон съемки 2θ = 10°–70° с шагом 0.02° и временем накопления 35 с. Степень аморфизации (A) компонентов смеси после механической активации была рассчитана по выражению A (%) = {(So – St)/So} × × 100%, где St – интегральная интенсивность рефлексов бемита 021 или карбоната лития 110 после активации, So – интенсивность рефлексов для исходной смеси.
Для высокотемпературных in situ исследований применяли дифрактометр D8 Advance, нагрев образца осуществляли в камере HTK 1200N (Anton Paar, Австрия) в корундовой кювете на воздухе ступенчато, скорость нагрева составляла 12°С/мин. При достижении 100, 200, 300, 400, 500, 600, 700, 800, 900°С нагрев прекращали и проводили регистрацию рентгенограмм. Для полуколичественного описания изменения фазового состава в процессе нагрева измеряли интегральную интенсивность рефлексов бемита 020, карбоната лития 110, а также образующихся при взаимодействии продуктов, включая α-LiAlO2 003 и γ-LiAlO2 101. Так как наиболее интенсивные рефлексы γ‑Al2O3, образующегося при разложении бемита, перекрываются с рефлексами α-LiAlO2 и карбоната лития, то измерение их интегральной интенсивности не проводили. Эксперименты по термическому анализу были выполнены на приборе синхронного термического анализа STA 449 F1 Jupiter, сопряженном с квадрупольным масс-спектрометром QMS 403C Aeolos для анализа выделяющихся продуктов. Расчет степени газовыделения воды и диоксида углерода из данных ТГ и масс-спектрометрии проводили по методике, изложенной в [10].
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
Механическая активация смеси приводит к уширению рефлексов бемита и карбоната лития и уменьшению их интегральной интенсивности, что свидетельствует об уменьшении размера кристаллитов и увеличении микродеформаций, а также об аморфизации бемита и карбоната лития (рис. 1). Рефлексы новых фаз не обнаружены. Величина примеси железа при 5-минутной активации смеси составляет 0.04% при 0.003%-ном содержании в исходной смеси.
Рис. 1.
Рентгенограммы исходной смеси бемита и карбоната лития (1) и продуктов ее активации при 1 (2), 5 (3), 10 мин (4): B – AlO(OH), C – Li2CO3 (а); зависимости степени аморфизации бемита (1) и карбоната лития (2) от времени механической обработки (б).

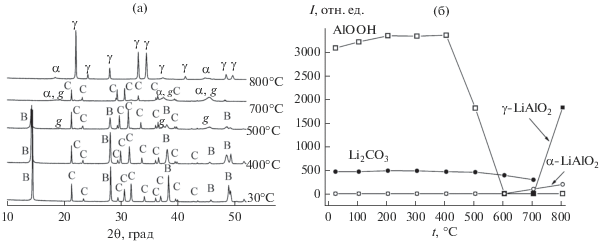
При нагревании смеси бемита и карбоната лития на воздухе при температуре выше 400°С происходит разложение бемита и образование γ-Al2O3. Об этом свидетельствуют уменьшение интегральных интенсивностей пиков бемита, практически исчезающих при нагревании до 600°С, и появление уширенных рефлексов γ-Al2O3, расположенных при 2θ = 37.6°, 45.5°, 66.6°, при сохранении интегральной интенсивности рефлексов карбоната лития (рис. 2). При температуре выше 600°С карбонат лития взаимодействует с γ-Al2O3 с образованием α-LiAlO2. На это указывает уменьшение интегральной интенсивности рефлексов карбоната лития, а также появление уширенных рефлексов α-LiAlO2 при 2θ = 18.7°, 37.4°, 45.4°, 66.3°, часть которых (37.4°, 45.4°, 66.3°) перекрывается с уширенными рефлексами γ-Al2O3. При дальнейшем нагревании до 800°С и далее до 900°С на рентгенограмме наряду со слабыми рефлексами α-LiAlO2 фиксируются интенсивные рефлексы γ-LiAlO2.
Рис. 2.
РФА in situ исходной смеси бемита и карбоната лития: B – AlO(OH), C – Li2CO3, g – γ-Al2O3, α – α-LiAlO2, γ – γ-LiAlO2 (а); зависимости интегральной интенсивности рефлексов фаз, образующихся при термической обработке смеси карбоната лития и бемита, от температуры термической обработки (б).
При нагревании смеси, активированной в течение 1 мин, до 300°С наблюдается появление рефлексов новой фазы (Х-фазы) (2θ = 14.7°, 27.4°, 44.1°, 47.1°, 61.7°, 66.3°), которые нельзя отнести к известным оксидам алюминия и алюминатам лития.
Увеличение температуры до 400°С и далее до 500°С приводит к увеличению интенсивности рефлексов Х-фазы при одновременном уменьшении интенсивности рефлексов бемита и карбоната лития. Наряду с этим нагрев до 500°С сопровождается появлением рефлексов γ-Al2O3 (2θ = = 19.2°, 31.7°, 37.4°, 45.4°). Повышение температуры до 600°С приводит к практически полному исчезновению рефлексов бемита и уменьшению интегральной интенсивности линий карбоната лития. Дальнейшее увеличение температуры до 700°С приводит к увеличению интенсивности рефлексов при 2θ = 18.7°, 37.4°, 45.1°, относящихся к α-LiAlO2, а также к снижению интенсивности рефлексов Х-фазы. Наконец, повышение температуры до 800°С приводит к резкому возрастанию интенсивности рефлексов γ-LiAlO2. При 900°С регистрируются только рефлексы γ-LiAlO2 (рис. 3).
Рис. 3.
РФА in situ смеси бемита и карбоната лития, активированной в течение 1 мин, на воздухе: B – AlO(OH), C – Li2CO3, g – γ- Al2O3, α – α-LiAlO2, γ – γ-LiAlO2, * – Х-фаза.
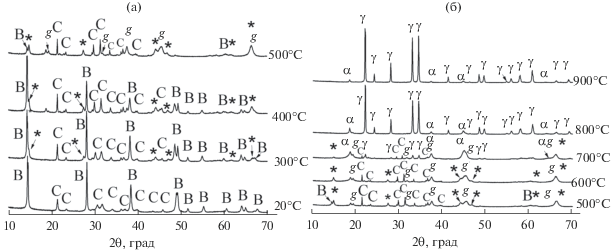
Увеличение времени активации до 5 мин и далее до 10 мин качественно не влияет на картину фазовых превращений. Однако интенсивность рефлексов Х-фазы (ее максимальное содержание наблюдается при 500°С) существенно больше (рис. 4, 5).
Рис. 4.
РФА in situ смеси бемита и карбоната лития, активированной в течение 10 мин, на воздухе: B – AlO(OH), C – Li2CO3, g – γ-Al2O3, α – α-LiAlO2, γ – γ-LiAlO2, * – Х-фаза.
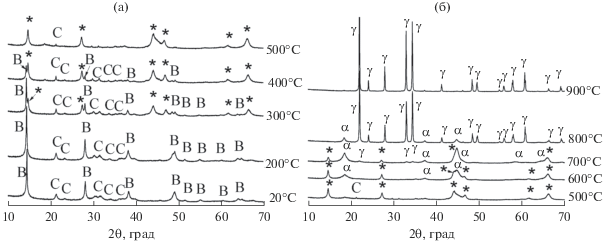
Рис. 5.
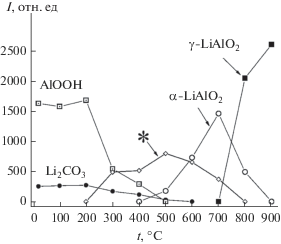
Зависимости интегральной интенсивности рефлексов фаз, образующихся при термической обработке механически активированной смеси карбоната лития и бемита, от температуры термической обработки: время механической активации 10 мин; * – Х‑фаза (2θ = 14.7°).
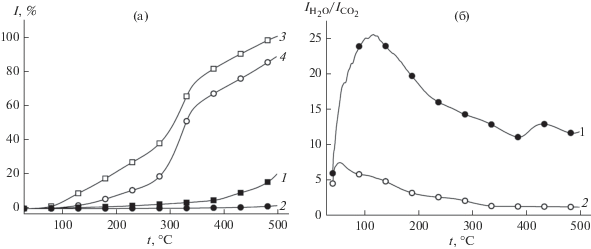
Для выяснения природы процессов, происходящих при термической обработке механически активированной смеси бемита и карбоната лития, были исследованы процессы газовыделения воды и диоксида углерода в интервале температур образования Х-фазы. Для исследования были взяты образцы, полученные при десятиминутной активации смеси бемита и карбоната лития. Как видно из сравнения кривых газовыделения (рис. 6а), механическая активация в течение 10 мин приводит к существенному возрастанию степени газовыделения воды и диоксида углерода по сравнению с неактивированной смесью, причем нагревание до 500°С приводит к практически полному удалению воды, а также к существенному разложению карбоната лития. При температурах выше 300°С наблюдается симбатная зависимость степени газовыделения воды и диоксида углерода от температуры (рис. 6а). Отношение ионного тока выделяющейся воды к ионному току диоксида углерода при температуре начала формирования Х-фазы (300°С) близко к 1 (рис. 6б). Учитывая, что отношение сечений ионизации воды к диоксиду углерода достаточно близко к 1 [11–13], можно предположить, что и мольное отношение выделяющейся воды к диоксиду углерода также достаточно близко к 1.
Рис. 6.
Кривые газовыделения воды (1, 3) и диоксида углерода (2, 4) для исходной (1, 2) и механически активированной в течение 10 мин смеси бемита и карбоната лития (3, 4) (а); зависимости отношения ионного тока воды $({{I}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}})$ к ионному току диоксида углерода $({{I}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}})$ от температуры термической обработки для исходной (1) и механически активированной в течение 10 мин смеси бемита и карбоната лития (2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют о том, что процессы, происходящие при нагревании неактивированной смеси бемита и карбоната лития на воздухе, могут быть описаны следующими реакциями (1)–(3)
(1)
$\begin{gathered} {\text{AlO}}\left( {{\text{OH}}} \right) + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}\xrightarrow{{t > 400^\circ {\text{C}}}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow ~ + \\ + \,\,\gamma {\text{ - A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}, \\ \end{gathered} $(2)
$\begin{gathered} \gamma {\text{ - A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}{\text{ }}\xrightarrow{{t > 600^\circ {\text{C}}}} \\ \alpha {\text{ - }}\,{\text{LiAl}}{{{\text{O}}}_{{\text{2}}}} + {\text{C}}{{{\text{O}}}_{{\text{2}}}}{\kern 1pt} \uparrow , \\ \end{gathered} $(3)
$~\alpha {\text{ - LiAl}}{{{\text{O}}}_{{\text{2}}}}\xrightarrow{{t > 700^\circ {\text{C}}}}\gamma {\text{ - LiAl}}{{{\text{O}}}_{{\text{2}}}}.$Для механически активированных образцов наряду с процессами, описываемыми реакциями (1)–(3), при температурах выше 300оС наблюдается образование фазы Х, интенсивность рефлексов которой возрастает при увеличении времени активации бемита. Близость положения рефлексов Х-фазы (2θ = 14.7°, 27.4°) к рефлексам 020, 021 бемита (2θ = 14.3°, 28.1°), позволяет предположить, что при образовании этой фазы происходит наследование фрагментов структуры бемита, в том числе его слоистый характер. Так как при формировании Х-фазы мольное отношение выделяющейся воды к диоксиду углерода близко к 1, то можно предположить, что образование этой фазы происходит за счет взаимодействия бемита и карбоната лития по реакции
(4)
${\text{AlO(OH)}} + {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} \to Х{\text{ - фаза}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow + \,{\text{C}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow .$Механическая активация приводит к увеличению дисперсности и дефектности бемита, что, по-видимому, и ускоряет процесс его взаимодействия с карбонатом лития при нагревании активированной смеси.
Один из возможных путей образования Х-фазы может быть связан с катионным обменом протонов водорода бемита на катионы лития по реакции
(5)
${\text{AlO}}\left( {{\text{OH}}} \right) + {\text{L}}{{{\text{i}}}^{ + }} \to {\text{AlO}}\left( {{\text{OLi}}} \right) + {{{\text{H}}}^{ + }}.$Образующиеся ионы водорода реагируют с карбонат-ионами с последующим выделением воды и диоксида углерода.
Таким образом, Х-фаза может представлять собой метастабильный алюминат лития со слоистой структурой, который при температуре выше 500°С превращается в α-LiAlO2.
ЗАКЛЮЧЕНИЕ
Термическая обработка смеси бемита и карбоната лития на воздухе приводит к разложению бемита и появлению γ-Al2O3, реагирующего с карбонатом лития с образованием α-LiAlO2. Термическая обработка смеси, механически активированной в планетарном активаторе при центробежном ускорении 40 g, на воздухе при температуре выше 300°С приводит к появлению промежуточного метастабильного алюмината лития, образующегося, предположительно, за счет обмена протонов бемита на катионы лития с последующим взаимодействием этих протонов с карбонат-ионами и образованием воды и диоксида углерода. При температуре выше 500оС метастабильный алюминат лития превращается в α-LiAlO2, который при температуре выше 700°С переходит в γ-LiAlO2.
Список литературы
Molten Carbonate Fuel Cells // Fuel Cell Handbook. 7-th Ed. Morgantown, 2004.
Choi H.J., Lee J.J., Hyun S.H., Lim H.C. Fabrication and Performance Evaluation of Electrolyte-Combined α-LiAlO2 Matrices for Molten Carbonate Fuel Cells // Int. J. Hydrogen Energy. 2011. V. 36. P. 11048–11055. https://doi.org/10.1016/j.ijhydene.2011.05.184
Carrera L.M., Jiménez-Becerril J., Basurto R., Arenas J., López M.B.E., Bulbulian S., Bosch P. Tritium Recovery from Nanostructured LiAlO2 // J. Nucl. Mater. 2001. V. 299. № 3. P. 242–249. https://doi.org/10.1016/S0022-3115(01)00693-6
Morita M., Fujisaki T., Yoshimoto N., Ishikawa M. Ionic Conductance Behavior of Polymeric Composite Solid Electrolytes Containing Lithium Aluminate // Electrochim. Acta. 2001. V. 46. № 10–11. P. 1565–1569. https://doi.org/10.1016/S0013-4686(00)00754-4
Raja M., Sanjeev G., Kumar T.P., Stephan A.M. Lithium Aluminate-Based Ceramic Membranes as Separators for Lithium-Ion Batteries // Ceram. Int. 2015. V. 41. № 2. Part B. P. 3045–3050. https://doi.org/10.1016/j.ceramint.2014.10.142
Исупов В.П., Трухина Я.Е., Еремина Н.В., Булина Н.В., Бородулина И.А. Механохимический синтез высокодисперсного γ-LiAlO2 // Неорган. материалы. 2016. Т. 52. № 11. С. 1262–1270. https://doi.org/10.7868/S0002337X1611004X
Исупов В.П., Булина Н.В., Бородулина И.А. Влияние реакционной среды на механохимический синтез LiAlO2 // Неорган. материалы. 2018. Т. 54. № 2. С. 115–123. https://doi.org/10.7868/S0002337X18020070
Татаринова Я.Е., Исупов В.П. Исследование влияния состава и влажности шихты на величину удельной поверхности и фазовый состав гамма-моноалюмината лития, образующегося при механохимическом синтезе из карбоната лития и гидроксида алюминия // Химия в интересах устойчивого развития. 2014. № 22. С. 71–75.
Poeppelmeier K.R., Chiang C.K., Kipp D.O. Synthesis of High Surface Area α-LiAlO2 // Inorg. Chem. 1988. V. 27(25). P. 4523–4524. https://doi.org/10.1021/ic00298a002
Исупов В.П., Герасимов К.Б., Бородулина И.А., Трухина Я.Е. Исследование низкотемпературных стадий механохимического синтеза гамма-моноалюмината лития // Неорган. материалы. 2017. Т. 53. № 1. С. 54–58. https://doi.org/10.7868/S0002337X17010080
Orient O.J., Srivastava S.K. Electron Impact Ionisation of H, O, CO, CO, and CH // J. Phys. B: At. Mol. Phys. 1987. V. 20. P. 3923–3936.
Freund R.S., Wetzel R.C. Measurements of Electron-Impact-Ionization Cross Sections of N2, CO, CO2, CS, S2, CS2, and Metastable N2 // Phys. Rev. A. 1990. V. 41. № 11. P. 5861–5868.
Djurić N.Lj., Čadež I.M., Kurepa M.V. H2O and D2O Total Ionizations Cross-Sections by Electron Impact // Int. J. Mass. Spectrometry. 1988. V. 83. P. R7–R10.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


