Неорганические материалы, 2020, T. 56, № 1, стр. 37-43
Восстановление кислородных соединений металлов V и VI групп парами кальция
В. Н. Колосов 1, *, В. М. Орлов 1, М. Н. Мирошниченко 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева ФИЦ КНЦ
Российской академии наук
184209 Мурманская обл., Апатиты, Академгородок, 26а, Россия
* E-mail: tantal@chemy.kolasc.net.ru
Поступила в редакцию 09.01.2019
После доработки 23.04.2019
Принята к публикации 06.06.2019
Аннотация
Исследован процесс восстановления кислородных соединений металлов V и VI групп (Ta2O5, Nb2O5, WO3, MoO3, MgWO4, MgMoO4 и CaMoO4) парами кальция. Реакции осуществляли при температуре 800–860°С и остаточном давлении аргона 5–10 кПа. После восстановления соединений V группы продукты представляли собой однородную смесь, соответствующую стехиометрической по реакции. После восстановления соединений VI группы в аналогичных условиях имело место пространственное разделение продуктов, заключающееся в том, что основная масса оксида металла-восстановителя находилась вне реакционной зоны. При восстановлении MgWO4 и MgMoO4 на начальном этапе происходит замещение магния кальцием. Оксид магния одновременно с оксидом кальция образует слой на поверхности реакционной массы. Анализ результатов свидетельствует о том, что процесс восстановления оксидных соединений VI группы парами кальция, вероятно, протекает по механизму электронно-опосредованной реакции.
ВВЕДЕНИЕ
Тугоплавкие металлы V и VI групп широко используются в технике. Одним из способов их получения является металлотермическое восстановление оксидных соединений [1–7]. Вследствие высокой температуры плавления металлов продуктом восстановления обычно является порошок металла. Значительное увеличение удельной поверхности порошков может быть достигнуто при восстановлении парами магния двойных оксидов металлов V и VI групп типа Mg4Ta2O9, Mg4Nb2O9, Ca3WO6, MgWO4, MgMoO4 и CaMoO4 [6–9]. По данным авторов работы [10], изучавших строение восстановленной частицы пентаоксида тантала, пары магния проникают внутрь частицы оксида по микротрещинам. Восстановление происходит в объеме частицы, продукт восстановления представляет собой чередование прослоек MgO и образовавшихся частиц металла. После выщелачивания MgO растворами минеральных кислот отмытый порошок металла характеризуется мезопористой структурой. Наличие в составе двойного оксида MgO или СаО увеличивает количество прослоек. Возрастает число пор и, соответственно, увеличивается удельная поверхность порошков.
Несмотря на общий механизм образования порошка металла, при восстановлении парами магния в некоторых случаях наблюдалось существенное различие в составе продуктов реакции металлов V и VI групп. После восстановления оксидных соединений тантала и ниобия продукты реакции представляли собой однородную смесь металла и оксида металла восстановителя, соответствующую стехиометрическому соотношению [6–8]. В то же время, после восстановления в определенных условиях некоторых оксидных соединений вольфрама и молибдена (WO3, MgWO4, MoO3, MgMoO4 и CaMoO4) имело место пространственное разделение металлической и оксидной фаз [11, 12]. При остаточном давлении аргона в реакторе 5–10 кПа продукты восстановления были разделены на несколько слоев.
После восстановления WO3 и MoO3 нижний слой представлял собой порошок вольфрама или молибдена. На его поверхности и на стенках тиглей находились плотные отложения чистого оксида магния. После восстановления двойных оксидов отложения оксида магния вне зоны реакции также наблюдались. Однако при использовании в качестве прекурсора MgWO4 и MgMoO4 в нижнем слое был порошок вольфрама или молибдена с примесью MgO, а CaMoO4 – порошок Mo с примесью CaO. Такое разделение продуктов реакции при восстановлении оксидных соединений тугоплавких металлов парами щелочноземельного металла в литературе не описано. Это явление тем более странно, что оксид магния, образующийся в процессе восстановления, не только характеризуется высокой температурой плавления и низкой упругостью паров (10–8 Па при температуре 1000°С), но и находится внутри восстанавливаемой частицы оксида в виде тонких прослоек между частицами металла [10]. Можно предположить, что процесс восстановления в данном случае протекает без непосредственного физического контакта реагирующих веществ – посредством переноса электронов. Возможность протекания реакций по такому механизму применительно к восстановлению в расплаве показана в работах [13–15]. Авторы называют их “электронно-опосредованными реакциями” (ЭОР).
Одним из подтверждений того, что восстановление оксидных соединений вольфрама и молибдена в определенных условиях протекает по механизму ЭОР, может быть аналогичное явление при использовании другого восстановителя в парообразном состоянии, например кальция. В этом случае верхний слой продуктов реакции и отложения на стенках тигля должны представлять собой оксид кальция.
Цель настоящей работы – исследование восстановления кислородных соединений тантала, ниобия, вольфрама и молибдена парами кальция.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве прекурсоров для восстановления использовали Ta2O5 и Nb2O5 (производство ОАО “Соликамский магниевый завод” по ТУ 1764-027-00545484-2000), WO3 (“ч.”), MoO3 (“ч.”), а также молибдаты и вольфраматы состава MgMoO4, CaMoO4, MgWO4. Последние синтезировали методом спекания CaCO3 (“ч. д. а.”) или MgO (“ч. д. а.”) с MoO3 (“ч.”) или WO3 (“ч.”) [16]. Процесс вели в атмосфере паров кальция и аргона (“ВЧ”) на установке, подробно описанной в [11].
Емкость с кальцием (ТУ 083.5.290-92 производства АО “ЧМЗ”) помещали на дно реакционного стакана. Навески кислородных соединений загружали в металлические тигли, которые устанавливали в контейнер над емкостью с кальцием. Над тиглями находился экран, расстояние от которого до поверхности прекурсора составляло 27–30 мм. Реакционный стакан закрывали крышкой с отверстием для ввода термопары. Сборку помещали в реторту-реактор из нержавеющей стали, которую герметизировали, вакуумировали, заполняли аргоном и нагревали до требуемой температуры при закрытой крышке реакционного стакана, чтобы избежать потери кальция. При температуре 800–860°С реактор вакуумировали до остаточного давления аргона 5–10 кПа и в этих условиях вели восстановление в течение 5 ч. Продукты восстановления обрабатывали 10%-ным раствором соляной кислоты (“х. ч.”) для удаления MgO и CaO. Порошки металлов отмывали дистиллированной водой до нейтральной реакции и сушили на воздухе при температуре 80°С.
Рентгенофазовый анализ (РФА) проводили на рентгеновском дифрактометре Shimadzu XRD-6000 (CuKα-излучение). Удельную поверхность и пористость порошков измеряли соответственно методами БЭТ и BJH на приборе TriStar II 3020 V1.03.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Особенностью взаимодействия оксидных соединений тугоплавких металлов V и VI групп со щелочноземельными металлами (Mg и Ca) является высокий тепловой эффект реакций. Так, при осуществлении взаимодействия Ta2O5, Nb2O5, MoO3 и WO3 с магнием в режиме самораспространяющегося высокотемпературного синтеза температура в зоне горения достигает 1900–2700°С [1–3]. Восстановление парами магния ограничивает скорость подачи восстановителя в зону реакции и позволяет вести процесс при температуре 700–900°С [6–9].
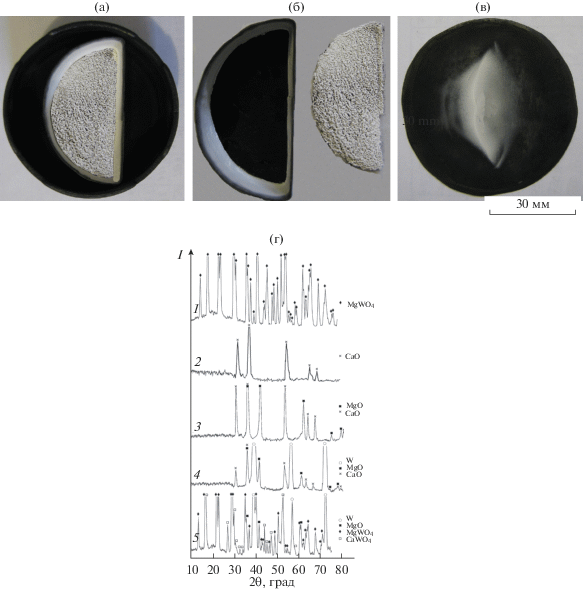
На рис. 1 представлен вид поверхности тиглей до (рис. 1а) и после восстановления (рис. 1б) парами кальция оксидов ниобия, тантала, молибдена и вольфрама. Видно, что после восстановления Ta2O5 и Nb2O5 поверхность реакционной массы темная, в то время как после восстановления WO3 и MoO3 поверхность более светлая, чем исходная (рис. 1б). На поверхности экрана, обращенной к прекурсору, появляются отложения белого цвета (рис. 1в). По данным РФА, слои на поверхности продуктов реакции после восстановления WO3 и MoO3, а также отложения белого цвета на экране идентичны и представляют собой оксид кальция (рис. 1ж, дифрактограмма 1). Отложения CaO на экране связаны с восстановлением оксидов WO3 и MoO3, поскольку после восстановления оксидов Ta2O5 и Nb2O5 на поверхности экрана отложения отсутствуют (рис. 1г–1е). Согласно данным РФА, реакционная масса под слоем CaO после восстановления WO3 и MoO3 представляла собой практически не содержащий оксида восстановителя порошок соответственно вольфрама и молибдена (рис. 1ж, дифрактограммы 2 и 3).
Рис. 1.
Вид тиглей с оксидами металлов V и VI групп до (а, г) и после (б, д) восстановления и соответствующих им экранов (в, е); дифрактограммы белого вещества с экрана (1), продуктов реакций под белыми корками после восстановления WO3 (2) и MoO3 (3) и реакционной массы после восстановления Nb2O5 (4) и Ta2O5 (5) (ж) (температура 800°C, остаточное давление 5 кПа, выдержка 5 ч).

Восстановление MoO3 протекает в две стадии. Сначала образуется диоксид молибдена:
(1)
$\begin{gathered} {\text{Mo}}{{{\text{O}}}_{3}} + {\text{Ca}} = {\text{Mo}}{{{\text{O}}}_{2}} + {\text{CaO}}, \\ \Delta Н_{{298}}^{0} = --436\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Затем он восстанавливается до металла:
(2)
$\begin{gathered} {\text{Mo}}{{{\text{O}}}_{2}} + 2{\text{Ca}} = {\text{Mo}} + 2{\text{CaO}}, \\ \Delta Н_{{298}}^{0} = --724\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Такой механизм подтверждается данными РФА продуктов после восстановления в течение 1 ч. Реакция (1) протекает при температуре 550–650°C в процессе нагрева реактора [17]. Упругость паров МоО2 значительно ниже, чем МоО3 [18]. Формирующийся на поверхности частиц оксида слой МоО2 препятствует испарению MoO3 при дальнейшем повышении температуры.
После восстановления Ta2O5 и Nb2O5 реакционная масса представляла собой однородный порошок, содержащий Ta и CaO или Nb и CaO в массовом отношении металла к оксиду, соответствующем стехиометрии (рис. 1ж, дифрактограммы 4 и 5). Поскольку при восстановлении парами кальция оксидов тантала и ниобия, как и при восстановлении парами магния [6–8], разделения металлической и оксидной фаз не наблюдалось, в дальнейшем исследовали только восстановление сложных оксидов металлов VI группы.
После восстановления CaMoO4 на части поверхности экрана, располагавшегося над ним, на стенках тигля и на поверхности реакционной массы наблюдались отложения белого вещества, которое представляет собой чистый оксид кальция (рис. 2в, дифрактограмма 1). Под слоем CaO в тигле находится порошок молибдена, содержащий CaO в соотношении, соответствующем его содержанию в исходном соединении (рис. 2в, дифрактограмма 2).
Рис. 2.
Вид тигля после восстановления CaMoO4 (а) и его экрана (б); дифрактограммы исходного соединения и продуктов восстановления (в) (температура 860°C, остаточное давление 5 кПа).
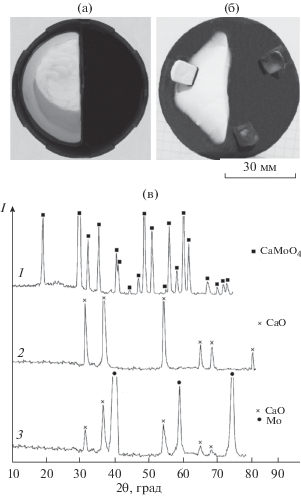
Вид тиглей после восстановления MgMoO4 и MgWO4 приведен на рис. 3а и рис. 4а. На поверхности продуктов реакции, на стенках тигля выше уровня загрузки и на поверхности экрана отчетливо видны слои вещества белого цвета. Согласно данным РФА, отложения на внутренних стенках тиглей и на поверхностях экранов представляют собой оксид кальция. Слои на поверхности продуктов реакции восстановления MgMoO4 и MgWO4 по составу отличались от образующихся при восстановлении этих соединений парами магния. Они представляли собой смесь CaO и MgO примерно в равном массовом отношении (дифрактограммы 3 на рис. 3в и 4г). Под поверхностным слоем оксида был однородный порошок молибдена или вольфрама, содержащий CaO и MgO (дифрактограммы 4 на рис 3в и 4г). Наличие значительного количества оксида магния в корке на поверхности реакционной массы, по-видимому, обусловлено тем, что на начальном этапе взаимодействия MgMoO4 и MgWO4 с парами кальция протекают реакции обмена:
(3)
$\begin{gathered} {\text{MgMo}}{{{\text{O}}}_{4}} + {\text{Ca}} = {\text{CaMo}}{{{\text{O}}}_{4}} + {\text{Mg}}, \\ \Delta Н_{{298}}^{0} = - 140.6\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $(4)
$\begin{gathered} {\text{MgW}}{{{\text{O}}}_{4}} + {\text{Ca}} = {\text{CaW}}{{{\text{O}}}_{4}} + {\text{Mg}}, \\ \Delta Н_{{298}}^{0} = - 113.0\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Рис. 3.
Вид тигля после восстановления MgMoO4 (а) и его экрана (б); дифрактограммы MgMoO4 и продуктов его восстановления (в) (температура 860°C, остаточное давление 10 кПа), выдержка: 5 (2–4), 1 ч (5).
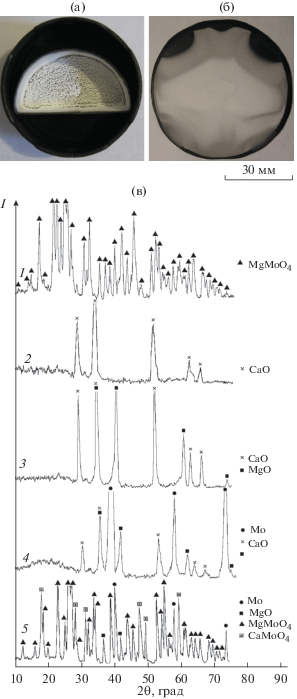
Рис. 4.
Вид тигля после восстановления MgWO4 (а), после удаления корки с поверхности (б) и его экрана (в); дифрактограммы MgWO4 и продуктов его восстановления (г) (температура 860°C, остаточное давление 5 кПа), выдержка: 5 (2–4), 1 ч (5).
Это подтверждается данными по составу реакционной массы после восстановления в течение 1 ч (рис. 3в и 4г, дифрактограммы 5). Образующийся в результате обменных реакций (3) и (4) металлический магний испаряется из реакционной массы и конденсируется на ее поверхности, участвуя далее в восстановлении по механизму ЭОР. В результате наряду с оксидом кальция в поверхностном слое присутствует оксид магния. Оксид магния, входящий в состав исходных соединений, и оксид кальция, входящий в состав образовавшихся в результате реакции замещения молибдата и вольфрамата магния, остаются в порошке металла.
Таким образом, наблюдавшееся ранее при восстановлении парами магния некоторых оксидных соединений металлов VI группы пространственное разделение продуктов реакции подтверждается при использовании в качестве восстановителя паров кальция. Состав и расположение продуктов подтверждают вероятность того, что процесс восстановления этих соединений протекает по механизму ЭОР.
Известно, что для протекания такой реакции необходима замкнутая проводящая цепь между восстанавливаемым веществом и восстановителем [13–15]. В нашем случае исходные реагенты при высокой температуре представляют собой электропроводящую среду, способную обеспечить перенос электронов. Вольфраматы и молибдаты являются смешанными электронно-ионными проводниками [19], оксиды WO3 и MoO3 – полупроводниками n-типа [20], а диоксид MoO2, образующийся в результате реакции (1), обладает металлической проводимостью [21]. Таким образом, имеется возможность образования замкнутой электрической цепи, включающей реагирующие вещества и металлические детали аппаратуры, обеспечивающая перенос электронов. Находящиеся в парообразном состоянии атомы восстановителя, сталкиваясь со стенками тигля, его крышкой и поверхностью восстанавливаемого материала, отдают электроны, которые по цепи поступают в зону реакции и восстанавливают ион металла в оксидном соединении.
Для соблюдения электронейтральности ион кислорода должен переместиться к иону металла-восстановителя. Переносчиком иона кислорода в определенных условиях, которые обеспечиваются высоким тепловым эффектом реакций восстановления рассматриваемых оксидных соединений молибдена и вольфрама, становится среда инертного газа. Так образуются наблюдаемые в эксперименте слои оксида металла-восстановителя вне зоны реакции. Полное восстановление прекурсора при наличии на его поверхности плотного слоя оксида металла восстановителя также свидетельствует в пользу протекания процесса по механизму ЭОР. После образования этого слоя непосредственный контакт между оксидным соединением и восстановителем существенно затруднен.
Результаты исследования порошков вольфрама и молибдена, полученных при использовании в качестве восстановителя кальция, подтверждают установленную ранее при восстановлении оксидных соединений этих металлов парами магния закономерность увеличения удельной поверхности при использовании в качестве прекурсора сложных оксидов [9]. При восстановлении парами кальция вольфраматов и молибдатов удельная поверхность порошков вольфрама и молибдена SБЭТ составила 14–16 м2/г, что значительно превышает соответствующую величину для порошков, полученных в аналогичных условиях из WO3 и MoO3, 0.9–1.5 м2/г. Изучение пористой структуры порошков показало, что удельная поверхность практически полностью определяется поверхностью пор. Кривые адсорбции порошков соответствуют IV типу по IUPAC.
Эффект разделения продуктов кальциетермического восстановления кислородных соединений вольфрама и молибдена может быть полезным для получения высокодисперсных порошков вольфрама и молибдена. Вследствие пространственного разделения оксидной и металлической фаз из технологического процесса может быть исключена операция выщелачивания оксида металла-восстановителя или сокращено время выщелачивания и уменьшен расход минеральных кислот.
ЗАКЛЮЧЕНИЕ
Исследованы закономерности восстановления парами кальция кислородных соединений тугоплавких металлов V и VI групп при температуре 800–860°С и остаточном давлении аргона 5–10 кПа.
При восстановлении WO3, MoO3, MgWO4, MgMoO4 и CaMoO4 парами кальция подтвержден эффект пространственного разделения металлической и оксидной фаз в продуктах реакций, обнаруженный ранее при использовании в качестве восстановителя магния.
Показано, что на начальном этапе восстановления соединений MgWO4 и MgMoO4 в них происходит замещение магния кальцием. Образующийся в результате реакций замещения металлический магний служит в качестве восстановителя, оксид которого в основном концентрируется на поверхности реакционной массы совместно с оксидом кальция.
Анализ полученных результатов свидетельствует о том, что процесс восстановления оксидных соединений VI группы парами кальция при наличии остаточного давления аргона, вероятно, протекает по механизму ЭОР без непосредственного физического контакта между реагирующими веществами.
Список литературы
Won C.W., Nersisyan H.H., Won H.I., Lee J.H. Refractory Metal Nanopowders: Synthesis and Characterization // Curr. Opin. Solid State Mater. Sci. 2010. V. 14. № 3–4. P. 53–68. https://doi.org/10.1016/j.cossms.2009.10.001
Aydinyan S.V., Gumruyan Zh., Manukyan K.V., Kharatyan S L. Self-sustaining Reduction of MoO3 by the Mg–C Mixture // Mater. Sci. Eng., B. 2010. V. 172. № 3. P. 267–271. https://doi.org/10.1016/j.mseb.2010.05.028
Dine, S., Aïd S., Ouaras K., Malard V. Synthesis of Tungsten Nanopowders: Comparison of Milling, SHS, MASHS and Milling-induced Chemical Processes // Adv. Powder Technol. 2015. V. 26. № 5. P. 1300–1305.https://doi.org/10.1016/j.apt. 2015.07.004
Гостищев В.В., Хосен Ри, Химухин С.Н. и др. Получение порошков молибдена и вольфрама алюминотермией их соединений в расплаве хлорида натрия // Литье и металлургия. 2012. № 3(67). С. 143–145.
Zhong H., Jianghao L., Xiangong D. Low Temperature Molten salt Preparation of Molybdenum Nanoparticles // Int. J. Refract. Met. Hard Mater. 2016. V. 54. № 1. P. 315–321. https://doi.org/10.1016/j.ijrmhm.2015.08.011
Орлов В.М., Крыжанов М.В., Калинников В.Т. Магниетермическое восстановление кислородных соединений тантала // Докл. АН. 2014. Т. 457. № 5. С. 555–558. https://doi.org/10.7868/S0869565214230157
Орлов В.М., Крыжанов М.В., Калинников В.Т. Восстановление оксидных соединений ниобия парами магния // Докл. АН. 2015. Т. 465. № 1. С. 182–185. https://doi.org/10.7868/S0869565215320146
Орлов В.М., Крыжанов М.В. Влияние состава прекурсора и условий восстановления на характеристики магниетермических порошков ниобия // Металлы. 2016. № 4. С. 20–26.
Орлов В.М., Колосов В.Н. Магниетермическое восстановление оксидных соединений вольфрама и молибдена // Докл. АН. 2016. Т. 468. № 3. С. 288–292. https://doi.org/10.7868/S0869565216150147
Müller R., Bobeth M., Brumm H. et al. Kinetics of Nanoscale Structure Development during Mg-vapour Reduction Tantalum Oxide // Int. J. Mater. Res. 2007. V. 98. № 11. P. 1138–1145. https://doi.org/10.3139/146.101567
Колосов В.Н., Мирошниченко М.Н., Орлов В.М. Влияние химического состава прекурсоров и условий их восстановления на свойства магниетермических порошков вольфрама // Неорган. материалы. 2016. Т. 52. № 8. С. 945–852. https://doi.org/10.7868/S0002337X16080108
Колосов В.Н., Мирошниченко М.Н., Орлов В.М. Влияние состава прекурсора и условий восстановления на свойства магниетермических порошков молибдена // Неорган. материалы. 2017. Т. 53. № 10. С. 1081–1086. https://doi.org/10.7868/S0002337X17100098
Okabe T.H., Park I., Waseda J.Y. Production of Niobium Powder by Electronically Mediated Reaction (EMR) Using Calcium as a Reductant // J. Alloys Compd. 1999. V. 288. № 1–2. P. 200–210. https://doi.org/10.1016/S0925-8388(99)00130-9
Park I., Abiko T., Okabe T. H. Production of Titanium Powder Directly from TiO2 in CaCl2 through an Electronically Mediated Reaction (EMR) // J. Phys. Chem. Solids.2005. V. 66. № 2–4. P. 410–413. https://doi.org/10.1016/j.jpcs.2004.06.052
Yoon J.S., Kim B.I. The Preparation of Tantalum Powder Using a MR-EMR Combination process // Met. Mater. Int. 2007. V. 13. № 2. P. 177–184. https://doi.org/10.1007/BF03027570
Мирошниченко М.Н., Колосов В.Н., Макарова Т.И., Орлов В.М. Синтез молибдатов и вольфраматов кальция и магния // Изв. СПбГТИ (ТУ). 2017. № 38(64). С. 44–47.https://doi.org/10.15217/issn 1998984-9.2017.38
Kim H., Oh J., Suh C. et al. Method of Producing Low Oxygen-Content Molybdenum Powder by Reducing Molybdenum Trioxide: Патент США № 8979975. Опубл. 17.03.2015.
Куликов И.С. Термическая диссоциация соединений. М.: Металлургия, 1969. 576 с.
Котенева Е.А., Пестерева Н.Н., Астапова Д.В. и др. Транспортные свойства на границе SrMoO4/MoO3 и свойства композитных фаз на их основе // Электрохимия. 2017. Т. 53. № 2. С. 208–216.https://doi.org/10.7868/S0424 857017020098
Кофстад П. Отклонение от стехиометрии, диффузия и электропроводность в простых оксидах металлов. М.: Мир, 1975. 336 с.
Лазарев В.Б., Соболев В.В., Шаплыгин И.С. Химические и физические свойства простых оксидов металлов. М.: Наука, 1983. 571 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


