Неорганические материалы, 2020, T. 56, № 1, стр. 44-49
Кристаллическая структура сложных оксидов в системах Nd2O3–MO–Fe2O3 (M = Ca, Sr)
А. С. Урусова 1, *, А. Е. Вахромеева 1, Т. В. Аксенова 1, А. В. Брюзгина 1, В. А. Черепанов 1
1 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: Anastasia.Podzorova@urfu.ru
Поступила в редакцию 16.12.2018
После доработки 12.05.2019
Принята к публикации 19.06.2019
Аннотация
Методом гомогенизирующих отжигов и рентгеновской порошковой дифракции определены границы областей гомогенности и структура твердых растворов, образующихся в квазитройных системах Nd2O3–MO–Fe2O3 (M = Ca, Sr) при 1373 K на воздухе. Установлено, что в системе Nd‒Ca–Fe–O образуются два типа твердых растворов: Nd1 – xCaxFeO3 – δ (0 < x < 0.35 и 0.95 ≤ x < 1.00) и Ca2– yNdyFeO4 – δ (0.90 ≤ y ≤ 0.95), а в системе Nd–Sr–Fe–O – четыре типа: Nd1– xSrxFeO3 – δ (0 < x ≤ 0.6 и 0.7 ≤ x ≤ 0.9), Sr2 –yNdyFeO4 – δ (0.7 ≤ y ≤ 0.9), Sr3– zNdzFe2O7 – δ (0 < z ≤ 0.4 и 1.8 ≤ z ≤ 1.9) и. Sr4 – uNduFe3O10 – δ (0.7 ≤ u ≤ 0.9). Методом полнопрофильного анализа Ритвельда уточнены структурные параметры сложных оксидов. Получены концентрационные зависимости параметров элементарных ячеек от состава твердых растворов.
ВВЕДЕНИЕ
Практическое использование новых сложнооксидных материалов на основе ферритов неодима и щелочноземельных металлов предполагает знание их физико-химических характеристик: условий получения, термодинамической стабильности индивидуальных соединений и твердых растворов на их основе, кристаллической структуры, кислородной нестехиометрии, электрических и магнитных свойств. На сегодняшний день достаточно подробно изучены фазы, образующиеся в системах Nd–Fe–O [1] и Ca(Sr)–Fe–O [2–16], однако сведения о фазовых равновесиях в квазитройных системах Nd–Ca(Sr)–Fe–O малочисленны.
В системе Nd–Fe–O образуется единственный сложный оксид NdFeO3 – δ (a = 5.576 Å, b = 7.756 Å, c = 5.447 Å (пр. гр. Pbnm [1]).
В системе Ca–Fe–O известно о существовании трех бинарных оксидов: Ca2Fe2O5 – δ, CaFe2O4 – δ и CaFe5O7 – δ [2–10]. Ca2Fe2O5 – δ имеет структуру браунмиллерита и кристаллизуется в пр. гр. Pсmn [5] или Pnmа [6]. Оксид состава CaFe2O4 – δ устойчив на воздухе при температурах выше 1073 K [7], имеет орторомбическую элементарную ячейку (пр. гр. Pbnm [8] или Pnmа [9]). Согласно данным [10], соединение CaFe5O7 – δ (пр. гр. P21/m), полученное в вакууме при 1023–1123 K, содержало примесные количества FeO.
В системе Sr–Fe–O образуются следующие бинарные соединения: SrFeO3 – δ, Sr2FeO4 – δ, Sr3Fe2O7 – δ, Sr4Fe6O13 – δ и SrFe12O19 – δ [11–16]. Кристаллическая структура SrFeO3 – δ существенно зависит от содержания кислорода: при 2.88 ≤ (3 – δ) ≤ 3.0 SrFeO3 – δ имеет идеальную кубическую структуру, при 2.76 ≤ (3 – δ) ≤ 2.84 – тетрагональную, при (3 – δ) = 2.75 – орторомбическую и при (3 – δ) = 2.5 – структуру браунмиллерита [11]. Феррит Sr2FeO4 – δ стабилен на воздухе до 1203 K [12]. Соединение Sr3Fe2O7 – δ имеет структуру слоистого перовскита и кристаллизуется в тетрагональной ячейке (пр. гр. I4/mmm) [13]. Феррит Sr4Fe6O13 – δ устойчив на воздухе только при температурах выше 1048 K [14], имеет орторомбическую ячейку (пр. гр. Ic2a [15]). SrFe12O19 – δ имеет структуру магнитоплюмбита (пр. гр. P63/mmc).
Фазовые соотношения в квазитройной системе Nd–Ca–Fe–O мало изучены [16]. Известно, что однофазные оксиды Nd1 – xCaxFeO3 – δ c x = = 0.25, 0.50 и 0.75 были получены отжигом при 1423 К на воздухе [16]. Кристаллическая структура состава с x = 0.25 была описана в рамках орторомбической ячейки, с x = 0.50 – кубической, с x = 0.75 – ячейки браунмиллерита [16].
Область гомогенности оксидов Nd1 –xSrxFeO3 – δ, полученных по стандартной керамической технологии при 1473 K на воздухе, лежит в интервале составов 0 ≤ x ≤ 0.5 [17]. При увеличении концентрации стронция происходит переход от орторомбической структуры O-типа, характеризующейся соотношением параметров элементарной ячейки $a \leqslant {c \mathord{\left/ {\vphantom {c {\sqrt 2 }}} \right. \kern-0em} {\sqrt 2 }} \leqslant b$ или $b \leqslant {с \mathord{\left/ {\vphantom {с {\sqrt 2 }}} \right. \kern-0em} {\sqrt 2 }} \leqslant a,$ к O'-типу для x = 0.4 с соотношением параметров ячейки ${c \mathord{\left/ {\vphantom {c {\sqrt 2 }}} \right. \kern-0em} {\sqrt 2 }} \leqslant a \leqslant b$ [18].
Целью настоящей работы является установление областей гомогенности твердых растворов, образующихся в квазитройных системах Nd‒Ca(Sr)–Fe–O при 1373 K на воздухе.
Выбор температуры синтеза образцов 1373 К обусловлен тем, что она является оптимальной: однофазный продукт образуется уже с достаточно высокой скоростью и в то же время взаимодействие с материалом тигля, а в топливном элементе с материалом твердого электролита, еще не настолько критично.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы для исследования получали по глицерин-нитратной технологии. В качестве исходных реагентов для синтеза использовали оксид неодима Nd2O3 (HО-Л), карбонаты кальция и стронция CaCO3 и SrCO3 (“ос. ч.”), предварительно прокаленные для удаления адсорбированной влаги и газов, оксалат железа FeC2O4 ⋅ 2Н2О (“ч. д. а.”), азотную кислоту HNO3 (“ос. ч.”) и глицерин C3H8O3 (“ч. д. а.”).
Сухой остаток ступенчато нагревали в интервале 873–1373 K. Заключительный отжиг оксидов проводили при температуре 1373 K на воздухе в течение 60 ч с промежуточными перетираниями в этаноле через 10–12 ч. Образцы закаливали на воздухе с 1373 K на комнатную температуру (скорость ∼400–500 К/мин).
Фазовый состав полученных образцов контролировали методом рентгенофазового анализа (РФА) на дифрактометре Shimadzu XRD-7000 (CuKα-излучении (λ = 1.5418 Å) в интервале углов 20° ≤ 2θ° ≤ 70° со скоростью 0.02 град/мин с выдержкой в точке 2 с).
Параметры элементарных ячеек были рассчитаны методом полнопрофильного анализа Ритвельда в программе Fullprof 2018.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В системе Nd–Fe–O при 1373 K на воздухе подтверждено образование единственного оксида состава NdFeO3-δ с параметрами орторомбической ячейки a =5.453(1) Å, b = 5.581(1) Å, c = = 7.763(1) Å (пр. гр. Pbnm), что хорошо согласуется с данными [1].
Для уточнения фазовых равновесий в квазибинарной системе Ca–Fe–O было приготовлено 12 смесей с различным содержанием кальция и железа. По результатам РФА установлено, что при 1373 K на воздухе устойчивыми являются сложные оксиды Ca2Fe2O5 – δ и CaFe2O4 – δ, ранее описанные в работах [2–9]. Кристаллическая структура закаленного с 1373 K феррита кальция Ca2Fe2O5 – δ была описана в рамках орторомбической симметрии типа искаженного браунмиллерита с параметрами ячейки a = 5.422(1) Å, b = = 14.769(1) Å, c =5.592(1) Å (пр. гр. Pnma). Сложный оксид CaFe2O4 – δ имеет орторомбическую структуру и кристаллизуется в пр. гр. Pnma с параметрами a = 9.223(1) Å, b = 3.018(1) Å и c = = 10.693(1) Å, что неплохо согласуется с данными [9].
Фазовые соотношения в квазибинарной системе Sr–Fe–O при 1373 K на воздухе были ранее подробно исследованы и описаны [14]. В условиях эксперимента установлено существование четырех бинарных соединений: SrFeO3 – δ (a = 10.945(1) Å, c = 7.705(1) Å, пр. гр. I4/mmm), Sr3Fe2O7 – δ (a = = 3.866(1) Å, c = 20.162(1) Å, пр. гр. I4/mmm), Sr4Fe6O13 – δ (a = 11.107(1) Å, b = 18.949(1) Å, c = = 5.580(1) Å пр. гр. Iba2) и SrFe12O19 – δ (a = 5.878(1) Å, c = 23.045(1) Å пр. гр. P63/mmc).
Исследования систем Nd–M–O (M = Ca, Sr) показали, что при 1373 K на воздухе на основе Nd2O3 образуются твердые растворы с общей формулой Nd2 – mMmO3 – m/2. По данным РФА, растворимость CaO в Nd2O3 ограничивается составом с NCa = 0.05, тогда как область гомогенности стронцийзамещенных оксидов расширяется до NSr = 0.075. Подобно крайнему члену ряда, твердые растворы Nd2 –mMmO3 –m/2 (0 < m ≤ 0.1 для M = Ca и 0 < m ≤ 0.15 для M = Sr) имеют гексагональную структуру и кристаллизуются в пр. гр. P${\bar {3}}$m1.
Согласно результатам РФА закаленных образцов в системах Nd–M–Fe–O при 1373 K на воздухе образуются следующие типы твердых растворов: Nd1 – xMxFeO3 – δ, M2 – zNdzFeO4 – δ (M = Ca, Sr), Sr3 – yNdyFe2O7 – δ и Sr4 – uNduFe3O10 – δ.
Для уточнения границ существования и исследования кристаллической структуры твердых растворов Nd1 – xМxFeO3 – δ (M = Ca, Sr) по глицерин-нитратной технологии были приготовлены образцы с x = 0.05–0.50 и x = 0.8–0.95 с шагом 0.05 для M = Ca и с x = 0.1–0.9 c шагом 0.1 для M = Sr. По результатам РФА установлено, что однофазные сложные оксиды Nd1 – xMxFeO3 – δ образуются в интервале составов 0 ≤ x ≤ 0.35, 0.95 ≤ x ≤ 1.00 для M = Ca и 0 ≤ x ≤ 0.6, 0.7 ≤ x ≤ 0.9 для M = Sr.
Рентгенографические данные для твердых растворов Nd1 – xMxFeO3 – δ с 0 < x ≤ 0.35 (M = Ca) и 0 < x ≤ 0.6 (M = Sr) были проиндексированы в рамках орторомбической ячейки (рис. 1). Однако отметим, что увеличение концентрации стронция, замещающего неодим в Nd1 – xSrxFeO3 – δ, приводит к появлению двух типов орторомбической структуры, что согласуется с данными [18]. Так, оксиды Nd1 – xSrxFeO3 – δ с 0 ≤ x ≤ 0.2 и 0.5 ≤ x ≤ ≤ 0.6 кристаллизуются в O-орторомбической, а с 0.3 ≤ x ≤ ≤ 0.4 – в O'-орторомбической структуре (пр. гр. Pbnm).
Рис. 1.
Рентгеновские данные для Nd0.8Ca0.2FeO3 – δ (а) и Nd0.7Sr0.3FeO3 – δ (б), обработанные по методу Ритвельда.
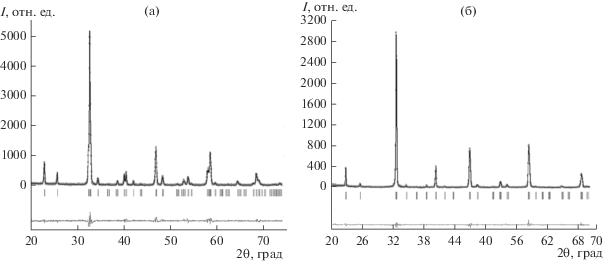
Установленная область гомогенности для Nd1 – xCaxFeO3 – δ (0 ≤ x ≤ 0.35) существенно меньше найденной для Sr-замещенных ферритов неодима (0 ≤ x ≤ 0.6), что, вероятно, связано с размерным фактором: уменьшение размера катиона в позиции A уменьшает устойчивость перовскитоподобных фаз.
Обогащенные кальцием оксиды Nd1 –xCaxFeO3 – δ с 0.95 ≤ x ≤ 1.00, подобно незамещенному Ca2Fe2O5 – δ, имеют структуру искаженного браунмиллерита (пр. гр. Pnma), а ферриты Nd1 –xSrxFeO3 – δ с 0.7 ≤ x ≤ 0.9 кристаллизуются в идеальной кубической структуре (пр. гр. Pm3m).
Для всех однофазных твердых растворов Nd1 – xMxFeO3 – δ (M = Ca, Sr) из рентгенографических данных были вычислены параметры элементарных ячеек. Установлено, что увеличение концентрации допанта приводит к монотонному уменьшению объема элементарных ячеек оксидов (рис. 2).
Рис. 2.
Зависимости объема элементарных ячеек от состава твердого раствора Nd1 –xMxFeO3 – δ (M = Ca, Sr).

Для определения области существования твердых растворов на основе ферритов М2FeO4 – δ (M = Ca, Sr) по глицерин-нитратной технологии были приготовлены образцы общего состава М2 – yNdyFeO4 – δ (M = Ca, Sr) с 0.7 ≤ y ≤ 1.1 и шагом 0.1.
По результатам РФА установлено, что при 1373 K на воздухе однофазные оксиды М2 –yNdyFeO4 – δ образуются в интервале 0.9 ≤ y ≤ 0.95 для M = Ca и 0.7 ≤ y ≤ 0.9 для M = Sr. Недопированные ферриты М2FeO4 – δ в условиях эксперимента термодинамически нестабильны. Введение неодима в подрешетку кальция/стронция понижает среднюю степень окисления железа в твердом растворе М2 – yNdyFeO4 – δ, тем самым стабилизируя фазу со структурой типа K2NiF4 (рис. 3а).
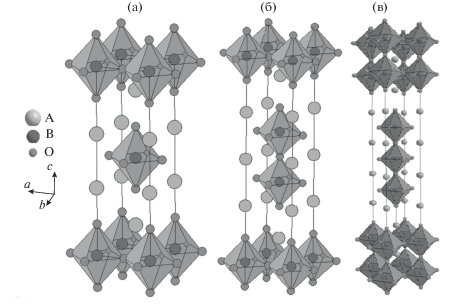
Рис. 3.
Кристаллическая структура оксидов гомологического ряда AO(ABO3)n, где n = 1, формула A2BO4 (а); n = 2, формула A3B2O7 (б); n = 3, формула A4B3O10 (в).
Рентгенограммы твердых растворов Ca2 – yNdyFeO4 – δ с 0.9 ≤ y ≤ 0.95 были описаны в рамках орторомбической (пр. гр. Cmca), а Sr2 – yNdyFeO4 – δ с 0.7 ≤ y ≤ 0.9 – тетрагональной (пр. гр. I4/mmm) симметрии. В табл. 1 приведены структурные параметры элементарных ячеек твердых растворов M2 –yNdyFeO4 – δ.
Таблица 1.
Параметры элементарных ячеек твердых растворов M2 –yNdyFeO4 – δ (M = Ca, Sr), закаленных с 1373 K на воздухе
| y | 0.90 | 0.95 | у | 0.7 | 0.8 | 0.9 |
|---|---|---|---|---|---|---|
| a, Å | 5.398(1) | 5.409(1) | a, Å | 3.825(1) | 3.834(1) | 3.841(1) |
| b, Å | 12.112(1) | 12.087(1) | c, Å | 12.651(1) | 12.639(1) | 12.599(1) |
| c, Å | 5.457(1) | 5.472(1) | V, Å3 | 185.17(2) | 185.79(2) | 185.95(2) |
| V, Å3 | 356.75(2) | 357.74(1) | c/a, Å | 3.307 | 3.296 | 3.280 |
| RBr, % | 5.81 | 4.67 | RBr, % | 3.45 | 3.21 | 3.71 |
| Rf, % | 5.93 | 4.23 | Rf, % | 2.74 | 2.56 | 2.74 |
| Rp, % | 9.51 | 9.14 | Rp, % | 6.89 | 7.07 | 8.16 |
| пр. гр. Cmca: Ca/Nd (0; y; z); Fe (0; 0; 0); O1 (0.25; y; 0.25); O2 (0; y; z) | пр. гр. I4/mmm: Sr/Nd (0; 0; z); Fe (0; 0; 0); O1 (0; 0.5; 0); O2 (0; 0; z) | |||||
Отметим, что при увеличении содержания неодима в образцах наблюдается анизотропия в изменении параметров решетки. С одной стороны, уменьшение параметров можно объяснить с точки зрения размерного фактора: радиус ионов неодима ${{r}_{{{\text{N}}{{{\text{d}}}^{{3 + }}}}}}$ = 1.27 Å (к. ч. = 12) меньше, чем радиус ионов кальция/стронция ${{r}_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}}$ = 1.34 Å и ${{r}_{{{\text{S}}{{{\text{r}}}^{{2 + }}}}}}$ = = 1.44 Å (к. ч. = 12). С другой стороны, увеличение концентрации неодима способствует понижению средней степени окисления 3d-металла и, следовательно, увеличению количества ионов Fe3+ (r = 0.785 Å, к. ч. = 6) по сравнению с ионами Fe4+ (r = 0.725 Å, к. ч. = 6). Влияние этих факторов приводит к незначительному росту объемов элементарных ячеек оксидов M2 – yNdyFeO4 – δ (M = = Ca, Sr) внутри областей гомогенности.
Рентгенографический анализ оксидов Sr3 – zNdzFe2O7 – δ (0 < z ≤ 0.5 и 1.7 ≤ z ≤ 2.2 с шагом 0.1) и Sr4 – uNduFe3O10 – δ (0.5 ≤ u ≤ 1.0 с шагом 0.1) показал, что область существования твердых растворов при 1373 K на воздухе лежит в интервале составов 0 ≤ z ≤ 0.5, 1.7 ≤ z ≤ 2.2 и 0.7 ≤ u ≤ 0.9 соответственно. Дифрактограммы однофазных ферритов Sr3 – zNdzFe2O7 – δ и Sr4 – uNduFe3O10 – δ были описаны в тетрагональной ячейке (пр. гр. I4/mmm) (рис. 4). При кристаллизации эти фазы образуют слоистые решетки, в которых попеременно чередуются имеющие общую ось с перовскитные слои АВО3 и слои АО с решеткой типа NaCl (рис. 3б и 3в).
Рис. 4.
Рентгеновские данные для Sr2.6Nd0.4Fe2O7 – δ (1) и Sr3.1Nd0.9Fe3O10 – δ (2), обработанные по методу Ритвельда.
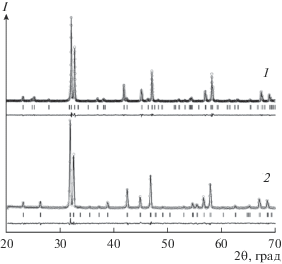
Замещение стронция на неодим приводит к уменьшению объема элементарных ячеек твердых растворов Sr3 –zNdzFe2O7 – δ и Sr4 – uNduFe3O10 – δ, что связано с размерным эффектом: замещение ионов стронция (${{r}_{{{\text{S}}{{{\text{r}}}^{{2 + }}}}}}$ = 1.44 Å, к. ч. = 12) меньшими по размеру ионами неодима (${{r}_{{{\text{N}}{{{\text{d}}}^{{3 + }}}}}}$ = 1.27 Å, к. ч. = 12).
ЗАКЛЮЧЕНИЕ
Установлены границы областей гомогенности твердых растворов, образующихся в системах Nd–Ca(Sr)–Fe–O при 1373 K на воздухе: Nd1 – xMxFeO3 – δ с 0 < x ≤ 0.35 и 0.95 ≤ x < 1.00 для M = Ca и 0 < x ≤ 0.6 и 0.7 ≤ x ≤ 0.9 для M = Sr; М2 – yNdyFeO4 – δ с 0.9 ≤ y ≤ 0.95 для M = Ca и 0.7 ≤ ≤ y ≤ 0.9 для M = Sr; Sr3 –zNdzFe2O7 – δ с 0 < z ≤ 0.5 и 1.7 ≤ z ≤ 2.2; Sr4 –uNduFe3O10 – δ с 0.7 ≤ u ≤ 0.9. Показано, что, хотя радиус иона неодима меньше, чем радиусы ионов кальция и стронция, зависимости и параметров элементарных ячеек, и объемов носят сложный характер, связанный с изменеием содержания кислорода, а следовательно, и степени окисления ионов железа.
Список литературы
Sajad Ahmad Mir, Ikram M., Asokan K. Structural, Optical and Dielectric Properties of Ni Substituted NdFeO3 // Optic. 2014. V. 125. P. 6903–6908. https://doi.org/10.1016/j.ijleo.2014.08.050
Li Q., Sun L., Huo L., Zhao H., Grenier J.-C. Electrode Properties of Co-Doped Ca2Fe2O5 as New Cathode Materials for Intermediate-Temperature SOFCs // Int. J. Hydrogen Energy. 2010. V. 35. P. 9151–9157. https://doi.org/10.1016/j.ijhydene.2010.06.048
Liu X., Jiang J., Jia Yu., Jin A., Chen X., Zhang F., Han H. p-Type CaFe2O4 Semiconductor Nanorods Controllably Synthesized by Molten Salt Method // J. Energy Chem. 2016. V. 25. P. 381–386. https://doi.org/10.1016/j.jechem.2016.03.019
Berastegui P., Eriksson S.-G., Hull S. A Neutron Diffraction Study of the Temperature Dependence of Ca2Fe2O5 // Mater. Res. Bull. 1999. V. 34. № 2. P. 303–314. https://doi.org/10.1016/S0025-5408(99)00007-0
Cascos V., Martinez-Coronado R., Alonso J.A., Fernández-Díaz M.T. Structural and Electrical Characterization of the Co-Doped Ca2Fe2O5 Brownmillerite: Evaluation as SOFC-cathode Materials // Int. J. Hydrogen Energy. 2015. V. 40. P. 5456–5468. https://doi.org/10.1016/j.ijhydene.2015.01.067
Gupta K., Singh S., Rao R.M.S. Fast, Reversible CO2 Capture in Nanostructured Brownmillerite CaFeO2.5 // Nano Energy. 2015. V. 11. P. 146–153. https://doi.org/10.1016/j.nanoen.2014.10.016
Candeia R.A., Bernardi M.I.B., Longo E., Santos I.M.G., Souza A.G. Synthesis and Characterization of Spinel Pigment CaFe2O4 Obtained by the Polymeric Precursor Method // Mater. Lett. 2004. V. 58. P. 569–572. https://doi.org/10.1016/S0167-577X(03)00563-9
Tsipis E.V., Pivak Y.V., Waerenborgh J.C., Kolotygin V.A. Oxygen Ionic Conductivity, Mössbauer Spectra and Thermal Expansion of CaFe2O4 – δ // Solid State Ionics. 2007. V. 178. P. 1428–1436. https://doi.org/10.1016/j.ssi.2007.09.003
Khanna L., Verma N.K. Biocompatibility and Superparamagnetism in Novel Silica/CaFe2O4 Nanocomposite // Mater. Lett. 2014. V. 128. P. 376–379. https://doi.org/10.1016/j.matlet.2014.04.168
Delacotte C., Hébert S., Hardy V., Bréard Y., Maki R., Mori T., Pelloquin D. Impact of Densification on Microstructure and Transport Properties of CaFe5O7 // Solid State Sci. 2016. V. 54. P. 54–58. https://doi.org/10.1016/j.solidstatesciences.2015.11.006
Taguchi H. Electrical Properties of SrFeO3 – δ under Various Partial Pressures of Oxygen // J. Mater. Sci. Lett. 1983. V. 2. P. 665–666. https://doi.org/10.1007/BF02758386
Dann S.E., Weller M.T., Currie D.B. The Synthesis and Structure of Sr2FeO4 // J. Solid State Chem. 1991. V. 92. P. 237–240. https://doi.org/10.1016/0022-4596(91)90263-H
Mori K., Kamiyama T., Kobayashi H., Torii S., Izumi F., Asano H. Crystal Structure of Sr3Fe2O7-δ // J. Phys. Chem. Solids. 1999. V. 60. P. 1443–1446. https://doi.org/10.1016/S0022-3697(99)00158-4
Fossdal A., Einarsrud M.A., Grande T. Phase Equilibria in the Pseudo-Binary System SrO–Fe2O3 // J. Solid State Chem. 2004. V. 177. P. 2933–2942. https://doi.org/10.1016/j.jssc.2004.05.007
Mellenne B., Retoux R., Lepoittevin C., Hervieu M., Raveau B. Oxygen Nonstoichiometry in Sr4Fe6O13 – δ: the Derivatives [Sr8Fe12O26] ⋅ [Sr2Fe3O6]n // Chem. Mater. 2004. V. 16. P. 5006–5013. https://doi.org/10.1021/cm040127d
Yo C.H., Jung I.Y., Ryu K.H., Ryu K.S., Choy J.H. A Study of the Nonstoichiometry and Physical Properties of the Perovskite Nd1 – xCaxFeO3 – y System // J. Solid State Chem. 1995. V. 114. P. 265–270. https://doi.org/10.1006/jssc.1995.1038
Dasgupta N., Krishnamoorthy R., Thomas J.K. Crystal Structure and Thermal and Electrical Properties of the Perovskite Solid Solution Nd1 –xSrxFeO3 (0 ≤ x ≤ 0.4) // Solid State Ionics. 2002. V. 149. P. 227–236. https://doi.org/10.1016/S0167-2738(02)00179-0
Aksenova T.V., Vakhromeeva A.E., Elkalashy Sh.I., Urusova A.S., Cherepanov V.A. Phase Equilibria, Crystal Structure, Oxygen Nonstoichiometry and Thermal Expansion of COMPLEX OXIDES in the Nd2O3–SrO–Fe2O3 System // J. Solid State Chem. 2017. V. 251. P. 70–78. https://doi.org/10.1016/j.jssc.2017.04.015
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


