Неорганические материалы, 2020, T. 56, № 10, стр. 1065-1073
Рентгеновское фотоэлектронное исследование адсорбции Mg на нанокристаллическом гидроксиапатите
Ю. А. Тетерин 1, 2, *, В. Н. Рудин 1, А. В. Северин 1, М. Э. Пауль 1, К. И. Маслаков 1, А. Ю. Тетерин 2, С. В. Дворяк 1
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
2 НИЦ “Курчатовский институт”
123182 Москва, Площадь Академика Курчатова, 1, Россия
* E-mail: teterin_ya@yandex.ru
Поступила в редакцию 29.03.2019
После доработки 11.05.2020
Принята к публикации 27.05.2020
Аннотация
Изучена адсорбция ионов Mg2+ на нанокристаллах гидроксиапатита (ГАП) и построена ее изотерма в интервале равновесных концентраций катиона от 0 до 0.35 моль/л. Для ряда образцов, соответствующих характерным точкам на изотерме, методом рентгеновской фотоэлектронной спектроскопии (РФЭС) определены состав и степень окисления элементов поверхности сорбента. При этом оказалось, что концентрация ионов магния на поверхности, найденная методом РФЭС, когда регистрируются ионы только поверхностных слоев толщиной в несколько нанометров, значительно меньше общего количества катионов, перешедших в твердую фазу, рассчитанного на основе экспериментальной изотермы. Предположено, что в процессе сорбции часть ионов магния замещает ионы кальция в объеме ГАП, а другая часть адсорбируется в виде MgCl2. Полученные результаты представляют фундаментальную основу для практических решений при разработке комплексных препаратов ГАП с магнием медицинского назначения.
ВВЕДЕНИЕ
Биологический гидроксиапатит (ГАП) является основным минеральным ингредиентом костной ткани животных и человека, причем находится он в ткани в виде нанокристаллов, связанных с коллагеном [1]. В связи с этим остается актуальным определение характеристик нанокристаллов ГАП и состояния молекул биологически активных веществ и ионов, адсорбированных на их поверхности.
Живой организм производит биологический ГАП для использования в качестве структурного компонента в костях. Синтетический ГАП имеет тот же химический состав, что и биологический (Ca10(PO4)6(OH)2), и отражает многие свойства натуральной костной ткани [2, 3]. Кроме того, в костях содержатся и другие ионы, например, Na+, Mg2+, K+, Cl–. Особую роль играют ионы магния. Контроль и поддержание гомеостаза магния важны для сохранения целостности костной ткани. В норме структура кости постоянно ремоделируется путем координирования взаимодействий между остеокластами и остеобластами. Дисбаланс их функционирования приводит к преобладанию процессов резорбции (разрушения) кости, ухудшению ее структуры, уменьшению плотности и, как следствие, возникновению остеопороза. Непосредственно сам синтетический нанокристаллический ГАП успешно используется для лечения больных с различными переломами костей [4]. Вместе с тем, применение ГАП, допированного ионами Mg2+ [2, 3, 5], способствует увеличению активности остеобластов под воздействием ферментной системы организма, что усиливает репаративные возможности последнего. Однако доступность магния при его введении методом сокристаллизации [2] существенно ниже, чем при его адсорбции на поверхности нанокристаллов ГАП. В связи с этим актуально изучение особенностей сорбционного взаимодействия магния с ГАП и его состояния на поверхности нанокристаллов сорбента. В качестве метода, характеризующего элементный состав и электронное строение поверхностного слоя кристаллов, используется рентгеновская фотоэлектронная спектроскопия (РФЭС) [6–8].
Цель работы состояла в изучении механизма адсорбции ионов Mg2+ на поверхности нанокристаллов ГАП [6] и построении изотермы адсорбции при изменении равновесной концентрации магния от 0 до 0.35 моль/л, при этом методом РФЭС определяли как количество ионов магния в поверхностном слое сорбента, так и степень окисления элементов, а также в оценке доли поверхностных ионов магния по сравнению с их общим количеством, перешедшим в процессе взаимодействия с ГАП в твердую фазу.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
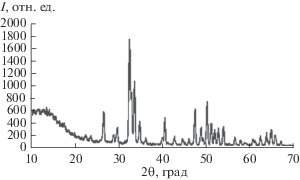
Нанокристаллический сорбент. В качестве наносорбента в данных исследованиях использовали 5.5%-ную водную суспензию ГАП, полученную по методике [6]. Нанокристаллы имели следующие средние размеры: длину l 62 ± 30 нм, ширину d 15 ± 7 нм и толщину h от 1 до 3 кристаллографических трансляций элементарной ячейки ГАП (~0.8–2.4 нм). Расчетная (геометрическая) удельная поверхность нанокристаллов в суспензии составляла ~900 м2/г, однако из-за агрегации наночастиц между собой ее реальная величина существенно меньше – ~170 м2/г [6, 7]. Рентгенограмма нанокристаллов ГАП приведена на рис. 1.
Изотерма адсорбции Mg2+ на ГАП. В эксперименте определенную навеску суспензии ГАП помещали во флакон емкостью 12 мл, добавляли рассчитанные объемы растворов хлорида магния и воды. Образцы помещали на орбитальный шейкер SkyLine Shaker S-3.08L (Elmi, Латвия) и перемешивали в идентичных условиях. После достижения равновесия (спустя 2 суток) фазы разделяли центрифугированием и остаточную концентрацию магния в растворе определяли с использованием спектрофотометра SHIMADZU UV-1280 при длине волны 540 нм. Содержание магния определяли с помощью специального реагента, основной компонент которого трис(гидроксиметил)аминометан.
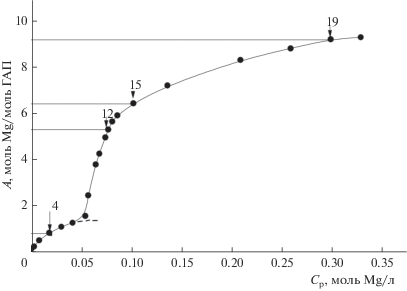
Для построения изотермы адсорбции было взято 20 точек с различным соотношением ГАП и хлорида магния. Полученная изотерма адсорбции представлена на рис. 2 (А – величина адсорбции в моль Mg/моль ГАП, Ср – равновесная концентрация Mg в моль/л).
Рис. 2.
Изотерма сорбции из раствора ионов Mg2+ на нанокристаллический ГАП: А – величина адсорбции в моль Mg/моль ГАП, Ср – равновесная концентрация Mg в моль/л; на изотерме указаны номера точек, для которых отобранные образцы были изучены методом РФЭС.
Приготовление образцов для изучения методом РФЭС. Образцы для РФЭС готовили следующим образом: после установления адсорбционного равновесия в изучаемой системе маточный раствор отделяли от твердой фазы центрифугированием при 6000g. Затем брали покровное стекло, обезжиривали его поверхность ацетоном и наносили на него небольшое количество твердой фазы, оставшееся после центрифугирования. Нанокристаллы ГАП распределяли равномерно по покровному стеклу, высушивали при 50°С и остаток воды отгоняли на форвакуумном насосе в течение 2 ч в эксикаторе. При этом на подложке покровного стекла (10 × 10 мм) формировался слой нанокристаллов толщиной 1.5 мм на площади 7 × 7 мм2. В результате для РФЭС были подготовлены следующие образцы: 1 – чистый ГАП (получен центрифугированием исходной суспензии), 2 (ГАП-4), 3 (ГАП-12), 4 (ГАП-15) и 5 (ГАП-19) соответствуют точкам на изотерме адсорбции (см. рис. 2).
Получение РФЭС. РФЭС изученных образцов были получены на спектрометре Kratos Axis Ultra DLD с использованием монохроматического AlKα-излучения (hν = 1486.6 эВ) при мощности 150 Вт рентгеновской трубки, давлении 1.3 × 10–7 Па и комнатной температуре. Площадь анализа равна 300 × 700 мкм2. Калибровка спектрометра была проведена относительно положения пиков Au4f7/2 (83.96 эВ) и Cu2p3/2 (932.62 эВ) остовных уровней для металлов чистого золота и меди. Спектры были получены в энергетическом постоянном окне с энергией прохождения 20 эВ и шагом 0.05 эВ. Разрешение спектрометра, измеряемое как полная ширина на полувысоте (FWHM) максимума линии Au4f7/2-электронов, была равна 0.65 эВ. Энергии связи (Eb) были измерены относительно Eb C1s-электронов углеводородов, адсорбированных на поверхности образца, которая была принята равной 285.0 эВ. Ошибка в определении энергии связи и ширины линий не превышала ±0.05 эВ, а погрешности в определении относительной интенсивности линий ±5%. Фон, связанный с вторично рассеянными электронами, вычитался по методу Ширли [8].
Был проведен количественный элементный анализ поверхностных слоев изученных образцов толщиной в несколько нанометров (~3–5 нм [9]). Он основан на том, что спектральная интенсивность пропорциональна количеству определяемых атомов в исследуемом образце. Было использовано следующее соотношение: ni/nj = (Si/Sj)(kj/ki), где ni/nj – относительная концентрация исследуемых атомов, Si/Sj – относительная спектральная интенсивность, kj/ki – относительный экспериментальный коэффициент чувствительности. В работе использованы следующие коэффициенты по отношению к С1s: 1.00 (С1s), 2.81 (O1s), 6.59 (Ca2p), 1.75 (P2p), 3.21 (Cl2p), 8.13 (Mg1s).
Для идентификации линий спектров ГАП и Mg использовали энергии связи электронов для эталонных образцов: 1304.8 и 51.5 эВ для Mg1s- и 2p-электронов (MgCl2 ⋅ 6H2O); 1302.7 и 49.5 эВ для Mg1s- и 2p-электронов (Mg(OH)2); 1303.9 и 50.8 эВ для Mg1s- и 2р-электронов (MgO) [11]; 346 и 347.3 эВ для Ca2p3/2-электронов (СаО и СаСО3) [10, 11]; а также данные для MgCl2 ⋅ 6H2O и Mg(OH)2, полученные в настоящей работе (табл. 1). Во всех случаях были получены обзорные и детализированные спектры валентной зоны в интервале от 0 до 50 эВ, а также наиболее интенсивные линии остовных электронов магния, кальция и фосфора, линии О1s- и С1s-электронов кислорода и углерода.
Таблица 1.
Энергии связи Eb электронов и ширины линий Г образцов
| Образец | Eb, эВ (Γ, эВ) | ||||||
|---|---|---|---|---|---|---|---|
| Mg2p | Mg1s | Ca2p3/2 | P2p | Cl2p3/2 | O1s | C1s | |
| ГАП | – – – |
347.6 (1.2) | 133.6 (1.5) | 531.4 533.0 (1.2) |
285.0 289.0 (1.3) |
||
| ГАП-4 | 51.1 (1.2) |
1304.4 (1.4) |
347.5 (1.1) |
133.6 (1.4) |
199.0 (1.0) |
531.3 533.2 (1.1) |
285.0 289.1 (1.3) |
| ГАП-12 | 51.2 (1.3) |
1304.5 (1.4) |
347.5 (1.1) |
133.6 (1.4) |
199.0 (1.0) |
531.4 533.2 (1.2) |
285.0 289.1 (1.3) |
| ГАП-15 | 51.2 (1.4) |
1304.6 (1.4) |
347.6 (1.0) |
133.7 (1.4) |
199.0 (1.0) |
531.6 533.2 (1.1) |
285.0 289.2 (1.3) |
| ГАП-19 | 51.1 (1.4) |
1304.6 (1.4) |
347.5 (1.1) |
133.6 (1.4) |
198.9 (1.0) |
531.5 533.2 (1.1) |
285.0 289.2 (1.3) |
| MgCl2 ⋅ 6H2O | 51.4 (1.4) 51.5* |
1304.6 (1.4) 1304.8* |
199.1 (1.1) |
285.0 (1.3) |
|||
| Mg(OH)2 | 49.5* | 1302.7* | |||||
| MgO | 50.8* | 1303.9* | |||||
| CaO [10] | 346.0 (1.7) 346.1* |
528.9 (1.4) | 285.0 | ||||
| CaCO3 [10] | 347.3 (1.7) 347.4* |
531.6 (1.6) |
285.0 289.7 (1.3) |
||||
Примечание. Энергии связи приведены относительно Eb(C1s) = 285.0(1.3) эВ. * Данные [11] (для сравнения).
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
В обзорном РФЭС (рис. 3) нанокристалла ГАП (Ca10(PO4)6(OH)2) в интервале энергий связи Еb от 0 до 1250 эВ возникают относительно узкие линии атомов Са, Р и О. В нем также наблюдаются линии C KLL и O KLL оже-электронов углерода и кислорода и линии C1s- и Na1s-электронов углерода и натрия. Адсорбция магния на поверхности нанокристаллического ГАП приводит к появлению в обзорном спектре линий Mg1s-, Mg2s- и Mg2p-электронов, уменьшению интенсивности линии Na1s-электронов и возникновению основной линии Mg KLL оже-электронов при 299.3 эВ. На основании интенсивностей линий с учетом коэффициентов чувствительности проведен элементный химический анализ поверхности изученных образцов (табл. 2).
Рис. 3.
Обзорные РФЭС: а – спектр недопированного ГАП, б – спектр образца с адсорбированным Mg (ГАП-12).
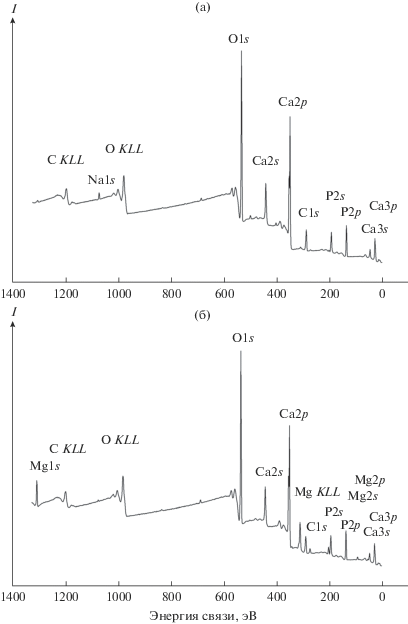
Таблица 2.
Атомный состав поверхности образцов по отношению к атому Р для различных равновесных концентраций магния
| Образец | Ср, моль/л | А, моль Mg/моль ГАП | Состав поверхности* |
|---|---|---|---|
| ГАП | – | – | Ca10P6O24+2H2 (расчет) |
| – | – | Ca9.5P6O25.1+3.4 С1.2 (эксперимент) | |
| ГАП-4 | 0.019 | 0.84 | Ca9.2P6O25.5+5 C0.6 Mg1.5 Cl0.3 |
| ГАП-12 | 0.078 | 5.31 | Ca8.8P6O25.3+2.2 C0.1 Mg3.1 Cl0.9 |
| ГАП-15 | 0.103 | 6.43 | Ca9.2P6O26.0+9.0 C1.4 Mg3.3 Cl3.0 |
| ГАП-19 | 0.31 | 9.19 | Ca8.7P6O26.0+11.8 C1.5 Mg3.0Cl2.6 |
Примечание. Атомный состав получен методом РФЭС и приведен по отношению к шести атомам фосфора; цифра у образца ГАП соответствует его номеру на изотерме (рис. 2). * Для кислорода дополнительно отмечена концентрация атомов, принадлежавших H2O; концентрация углерода приведена для карбонатных групп ${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}.$
Значения энергий связи валентных и остовных электронов и ширины линий на их полувысоте приведены в табл. 1. Там же приведены характеристики спектров эталонных образцов [10]. В Базе данных РФЭС [11] приведены значения энергии связи Ca2p3/2-электронов, равные 346.1 эВ для СаО и 347.4 эВ для CaСО3, которые хорошо согласуются с данными [10].
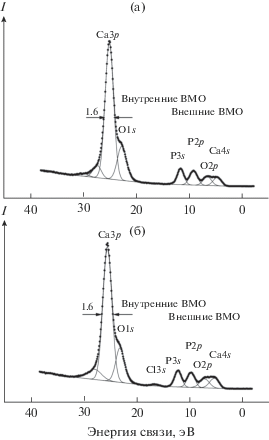
Спектры валентных и остовных электронов некоторых изученных образцов ГАП, ГАП-4, 12, 15, 19 представлены на рис. 3–6.
Рис. 4.
РФЭС валентных электронов: а – спектр недопированного ГАП, б – спектр образца с адсорбированным Mg (ГАП-12).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В обзорном РФЭС ГАП, так же как и в спектре ГАП-12 (рис. 3), наблюдаются все линии элементов Ca10(PO4)6(OH)2 и линия C1s-электронов углеводородов, адсорбированных на поверхности из воздуха. Кроме того, в спектре образца ГАП-12 наблюдаются линии Mg1s-, 2s-, 2p-электронов адсорбированного магния (рис. 3).
В низкоэнергетической области спектра ГАП наблюдаются линии электронов внешних валентных молекулярных орбиталей (ВМО) от 0 до ~15 эВ и внутренних ВМО от ~15 до ~35 эВ. Наиболее интенсивные максимумы появляются в области энергий связи O2s- и Ca3p-электронов. Структура спектра электронов внешних и внутренних ВМО ГАП, как и следовало ожидать, слабо изменяется при адсорбции небольшого количества магния (рис. 4). Спектр электронов внешних ВМО содержит ряд характерных максимумов. Спектр Mg3s-электронов ГАП-12 имеет малую интенсивность по сравнению со спектрами электронов внешних ВМО ГАП (рис. 4).
Со стороны больших энергий связи электронов внешних ВМО для ГАП-12 при 16.5 эВ наблюдается малоинтенсивный максимум Cl3s-электронов хлора (рис. 4). Со стороны малых энергий связи от линии Ca3p-электронов при 23.1 эВ наблюдается линия O2s-электронов, участвующих в химической связи с образованием внутренних ВМО, тогда как состояния O2p-электронов образуют внешнюю валентную зону. В структуру спектра электронов внешних ВМО заметный вклад вносят состояния P3s-электронов при 12.2 и 23.1 эВ, а состояния P3p-электронов вносят вклад в максимум при 9.8 эВ. Из-за участия в химической связи O2s-электронов их спектр уширен по сравнению с линией O1s-электронов и состоит из нескольких компонент. Структура в области Ca3p- и O2s-электронов связана с участием их оболочек в образовании внутренних ВМО. Ширина валентной полосы у потолка зоны, равная 8.6 эВ для ГАП, и ее структура практически не изменяются с адсорбцией магния. Аналогичная структура наблюдается и в спектрах других образцов ГАП, содержащих Mg. Регистрация валентной области, которая является одной из спектральных характеристик образования нанокристаллической структуры ГАП, важна и для того, чтобы с уверенностью заключить, что на поверхности образца практически отсутствуют неконтролируемые примеси, которые могли появиться в процессе адсорбции магния.
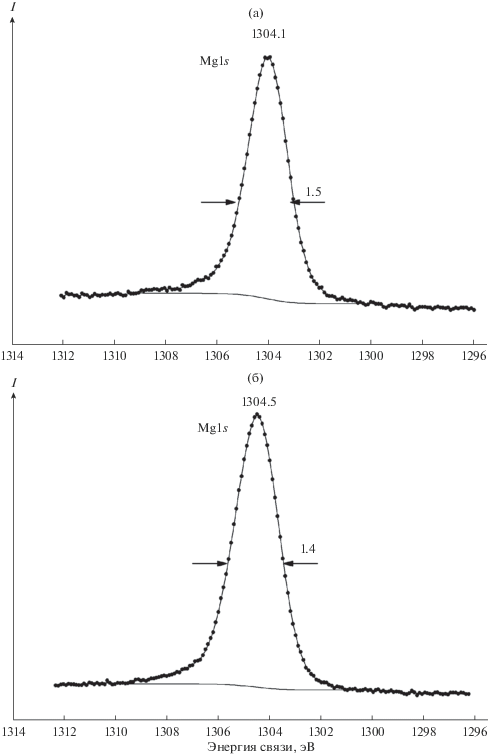
Состав поверхности изученных образцов был определен на основании энергий связи остовных электронов и интенсивностей их линий для ионов: Ca2p-, P2p-, Mg2р-, Mg1s-, Cl2p-, O1s- и C1s-электронов (см. табл. 1, 2). Следует отметить, что энергии связи Mg2s- и Mg2p-электронов и ширина линий магния, адсорбированного на ГАП, превосходят соответствующие значения для MgO (табл. 1). Это обусловлено тем, что магний в ГАП может быть связан с кислородом фосфатной группы ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ или карбонатной группы ${\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}$ на поверхности. Фосфатные группы в ГАП образуют устойчивые тетраэдры, состояние фосфора в которых мало отличается у разных образцов. Действительно, энергия связи Р2р-электронов ГАП не изменяется при адсорбции магния. Поэтому при количественном элементном анализе образцов 1–5 использовали величины интенсивностей линий электронов других элементов по отношению к интенсивности линии P2p-электронов (см. табл. 2). В этом случае наблюдается меньшее содержание кальция в ГАП (образец 1) по сравнению с расчетным значением. Отметим, что экспериментальный состав ГАП в пределах ошибки измерения согласуется с рассчитанным (табл. 2). Дальнейшее уменьшение содержания кальция происходит при адсорбции магния (образцы 2–5). Можно предположить, что магний частично замещает кальций в ГАП.
В качестве эталонных образцов (6–10) для сравнения их энергий связи с энергиями связи изученных образцов (1–5) использовали соединения MgCl2, Mg(OH)2, MgO, CaO, CaCO3 (табл. 1). Из данных табл. 1 видно, что энергии связи Mg2p- и Mg1s-электронов по своим значениям ближе всего к соответствующим величинам для MgCl2 и заметно больше соответствующих величин для Mg(OH)2 и MgO. С увеличением концентрации магния на поверхности образцов (см. табл. 2) наблюдается заметное уширение линии Mg2p-электронов (см. табл. 1). При этом количество атомов хлора становится сравнимым с числом атомов магния (см. табл. 2). Это позволяет предположить, что при адсорбции магния в начальный момент он частично замещает атомы кальция в ГАП, а 10-я (0.15MgCl2/1.5Mg) часть находится в виде MgCl2. Увеличение адсорбированного магния на поверхности приводит к тому, что примерно половина атомов находится в виде MgCl2 (см. табл. 1).
РФЭС Ca2p-электронов ГАП состоит из дублета, связанного со спин-орбитальным расщеплением с ∆Esl = 3.5 эВ. Со стороны больших энергий связи от линии Са2р3/2-электронов наблюдается сателлит небольшой интенсивности (~1%) при 7.8 эВ. При адсорбции магния структура этого спектра изменяется незначительно (см. табл. 1). Энергия связи Са2р3/2-электронов ГАП Eb(Ca2p3/2) = 347.6 эВ остается практически постоянной для изученных образцов. Она превышает соответствующее значение для CaO и даже несколько больше значения для CaCO3. Энергия связи Cl2p3/2-электронов в изученных образцах (2–5) практически не отличается от соответствующего значения для MgCl2 (см. табл. 1).
В спектрах С1s-электронов изученных образцов (1–5) кроме мало интенсивной линии при 285.0 эВ, обусловленной насыщенными углеводородами на поверхности, наблюдается линия карбонатной группы ${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}$ при ~290.0 эВ (см. табл. 1). Концентрация углерода этой группы приведена в табл. 2. Ее концентрация изменяется при переходе от одного образца к другому, и она может участвовать в образовании связи с магнием.
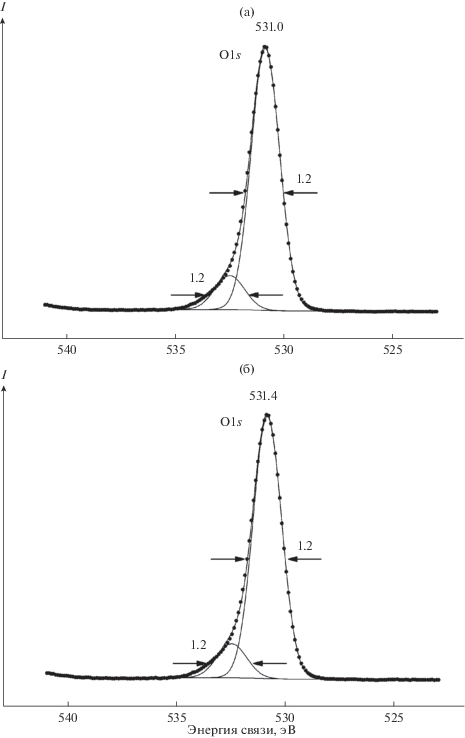
Спектры O1s-электронов изученных образцов содержат одну основную линию, со стороны больших энергий связи от которой наблюдается плечо небольшой интенсивности (рис. 5). Это связано с присутствием на поверхности образцов кислорода гидроксильных групп и воды. Величина энергии связи ~531.4 эВ относится к гидроксильным группам и мостиковым ионам кислорода преимущественно связей P–O–P при наличии определенного вклада связей P–O–Ca и P–O–Mg, а величины энергии связи ~533.0 эВ – к воде в ГАП и адсорбированной на поверхности. Концентрация кислорода тетраэдра ${\text{РО}}_{{\text{4}}}^{{{\text{2}} - }}$ и воды, отмеченная в виде суммы в табл. 2, изменяется с увеличением адсорбции магния на ГАП. С учетом выражения
(1)
${{R}_{{{\text{Э}}--{\text{O}}}}}\left( {{\text{нм}}} \right) = 2.27\,\,{{({{E}_{b}}--519.4)}^{{--1}}}$были оценены длины связей RЭ–O(нм) элемент–кислород. Эти величины для энергий связи O1s-электронов 531.4 и 533.0 эВ (см. табл. 1) соответственно равны 0.189 и 0.167 нм и характеризуют длины связей элемент–кислород на поверхности изученных образцов. Указанные значения являются усредненными для всех длин связей (P–O, Ca–O, Mg–O), присутствующих в рассматриваемых образцах. Выражение (1) получено для оксидов металлов в октаэдрическом окружении, каким является MgO с Eb(O1s) = 530.1 эВ (см. табл. 1). Учитывая выражение (1), для MgO можно найти, что RMg–O = 0.212 нм. Эта величина сравнима с суммой ионных радиусов R(O2–) = 0.136 нм и R(Mg2+) = 0.074 нм, равной 0.210 нм.
ЗАКЛЮЧЕНИЕ
В работе изучена адсорбция ионов Mg2+ на нанокристаллах ГАП и построена ее изотерма при изменении равновесной концентрации магния от 0 до 0.35 моль/л. Для образцов, соответствующих отдельным участкам изотермы, методом РФЭС определена степень окисления элементов поверхности кристаллов ГАП с адсорбированным магнием. Проведено сравнение полученных результатов с данными изотермы адсорбции.
Результаты сравнения дали возможность предположить, что на начальном этапе адсорбции ионы магния частично замещают ионы кальция в ГАП, а меньшая часть адсорбируется в виде MgCl2. С увеличением концентрации ионов магния в растворе концентрация ионов магния на поверхности растет и соотношение между адсорбированными ионами магния и ионами в MgCl2 увеличивается до 1 : 1.
Как и следовало ожидать, концентрация ионов магния на поверхности значительно меньше величин, соответствующих изотерме адсорбции. Это связано с тем, что в методе РФЭС регистрируются только те электроны, которые выходят с глубины в несколько нм, остальная часть ионов магния в объеме остается “невидимой” для этого метода.
Полученные результаты объясняют механизм сорбционного взаимодействия нано-ГАП с ионами магния в широких пределах равновесных концентраций последнего, что необходимо для создания препаратов медицинского назначения на основе ГАП и магния.
Список литературы
Melikhov I.V., Teterin Yu.A., Rudin V.N., Teterin A.Yu., Maslakov K.I., Severin A.V. X-ray Study of Nano-Dispersed Hydroxyapatite // Russ. J. Phys. Chem. A. 2009. V. 83. № 1. P. 91–97.
Webster T.J., Massa-Schlueter E.A., Smith J.L., Slamovich E.B. Osteoblast Response to Hydroxyapatite Doped with Divalentand Trivalent Cations // Biomaterials. 2004. V. 25. P. 2111–2121.
Narasaraju T.S.B., Phebe D.E. Review: Some Physico-chemical Aspects of Hydroxylapatite // J. Mater. Sci. 1996. V. 3. P. 11–21.
Зуев В.П., Панкратов А.С., Алексеева А.Н. Применение гидроксиапатита ультравысокой дисперсности в комплексном лечении больных с переломами нижней челюсти // Стоматология. 1994. № 4. С. 31–33.
Janning C., Willbold E., Vogt C., Nellesen J., Meyer-Lindenberg A., Windhagen H., Thorey F., Witte F. Magnesium Hydroxide Temporarily Enhancing Osteoblast Activity and Decreasing the Osteoclast Number in Peri-implant Bone Remodeling // ActaBiomaterialia. 2010. V. 6. P. 1861–1868.
Мелихов И.В., Комаров В.Ф., Северин А.В., Божевольнов В.Е., Рудин В.Н. Двумернокристаллический гидроксиапатит // ДАН. 2000. Т. 373. № 3. С. 355–358.
Suvorova E.I., Buffat P.A. Electron Diffraction from Micro- and Nanopartical of Hydroapatite// J. Microscopy. 1999. V. 196. № 1. P. 46–58.
Shirley D.A. High-Resolution X-Ray Photoemission Spectrum of the Valence Bands of Gold // Phys. Rev. B. 1972. V. 5. P. 4709–4714.
Нефедов В.И. Рентгеноэлектронная спектроскопия химических соединений. М.: Химия, 1984. 256 с.
Sosulnikov M.I., Teterin Yu.A. X-ray Photoelectron Studies of Ca, Sr, Ba and their Oxides and Carbonates // J. Electron. Spectrosc. Relat. Phenom. 1992. V. 59. P. 111–126.
NIST X-ray Photoelectron Spectroscopy Database, Version 4.1 (National Institute of Standards and Technology, Gaithersburg, 2012). https://doi.org/10.18434/T4T88K
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы