Неорганические материалы, 2020, T. 56, № 11, стр. 1188-1193
Синтез, структура и свойства наноразмерного диборида титана
А. А. Винокуров 1, Д. Ю. Ковалев 2, И. И. Коробов 1, О. В. Кравченко 1, С. В. Коновалихин 2, Н. Ю. Хоменко 2, Г. В. Калинников 1, С. Е. Надхина 1, С. П. Шилкин 1, *
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. академика Семенова, 1, Россия
2 Институт структурной макрокинетики и проблем материаловедения им А.Г. Мержанова
Российской академии наук
142432 Московская обл., Черноголовка, ул. академика Осипьяна, 8, Россия
* E-mail: ssp@icp.ac.ru
Поступила в редакцию 03.03.2020
После доработки 19.06.2020
Принята к публикации 30.06.2020
Аннотация
Различными методами физико-химического анализа исследованы продукты взаимодействия TiCl4 c NaBH4 в ионных расплавах NaCl/KCl или KBr под давлением аргона 5 МПа при 973 и 1023 К. Показано, что в этих условиях образуются наночастицы TiB2, кристаллизующиеся в гексагональной сингонии, пр. гр. P6/mmm, структурный тип AlB2, периоды решетки: a = 0.3022–0.3025 нм, с = = 0.3214–0.3221 нм. Диаметры частиц наноразмерного TiB2 в зависимости от температуры, оцененные из данных электронной микроскопии, измерения удельной поверхности и области когерентного рассеяния, составляют ~10 и ~15, ~12 и ~17 нм, ~5 и ~10 нм соответственно.
ВВЕДЕНИЕ
Диборид титана (TiB2), сочетающий в себе высокую температуру плавления (3498 К), высокую твердость (≥25 ГПа), высокий модуль упругости (≥450 ГПа) с низким удельным сопротивлением (10–30 Ом см), высокой теплопроводностью (60–120 Вт/(м К)), химической и коррозионной устойчивостью в реакционных газовых и жидких средах, низкой плотностью (4.5 г/см3), находит реальное применение в различных областях современной техники и промышленности [1–5]. В настоящее время интерес к дибориду титана и родственным ему соединениям заметно возрос в связи с созданием на их основе наноматериалов с высоким и разнообразным уровнем физико-химических, механических и других свойств, существенно отличающихся от свойств микрокристаллических аналогов (см., например, [6, 7]).
Наноразмерный диборид титана может быть получен при термолизе производных борогидрида титана при температуре ~488 К [8, 9], например по схеме
(1)
$\begin{gathered} {\text{Ti}}{{\left( {{\text{B}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} \cdot nSol{v}{\text{ }}\xrightarrow{t} \\ \to {\text{Ti}}{{{\text{B}}}_{{\text{2}}}} + 0.{\text{5}}{{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{4}}.{\text{5}}{{{\text{H}}}_{{\text{2}}}} + nSol{v}{\text{,}} \\ \end{gathered} $(2)
$\begin{gathered} {\text{TiC}}{{{\text{l}}}_{{\text{3}}}} + {\text{2LiB}}{{{\text{H}}}_{{\text{4}}}} + {\text{LiH}}\xrightarrow{t} \\ \to {\text{Ti}}{{{\text{B}}}_{{\text{2}}}} + {\text{3LiCl}} + {\text{4}}.{\text{5}}{{{\text{H}}}_{{\text{2}}}}. \\ \end{gathered} $При термической обработке до ~873 К предварительно активированной в высокоэнергетической мельнице смеси LiBH4 с TiО2 получен TiB2 с размером кристаллитов в несколько нанометров [11]. Наночастицы TiB2 могут быть получены при механохимическом взаимодействии микрокристаллических титана и бора в высокоэнергетической мельнице [12]. Наноразмерный диборид титана образуется также при взаимодействии борогидрида натрия с TiCl4 при повышенных температурах и давлениях [13, 14] или Ti с BBr3 в присутствии натрия при 673 К [15], а также карботермическим методом [16] по реакции
(3)
${\text{Ti}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{5C}}\xrightarrow{t}{\text{Ti}}{{{\text{B}}}_{{\text{2}}}} + {\text{5CO,}}$а также магнийтермическим восстановлением смесей оксидов титана и бора в расплаве LiCl/KCl [17]. Кроме того, наноразмерный диборид титана образуется при взаимодействии порошкообразных бора и титана в ионном расплаве Na2B4O7 [18].
Каждая из перечисленных методик имеет свои преимущества и недостатки. Одни из них позволяют получать наночастицы с малым содержанием примесей, но с низкой производительностью, другие обеспечивают образование наночастиц диборида титана стехиометрического состава и определенного размера при невысоких температурах, однако требуют сложного аппаратурного оформления и т.д.
Целью данной работы является изучение возможности образования наночастиц TiB2 при гетерофазном взаимодействии TiCl4 с NaBH4 в ионных расплавах NaCl/KCl или KBr и исследование их физико-химических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные реагенты. Борогидрид натрия с чистотой >99.5% получали перекристаллизацией технического препарата из 1N раствора NaOH и сушили в вакууме 1.33 × 10–1 Па при 373 K. В работе использовали товарный TiCl4 марки ОТТ –О, который перед синтезом перегоняли в вакууме над медной стружкой; KCl, NaCl, KBr квалификации “х. ч.”; аргон высокой чистоты (99.998%, ТУ 2114 – 005 – 0024760 – 99). Источником водорода с чистотой не менее 99.999% служил автономный лабораторный генератор водорода, содержащий в качестве рабочего материала гидридные фазы на основе интерметаллидов LaNi5 и TiFe, принцип действия которого подробно описан в [19, 20].
Методы анализа. Рентгенофазовый анализ (РФА) полученных наночастиц TiB2 проводили на дифрактометре ДРОН-3 с монохроматором на вторичном пучке. Регистрацию рентгенограмм вели в режиме пошагового сканирования на излучении CuKα в интервале углов 20°–90° (2θ) с шагом съемки 0.02° и экспозицией 4 с в точке. Профильный анализ рентгенограмм осуществляли в программном пакете “Буревестник”. Расчет метрики ячейки и параметров тонкой структуры проводили по 8 отражениям. Инструментальное уширение учитывали по уширению линий эталона – LaB6 (SRM 660b). Для расчета размера кристаллитов D – областей когерентного рассеяния (ОКР) – использовали метод вторых моментов.
Термические исследования выполняли методом синхронного термического анализа на термоанализаторе Netzch STA 409 PC Luxx, сопряженном с квадрупольным масс-спектрометром QMS 403 C Aёolos при линейном нагреве образца со скоростью 10 К/мин в потоке аргона в интервале температур от 293 до 1273 К.
Электронно-микроскопические исследования и рентгеновский энергодисперсионный анализ осуществляли на комплексе, состоящем из растрового сканирующего автоэмиссионного электронного микроскопа Zeiss Supra 25 и рентгеноспектральной установки INCA x-sight. Электронные микрофотографии получали при низких ускоряющих напряжениях электронного пучка (~4 кВ). При таких ускоряющих напряжениях вклад в регистрируемый сигнал от подложки минимален либо отсутствует вовсе. Рентгеновский энергодисперсионный анализ осуществляли при ускоряющем напряжении ~8 кВ.
Для уточнения качественного состава поверхности порошков диборида титана регистрировали рентгеновские фотоэлектронные спектры (РФЭС) на электронном спектрометре для химического анализа PHOIBOS 150 MCD. Удельную поверхность образцов (Sуд) находили по величине адсорбции криптона при температуре жидкого азота после удаления из твердой фазы летучих примесей в вакууме 1.33 × 10–3 Па при температуре 373 К и рассчитывали по методу БЭТ. Площадь, занимаемую адсорбированным атомом криптона, принимали равной 19.5 × 10–20 м2. Ошибка определения не превышала ±10%. Из данных измерения Sуд проводили оценку размера частиц TiB2 в предположении их сферической формы по известной формуле dx = 6/(γSуд), где dx – размер частиц, γ – рентгеновская плотность.
Содержание бора, титана, хлорид-, бромид-ионов и кислорода определяли по стандартным аналитическим методикам, а также рентгеновским энергодисперсионным анализом. Содержание водорода определяли на CHNS/O-элементном анализаторе Vario EL cube Elementar. Давление в системе измеряли образцовыми манометрами класса точности 0.4.
Методика эксперимента. Взаимодействие TiCl4 с NaBH4 в ионных расплавах NaCl/KCl или KBr осуществляли следующим образом: в реактор-автоклав из нержавеющей стали в атмосфере аргона высокой чистоты помещали кварцевую ампулу с тетрахлоридом титана, борогидридом натрия и эвтектикой 50 мол. % NaCl + 50 мол. % KCl или KBr. Реактор-автоклав охлаждали до 173 К и вакуумировали в течение 5 мин, заполняли аргоном под давлением 5 МПа и нагревали в течение заданного времени при температуре 973 или 1023 К. Температуры проведения реакции (973 и 1023 К) были выбраны исходя из температур плавления эвтектики 50 мол. % NaCl + 50 мол. % KCl (931 К) или KBr (1007 K). Давление аргона в реакторе-автоклаве, равное 5 МПа, создавали выше критического давления для TiCl4 (pк = 4.57 МПа), NaBH4 брали в заведомом избытке по отношению к TiCl4 (мольное соотношение реагентов 1 : 10).
Далее температуру в реакторе доводили до комнатной и продукты реакции вакуумировали еще в течение 0.5 ч. После вскрытия реактора в атмосфере аргона полученную реакционную массу последовательно обрабатывали охлажденной дистиллированной водой, ацетоном, этиловым спиртом и вакуумировали при 313 К в течение 5–6 ч до остаточного вакуума 1.3 × 10–1 Па. Затем полученный порошок снова помещали в реактор, обрабатывали водородом из водородного аккумулятора в проточном режиме под давлением 5 МПа при 373 К по методике [21] и затем снова вакуумировали при комнатной температуре до остаточного вакуума 1.33 × 10–1 Па. Полученное вещество выгружали из реактора в атмосфере аргона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
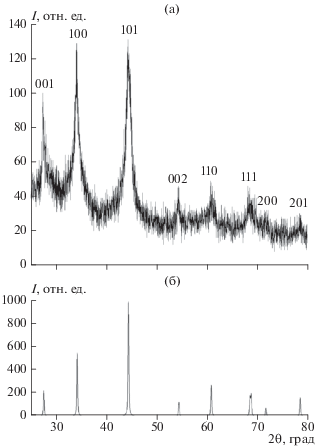
В табл. 1 представлены результаты исследования взаимодействия TiCl4 с NaBH4 под давлением аргона при продолжительности реакции 5–7 ч в ионных расплавах NaCl/KCl или KBr. Полученный диборид титана, по результатам химического и энергодисперсионного анализов, имеет состав TiB2.0–2.02O0.01–0.03, следов хлорид-, бромид-ионов и водорода в нем не обнаружено. Результаты РФА свидетельствуют о том, что наночастицы диборида титана кристаллизуются в гексагональной сингонии, пр. гр. P6/mmm, структурный тип AlB2 (рис. 1а) с периодами решетки (табл. 1), которые не противоречат данным [13–15, 18] и согласуются с рентгенодифракционной базой данных ICDD PDF-2 (рис. 1б). Значимого количества примесных фаз не обнаружено.
Таблица 1.
Условия и результаты взаимодействия TiCl4 с NaBH4 в ионном расплаве NaCl/KCl или KBr и без него
Результаты термического анализа, РФА и электронной микроскопии указывают на то, что при нагревании в атмосфере аргона от 293 до 1273 К наночастицы диборида титана, полученные рассмотренным методом, не испытывают заметных превращений, связанных с выделением, поглощением тепла, изменениями массы, размера и формы частиц, периодов кристаллической решетки и ОКР, что говорит об их высокой термостабильности.
В табл. 2 сопоставлены средние диаметры частиц TiB2, оцененные из данных электронно-микроскопических и рентгенографических исследований, а также по результатам измерения удельной поверхности. На рис. 2 представлены электронные микрофотографии частиц порошка TiB2, полученных при 973 (а), 1023 К (б) в ионном расплаве NaCl/KCl и при 1023 К в ионном расплаве KBr (в). По данным сканирующей электронной микроскопии, форма частиц диборида титана, синтезированных при температурах 973 и 1023 К в ионных расплавах NaCl/KCl и KBr, не осколочная, а близка к сферической, что характерно для соединений, полученных в результате прохождения химической реакции. Размер частиц TiB2, по данным электронной микроскопии, хорошо согласуется с результатами оценки эквивалентного диаметра частиц TiB2 исходя из определения удельной поверхности частиц TiB2 методом БЭТ (табл. 2). С повышением температуры синтеза размеры частиц TiB2 увеличиваются. Полученные наночастицы TiB2 преимущественно агрегированы.
Таблица 2.
Средний диаметр частиц TiB2, полученных при взаимодействии TiCl4 с NaBH4 в ионном расплаве NaCl/KCl или KBr и без него при температурах 973 и 1023 K
Рис. 2.
Электронные микрофотографии наночастиц порошка TiB2, полученных при 974 (а), 1023 К в ионном расплаве NaCl/KCl (б) и при 1023 К в ионном расплаве KBr (в).

Для уточнения качественного состава поверхности наночастиц TiB2 регистрировали их РФЭС. Наряду с линиями, характерными для диборида титана (187.5–187.7 эВ – B1s; 454.2–454.4 эВ – Ti2p3/2), присутствуют слабые линии, соответствующие оксидам бора и титана (193.7–193.8; 463.2–463.3 и 468.7–468.2 эВ), что находится в соответствии с литературными данными.
Новизна предлагаемой методики синтеза TiB2 заключается в проведении реакции между TiCl4 и NaBH4 в ионном расплаве, что позволяет по сравнению с взаимодействием TiCl4 и NaBH4 в его отсутствие получать при меньших временах синтеза более мелкие наноразмерные частицы TiB2 без их консолидации при высоких температурах взаимодействия исходных реагентов, препятствием чему является присутствие расплава NaCl/KCl или KBr.
В работе [13] в интервале температур 773–973 К была предложена возможная реакция образования наноразмерного диборида титана
(4)
${\text{TiC}}{{{\text{l}}}_{{\text{4}}}} + 2{\text{NaB}}{{{\text{H}}}_{4}} = {\text{Ti}}{{{\text{B}}}_{2}} + 2{\text{NaCl}} + 2{\text{HCl}} + 3{{{\text{H}}}_{2}},$а при T < 723 К взаимодействие TiCl4 с NaBH4, по-видимому, может происходить по реакции
(5)
$\begin{gathered} {\text{2TiC}}{{{\text{l}}}_{{\text{4}}}} + 2{\text{NaB}}{{{\text{H}}}_{4}} = \\ = \,\,{\text{Ti}}{{{\text{B}}}_{2}} + {\text{Ti}}{{{\text{H}}}_{2}} + 2{\text{NaCl}} + 6{\text{HCl}}. \\ \end{gathered} $Нами был проведен расчет термодинамических параметров для реакций (4), (5) в температурном интервале 623–1073 K (табл. 3). Для расчета использовали справочные данные [22]. Как следует из полученных данных, тепловой эффект и изменение энтропии в реакциях (4) и (5) практически не зависят от температуры, при этом реакция (4) является экзотермической, а реакция (5) эндотермической. Расчеты изменения энергии Гиббса в этих реакциях говорят о том, что реакция (4) в данном температурном интервале энергетически более выгодна и более вероятна, чем реакция (5).
Таблица 3.
Расчет термодинамических параметров для реакций (4), (5) в температурном интервале 623–1073 K
| Т, К | ΔН, кДж/моль | ΔS, Дж/(моль К) | ΔG, кДж/моль | ΔН, кДж/моль | ΔS, Дж/(моль К) | ΔG, кДж/моль |
|---|---|---|---|---|---|---|
| (4) | (5) | |||||
| 623 | –135.8 | 390.4 | –379.0 | 104.6 | 399.1 | –144.0 |
| 673 | –135.8 | 390.3 | –398.5 | 103.7 | 397.7 | –163.9 |
| 723 | –136.0 | 390.0 | –418.0 | 102.7 | 396.3 | –183.8 |
| 773 | –136.3 | 389.7 | –437.5 | 101.9 | 395.2 | –203.6 |
| 823 | –136.5 | 389.3 | –457.0 | 101.1 | 394.2 | –223.3 |
| 873 | –136.8 | 389.0 | –476.4 | 100.5 | 393.4 | –243.0 |
| 923 | –137.0 | 388.8 | –495.9 | 99.9 | 392.9 | –262.7 |
| 973 | –137.2 | 388.6 | –515.3 | 99.6 | 392.5 | –282.3 |
| 1023 | –137.2 | 388.6 | –534.7 | 99.5 | 392.4 | –301.9 |
| 1073 | –137.1 | 388.7 | –554.2 | 99.5 | 392.4 | –321.5 |
ЗАКЛЮЧЕНИЕ
Методами рентгенографии, сканирующей электронной микроскопии, РФЭС, термического, энергодисперсионного и элементного анализов, измерения удельной поверхности исследованы продукты взаимодействия TiCl4 c NaBH4 в ионных расплавах NaCl/KCl или KBr под давлением аргона 5 МПа при 973 и 1023 К. Показано, что в этих условиях образуются наночастицы TiB2, кристаллизующиеся в гексагональной сингонии, пр. гр. P6/mmm, структурный тип AlB2, с периодами решетки a = 0.3022–0.3025 нм, с = = 0.3214–0.3221 нм. Диаметры частиц наноразмерного TiB2 в зависимости от температуры, оцененные из данных электронной микроскопии, измерения удельной поверхности и ОКР, составляют ~10 и ~15 нм, ~12 и ~17 нм, ~5 и ~10 нм соответственно.
Список литературы
Berger M., Hogmark S., Karlsson L., Larsson M. Low Stress TiB2 Coatings with Improved Tribological Properties // Thin Solid Films. 2001. V. 401. № 1–2. P. 179–186.
Agarwal A., Dahotre N.B. Laser Surface Engineering of Steel for hard Refractory Ceramic Composite Coating // Int. J. Refract. Met. Hard Mater. 1999. V. 17. P. 283–293.
Cardarelli F. Material Handbook. Charm: Springer, 2018. P. 936–937.
Ефимова К.А., Галевский Г.В., Руднева В.В. Современное состояние производства диборида титана: оценка, определение доминирующих тенденций и перспектив // Научно-технические ведомости CПбПУ. Естественные и инженерные науки. 2017. Т. 23. № 2. С. 144–158.
Самсонов Г.В., Серебрякова Т.И., Неронов В.А. Бориды. М.: Атомиздат, 1975. 376 с.
Andrievski R.A., Khatchoyan A.V. Nanomaterials in Extreme Environments, Fundamentals and Applications. Berlin: Springer, 2016. 107p.https://doi.org/10.1007/978-3-319-25331-2
Андриевский Р.А. Наноструктурные дибориды титана, циркония и гафния: синтез, свойства, размерные эффекты и стабильность // Успехи химии. 2015. Т. 84. Вып. 5. С. 540–554. https://doi.org/10.1070/RCR4469
Jensen J.A., Gozum J.E., Pollina D.M., Girolami G.S. Titanium, Zirkonium and Hafnium Tetrahydroborates as “tailored” CVD Precursors for Metal Diboride Thin Films // J. Am. Chem. Soc. 1988. V. 110. № 5. P. 1643–1644.https://doi.org/10.1021/ja00213a058
Andrievski R.A., Kalinnikov G.V., Kravchenko S.E., Tarasov B.P., Shilkin S.P. Synthesis of Boride Ultrafine Powders and Films // Abstracts Papers Am. Chem. So. 1995. V. 210. P. 156-PMSE (2).
Kim J.W., Shim J.-H., Ahn J.-P., Cho Y.W., Kim J.-H., Oh K.H. Mechanochemical Synthesis and Characterization of TiB2 and VB2 Nanopowders // Mater. Lett. 2008. V. 62. P. 2461–2464. https://doi.org/10.1016/j.matlet.2007.12.022
Pan W.Y., Qian W.B., Mao Y.J., Liu B.H., Li Z.P. Low-Temperature Synthesis of Nanosized Metal Borides Through Reaction of Lithium Borohydride with Metal Hydroxides or Oxides // J. Alloys Comp. 2015. V. 651. P. 666–672. https://doi.org/10.1016/j.jallcom.2015.08.149
Tang W.M., Zheng Z.X., Wu Y.C., Wang J.M., Lű J., Liu J.W. Synthesis of TiB2 Nanocrystalline Powder by Mechnical Alloying // Trans. Nonferrous. Met. Soc. China. 2006. V. 16. P. 613–617.
Chen L., Gu Y., Qian Y., Chi L., Yang Z., Ma J. A Facile One-Step Route to Nanocrystalline TiB2 Powders // Mater. Res. Bull. 2004. V. 39. P. 609–613.https://doi.org/10.1016/j.materresbull.2003.12.005
Кравченко С.Е., Торбов В.И., Шилкин С.П. Получение наноразмерного порошка диборида титана // Неорган. материалы. 2010. Т. 46. № 6. С. 691–693.
Chen L., Gu Y., Shi L., Yang Z., Ma J., Qian Y. A Reduction – Boronation Route to Nanocrystalline Titanium Diboride // Solid State Commun. 2004. V. 130. P. 231–233.https://doi.org/10.1016/j.ssc.2004.01.037
Gorlanov E.S., Bazhin V.Yu., Fedorov S.N. Carbothermic Synthesis of Titanium Diboride: Upgrade //J.Sib. Fed. Univ. Chem. 2018. V. 11. № 2. P. 156–166. https://doi.org/10.17516/1998-2836-0065
Javadi A., Pan S., Cao C., Yao G., Li X. Facile Synthesis of 10 nm Surface clean TiB2 Nanoparticles // Mater. Lett. 2018. V. 229. P. 107–110. https://doi.org/10.1016/j.matlet.2018.06.054
Волкова Л.С., Шульга Ю.М., Шилкин С.П. Синтез наноразмерного диборида титана в расплаве безводного тетраборнокислого натрия // Журн. общ. химии. 2012. Т. 82. Вып. 5. С. 709–712.
Фокин В.Н., Фокина Э.Э., Шилкин С.П. Синтез гидридов некоторых металлов в крупнокристаллическом состоянии // Журн. общ. химии. 1996. Т. 66. Вып. 8. С. 1249–1252.
Fokin V.N., Fokina E.E., Tarasov B.P., Shilkin S.P. Synthesis of the Tetragonal Titanium Dihydride in Ultradispersed State // Int. J. Hydrogen Energy. 1999. V. 24. № 2–3. P. 111–114. https://doi.org/10.1016/S0360-3199(98)00070-6
Фокин В.Н., Троицкая С.Л., Фокина Э.Э., Румынская З.А., Шилкин С.П. О взаимодействии гидрида титана с кислородом // Журн. общ. химии. 1992. Т. 62. Вып. 8. С. 1719–1725.
NIST-JANAF Thermochemical Tables. 1998. https://doi.org/10.18434/T42S31
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы