Неорганические материалы, 2020, T. 56, № 12, стр. 1317-1327
Нанотубулярный гидросиликат никеля и продукты его термического отжига в качестве анодных материалов литий-ионных аккумуляторов
Е. К. Храпова 1, 2, *, И. С. Ежов 3, А. М. Румянцев 1, В. В. Жданов 1, А. А. Красилин 1
1 Физико-технический институт им. А.Ф. Иоффе Российской академии наук
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
2 Санкт-Петербургский государственный электротехнический университет “ЛЭТИ” им. В.И. Ульянова (Ленина)
197376 Санкт-Петербург, ул. Профессора Попова, 5, Россия
3 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, ул. Политехническая, 29, Россия
* E-mail: e.k.khrapova@mail.ioffe.ru
Поступила в редакцию 09.01.2020
После доработки 08.07.2020
Принята к публикации 17.07.2020
Аннотация
Исследовалась работа нанотубулярного гидросиликата никеля и его производных в качестве отрицательного электрода литий-ионного аккумулятора. Гидросиликат никеля состава Ni3Si2O5(OH)4 был синтезирован в гидротермальных условиях (350°C, 14 МПа, 10 ч). Получение его производных осуществлялось термическим отжигом при температурах 400, 600 и 1000°C. При этом тубулярная структура частиц сохранялась вплоть до 600°C, а при 1000°C формировался хорошо окристаллизованный Ni2SiO4. Заряд/разряд проводился в диапазоне напряжений 0.05–3 В при удельном токе 10 мА/г. Было показано, что термическая обработка способствовала увеличению разрядной емкости и обратимой емкости на первом цикле. Наиболее высокие показатели продемонстрировал образец, обработанный при 400°C, – его разрядная емкость достигла 678 мА ч/г, а обратимая емкость на первом цикле составила 58% и около 85% на последующих циклах.
ВВЕДЕНИЕ
С момента разработки современных литий-ионных аккумуляторов (ЛИА) [1] и начала их производства [2] ведется поиск новых материалов для них с целью улучшения рабочих характеристик. Повышение количества циклов работы и удельной емкости, безопасность при эксплуатации, время заряда/разряда являются приоритетными задачами [3, 4]. В массовом производстве ЛИА в качестве катодов применяются LiCoO2, а также смешанные оксиды лития и переходных металлов [5–8], LiFePO4 [9–12], LiMn2O4 [13–16], а в качестве анода – графит с теоретической емкостью 372 мА ч/г [2, 5]. Немаловажную роль играет электролит, который для обеспечения эффективной работы ЛИА должен обладать хорошей ионной проводимостью и стабильной работой в определенных условиях [17]. Одной из особенностей работы ЛИА является образование защитного слоя на первом цикле работы на отрицательном электроде – Solid Electrolyte Interface (SEI) [18]. Этот слой представляет собой разложившийся электролит, который способствует сохранению отрицательного электрода и предотвращает дальнейшее разложение электролита при работе ЛИА [4, 19].
Поскольку для используемых в настоящее время материалов значения эффективности работы близки к максимальным, ведется поиск новых материалов, которые потенциально могут продемонстрировать более высокие емкостные характеристики. Одним из самых перспективных анодных материалов считается кремний, обладающий теоретической удельной емкостью 4200 мА ч/г [20–22]. Однако интеркаляция ионов лития сопровождается увеличением удельного объема материала, что приводит к механическому разрушению электрода. Это характерно также для ряда материалов на основе кремния, олова и некоторых других элементов, способных вместить большое количество ионов лития [23–25]. В связи с этим ряд исследований направлен на создание наноструктурированных анодных материалов [26, 27].
На данный момент активно исследуется работа 1D-материалов в составе ЛИА [28–31], в частности, нанотрубок, которые потенциально могут обеспечить более эффективную работу ЛИА за счет наличия ионной и электронной проводимостей [32]. Наличие полого канала может предоставить дополнительную область для “хранения” ионов лития, а также увеличивает удельную поверхность материала в целом [33].
Перспективным кандидатом на роль анодного материала для ЛИА и других устройств хранения энергии может служить нанотубулярный гидросиликат никеля со структурой пекораита. Он представляет собой многостенный наносвиток, содержащий около 25 слоев в стенке [34]. Внешний диаметр находится в диапазоне 15–70 нм, внутренний составляет 5–15 нм, а длина наносвитка может быть несколько мкм [35–38]. Каждый слой состоит из двух подслоев. Внешний представляет собой октаэдры NiO6, которые двумя вершинами связаны с тетраэдрами SiO4, образующими внутренний подслой. Размерное несоответствие двух подслоев приводит к изгибу слоя [34, 39].
В работе [40] показано, что данные материалы достигают высоких значений разрядной емкости, но после первого цикла она заметно падает. В работе [41] гидросиликат никеля использовался в составе композитного материала для суперконденсаторов, демонстрируя высокие эксплуатационные характеристики.
В данной работе исследуется влияние термического отжига на структурно-морфологические особенности нанотубулярного гидросиликата никеля и его эксплуатационные характеристики при работе в качестве материала отрицательного электрода ЛИА. Предполагается, что термический отжиг должен привести к повышению эффективности работы ЛИА вследствие удаления структурно связанной воды сначала из приповерхностных слоев, а затем и из объема наносвитков.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез нанотубулярного гидросиликата никеля. В качестве исходных реагентов использовались NiCl2 · 6H2O (“х. ч.”), SiO2 (аэросил марки А-300), NaOH (“х. ч.”). Из расчета мольного соотношения Ni : Si = 3 : 2 необходимое количество SiO2 диспергировалось в 1 М водном растворе NaOH при постоянном перемешивании в течение 12 ч до полного растворения, затем по каплям добавлялся 0.5 M водный раствор NiCl2. Полученный осадок отмывался дистиллированной водой декантацией до отсутствия в растворе хлорид-ионов, что проверялось с помощью качественной реакции с раствором нитрата серебра. После этого осадок высушивался на воздухе при температуре 100°C и измельчался в агатовой ступке.
Высушенный и измельченный осадок массой 2 г подвергался гидротермальной обработке при постоянном перемешивании, температуре 350°C и давлении 14 МПа в течение 10 ч в сосуде высокого давления из нержавеющей стали. В качестве гидротермальной среды использовался 0.1 М водный раствор NaOH. Затем продукт гидротермальной обработки отмывался дистиллированной водой декантацией до нейтральной реакции раствора и высушивался на воздухе при температуре 100°C. Аналогичным образом для дальнейшего термического отжига были подготовлены еще три образца.
Продукты гидротермальной обработки подвергались термическому отжигу на воздухе при температурах 400, 600 и 1000°C при скорости нагрева 5°С/мин и времени изотермической выдержки 12 ч. По истечении времени выдержки образцы охлаждались вместе с печью.
Изготовление рабочих электродов. Для создания анодных материалов готовился раствор поливинилиденфторида Solef 5130 (Solvay) в N-метилпирролидоне в массовом соотношении 1 : 10. В данный раствор добавлялась навеска сажи марки Super C65 (Timcal). К полученной суспензии добавлялась навеска порошка исследуемого материала (около 1 г). Расчетное массовое соотношение активный материал/сажа/сухое связующее составляло 90/5/5. Суспензия наносилась на медную фольгу с помощью лабораторной намазочной машины AFA-I (MTI) и ракельного станка, обеспечивающего фиксированный зазор между его лезвием и фольгой 200 мкм.
Заготовка электрода сушилась в течение 20 мин в предварительно нагретом сушильном шкафу с усиленной конвекцией при температуре 100°C. После сушки заготовка электрода прокатывалась на прокатном стане. Из заготовки электрода с помощью штампа вырубались электроды диаметром 15 мм. Полученные электроды сушились в течение 10 ч под вакуумом в форкамере перчаточного бокса OmniLab (Vacuum Atmospheres) при температуре 110°C. Далее в этом перчаточном боксе, заполненном аргоном, проводилась сборка дисковых макетов аккумуляторов (электрохимических ячеек) с рабочим электродом из исследуемого материала и вспомогательным электродом из металлического лития в пуговичных элементах типоразмера R2032. В качестве сепаратора использовался Celgard 2325 (Celgard), в качестве электролита – TC-E 918 (Tinci), представляющий собой 1 М раствор LiPF6 в смеси органических карбонатов.
Формировка (первый заряд) и циклирование изготовленных макетов проводились на автоматизированном зарядно-разрядном стенде CT3008W-5V10mA (Neware) в диапазоне напряжений от 0.05 до 3 В при удельном токе 10 мА/г. После испытаний (6 циклов) и делитирования (при удельном токе 10 мА/г до 3 В) макеты были аккуратно разобраны в сухом перчаточном боксе, исследуемые электроды отмыты в диметилкарбонате.
Характеристика образцов. Фазовый состав продуктов гидротермальной обработки и термического отжига, а также анодных материалов после циклирования исследовался методом порошковой рентгеновской дифракции с использованием дифрактометра Rigaku SmartLab 3 (CuKα-излучение). Расшифровка рентгеновских дифрактограмм проводилась с помощью базы данных ICDD PDF-2. Морфология продуктов гидротермальной обработки и термического отжига исследовалась на растровом электронном микроскопе (РЭМ) FEI Quanta 200. Элементный состав образцов определялся с помощью встроенного рентгеноспектрального Si(Li)-микроанализатора (РСМА) марки EDAX. Удельную поверхность определяли методом низкотемпературной адсорбции азота на приборе Micromeritics ASAP 2020. Предварительно образцы подвергались дегазации под вакуумом при температуре 90°С в течение 3 ч. Измерения проходили в диапазоне относительных давлений p/p0 0.05–0.3. Обсчет изотерм адсорбции проводился с помощью теории Брунауэра–Эммета–Теллера (БЭТ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
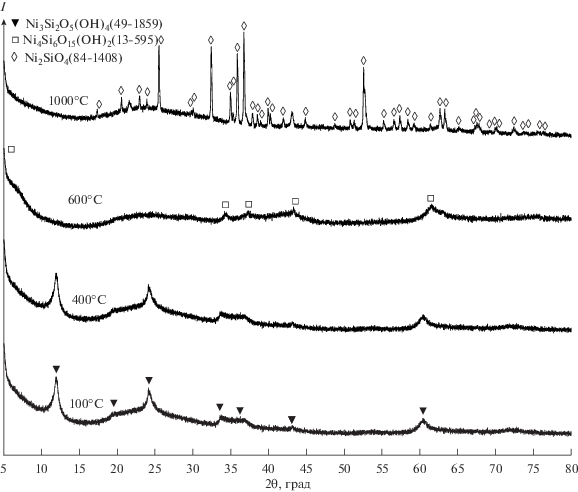
Физико-химическая характеристика образцов. Рентгеновские дифрактограммы продуктов гидротермальной обработки (ГТО) и термического отжига приведены на рис. 1. Основной фазой, образовавшейся в процессе ГТО, является нанотубулярный пекораит Ni3Si2O5(OH)4. Данная кристаллическая структура сохраняется после термического отжига при 400°C. В образце, обработанном при 600°C, наблюдается фазовый переход из пекораита в фазу со структурой, аналогичной структуре сепиолита Mg4Si6O15(OH)2 [42]. Слабая кристалличность данной фазы может быть связана с изначальным несоответствием заданного по синтезу стехиометрического соотношения Ni : Si (3 : 2) характерному мольному отношению этих элементов в фазе со структурой сепиолита (2 : 3). Также слабая кристалличность сепиолитоподобной фазы может быть вызвана тем, что она образуется из нанотубулярной формы вещества с отсутствием (в классическом понимании) трансляционной симметрии. Увеличение температуры термического отжига до 1000°C приводит к формированию новой хорошо окристаллизованной фазы ортосиликата никеля Ni2SiO4, которая могла сформироваться при данных условиях, вероятно, из-за небольшого количества примесного железа, попавшего в образец на этапе ГТО [43, 44].
Рис. 1.
Рентгеновские дифрактограммы продуктов гидротермальной обработки и термического отжига при 400, 600 и 1000°С.
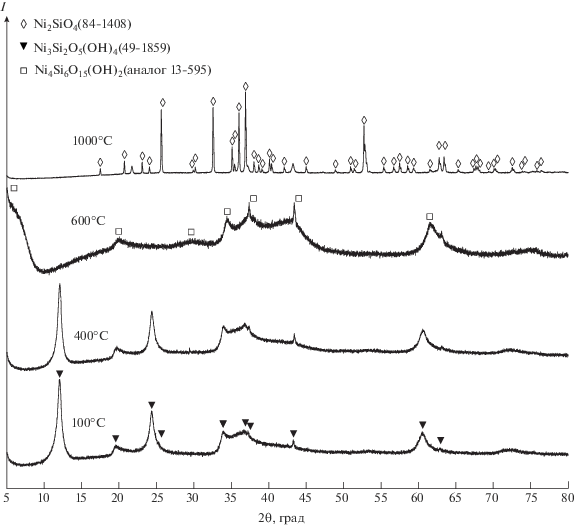
РЭМ-снимки продуктов ГТО и термического отжига представлены на рис. 2. В результате ГТО образовались частицы волокнистой формы с внешним диаметром до 100 нм и наблюдаемой длиной около 4 мкм, склонные к образованию агрегатов размером в несколько десятков мкм. Общая морфология частиц сохранялась при термическом отжиге вплоть до 600°С (рис. 2в). Дальнейшее повышение температуры до 1000°C в данном случае привело к разрушению нанотубулярной морфологии и спеканию материала с образованием Ni2SiO4, по данным рентгенофазового анализа.
Рис. 2.
РЭМ-снимки продуктов гидротермальной обработки (а) и термического отжига при 400 (б), 600 (в) и 1000°С (г).
Элементный состав смеси, полученной в результате осаждения, продуктов ГТО и термического отжига представлен в табл. 1. Рентгеноспектральный анализ показал, что мольное соотношение Ni : Si = 1.5 в смеси до ГТО соответствует расчетному. В результате ГТО это отношение уменьшается до 1.3, что может быть вызвано как погрешностью измерения, так и действительным отклонением состава нанотубулярного гидросиликата от стехиометрического. Одной из причин такого отклонения может выступать процесс уменьшения размерного несоответствия путем образования катионных вакансий в октаэдрическом слое. В процессе термического отжига соотношение Ni : Si увеличивается, достигая максимума при 1000°С, связанного с образованием фазы Ni2SiO4.
Таблица 1.
Элементный состав и удельная поверхность образцов до и после ГТО и термического отжига
| Образец | Содержание, ат. % | Ni : Si | Удельная поверхность, м2/г |
||
|---|---|---|---|---|---|
| Ni | Si | O | |||
| До ГТО | 14.5 | 9.5 | 76.0 | 1.5 | н/д* |
| После ГТО | 21.9 | 16.5 | 61.6 | 1.3 | 137 |
| 400°C | 20.8 | 15.5 | 63.7 | 1.3 | 120 |
| 600°C | 24.0 | 17.7 | 58.3 | 1.4 | 114 |
| 1000°C | 27.0 | 11.5 | 61.5 | 2.3 | 71 |
Результаты определения удельной поверхности приведены в табл. 1. С увеличением температуры термического отжига удельная поверхность образцов снижается, причем для образца, обработанного при 1000°C, почти в два раза по сравнению с исходным значением. Это связано с наблюдающимися, согласно данным рентгеновской дифрактометрии (рис. 1), фазовыми переходами, приводящими к разрушению внутреннего канала и спеканию частиц.
Работа макета ЛИА. На рис. 3 представлены дифрактограммы исследуемых электродов на основе нанотубулярного гидросиликата никеля и продуктов его термического отжига до сборки макетов и проведения испытаний. Гидросиликат никеля и продукты его термического отжига наблюдаются на дифрактограммах в качестве основных фаз. Гало в области 20°–35° может наблюдаться в связи с наличием в составе анодного материала сажи и полимерного связующего.
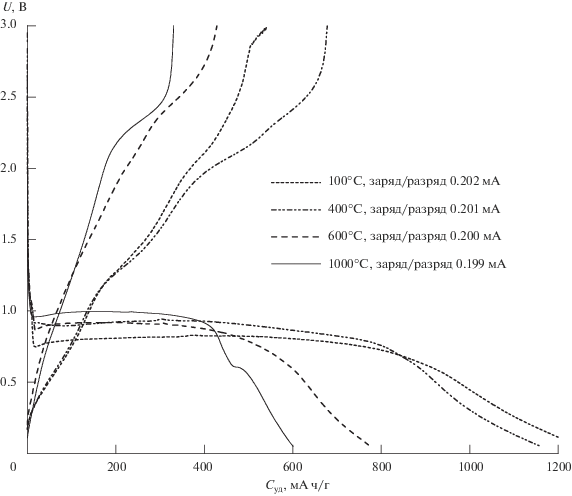
На рис. 4 представлены зарядные и разрядные кривые макетов ЛИА с исследуемым электродом на основе нанотубулярного гидросиликата никеля и продуктов их термического отжига в диапазоне напряжений от 0.05 до 3 В при удельном токе 10 мА/г. Все макеты демонстрируют высокие значения удельной емкости при внедрении лития на первом цикле, однако при извлечении лития это значение снижается примерно в 2 раза. Одной из причин наблюдаемой низкой кулоновской эффективности на первом цикле является образование пассивирующего слоя SEI на отрицательном электроде из-за высокой удельной поверхности исследуемого материала.
Рис. 4.
Зарядно-разрядные кривые макетов ЛИА с материалами на основе нанотубулярных гидросиликатов никеля и продуктов их термического отжига в качестве исследуемого электрода и металлическим литием в качестве вспомогательного электрода (плотность тока заряда/разряда 10 мА/г).
С целью получения дополнительной информации о возможных необратимых фазовых превращениях в анодном материале макеты после 6 циклов заряда/разряда были разобраны, и материалы были исследованы методами порошковой рентгеновской дифракции. Соответствующие дифрактограммы представлены на рис. 5. По виду рентгеновских дифрактограмм можно заключить, что, вне зависимости от исходной кристаллической структуры анодного материала, при работе макета происходит ее разрушение с образованием, в основном, рентгеноаморфных или крайне слабо окристаллизованных продуктов. В области 20°–35° наблюдается гало, так же как и на дифрактограммах анодных материалов до проведения испытаний. Достоверное определение образовавшихся фаз представляется затруднительным.
Рис. 5.
Рентгеновские дифрактограммы анодных материалов после циклирования в диапазоне напряжений 0.05–3 В.
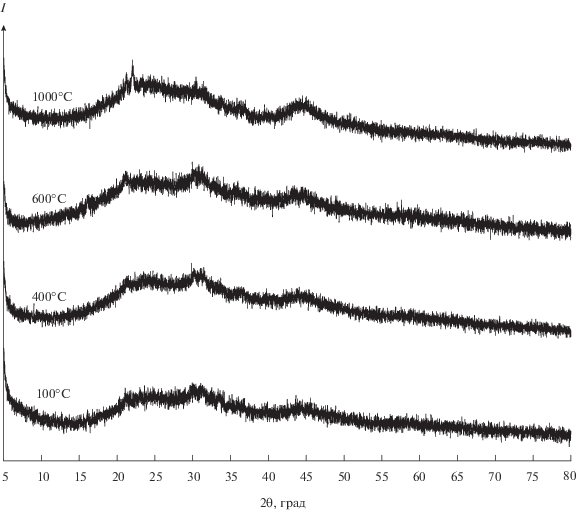
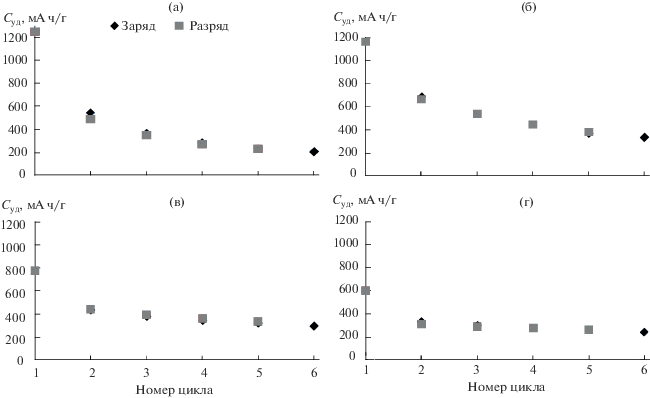
На рис. 6 представлены зарядные и разрядные удельные емкости образцов для 6 циклов. Чем выше температура термического отжига, тем более низкие значения удельной емкости демонстрируют образцы. При последующих циклах удельная емкость снижается медленнее для образцов, подвергшихся термическому отжигу. Значения обратимостей на первом и последующих циклах представлены на рис. 7. По всей вероятности, полное или частичное разрушение кристаллической структуры анодного материала происходит на первом цикле и наряду с образование пленки SEI обуславливает наблюдаемую кулоновскую эффективность в диапазоне 40–60%. После первого цикла исследуемые анодные материалы продолжают работать со средним значением кулоновской эффективности 88%. При этом наименьшей кулоновской эффективностью обладает электрод на основе нанотубулярного гидросиликата никеля, не подвергавшегося термическому отжигу. По сравнению с остальными образцами в серии он содержит наибольшее количество структурно связанной воды и OH-групп, способствующих протеканию необратимых процессов [45]. Наибольшую обратимость на первом цикле показывает образец, обработанный при 400°C. По всей видимости, при этой температуре достигается баланс между степенью дегидроксилирования и сохранностью нанотубулярной структуры, обуславливающей высокую удельную поверхность. Дальнейшее увеличение температуры термического отжига приводит к уменьшению как обратимости, так и разрядной емкости макетов на первом цикле. С другой стороны, при последующих циклах обратимость продуктов термического отжига при 600 и 1000°С быстрее достигает своих максимальных значений (рис. 7в, 7г).
Рис. 6.
Обратимость при циклировании макетов ЛИА с материалами на основе нанотубулярных гидросиликатов никеля и продуктов их термического отжига в качестве исследуемого электрода и металлическим литием в качестве вспомогательного электрода: при 100 (а), 400 (б), 600 (в), 1000°С (г).
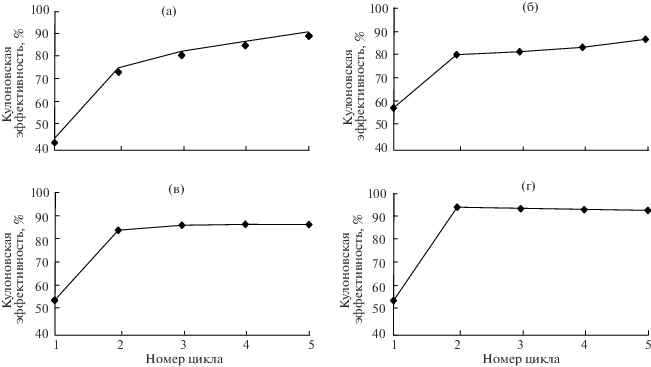
Рис. 7.
Зарядно-разрядные удельные емкости при циклировании макетов ЛИА с материалами на основе нанотубулярных гидросиликатов никеля и продуктов их термического отжига в качестве исследуемого электрода и металлическим литием в качестве вспомогательного электрода: при 100 (а), 400 (б), 600 (в), 1000°С (г).
ЗАКЛЮЧЕНИЕ
Проведен гидротермальный синтез нанотубулярных гидросиликатов никеля состава Ni3Si2O5(OH)4 с их последующим термическим отжигом на воздухе при температурах 400, 600 и 1000°С. Продукты ГТО и отжига использованы для создания макетов ЛИА и исследования их заряд-разрядных характеристик в диапазоне напряжений 0.05–3 В.
Кулоновская эффективность всех образцов после первого цикла заряда/разряда находилась в интервале 44–58%, что может быть вызвано аморфизацией кристаллической структуры анодных материалов в совокупности с образованием пассивирующего слоя с большой площадью поверхности. При дальнейшем циклировании кулоновская эффективность находилась в интервале 74–95%. Максимальными характеристиками – разрядной емкостью 680 мА ч/г и кулоновской эффективностью на первом цикле 58% – обладает материал на основе обработанного при 400°С гидросиликата никеля, в наибольшей степени освобожденный от OH-групп при сохранности нанотубулярной структуры.
Список литературы
Yoshino A., Sanechika K., Nakajima T. Lithium-Ion Batteries: Patent. Japaneese. N 1989293/5. 1985.
Nagura T., Tazawa K. Progress in Batteries and Solar Cells. Clevelend. 1990. V. 9. P. 209.
Tarascon J.-M., Armand M. Issues and Challenges Facing Rechargeable Lithium Batteries // Mater. Sustainable Energy. 2011. V. 414. P. 171–179. https://doi.org/10.1142/9789814317665_0024
Perla B.B., Yixuan W. Lithium-Ion Batteries: Solid-Electrolyte Interphase. L.: Imperial College Press, 2004. P. 407.
Kazunori O. Lithium-Ion Rechargeable Batteries with LiCoO2 and Carbon Electrodes: the LiCoO2/C System // Solid State Ionics. 1994. V. 69. № 3–4. P. 212–221. https://doi.org/10.1016/0167-2738(94)90411-1
Xue L., Savilov S.V., Lunin V.V., Xia H. Self-Standing Porous LiCoO2 Nanosheet Arrays as 3D Cathodes for Flexible Li-Ion Batteries // Adv. Funct. Mater. 2018. V. 28. № 7. P. 1705836. https://doi.org/10.1002/adfm.201705836
Da Silva S.P., Sita L.E., dos Santos C.S., Pavoni F.H., de Santana H., Andrello A.C., Scarminio J. Physical and Chemical Characterization of LiCoO2 Cathode Material Extracted from Commercial Cell Phone Batteries with Low and High States of Health // Mater. Chem. Phys. 2018. V. 213. P. 198–207. https://doi.org/10.1016/j.matchemphys.2018.04.038
Yang Q., Huang J., Li Y., Wang Y., Qiu J., Zhang J., Chen L. Surface-Protected LiCoO2 with Ultrathin Solid Oxide Electrolyte Film for High-Voltage Lithium Ion Batteries and Lithium Polymer Batteries // J. Power Sources. 2018. V. 388. P. 65–70. https://doi.org/10.1016/j.jpowsour.2018.03.076
Padhi A.K., Nanjundaswam K., Goodenough J.B. Phospho-Olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries // J. Electrochem. Soc. 1997. V. 144. № 4. P. 1184–1194. https://doi.org/10.1149/1.1837571
An C., Zhang B., Tang L., Xiao B., Zheng J. Ultrahigh Rate and Long-Life Nano-LiFePO4 Cathode for Li-Ion Batteries // Electrochim. Acta. 2018. V. 283. P. 385–392. https://doi.org/10.1016/j.electacta.2018.06.149
Huang S., Ren J., Liu R., Bai Y., Li X., Huang Y., Yuan G. Enhanced Electrochemical Properties of LiFePO4 Cathode Using Waterborne Lithiated Ionomer Binder in Li-Ion Batteries with Low Amount // ACS Sustainable Chem. Eng. 2018. V. 6. № 10. P. 12650–12657. https://doi.org/10.1021/acssuschemeng.8b01532
Bao L., Xu G., Wang M. Controllable Synthesis and Morphology Evolution of Hierarchical LiFePO4 Cathode Materials for Li-Ion Batteries // Mater. Character. 2019. V. 157. P. 109927. https://doi.org/10.1016/j.matchar.2019.109927
Macklin W.J., Neat J., Powel R.J. Performance of Lithium-Manganese Oxide Spinel Electrodes in a Lithium Polymer Electrolyte Cell // J. Power Source. 1991. V. 34. № 1. P. 39–49. https://doi.org/10.1016/0378-7753(91)85022-O
Yu X., Deng J., Yang X., Li J., Huang Z. H., Li B., Kang F. A Dual-Carbon-Anchoring Strategy to Fabricate Flexible LiMn2O4 Cathode for Advanced Lithium-Ion Batteries with High Areal Capacity // Nano Energy. 2020. V. 67. P. 104256. https://doi.org/10.1016/j.nanoen.2019.104256
Huang W., Wang G., Luo C., Xu Y., Xu Y., Eckstein B.J., Wu J. Controllable Growth of LiMn2O4 by Carbohydrate-Assisted Combustion Synthesis for High Performance Li-Ion Batteries // Nano Energy. 2019. V. 64. P. 103936. https://doi.org/10.1016/j.nanoen.2019.103936
Ha Y., Zhang Z., Liu H., Liao L., Fan P., Wu Y., Mei L. Facile Controlled Synthesis of Spinel LiMn2O4 Porous Microspheres as Cathode Material for Lithium Ion Batteries // Frontiers Chem. 2019. V. 7. № 437. P. 1–10. https://doi.org/10.3389/fchem.2019.00437
Wolfgang H.M. Electrolyte Polymer Electrolytes for Lithium-Ion Batteries // Adv. Mater. 1999. V. 10. № 6. P. 439–448. https://doi.org/0.1002/(SICI)1521-4095(199804)10:6<439: :AID-ADMA439>3.0.CO;2-I
Paled E. The Electrochemical Behavior of Alkali and Alkaline Earth Metals in Nonaqueous Battery Systems – The Solid Electrolyte Interphase Model // J. Electrochem. Soc. 1979. V. 126. № 12. P. 2047–2051. https://doi.org/10.1149/1.2128859
Balaya P., Li H., Kienle L., Maier J. Fully Reversible Homogeneous and Heterogeneous Li Storage in RuO2 with High Capacity // Adv. Funct. Mater. 2003. V. 13. № 8. P. 621–625. https://doi.org/10.1002/adfm.200304406
Boukamp B.A., Lesh G.C., Huggins R.A. All-Solid Lithium Electrodes with Mixed-Conductor Matrix // J. Electrochem. Soc. 1981. V. 128. № 4. P. 725–729. https://doi.org/10.1149/1.2127495
Zuo X., Zhu J., Müller-Buschbaum P., Cheng,Y.J. Silicon Based Lithium-Ion Battery Anodes: A Chronicle Perspective Review // Nano Energy. 2017. V. 31. P. 113–143. https://doi.org/10.1016/j.nanoen.2016.11.013
Feng K., Li M., Liu W., Kashkooli A.G., Xiao X., Cai M., Chen Z. Silicon-Based Anodes for Lithium-Ion Batteries: from Fundamentals to Practical Applications // Small. 2018. V. 14. № 8. P. 1702737. https://doi.org/10.1002/smll.201702737
Yoshio M., Tsumura T., Dimov N. Electrochemical Behaviors of Silicon Based Anode Material // J. Power Sources. 2005. V. 146. № 1–2. P. 10–14. https://doi.org/10.1016/j.jpowsour.2005.03.143
Winter M., Besenhard J.O. Electrochemical Lithiation of Tin and Tin-Based Intermetallics and Composites // Electrochim. Acta. 1999. V. 45. № 1–2. P. 31–50. https://doi.org/10.1016/S0013-4686(99)00191-7
Courtney I.A., Dahn J.R. Electrochemical and in Situ X-Ray Diffraction Studies of the Reaction of Lithium with Tin Oxide Composites // J. Electrochem. Soc. 1997. V. 144. № 6. P. 2045–2052. https://doi.org/10.1149/1.1837740
Arico A.S., Bruce P., Scrosati B., Tarascon J. M., Schalkwijk W.V. Local Conductivity Effects in Polymer Electrolytes // Nature Mater. 2005. V. 4. P. 366–371.
Jiang C., Hosono E., Zhou H. Nanomaterials for Lithium Ion Batteries // Nano Today. 2006. V. 1. № 4. P. 28–33. https://doi.org/10.1016/S1748-0132(06)70114-1
Tiwari J.N., Tiwari R.N., Kim K.S. Zero-Dimensional, One-Dimensional, Two-Dimensional and Three-Dimensional Nanostructured Materials for Advanced Electrochemical Energy Devices // Prog. Mater. Sci. 2012. V. 57. № 4. P. 724–803. https://doi.org/10.1016/j.pmatsci.2011.08.003
Zhu C., Mu X., van Aken P.A., Maier J., Yu Y. Fast Li Storage in MoS2-Graphene-Carbon Nanotube Nanocomposites: Advantageous Functional Integration of 0D, 1D, and 2D Nanostructures // Adv. Energy Mater. 2015. V. 5. № 4. P. 1401170. https://doi.org/10.1002/aenm.201401170
Wang B., Luo B., Li X., Zhi L. The Dimensionality of Sn Anodes in Li-Ion Batteries // Mater. Today. 2012. V. 15. № 12. P. 544–552. https://doi.org/10.1016/S1369-7021(13)70012-9
Xia, Y., Yang P., Sun Y., Wu Y., Mayers B., Gates B., Yan H. One-Dimensional Nanostructures: Synthesis, Characterization, and Applications // Adv. Mater. 2003. V. 15. № 5. P. 353–389. https://doi.org/10.1016/S1369-7021(13)70012-9
Wang K., Wei M., Morris M.A., Zhou H., Holmes J.D. Mesoporous Titania Nanotubes: Their Preparation and Application as Electrode Materials for Rechargeable Lithium Batteries // Adv. Mater. 2007. V. 19. № 19. P. 3016–3020. https://doi.org/10.1002/adma.200602189
Lou X.W., Archer L.A., Yang Z. Hollow Micro-/Nanostructures: Synthesis and Applications // Adv. Mater. 2008. V. 20. № 21. P. 3987–4019. https://doi.org/10.1002/adma.200800854
Krasilin A.A., Nevedomsky V.N., Gusarov V.V. Comparative Energy Modeling of Multiwalled Mg3Si2O5(OH)4 and Ni3Si2O5(OH)4 Nanoscroll Growth // J. Phys. Chem. C. 2017. V. 121. № 22. P. 12495–12502. https://doi.org/10.1021/acs.jpcc.7b03785
Alvarez-Ramírez F., Toledo-Antonio J.A., Angeles-Chavez C., Guerrero-Abreo J.H., López-Salinas E. Complete Structural Characterization of Ni3Si2O5(OH)4 Nanotubes: Theoretical and Experimental Comparison // J. Phys. Chem. C. 2011. V. 115. № 23. P. 11442–11446. https://doi.org/10.1021/jp201941x
White R.D., Bavykin D.V., Walsh F.C. Morphological Control of Synthetic Ni3Si2O5(OH)4 Nanotubes in an Alkaline Hydrothermal Environment // J. Mater. Chem. A. 2013. V. 1. № 3. P. 548–556. https://doi.org/10.1039/C2TA00257D
Корыткова Э.Н., Пивоварова Л.Н. Гидротермальный синтез нанотрубок на основе гидросиликатов (Mg,Fe,Co,Ni)3Si2O5(OH)4 // Физика и химия стекла. 2010. Т. 36. № 1. С. 69–78.
Корыткова Э.Н., Маслов А.В., Пивоварова Л.Н., Полеготченкова Ю.В., Повинич В.Ф., Гусаров В.В. Образование нанотрубчатых гидросиликатов системы Mg3Si2O5(OH)4–Ni3Si2O5(OH)4 при повышенных температурах и давлениях // Неорган. материалы. 2005. Т. 41. № 7. С. 849–855.
Krasilin A.A., Gusarov V.V. Redistribution of Mg and Ni Cations in Crystal Lattice of Conical Nanotube with Chrysotile Structure // Nanosyst.: Phys. Chem. Math. 2017. V. 8. № 5. P. 620–627. https://doi.org/10.17586/22208054201785620627
Yang Y., Liang Q., Li J., Zhuang Y., He Y., Bai B., Wang X. Ni3Si2O5(OH)4 Multi-Walled Nanotubes with Tunable Magnetic Properties and Their Application as Anode Materials for Lithium Batteries // Nan Res. 2011. V. 4. № 9. P. 882. https://doi.org/10.1007/s12274-011-0144-7
Wang Q., Zhang Y., Jiang H., Hu T., Meng C. In Situ Generated Ni3Si2O5(OH)4 on Mesoporous Heteroatom-Enriched Carbon Derived from Natural Bamboo Leaves for High-Performance Supercapacitors // ACS Appl. Energy Mater. 2018. V. 1. № 7. P. 3396–3409. https://doi.org/10.1021/acsaem.8b00556
Krasilin A.A., Danilovich D.P., Yudina E.B., Bruyere S., Ghanbaja J., Ivanov V.K. Crystal Violet Adsorption by Oppositely Twisted Heat-Treated Halloysite and Pecoraite Nanoscrolls // Appl. Clay Sci. 2019. V. 173. P. 1–11. https://doi.org/10.1016/j.clay.2019.03.007
Sarvaramini A., Larachi F. Mossbauer Spectroscopy and Catalytic Reaction Studies of Chrysotile-Catalyzed Steam Reforming of Benzene // J. Phys. Chem. C. 2011. V. 115. № 14. P. 6841–6848. https://doi.org/10.1021/jp2005309
Sarvaramini A., Larachi F. Catalytic Oxygenless Steam Cracking of Syngas-Containing Benzene Model Tar Compound over Natural Fe-Bearing Silicate Minerals // Fuel. 2012. V. 97. P. 741–750. https://doi.org/10.1016/j.fuel.2012.02.039
Wu K., Shao L., Jiang X., Shui M., Ma R., Lao M., Shu J. Facile Preparation of [Bi6O4](OH)4(NO3)6 · 4H2O, [Bi6O4](OH)4(NO3)6 · H2O and [Bi6O4](OH)4(NO3)6 · · H2O/C as Novel High Capacity Anode Materials for Rechargeable Lithium-Ion Batteries // J. Power Sources. 2014. V. 254. P. 88–97. https://doi.org/10.1016/j.jpowsour.2013.12.121
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы