Неорганические материалы, 2020, T. 56, № 2, стр. 135-140
Синтез наночастиц диборида ванадия взаимодействием VCl3 с NaBH4
И. И. Коробов 1, Д. Ю. Ковалев 2, Г. В. Калинников 1, С. В. Коновалихин 2, Н. Ю. Хоменко 2, А. А. Винокуров 1, А. В. Иванов 1, С. П. Шилкин 1, *
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. Академика Семенова, 1, Россия
2 Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова Российской академии наук
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 8, Россия
* E-mail: ssp@icp.ac.ru
Поступила в редакцию 02.01.2019
После доработки 26.04.2019
Принята к публикации 17.07.2019
Аннотация
Методами рентгенографии, сканирующей электронной микроскопии, рентгеновской фотоэлектронной спектроскопии, энергодисперсионного и элементного анализов показано, что образование однофазного VB2 со средним размером частиц 20–35 нм происходит в температурном интервале 595–930°C при взаимодействии хлорида ванадия(III) с борогидридом натрия в мольном соотношении 1 : 10 в атмосфере аргона в течение 14–28 ч.
ВВЕДЕНИЕ
Диборид ванадия VB2 – типичный представитель диборидов металлов V группы – характеризуется высокой температурой плавления (2745°C), высокими значениями твердости, прочности, износо- и ударостойкости, вследствие чего является перспективным материалом для высокотемпературной техники, при создании воздушных ванадиевоборидных электрохимических ячеек, для получения катализаторов жидкофазного окисления молекулярным кислородом различных органических соединений, например циклооктена [1–6].
В современном материаловедении интерес к боридам металлов IV–V групп заметно возрос в связи с созданием на их основе наноразмерных материалов, физико-химические, механические и другие свойства которых существенно отличаются от микрокристаллических материалов [7]. В этой связи актуальными становятся разработки новых эффективных методов получения диборида ванадия в наноразмерном состоянии.
Цель настоящей работы – изучение возможности образования наночастиц VB2 при твердофазном взаимодействии VCl3 с NaBH4 в интервале температур 420–930°C.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Известны следующие методы получения VB2: прямой синтез из элементов (спекание при высоких температурах), боротермическое восстановление различных оксидов и солей ванадия, карботермическое восстановление оксидов ванадия и бора, механохимический и плазмохимический синтезы [8–20].
Метод спекания прост и способен обеспечить синтез борида ванадия с высокой скоростью [8], однако полученный VB2 представляет собой оплавленный спек с примесями оксидов ванадия и бора. В работе [9] установлено, что достаточно крупный порошок VB2 с размером частиц <300 нм может быть получен боротермическим восстановлением NH4VO3 при 900–1000°C в атмосфере аргона в ионном расплаве NaCl/KCl или при его отсутствии:
(1)
$\begin{gathered} 6{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{V}}{{{\text{O}}}_{3}} + 22{\text{B}} \to 6{\text{V}}{{{\text{B}}}_{2}} + \\ + \,\,6{\text{N}}{{{\text{H}}}_{3}} + 5{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + {\mathbf{7}}{\text{B}} \to 2{\text{V}}{{{\text{B}}}_{2}} + 3{\text{BO}},$(3)
${{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 2{\text{С}} + {{{\text{B}}}_{{\text{4}}}}{\text{C}} \to 2{\text{V}}{{{\text{B}}}_{2}} + 3{\text{CO}}.$Порошок диборида ванадия может быть получен восстановлением оксида ванадия V2O3 бором в вакууме при t > 1500°C по реакции (2) [10] или борокарбидным способом при температуре 1500°C в атмосфере аргона по реакции (3) [11].
В работе [12] предложена механохимическая методика синтеза нанопорошка диборида ванадия в высокоэнергетической шаровой мельнице:
(4)
${\text{VC}}{{{\text{l}}}_{3}} + 2{\text{LiB}}{{{\text{H}}}_{4}} + {\text{LiH}} \to {\text{V}}{{{\text{B}}}_{2}} + 3{\text{LiCl}} + 4.5{{{\text{H}}}_{{\text{2}}}}.$После удаления хлорида лития получается порошок VB2 с размером частиц 15–60 нм.
В работе [13] изучены бориды ванадия следующих составов: V3B2, VB, V5B6, V3B4, V2B3, VB2, полученные методом самораспространяющегося высокотемпературного синтеза из порошков ванадия и аморфного бора. Наноразмерный борид ванадия с размером частиц ~36 нм получали методом механохимического синтеза из смеси Mg, V2O5 и B2O3 в высокоэнергетической шаровой мельнице [14]. Авторами [15] синтезированы наночастицы VB2 размером 50–100 нм при взаимодействии VCl4 с NaBH4 и Mg при температуре 650°C в стальном реакторе–автоклаве. Наночастицы VB2 размером ~10 нм получены при взаимодействии VCl3 с NaBH4 в эвтектической смеси безводных хлоридов лития и натрия в кварцевом реакторе при температуре 900°C [16]. В работе [17] исследован плазменный синтез диборида ванадия с размером частиц 46–60 нм при температурах 1700–2300°C в потоке азотной низкотемпературной плазмы из смеси оксида ванадия и аморфного бора. Методом высокоэнергетического разрушения могут быть получены дисперсные порошки различных соединений, включая VB2 [18]. В работе [19] рассмотрен высокотемпературный синтез VB2 твердофазным взаимодействием VCl3 с MgB2. В зависимости от условий взаимодействия хлоридов переходных металлов с порошками бора и олова (в запаянной ампуле в вакууме или в аргоне) в интервале температур 700–900°C получены бориды переходных металлов, включая VB2, в микро- и нанокристаллическом состоянии [20].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные реагенты. Борогидрид натрия с чистотой >99.3% получали перекристаллизацией технического препарата из 1N раствора NaOH и сушили в вакууме 1.33 × 10–1 Па при 100°C. В работе использовали товарный VCl3 чистотой 99.5% и аргон высокой чистоты – 99.998% (ТУ 2114-005-0024760-99). Источником водорода с чистотой не менее 99.999% служил автономный лабораторный генератор водорода, содержащий в качестве рабочего материала гидридные фазы на основе интерметаллидов LaNi5 и TiFe, принцип действия которого подробно описан в [21, 22].
Методы анализа. Рентгенофазовый анализ (РФА) полученных порошков VB2 проводили на дифрактометре ДРОН-3 с монохроматором на вторичном пучке. Регистрацию дифрактограмм вели в режиме пошагового сканирования на излучении CuKα в интервале углов 20°–90° 2θ с шагом съемки 0.02° и экспозицией 4 с в точке. Профильный анализ рентгенограмм осуществлялся в программном пакете “Буревестник”. Расчет метрики ячейки и параметров тонкой структуры проводили по 7 отражениям. Инструментальное уширение учитывали по уширению линий эталона – LaB6 (SRM 660b). Для расчета размера кристаллитов D (областей когерентного рассеяния (ОКР)) использовали метод вторых моментов.
Термические исследования выполняли методом синхронного термического анализа на термоанализаторе Netzch STA 409 PC Luxx, сопряженном с квадрупольным масс-спектрометром QMS 403 C Aёolos при линейном нагреве образца со скоростью 10°С/мин в потоке аргона в интервале температур от 20 до 1000°C.
Электронно-микроскопические исследования и рентгеновский энергодисперсионный анализ осуществляли на комплексе, состоящем из растрового сканирующего автоэмиссионного электронного микроскопа Zeiss Supra 25 и рентгеноспектральной установки INCA x-sight. Микрофотографии получали при низких ускоряющих напряжениях электронного пучка (~4 кВ). При таких ускоряющих напряжениях вклад в регистрируемый сигнал от подложки минимален либо отсутствует вовсе. Рентгеновский энергодисперсионный анализ осуществляли при ускоряющем напряжении ~8 кВ.
Для уточнения качественного состава поверхности порошков диборида ванадия регистрировали рентгеновские фотоэлектронные спектры (РФЭС) на электронном спектрометре для химического анализа PHOIBOS 150 MCD.
Удельную поверхность образцов (Sуд) находили по величине адсорбции криптона при температуре жидкого азота после удаления из твердой фазы летучих примесей в вакууме 1.33 × 10–3 Па при температуре 100°C и рассчитывали по методу Брунауэра–Эммета–Тэллера (БЭТ). Площадь, занимаемую адсорбированной молекулой криптона, принимали равной 19.5 × 10–20 м2. Ошибка определения не превышала ±10%.
Содержание бора, ванадия, хлора и кислорода определяли по стандартным аналитическим методикам, а также рентгеновским энергодисперсионным анализом. Содержание водорода определяли на CHNS/O-элементном анализаторе Vario EL cube Elementar. Давление в системе измеряли образцовыми манометрами (МО) класса точности 0.4.
Методика эксперимента. Взаимодействие VCl3 с NaBH4 осуществляли следующим образом. В реактор-автоклав из нержавеющей стали в атмосфере особо чистого аргона помещали кварцевую ампулу с трихлоридом ванадия и борогидридом натрия, взятыми в мольном соотношении 1 : 10, и вакуумировали при 1.33 × 10–1 Па в течение 5 мин, заполняли аргоном под давлением 4 МПа и нагревали при заданной температуре синтеза в течение 14–48 ч. Давление в реакторе после синтеза за счет выделившегося водорода достигало 10 МПа. Затем температуру реактора доводили до комнатной, понижали давление в реакторе до атмосферного, вакуумировали и заполняли реактор аргоном. После вскрытия реактора в атмосфере аргона реакционную массу последовательно обрабатывали охлажденной до +3°C дистиллированной водой, ацетоном, этиловым спиртом и вакуумировали при 40°C в течение 5–6 ч до остаточного вакуума 1.33 × 10–1 Па. Полученный порошок помещали в реактор, обрабатывали водородом в проточном режиме под давлением 5 МПа при 100°C, затем вакуумировали при комнатной температуре до остаточного вакуума 1.33 × 10–1 Па и выгружали из реактора в атмосфере аргона. Все последующие работы с полученным таким образом диборидом ванадия, включая отбор проб на анализ, проводили в атмосфере аргона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 представлены результаты исследования взаимодействия VCl3 с NaBH4 при мольном соотношении 1 : 10 в интервале температур 420–930°C под давлением аргона 4 МПа и продолжительности реакции 14–48 ч. Такой большой избыток борогидрида натрия был выбран по аналогии с синтезом диборида циркония [23].
Таблица 1.
Результаты исследования взаимодействия VCl3 с NaBH4 при мольном соотношении 1 : 10 в интервале температур 420–930°C под давлением аргона 4 МПа в течение 14–48 ч
| Температура синтеза, °C | Время синтеза, ч | Химический состав продуктов синтеза | Фазовый состав продуктов синтеза | Периоды кристаллической решетки, нм | Sуд, м2/г | |
|---|---|---|---|---|---|---|
| a | c | |||||
| 420 | 48 | V0.98 B3.8 Cl0.3 H2.7 O0.01 | Х-фаза* | – | – | – |
| 495 | 40 | V1.01B3.9 Cl0.4 H2.8O0.04 | Х-фаза* | – | – | – |
| 570 | 32 | V1.1B2.9 Cl0.2 H1.8O0.03 | VB2** + Х-фаза* | – | – | – |
| 595 | 28 | VB2.02О0.03 | VB2** | – | – | 73.9 |
| 645 | 24 | VB2.03О0.03 | VB2** | – | – | 64.4 |
| 725 | 18 | VB2.01О0.01 | VB2 | 0.3006 | 0.3046 | 53.2 |
| 850 | 16 | VB2.03О0.02 | VB2 | 0.3002 | 0.3038 | 39.2 |
| 930 | 14 | VB2.03О0.03 | VB2 | 0.2997 | 0.3057 | 36.0 |
Как следует из этих данных, образование однофазного наноразмерного диборида ванадия наблюдается при температуре интенсивного разложения борогидрида натрия t ≥ 595°C [24]. Образовавшийся черный порошок, полученный в интервале температур 595–930°C, по результатам химического и рентгеновского энергодисперсионного анализов, имеет состав VB2.01–2.03O0.01–0.03, следов хлора и водорода в нем не обнаружено.
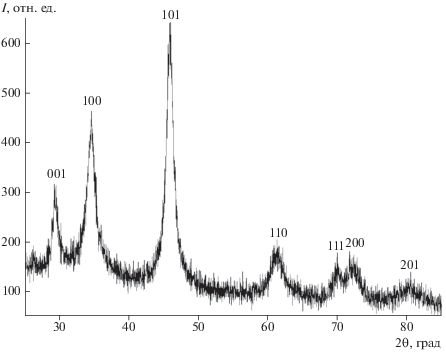
По данным РФА, полученный порошок является диборидом ванадия (гексагональная сингония, пр. гр. P6/mmm). Значимого количества примесных фаз не обнаружено (рис. 1). Параметры элементарной ячейки VB2 (табл. 1), синтезированного в интервале температур 595–930°C, согласуются с известными для диборида ванадия: a = 0.2994–2998 нм, c = 0.3048–3056 нм [25].
Согласно данным РФЭС, основным компонентом порошков является VB2: энергия связи электронов на 2р3/2-уровне ванадия равна 512.8 эВ и на 1s-уровне бора – 188.9 эВ, что удовлетворительно согласуется с данными [26, 27]. Наряду с линиями, характерными для диборида ванадия, присутствуют слабые линии, соответствующие оксидам бора (борной кислоты), ванадия и элементарному бору (191.6, 517.0, 532.5, 530.3 и 187.1 эВ). Следовательно, поверхностный слой порошка диборида ванадия глубиной до ~40 Å содержит незначительное количество оксидов ванадия и бора или борной кислоты с включениями элементарного бора.
Взаимодействие трихлорида ванадия с избытком NaBH4 при температуре 570°C приводит к образованию смеси диборида ванадия и Х-фазы. На дифрактограммах помимо уширенных дифракционных линий, относящихся к VB2, присутствуют две слабые размытые линии, не относящиеся к возможным известным фазам в рассматриваемой системе.
При температурах ниже 570°C образование диборида ванадия не наблюдается, а на дифрактограммах фиксируются два размытых рефлекса Х-фазы валового состава V0.98‒1.01B3.8–3.9Cl0.3–0.4H2.7–2.8O0.01–0.04.
В табл. 2 представлен средний диаметр частиц VB2, полученных взаимодействием VCl3 с NaBH4 при различных температурах, а на рис. 2 – электронные микрофотографии частиц порошка VB2, полученных при 595 (а), 725 (б) и 930°C (в).
Таблица 2.
Средний диаметр частиц VB2, полученных при взаимодействии VCl3 с NaBH4 при мольном соотношении 1 : 10 в интервале температур 595–930°C под первоначальном давлением аргона 4 МПа в течение 14–28 ч
| Температура взаимодействия, °C | Средний диаметр частиц, оцененный из данных электронной микроскопии, нм | ОКР D, нм | Средний диаметр частиц, оцененный из Sуд, нм |
|---|---|---|---|
| 595 | ~20 | ~ | ~16 |
| 645 | ~20 | ~ | ~18 |
| 725 | ~25 | ~10 | ~22 |
| 850 | ~32 | ~9.5 | ~30 |
| 930 | ~35 | ~10 | ~33 |
Рис. 2.
Электронные микрофотографии наночастиц порошка VB2, полученного взаимодействием VCl3 с NaBH4 при 595 (а), 725 (б) и 930°C (в).

По данным сканирующей электронной микроскопии, форма частиц диборида ванадия, синтезированных в интервале температур 595–930°C, близка к сферической, что характерно для соединений, полученных в результате прохождения химической реакции.
Размер частиц VB2, по данным электронной микроскопии, хорошо согласуется с результатами определения эквивалентного диаметра частиц VB2 по измерению удельной поверхности порошка методом БЭТ (табл. 2). С повышением температуры синтеза размеры частиц VB2 увеличиваются. Полученные нанопорошки VB2 преимущественно агрегированы, а размер ОКР D в интервале температур 595–930°C составляет ~10 нм. При температурах синтеза 595 и 645°C диборид ванадия характеризуется низкой степенью кристалличности, а при t ≥ 850°C наблюдается спекание образцов. Следовательно, по совокупности представленных данных, оптимальной температурой синтеза является температура 725°C.
При нагревании в атмосфере аргона до 1000°C образцы диборида ванадия стабильны и не испытывают превращений, связанных с выделением или поглощением тепла или изменением массы.
ЗАКЛЮЧЕНИЕ
Методами рентгенографии, сканирующей электронной микроскопии, РФЭС, энергодисперсионного и элементного анализов показано, что образование однофазного VB2 со средним размером частиц 20–35 нм происходит в температурном интервале 595–930°C. Установлено, что при взаимодействии VCl3 с NaBH4 в мольном соотношении 1 : 10 в атмосфере аргона в течение 14–28 ч оптимальная температура синтеза составляет 725°C.
Список литературы
Серебрякова Т.И., Неронов В.А., Пешев П.Д. Высокотемпературные бориды. Челябинск: Металлургия, 1991. 368с.
Carenco S., Portehault D., Boissiere C., Mezailles N., Sanchez C. Nanoscaled Metal Borides and Phosphides: Recent Developments and Perspectives. // Chem. Rev. 2013. V. 113. № 10. P. 7981–8065. https://doi.org/10.1021/cr400020d
Trach Yu.B., Bulgakova L.V., Macota O.I., Suprun W.Ya., Schulze B., Stank C.B.W. Vanadium Diboride Catalyzed Oxidation of Cyclooctene by Molecular Oxygen: Kinetic Study // J. Mol. Catal. A: Chem. 2009. V. 302. P. 124–128. https://doi.org/10.1016/j.molcata.2008.12.008
Lefler M., Stuart J., Parkey J., Licht S. Higher Capacity, Improved Conductive Matrix VB2 Air Batteries // J. Electrochem. Soc. 2016. V. 163. № 5. P. A781–A784. https://doi.org/10.1149/2.0031606jes
Licht S., Ghosh S., Wang B., Jiang D., Hettige C., Lau J., Asercion J. An 11 Electron Redox Couple for Anodic Charge Storage: VB2 // ECS Transactions. 2011. V. 35. № 33. P. 21–29. https://doi.org/10.1149/1.3655434
Прохоров А.М., Лякишев Н.П., Бурханов Г.С., Дементьев В.А. Высокочистые бориды переходных металлов – перспективные материалы современной техники // Неорган. материалы. 1996. Т. 32. № 11. С. 1365–1371.
Andrievski R.A., Khatchoyan A.V. Nanomaterials in Extreme Environments, Fundamentals and Applications. Switzerland: Springer Int. Publ., 2016. 107 p.
Левашов Е.А., Рогачев А.С., Курбаткина В.В., Максимов Ю.М., Юхвид В.И. Перспективные материалы и технологии самораспространяющегося высокотемпературного синтеза. М.: ИД МИСиС, 2011. 377 с.
Wei Y., Huang Zh., Zhou L., Ran S. Novel Borotermal Synthesis of VB2 Powders // Int. J. Mater. Res. 2015. V. 9. P. 1–3. https://doi.org/10.3139/146.111286
Peshev P., Leyarovska L., Bliznakov G. On the Borothermic Preparation of Some Vanadium, Niobium and Tantalum Borides // J. Less-Common Mets. 1968. V. 15. P. 259–267.
Крутский Ю.Л., Максимовский Е.А., Крутская Т.М., Попов М.В., Нецкина О.В., Никулина А.А., Черкасова Н.Ю., Квашина Т.С. Синтез высокодисперсного диборида ванадия с использованием нановолокнистого углерода // Журн. прикл. химии. 2017. Т. 90. Вып. 9. С. 1121–1127.
Kim J.W., Shim J.H., Ahn J.P., Cho Y.W., Kim J.H., Oh K.H. Mechanochemical Synthesis and Characterization of TiB2 and VB2 // Mater. Lett. 2008. V. 62. P. 2461–2464. https://doi.org/10.1016/j.matlet.2007.12.022
Yeh C.L., Wang H.J. Combustion Synthesis of Vanadium Borides // J. Alloys Compd. 2011. V. 509. P. 3257–3261. https://doi.org/10.1016/j.jallcom.2010.12.004
Hassanzadeh-Tabrizi S.A., Davoodi D., Beykzadeh A.A., Salahshour S. Fast Mechanochemical Combustion Synthesis of Nanostructured Vanadium Boride by a Magnesiothermic Reaction // Ceram. Int. 2016. V. 42. P. 1812–1816. https://doi.org/10.1016/j.ceramint.2015.09.144
Shi L., Gu Y., Chen L., Yang Z., Ma J., Qian Y. Low-Temperature Synthesis of Nanocrystalline Vanadium Diboride // Mater. Lett. 2004. V. 58. P. 2890–2892. https://doi.org/10.1016/j.matlet.2004.05.013
Portehaut D., Devis S., Beaunier P., Gervais C., Giordano C., Sanchez C., Antonietti M. A General Solution Route toward Metal Boride Nanocrystals // Angew. Chem. 2011. V. 50. P. 3262–3265. https://doi.org/10.1002/anie.201006810
Ноздрин И.В., Галевский Г.В., Ширяева Л.С., Терентьева М.А. // Изв. вузов. Черная металлургия. 2011. № 10. С. 12–17.
Авакумов Е.Г. Механические методы активации химических процессов. Новосибирск: Наука, 1989. 306 с.
Rao L., Gillan E.G., Kaner R.B. Rapid Synthesis of Transition – Metal Borides by Solid – State Metathesis // J. Mater. Res. 1995. V. 10. № 2. P. 353–361.
Palani R. Jothi, Kunio Yubuta, Boniface P.T. Fokwa. A Simple, General Synthetic Route toward Nanoscale Transition Metal Borides // Adv. Mater. 2018. V. 30. № 14. P. 1704181-1–1704181-6. https://doi.org/10.1002/adma.201704181
Фокин В.Н., Фокина Э.Э., Шилкин С.П. Синтез гидридов некоторых металлов в крупнокристаллическом состоянии // Журн. общ. химии. 1996. Т. 66. Вып. 8. С. 1249–1252.
Семененко К.Н., Шилкин С.П., Бурнашева В.В., Волкова Л.С., Говоркова Л.В., Мозгина Н.Г. О взаимодействии интерметаллических соединений ScT2, где T – Fe, Co, Ni с азотом в присутствии водорода // Журн. общ. химии. 1984. Т. 54. Вып. 3. С. 491–495.
Кравченко С.Е., Бурлакова А.Г., Домашнев И.А., Надхина С.Е., Дремова Н.Н., Винокуров А.А., Шилкин С.П. Образование наночастиц диборида циркония при взаимодействии тетрахлорида циркония с борогидридом натрия // Неорган. материалы. 2017. Т. 53. № 8. С. 817–821. https://doi.org/10.1134/S002016851708009X
Дымова Т.Н., Елисеева Н.Г., Михеева В.И. Термографическое изучение гидридобората натрия и некоторых родственных веществ // Журн. неорган. химии. 1967. Т. 12. № 9. С. 2317–2320.
Диаграммы состояния двойных металлических систем: Справочник / Под общ. ред. Лякишева Н.П. Т. 1. М.: Машиностроение, 1996. 992 с.
Алешин В.Г., Харламов А.И., Чудинов М.Г. Изучение поверхностного состояния тугоплавких соединений методом рентгеновской фотоэлектронной спектроскопии // Изв. АН СССР. Неорган. материалы. 1979. Т. 15. № 4. С. 672–676.
Terlan B., Levin A.A., Börrnert F., Simon F., Oschatz M., Schmidt M., Cardoso-Gil., Lorenz T., Baburin I.A., Joswig J-.O., Eychmüller A. Effect Surface Properties on the Microstructure, Thermal, and Colloidal Stability of VB2 Nanoparticles // Chem. Mater. 2015. V. 27. № 14. P. 5106–5115. https://doi.org/10.1021/acs.chemmater.5b01856
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы