Неорганические материалы, 2020, T. 56, № 2, стр. 125-134
Термодинамические функции PtS2 в широком интервале температур
А. В. Тюрин 1, *, Н. А. Полотнянко 2, Д. С. Тестов 2, Д. А. Чареев 3, 4, 5, А. В. Хорошилов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Государственный университет “Дубна”
141982 Московская обл., Дубна, ул. Университетская, 19, Россия
3 Институт экспериментальной минералогии им. Д.С. Коржинского Российской академии наук
142432 Московская обл., Черноголовка,
ул. Академика Осипьяна, 4, Россия
4 Физико-технологический институт Уральского федерального университета
620002 Екатеринбург, ул. Мира, 21, Россия
5 Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
* E-mail: tyurin@igic.ras.ru
Поступила в редакцию 27.03.2019
После доработки 03.09.2019
Принята к публикации 17.09.2019
Аннотация
Изучены термодинамические свойства кристаллического дисульфида платины в интервале от 5 до 875 K. Изобарная теплоемкость PtS2 измерена двумя методами: адиабатической калориметрии при 5.32–344.96 K и дифференциальной сканирующей калориметрии в диапазоне 344.6–874.6 K. На основании экспериментальных данных Cp = f(T) рассчитаны величины стандартных термодинамических функций в широком интервале температур. По результатам высокотемпературных измерений Cp исследованы регрессионные модели температурной зависимости изобарной теплоемкости в области от 298 до 875 К, основанные на уравнениях Майера–Келли и Ходаковского. Оценена характеристическая температура Дебая ΘD(T) PtS2.
ВВЕДЕНИЕ
Платина и ее халькогениды представляют особый интерес для теоретических и физико-химических исследований. В настоящее время среди платиновых минералов мало изучены некоторые сульфиды, в частности куперрит (PtS) и брэггит (Pt,Pd,Ni)S [1], встречающиеся в канадских и южноафриканских месторождениях [2], известны упоминания о других природных соединениях платины, например PtS2, Pt2S3 [3]. Механизмы минералообразования этих веществ досконально не изучены, для системы S–Pt полная фазовая диаграмма не построена [4]. Новые калориметрические исследования сульфидов платины, в том числе кристаллического PtS2, имеют большое значение, так как получение надежных термодинамических данных позволит в будущем провести физико-химическое моделирование условий образования платиновых месторождений.
Литературные данные по термодинамическим свойствам дисульфида платины приведены в табл. 1. Отметим, что до настоящего времени опубликована одна экспериментальная работа по исследованию изобарной теплоемкости в низкотемпературной области [5], в которой авторы с помощью метода адиабатической калориметрии получили значения стандартных термодинамических функций для PtS2(кр.) в интервале от 5 до 350 K.
Таблица 1.
Термодинамические величины для PtS2 при 298.15 К и 101.325 кПа
| $C_{p}^{^\circ },$ Дж/(моль К) | S°, Дж/(моль К) | ΔfH°, кДж/моль | ΔfG°, кДж/моль | Источник |
|---|---|---|---|---|
| 65.90 | 74.68 | –110 | –100.84 | [5] |
| 65.90 | 74.68 | –110.46 | –101.25 | [6] |
| 65.90 | 74.68 | –108.78 | –99.58 | [7] |
| – | 74.50–84.50 | –86.19 | – | [8] |
| 65.90 | 74.70 | –112.01 | –102.85 | [9] |
| 65.90 | 74.17 | –110.42 | –101.23 | [10] |
| 71.45 | 74.59 | –111.50 | –102.29 | [11] |
| 71.49 | 74.68 | –108.78 | –99.58 | [12] |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образца проводился из простых веществ в ампуле из кварцевого стекла, вакуумированной до давления 10 Па. Платиновая проволока (диаметр 0.1 мм, чистота 99.5%) и сера (ЛАБТЕХ, 99.9%), взятые в отношении 1 : 2.2, постепенно нагревались до температуры 1125 K и отжигались в течение 2 мес. с двумя промежуточными перетираниями. Избыток серы был отделен от дисульфида платины при медленном охлаждении ампулы в небольшом температурном градиенте, который позволял легколетучей сере конденсироваться в холодной части ампулы.
Полученный порошок исследовали методом рентгеновской порошковой дифрактометрии на дифрактометре BRUKER (CuKα1-излучение, графитовый монохроматор). Для образца получена рентгенограмма (рис. 1), в которой значения межплоскостных расстояний dэксп близки к табличным значениям dэтал базы данных FindIt [13] (номер карты 41388, P$\bar {3}$m, a0 = 3.5432 Å, c0 = 5.0388 Å).
Мольное соотношение элементов в полученном образце было подтверждено методом рентгеноспектрального микроанализа с помощью сканирующего электронного микроскопа Tescan Vega IIXMU с энергодисперсионным спектрометром INCA Energy 450 при ускоряющем напряжении 20 кВ.
Низкотемпературные измерения. Измерения изобарной теплоемкости образца PtS2 массой 0.41056 г в интервале температур 5.32–344.96 K проводились с помощью автоматизированного адиабатического вакуумного калориметра БКТ–3 (АОЗТ “Термис”, Россия) с дискретным вводом энергии, состоящего из миникриостата погружного типа с калориметрическим устройством, блока аналогового регулирования и компьютерно-измерительной системы “Аксамит АК-9” [14]. При температурах ниже 90 K измерения проводились в жидком гелии, выше 90 K – в сосуде Дьюара с жидким азотом. По данным измерений эталонных образцов (бензойной кислоты, меди и синтетического корунда) установлено, что калориметр позволяет получать величины теплоемкости с отклонениями при гелиевых температурах ±2%, при повышении температуры до 40 K отклонения уменьшаются до ±0.4% и составляют 0.2% в области 40−350 K.
Высокотемпературные измерения. Теплоемкость при 344.6–874.6 K изучалась методом дифференциальной сканирующей калориметрии на синхронном термическом анализаторе STA 449 F1 Jupiter® (Netzsch, Германия). Измерение теплоемкости α-корунда в области высоких температур показало, что полученные значения теплоемкости отличаются от литературных данных [15] не более чем на 3% во всем измеренном температурном диапазоне.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сглаживание 137 экспериментальных точек низкотемпературной теплоемкости (табл. 2) было проведено двумя методами: сплайн-аппроксимацией по программе, являющейся частью математического обеспечения банка данных ИВТАНТЕРМО [16], и ортонормированными полиномами [17]. Метод аппроксимирующего сплайна [16] не связан с конкретной формой представления зависимости Ср = f(Т), поэтому позволяет описывать различные аномалии теплоемкости.
Таблица 2.
Экспериментальные значения теплоемкости PtS2 в области низких температур
| T, K | Cp, Дж/(моль K) | T, K | Cp, Дж/(моль K) | T, K | Cp, Дж/(моль K) | T, K | Cp, Дж/(моль K) |
|---|---|---|---|---|---|---|---|
| Серия 1 | 192.39 | 55.01 | Серия 2 | 34.96 | 7.001 | ||
| 88.27 | 24.93 | 195.69 | 55.33 | 5.32 | 0.0644 | 36.53 | 7.314 |
| 90.32 | 25.62 | 198.98 | 55.99 | 5.52 | 0.0876 | 38.10 | 8.002 |
| 92.38 | 26.32 | 202.69 | 56.56 | 5.72 | 0.101 | 39.68 | 8.412 |
| 94.43 | 27.06 | 206.80 | 57.22 | 5.92 | 0.122 | 41.27 | 9.002 |
| 96.49 | 27.94 | 210.91 | 57.84 | 6.20 | 0.157 | 42.86 | 9.296 |
| 98.55 | 28.65 | 215.02 | 58.29 | 6.59 | 0.194 | 44.46 | 9.774 |
| 100.62 | 29.36 | 219.12 | 58.99 | 6.98 | 0.211 | 46.10 | 10.33 |
| 103.29 | 30.59 | 223.20 | 59.35 | 7.48 | 0.254 | 47.70 | 10.84 |
| 106.56 | 31.76 | 227.27 | 59.84 | 8.11 | 0.299 | 49.32 | 11.34 |
| 109.84 | 32.86 | 231.27 | 60.33 | 8.78 | 0.315 | 50.93 | 12.21 |
| 113.13 | 34.06 | 235.36 | 60.64 | 9.46 | 0.444 | 52.56 | 12.74 |
| 116.41 | 35.28 | 239.48 | 61.29 | 10.15 | 0.6241 | 54.19 | 13.11 |
| 119.72 | 36.45 | 243.55 | 61.54 | 10.85 | 0.7012 | 55.82 | 13.35 |
| 123.01 | 37.48 | 247.62 | 62.03 | 11.57 | 0.7839 | 57.45 | 14.01 |
| 126.31 | 39.25 | 251.67 | 62.47 | 12.28 | 0.8941 | 59.09 | 14.45 |
| 129.61 | 40.28 | 255.70 | 63.01 | 13.05 | 0.9991 | 60.73 | 15.21 |
| 132.91 | 40.81 | 259.72 | 63.25 | 13.79 | 1.115 | 62.37 | 16.04 |
| 136.21 | 41.75 | 263.73 | 63.77 | 14.54 | 1.214 | 64.02 | 16.54 |
| 139.51 | 43.15 | 267.72 | 63.87 | 15.30 | 1.333 | 65.66 | 17.00 |
| 142.81 | 43.66 | 271.70 | 64.01 | 16.08 | 1.655 | 67.31 | 17.34 |
| 146.11 | 44.53 | 275.67 | 64.64 | 16.86 | 1.741 | 68.96 | 17.85 |
| 149.42 | 45.91 | 279.62 | 64.99 | 17.64 | 1.824 | 70.62 | 18.54 |
| 152.72 | 46.57 | 283.55 | 65.24 | 18.43 | 1.925 | 72.50 | 19.11 |
| 156.03 | 47.57 | 287.47 | 65.42 | 19.23 | 2.116 | 74.56 | 19.77 |
| 159.34 | 48.11 | 291.36 | 65.71 | 20.02 | 2.222 | 76.62 | 20.45 |
| 162.65 | 48.64 | 295.06 | 65.89 | 21.34 | 2.635 | 78.68 | 21.19 |
| 165.96 | 49.47 | 298.92 | 66.25 | 22.80 | 2.889 | 80.74 | 21.96 |
| 169.27 | 50.55 | 303.23 | 66.47 | 24.28 | 3.399 | 82.81 | 23.01 |
| 172.57 | 51.33 | 309.50 | 67.03 | 25.77 | 3.716 | 84.89 | 24.11 |
| 175.88 | 51.84 | 316.77 | 67.34 | 27.27 | 4.271 | 86.96 | 24.44 |
| 179.18 | 52.52 | 323.89 | 67.51 | 28.78 | 4.787 | 89.04 | 25.29 |
| 182.49 | 53.33 | 330.96 | 67.94 | 30.31 | 5.274 | 91.12 | 25.83 |
| 185.79 | 53.84 | 338.06 | 68.33 | 31.85 | 5.875 | 93.20 | 26.52 |
| 189.09 | 54.42 | 344.96 | 68.57 | 33.40 | 6.303 | ||
Окончательно для расчета сглаженных значений теплоемкости и термодинамических функций был выбран метод полинома [17], коэффициенты которого представлены в табл. 3. Данное уравнение позволяет построить математическую модель, описывающую зависимость поведения изобарной теплоемкости от температуры:
где А – коэффициенты полинома,Таблица 3.
Коэффициенты уравнения (1) Ср = = $\sum\nolimits_0^{10} {{{A}_{j}}{{U}^{j}}} ,$ где U = ln(T/400), для PtS2
| j | Aj, Дж/(моль K) |
|---|---|
| 0 | 0.686821 × 102 |
| 1 | –0.1587457 × 102 |
| 2 | –0.15895866 × 103 |
| 3 | –0.392689861 × 103 |
| 4 | –0.5886759784 × 103 |
| 5 | –0.51133130662 × 103 |
| 6 | –0.26624272846 × 103 |
| 7 | –0.8486513535 × 102 |
| 8 | –0.16257310109 × 102 |
| 9 | –0.17206645396 × 101 |
| 10 | –0.7738693878 × 10–1 |
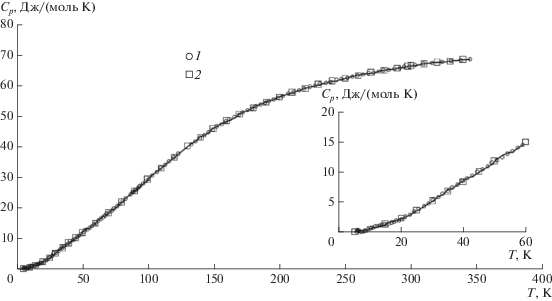
Сглаженные полиномом (1) значения теплоемкости и термодинамических функций PtS2 в низкотемпературной области приведены в табл. 4. Дисперсия и среднеквадратичное отклонение сглаженных значений от экспериментальных величин составляют соответственно 0.02 Дж2/(моль2 K2) и 0.14 Дж/(моль K). Сравнение сглаженных обоими методами величин теплоемкости Cp(T) представлено на рис. 2.
Таблица 4.
Теплоемкость и термодинамические функции PtS2 в области 10−330 K
| T, K | $C_{p}^{0}$(T)*, Дж/(моль K) |
$C_{p}^{0}$(T), Дж/(моль K) |
S0(T), Дж/(моль K) |
H0(T) − H0(0), Дж/моль |
Ф0(Т), Дж/(моль K) |
|---|---|---|---|---|---|
| сглаживание полиномом (1) [17] | |||||
| 10 | 0.5165 | 0.6033 | 0.2156 | 1.445 | 0.07105 |
| 15 | 1.295 | 1.329 | 0.6183 | 6.535 | 0.1826 |
| 20 | 2.367 | 2.187 | 1.104 | 15.07 | 0.3498 |
| 25 | 3.673 | 3.599 | 1.736 | 29.37 | 0.5607 |
| 30 | 5.157 | 5.255 | 2.537 | 51.47 | 0.8208 |
| 35 | 6.761 | 6.929 | 3.473 | 81.95 | 1.131 |
| 40 | 8.427 | 8.547 | 4.504 | 120.7 | 1.488 |
| 45 | 10.10 | 10.12 | 5.602 | 167.3 | 1.883 |
| 50 | 11.74 | 11.67 | 6.748 | 221.8 | 2.312 |
| 60 | 14.99 | 14.86 | 9.155 | 354.3 | 3.250 |
| 70 | 18.27 | 18.24 | 11.70 | 519.6 | 4.274 |
| 80 | 21.75 | 21.83 | 14.37 | 719.9 | 5.367 |
| 90 | 25.55 | 25.55 | 17.15 | 956.7 | 6.521 |
| 100 | 29.19 | 29.30 | 20.04 | 1231 | 7.727 |
| 110 | 33.01 | 32.97 | 23.00 | 1543 | 8.980 |
| 120 | 36.53 | 36.50 | 26.02 | 1890 | 10.27 |
| 130 | 40.20 | 39.82 | 29.08 | 2272 | 11.60 |
| 140 | 43.07 | 42.90 | 32.14 | 2686 | 12.96 |
| 150 | 45.74 | 45.73 | 35.20 | 3129 | 14.34 |
| 160 | 48.29 | 48.30 | 38.24 | 3599 | 15.74 |
| 170 | 50.63 | 50.61 | 41.24 | 4094 | 17.15 |
| 180 | 52.73 | 52.69 | 44.19 | 4611 | 18.57 |
| 190 | 54.56 | 54.55 | 47.09 | 5147 | 20.00 |
| 200 | 56.18 | 56.21 | 49.93 | 5701 | 21.42 |
| 210 | 57.63 | 57.69 | 52.71 | 6271 | 22.85 |
| 220 | 58.95 | 59.03 | 55.42 | 6854 | 24.27 |
| 230 | 60.17 | 60.23 | 58.07 | 7451 | 25.68 |
| 240 | 61.29 | 61.33 | 60.66 | 8059 | 27.08 |
| 250 | 62.32 | 62.32 | 63.18 | 8677 | 28.48 |
| 260 | 63.26 | 63.24 | 65.65 | 9305 | 29.86 |
| 270 | 64.13 | 64.09 | 68.05 | 9942 | 31.23 |
| 280 | 64.92 | 64.88 | 70.40 | 10 590 | 32.57 |
| 290 | 65.64 | 65.61 | 72.68 | 11 240 | 33.93 |
| 298.15 | 66.18 | 66.16 | 74.51 | 11 780 | 35.00 |
| 300 | 66.30 | 66.28 | 74.92 | 11 900 | 35.25 |
| 310 | 66.90 | 66.90 | 77.10 | 12 560 | 36.59 |
| 320 | 67.44 | 67.47 | 79.24 | 13 240 | 37.86 |
| 330 | 67.93 | 67.97 | 81.32 | 13 910 | 39.17 |
Рис. 2.
Зависимость $C_{p}^{0}$(T) для PtS2 в низкотемпературной области: линия – экспериментальные данные, 1 – сглаживание полиномом (1), 2 – сглаживание методом сплайн-аппроксимации.
По результатам высокотемпературных измерений выяснилось, что экспериментальные данные по теплоемкости существенно отличаются от экстраполяционных значений по уравнению авторов [5]:
которое приводит к сильно завышенным величинам Cp при температуре более 390 К (рис. 3), так как основано на узкой температурной области экспериментальных данных, полученных методом адиабатической калориметрии. Отметим, что в работе [5] не уточнены способы расчета параметров уравнения теплоемкости.
Рис. 3.
Зависимость $C_{p}^{0}$(T) для PtS2 в высокотемпературной области: линия – экстраполяция данных [5], 1 – экспериментальные данные настоящей работы.

Поэтому необходимо получить новое уравнение высокотемпературной теплоемкости PtS2, которое бы опиралось на экспериментальные данные. Среди множества существующих математических моделей [18–28] лучше всего описывает ход кривой Cp(T) уравнение Майера–Келли:
В 1986 г. И.Л. Ходаковский [28] предложил выразить свободный член a через равенство a = 3Rn, где R – универсальная газовая постоянная, n – количество атомов в молекуле:
(5)
${{C}_{p}} = 3Rn(1 + {{b}_{1}}{{T}^{{ - 1}}} + {{c}_{2}}{{T}^{{ - 2}}} + {{f}_{3}}{{T}^{{ - 3}}}) + bT.$Оценка моделей высокотемпературной теплоемкости. Оценка параметров уравнений высокотемпературной теплоемкости проведена с использованием метода наименьших квадратов:
(6)
$\begin{gathered} C_{{p,m}}^{o}(T) = {\text{74}}.{\text{97943}} + {\text{8}}.{\text{5255}} \times \\ \times \,\,{\text{1}}{{0}^{{ - {\text{4}}}}}T--{\text{8}}.00{\text{3824}} \times {\text{1}}{{0}^{{\text{5}}}}{{T}^{{ - {\text{2}}}}}\,\,\,\,({\text{Майера}}{\kern 1pt} - {\kern 1pt} {\text{Келли),}} \\ \end{gathered} $(7)
$\begin{gathered} {{C}_{p}} = 78.92 - 3Rn(36.55{{T}^{{ - 1}}} + 39.20{{T}^{{ - 2}}} + \\ + \,\,1.11 \times {{10}^{6}}{{T}^{{ - 3}}}) - 1.16 \times {{10}^{{ - 3}}}T\,\,({\text{Ходаковского)}}{\text{.}} \\ \end{gathered} $Оценка качества этих уравнений показала значение коэффициентов детерминации R2 для уравнения (6) – 0.9976, для уравнения (7) – 0.9998. Чем ближе R2 к 1, тем меньше влияние случайных факторов и сильнее зависимость от входящей в уравнение температуры. Для проверки значимости уравнения регрессии определена средняя ошибка аппроксимации $\bar {A},$ составившая для уравнений (6) и (7) 3.53 и 3.48% соответственно, что говорит о хорошей адекватности обеих моделей, которые можно использовать при расчете стандартных термодинамических функций PtS2. Различие коэффициентов $\bar {A}$ незначительное, в дальнейшем целесообразнее использовать наиболее часто используемое уравнение Майера–Келли (6).
Интерполяция полученных зависимостей (6) и (7) при T = 298.15 K приводит к величинам Cp 66.23 и 66.24 Дж/(моль K) соответственно. Рассчитанные значения хорошо согласуются с литературными данными [5] и величинами, полученными сплайн-аппроксимацией [16] и ортонормированными полиномами [17] на основании наших исследований методом адиабатической калориметрии в интервале от 5.32 до 344.96 K, равными 66.18 ± 0.13 и 66.16 ± 0.14 Дж/(моль K) соответственно.
Энергия Гиббса образования дисульфида платины из простых веществ ΔfG0(PtS2, 298.15 K). Стандартная энтальпия образования PtS2 ΔfH°(298.15) = = –111.712 ± 2.928 кДж/моль взята из [29], а стандартная энтропия образования вычислена на основании полученного нами из низкотемпературных измерений теплоемкости значения энтропии PtS2 и литературных данных по стандартным энтропиям платины и серы [29]. Погрешности измерений вычислялись по правилу сложения погрешностей. Таким образом, ΔfS°(298.15) = S°(PtS2) – ‒ S°(Pt) – 2S°(S) = –30.883 ± 0.393 Дж/(моль K), а энергия Гиббса образования ΔfG°(298.15) = –102.51 ± ± 2.93 кДж/моль.
Согласование низко- и высокотемпературной ветвей теплоемкости дисульфида платины. Стремясь к гладкой стыковке кривых теплоемкости, мы определили температуру, ниже которой теплоемкость хорошо описывалась бы уравнением (1), а выше – (6) или (7), при этом в точке стыка совпадали бы не только значения теплоемкости, но и ее производной по температуре. Для этого были построены масштабированные графики зависимости производной теплоемкости $С_{p}^{'}(T)$ (рис. 4). Для уравнения Майера–Келли (6) точкой стыка с низкотемпературными данными является T ≈ 333.3 K, для уравнения Ходаковского (7) – T ≈ ≈ 334 K. Значения термодинамических функций PtS2 в области 340–850 К, полученные интегрированием уравнения Майера–Келли, приведены в табл. 5.
Рис. 4.
Зависимость производной теплоемкости $C_{p}^{'}$(T) PtS2 по температуре в области стыка низко- и высокотемпературных кривых: 1 – дифференцирование Cp, сглаженной полиномом (1), 2 – дифференцирование зависимости Cp по уравнению Майера–Келли (6), 3 – дифференцирование зависимости Cp по уравнению Ходаковского (7).
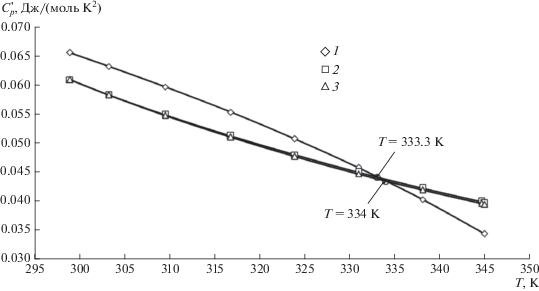
Таблица 5.
Теплоемкость и термодинамические функции PtS2 в области 340−850 K
| T, K | $C_{p}^{0}$(T), Дж/(моль K) |
S0(T), Дж/(моль K) |
H0(T) − H0(0), Дж/моль |
Ф0(Т), Дж/(моль K) |
|---|---|---|---|---|
| 340 | 68.35 | 83.35 | 14 590 | 40.43 |
| 350 | 68.74 | 85.34 | 15 280 | 41.68 |
| 360 | 69.11 | 87.28 | 15 970 | 42.92 |
| 370 | 69.45 | 89.18 | 16 660 | 44.15 |
| 380 | 69.76 | 91.04 | 17 360 | 45.36 |
| 390 | 70.05 | 92.85 | 18 060 | 46.55 |
| 400 | 70.32 | 94.63 | 18 760 | 47.73 |
| 410 | 70.57 | 96.37 | 19 460 | 48.90 |
| 420 | 70.80 | 98.07 | 20 170 | 50.05 |
| 430 | 71.02 | 99.74 | 20 880 | 51.18 |
| 440 | 71.22 | 101.4 | 21 590 | 52.31 |
| 450 | 71.41 | 103.0 | 22 300 | 53.41 |
| 460 | 71.59 | 104.6 | 23 020 | 54.51 |
| 470 | 71.76 | 106.1 | 23 740 | 55.59 |
| 480 | 71.91 | 107.6 | 24 450 | 56.66 |
| 490 | 72.06 | 109.1 | 25 170 | 57.71 |
| 500 | 72.20 | 110.5 | 25 900 | 58.76 |
| 550 | 72.80 | 117.5 | 29 520 | 63.78 |
| 600 | 73.27 | 123.8 | 331 70 | 68.52 |
| 650 | 73.64 | 129.7 | 36 850 | 73.01 |
| 700 | 73.94 | 135.2 | 40 540 | 77.25 |
| 750 | 74.20 | 140.3 | 44 240 | 81.28 |
| 800 | 74.41 | 145.1 | 47 960 | 85.12 |
| 850 | 74.60 | 149.6 | 51 680 | 88.78 |
Оценка фрактальной размерности. Приближение Дебая (8) для теплоемкости при постоянном объеме выведено для изотропных сред, а для слоистых структур целесообразнее применять уравнение (9) [30]:
(8)
${{C}_{V}} = 3Rr\left\{ {12{{{\left( {\frac{T}{{{{\Theta }_{D}}}}} \right)}}^{3}}\int\limits_0^{\frac{{{{\Theta }_{D}}}}{T}} {\frac{{{{x}^{3}}}}{{{{e}^{x}} - 1}}{\text{d}}y - \frac{{3{{{{\Theta }_{D}}} \mathord{\left/ {\vphantom {{{{\Theta }_{D}}} T}} \right. \kern-0em} T}}}{{{{e}^{{{{{{\Theta }_{D}}} \mathord{\left/ {\vphantom {{{{\Theta }_{D}}} T}} \right. \kern-0em} T}}}} - 1}}} } \right\},$(9)
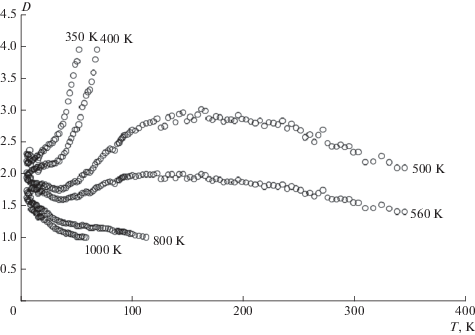
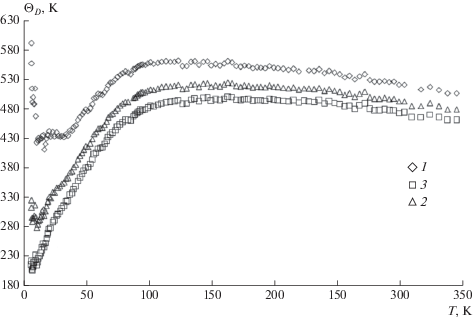
${{C}_{V}} = 3Rr\left\{ {D(D + 1){{{\left( {\frac{T}{{{{\Theta }_{D}}}}} \right)}}^{D}}\int\limits_0^{\frac{{{{\Theta }_{D}}}}{T}} {\frac{{{{x}^{D}}}}{{{{e}^{x}} - 1}}{\text{d}}y - \frac{{D{{{{\Theta }_{D}}} \mathord{\left/ {\vphantom {{{{\Theta }_{D}}} T}} \right. \kern-0em} T}}}{{{{e}^{{{{{{\Theta }_{D}}} \mathord{\left/ {\vphantom {{{{\Theta }_{D}}} T}} \right. \kern-0em} T}}}} - 1}}} } \right\},$Задавая различные величины характеристической температуры Дебая, из графика D = f(T) можно приближенно оценить фрактальную размерность для дисульфида платины: D ≈ 2.5 (рис. 5). Это подтверждает слоистую структуру PtS2, где между слоями действуют слабые ковалентные взаимодействия. Ориентируясь на это значение, из зависимости ΘD = f(T) можно оценить характеристическую температуру Дебая: ΘD ≈ 550 K (рис. 6). Падение характеристической температуры на кривых ΘD = f(T) при низких температурах обусловлено неучтенными квантовыми эффектами. При T ≥ 200 K ΘD начинает падать, что может быть связано с ангармонизмом тепловых колебаний, а также с неточностью определения вклада работы расширения решетки.
ЗАКЛЮЧЕНИЕ
В работе на основании измерения изобарной теплоемкости для кристаллического дисульфида платины двумя методами в широком температурном диапазоне рассчитаны термодинамические функции и проведено согласование низко- и высокотемпературных ветвей теплоемкости. Важным результатом работы можно считать определение энергии Гиббса образования (ΔfG°(PtS2, 298.15 K) = –102.51 ± 2.93 кДж/моль) и оценку температуры Дебая (ΘD ≈ 550 K).
Список литературы
Масленицкий И.Н., Чугаев Л.В., Борбат В.Ф. и др. Металлургия благородных металлов. М.: Металлургия, 1987. 432 с.
Бетехтин А.Г. Курс минералогии. М.: КДУ, 2007. 721 с.
Лякишев Н.П. Диаграммы состояния двойных металлических систем. Справочник. М.: Машиностроение, 1997. 586 с.
Рипан Р., Четяну И. Неорганическая химия. Химия металлов. М.: Мир, 1972. Т. 2. 672 с.
Westrum E.F., Jr., Carlson H.G. Low-Temperature Heat Capacities and Thermodynamic Functions of Some Palladium and Platinum Group Cha1cogenides. II. Dichalcogenides; PtS2, PtTe2, and PdTe2 // J. Chem. Phys. 1961. V. 35. № 5. P. 1670–1676.
Sassani D.C., Shock E.L. // Dep. Earth and Planetary Sci. 1982. V. 62. № 15. P. 2643–2671.
Wagman D., Evans W.H., Parker V.B. The NBS tables of chemical Thermodynamic Properties. Washington, DC: Am. Chem. Soc. A. 1982. V. 11. P. 407.
Карпов И.К., Кашик С.А., Пампура В.Д. Константы веществ для термодинамических расчетов в геохимии и петрологии. М.: Наука, 1968. 144 с.
Ефимов А.И., Белорикова И.И., Василькова И.В. и др. Свойства неорганических соединений. Справочник. Л.: Химия, 1983. 392 с.
Каржавин В.К. Сульфиды палладия и платины. Термодинамические свойства // Эл.-науч. журн. Вестник Отделения наук о Земле РАН. 2004. № 1(22).
Каржавин В.К. Сульфиды, селениды, теллуриды платины и палладия. Оценка термодинамических свойств // Геохимия. 2007. Т. 45. № 9. С. 1014–1021.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. Справочник термодинамических величин (для геологов). М.: Атомиздат, 1971. 240 с.
Furuseth S., Selte K., Kjekshus A. Redetermined Crystal Structures of NiTe2, PdTe2, PtS2, PtSe2 and PtTe2 // Acta Chem. Scand. 1965. V. 19. № 1. P. 257.
Varushchenko R.M., Druzhinina A.I., Sorkin E.L. Low Temperature Heat Capacity of 1-bromoperfluorooctane // J. Chem. Thermodyn. 1997. V. 29. № 6. P. 623−637. https://doi.org/10.1006/jcht.1996.0173
Ditmars D.A., Ishihara S., Chang S.S., Bernstein G., West E.D. Enthalpy and Heat-Capacity Standard Reference Material: Synthetic Sapphire (Alpha-Al2O3) from 10 to 2250 K // J. Res. Natl. Bur. Stand. 1982. V. 87. № 2. P. 159–163. https://doi.org/10.6028/jres.087.012
Иориш В.С., Толмач П.И. Методика и программа обработки экспериментальных данных по низкотемпературной теплоемкости с использованием аппроксимирующего сплайна // Журн. физ. химии. 1986. Т. 60. № 10. С. 2583–2587.
Гуревич В.М., Хлюстов В.Г. Калориметр для определения низкотемпературной теплоемкости минералов. Теплоемкость кварца в интервале 9–300 K // Геохимия. 1979. № 6. С. 829–839.
Maier, C.G., Kelley K.K. An Equation for the Representation of High-Temperature Heat Content Data // J. Am. Chem. Soc. 1932. V. 54. P. 3243–3246.
Сталл Д., Вестрам Э., Зинке Г. Химическая термодинамика органических соединений (пер. с англ. В.А. Левицкого, В.М. Сахарова). М.: Мир, 1971. 807 с.
Yokokawa H. Tables of Themodynamic. Properties of Inorganic Compounds // J. Nat. Chem. Lab. Ind. Jpn. 1988. V. 83. P. 147–173.
Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей: справочное пособие (пер. с англ. под ред. Б.И. Соколова). 3-е изд., перераб. и доп. Л.: Химия, 1982. 592 с.
Haas J.L., Jr., Fisher J.R. Simultaneous evaluation and Correlation of Thermodynamic Data // Am. J. Sci. 1976. V. 276. P. 525–545.
Holland T.J.B., Powell R. An Internally Consistent Thermodynamic Dataset with Uncertainties and Correlations; 2, Data and Results // J. Metamorph. Geol. 1985. № 3. P. 343–370.
Berman R.G., Brown T.H. The Heat Capacity of Minerals in the System K2O–Na2O–CaO–MgO–FeO–Fe2O3–Al2O3–SiO2–TiO2–H2O–CO2: Representation, Estimation, and High Temperature Extrapolation // Contrib. Mineral. Petrol. 1985. V. 89. P. 168–183.
Richet P., Gillet P., Fiquet G. Thermodynamic Properties of Minerals: Macroscopic and Microscopic Approaches // Adv. Phys. Geochem. N.Y.: Springer-Verlag, 1992. V. 8. P. 98–131.
Бычинский В.А., Исаев В.П., Тупицын А.А. Физико-химическое моделирование в нефтегазовой геохимии. Ч. 1. Теория и методология физико-химического моделирования: Уч. пособие. Иркутск: Ирк. ун-т, 2004. 131 с.
Fei Y., Saxena S.K. An Equation for the Heat Capacity of Solids // Geochim. Cosmochim. 1987. V. 51. P. 251–254.
Ходаковский И.Л. О новых полуэмпирических уравнениях температурной зависимости теплоемкости и объемного коэффициента термического расширения минералов // Вестн. ОНЗ РАН. 2012. Т. 4. NZ9001. https://doi.org/10.2205/2012NZ_ASEMPG
Термические константы веществ. Справочник под ред. Глушко В.П. М. 1965–1982. http://www.chem.msu.ru/cgi-bin/tkv.pl
Тюрин А.В., Изотов А.Д., Гавричев К.С. и др. Описание теплоемкости полупроводниковых соединений AIIIBVI с использованием фрактальной модели // Неорган. материалы. 2014. Т. 50. № 9. С. 979–982. https://doi.org/10.7868/S0002337X14090164
Шебершнева О.В., Изотов А.Д., Гавричев К.С., Лазарев В.Б. Метод обработки данных низкотемпературной калориметрии с учетом мультифрактальности колебательных состояний атомов // Неорган. материалы. 1996. Т. 32. № 1. С. 36–40.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы