Неорганические материалы, 2020, T. 56, № 3, стр. 283-289
Золь–гель-синтез легированной цинком шихты танталата лития
С. М. Маслобоева 1, *, М. Н. Палатников 1, Л. Г. Арутюнян 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение ФИЦ “Кольский научный центр Российской академии наук”
184209 Апатиты, Академгородок, 26а, Россия
* E-mail: sofia_masloboeva@mail.ru
Поступила в редакцию 19.03.2019
После доработки 22.08.2019
Принята к публикации 17.09.2019
Аннотация
Разработан метод синтеза легированной цинком шихты танталата лития (LiTaO3) из высокочистых танталсодержащих растворов, основанный на термической обработке цитратных литий-, тантал- и цинксодержащих прекурсоров. Продукты термолиза исследованы методами термического, рентгенофазового анализов и инфракрасной спектроскопии поглощения. Определены оптимальные условия синтеза и концентрация цинка, при которых получается однофазная шихта LiTaO3〈Zn〉. По предлагаемой технологической схеме получены образцы шихты LiTaO3〈Zn〉 с заданной концентрацией легирующей примеси, которые могут быть использованы как в технологии выращивания кристаллов LiTaO3〈Zn〉, так и при получении функциональной керамики на основе легированного танталата лития.
ВВЕДЕНИЕ
Ниобат и танталат лития (LiNbO3 и LiTaO3) относятся к важнейшим сегнетоэлектрическим, оптическим, пьезоэлектрическим и пироэлектрическим материалам [1–4], интерес к которым привлекает внимание многочисленных исследователей [5–13]. При этом кристаллы LiTaO3 изоморфны по отношению к кристаллам LiNbO3. Как и ниобат лития, танталат лития является фазой переменного состава с широкой областью гомогенности [1–4]. Причем состав конгруэнтного плавления в обеих фазах весьма существенно не совпадает со стехиометрическим составом, при котором отношения Li/Nb и Li/Ta равны единице [1, 2]. В связи с этим кристаллы ниобата и танталата лития обладают сходным типом дефектной структуры и практически одинаково изменяют свои характеристики при легировании [1–3]. В то же время, кристаллы LiNbO3 изучены в литературе гораздо шире, чем кристаллы LiТаO3 [1–13]. Так, активный поиск стойких к оптическому повреждению материалов инициировал интерес к исследованию сильно легированных кристаллов LiNbO3. Эти исследования показали, что при высоких концентрациях (~4.0–9.0 мол. % MО в расплаве) нефоторефракивных примесей (M – Mg, Zn, Sc и др.) происходит радикальное подавление фоторефрактивного эффекта в кристаллах LiNbO3 [3]. Логично полагать, что легирование кристаллов LiTaO3 нефоторефрактивными примесями (Mg, Zn и др.), как и в кристаллах LiNbO3, существенно повысит их оптическую стойкость, что позволит существенно расширить область практических приложений. Следует также ожидать, что легирование цинком шихты LiTaO3, по аналогии с шихтой LiNbO3〈Zn〉, существенно понизит низкотемпературную (T ≤ 450 K) электронную проводимость керамики LiTaO3〈Zn〉. В свою очередь, существенное снижение низкотемпературной электронной проводимости керамики LiTaO3〈Zn〉 позволит более эффективно провести ее поляризацию и тем самым значительно улучшить акустические и пьезоэлектрические свойства.
Кроме того, в целом ряде случаев использование танталата лития предпочтительнее, чем ниобата лития. Так, кристаллы LiTaO3 обладают естественной анизотропией, почти на порядок меньшей по сравнению с кристаллами LiNbO3 при одинаковой электрооптической эффективности. Это делает их перспективными для использования в электрооптических затворах и модуляторах лазерного излучения, особенно для световых пучков с заметной расходимостью [14]. К тому же, применение кристаллов LiTaO3 в качестве пироэлектрических сенсоров гораздо предпочтительнее по сравнению с кристаллами LiNbO3 вследствие существенно бóльших значений пироэлектрических коэффициентов [2]. Таким образом, задача получения легированных кристаллов LiTaO3〈М〉 (M – Mg, Zn, Sc и др.) высокой композиционной, оптической и структурной однородности и повышенной оптической прочности является весьма актуальной. Это требует разработки новых подходов к технологии получения легированной шихты LiTaO3〈М〉, как для выращивания оптических кристаллов, так и для создания функциональной керамики.
В настоящее время разработано несколько методов получения легированной шихты LiNbO3 [15–20], основным из которых является традиционный метод твердофазного синтеза [20], который не всегда позволяет получать сильно легированные кристаллы высокой оптической однородности. В то же время, синтез шихты LiTaO3 представлен лишь весьма ограниченным числом работ [20, 21]. В связи с этим разработка методов получения легированной различными примесями шихты танталата лития имеет важное научное и практическое значение.
Целью настоящей работы являлась разработка нового золь–гель-метода синтеза гомогенно легированной цинком шихты танталата лития и определение условий, обеспечивающих получение однофазного продукта.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
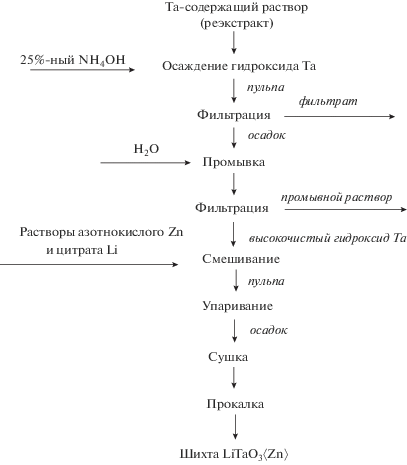
Легированную шихту танталата лития LiТаO3〈Zn〉 синтезировали в соответствии с технологической схемой, представленной на рис. 1. В исследованиях были использованы высокочистые реэкстракты состава (г/л): Та2O5 – 91.97, F– – 51.6, которые получены на стадии экстракционной переработки фторидно-сернокислых растворов, образуемых при разложении танталовых отходов [22]. В качестве экстрагента использован октанол-1.
Из высокочистого Та-содержащего раствора (реэкстракта) 25%-ным раствором NH4OH (“ос. ч.”) осаждали гидроксид тантала до рН ~ ~ 8–9. Осадок отфильтровывали на нутч-фильтре и далее репульпацией трехкратно промывали деионизированной водой от ионов аммония и фтора при соотношении твердой и жидкой фаз Т : Ж = = 1 : (3–5). Подсушенный до влажности 60–70% при 90°С высокочистый гидроксид тантала смешивали при Т : Ж = 1 : (1–2) с азотнокислыми растворами Zn и цитратным раствором Li заданных концентраций. Смесь перемешивали в течение 3 ч, после чего полученную пульпу упаривали до вязкого состояния, сушили при 140°С и прокаливали при ~1000–1200°С в течение 3 ч.
Растворы Zn(NO3)2 готовили растворением оксида ZnO (“ос. ч.”) в HNO3 (“ос. ч.”). Концентрацию Zn в шихте LiТаO3 варьировали в диапазоне 1.0–5 мас. %. Цитрат лития Li3C6H5O7 получали из Li2CO3 (“ос. ч.”) и раствора лимонной кислоты C6H8O7 (“х. ч.”). При этом концентрацию Li в растворе рассчитывали исходя из мольного отношения Li/Та = 1.0.
Количественное содержание тантала в исходных растворах и шихте танталата лития (после ее перевода в раствор) определяли гравиметрическим методом, фторид-ионов – потенциометрическим на иономере ЭВ-74 с F-селективным электродом ЭВЛ-1М3. Фтор в легированной шихте танталата лития определяли методом пирогидролиза. Концентрацию неконтролируемых катионных примесей (Mg, Al, Si, Ca, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Zr, Nb, Mo, Sn, Pb) в шихте LiТаO3 определяли методом спектрального анализа на приборе ДФС-13. Концентрацию легирующей примеси Zn – методом рентгенофлуоресцентной спектрометрии на приборе “Спектроскан MAKC-GV” и методом атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (АЭС-ИСП) на спектрометре Optima 8300 ИСП-АЭС с предварительным переводом твердых образцов в раствор. Методом АЭС-ИСП определяли также содержание Li в шихте LiТаO3.
Таблица 1.
Концентрация легирующей примеси Zn в шихте LiTaO3〈Zn〉
| Заданная концентрация Zn, % | Концентрация Zn по данным рентгенофлуоресцентного анализа, % | Концентрация Zn по данным АЭС-ИСП, % |
|---|---|---|
| 1 | 0.96 | 1.08 |
| 2.2 | 2.19 | 2.06 |
| 3.5 | 3.61 | 3.56 |
| 5 | 5.28 | 5.17 |
Синхронный термический анализ, включающий одновременное проведение дифференциальной сканирующей калориметрии (ДСК) и термогравиметрии (ТГ), осуществляли на синхронном анализаторе NETZSCH STA 409 PC/PG в интервале температур 25–250°С при скорости нагрева образцов ~10°C/мин на воздухе.
Рентгенофазовый анализ образцов проводили на дифрактометре ДРОН-2 со скоростью движения счетчика 2 град/мин (CuKα-излучение, графитовый монохроматор). Для идентификации фаз использовали базу данных JCPDS-ICDD 2002.
ИК-спектры образцов исследовали в области 4000–400 см–1 с использованием таблеток KBr на ИК-Фурье-спектрометре Nicolet 6700.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительные опыты показали, что примесь Zn в виде ZnO нельзя вводить в реэкстракт, так как при концентрации в растворе 2.5 г/л Zn и выше возрастает степень перехода ионов Zn2+ в фильтрат, получаемый после осаждения гидроксида тантала 25%-ным NH4OH. Потери Zn в этом случае весьма значительны, что объясняется образованием комплексных ионов [Zn(NH3)6]2+ или [Zn(NH3]4]2+. В связи с этим примесь цинка вводили в соответствии со схемой, приведенной на рис. 1, смешивая высокочистый гидроксид тантала с азотнокислым раствором Zn(NO3)2 с заданной концентрацией Zn.
Установлено, что после стадии смешения раствора Li3C6H5O7 и Zn(NO3)2 с гидроксидом тантала необходимо упаривание образующейся пульпы. В противном случае при ее фильтрации образуется фильтрат с высоким содержанием лития. При этом потери Li могут составлять до ~70%.
На рис. 2 приведены результаты термического анализа осадка, высушенного при 90°С, содержащего Та и Zn в качестве легирующей примеси. На начальном этапе (до t ~ 150–200°С) происходит удаление воды, а также оксидов азота из гидроксидного остатка и образуются цитратные комплексы металлов. Авторы [23] предполагают, что схема разложения лимонной кислоты, описанная в [24], должна быть свойственна и цитратам металлов. На кривой ДСК, приведенной на рис. 2, видно, что в области температур ~200–500°С наблюдаются два значительных экзотермических эффекта, которые можно объяснить протеканием сложных процессов, связанных с разложением комплексов и горением выделяющихся цитраконового и изомерного ему итаконового ангидридов. В диапазоне температур до ~500°С происходит основная потеря массы, которая составляет ~36%. В результате разложения комплексов возможно образование оксидов металлов и карбоната лития. При температуре выше ~500°С начинается кристаллизация LiTaO3, которая на кривой ДСК фиксируется в виде экзотермического эффекта при ~557°С (рис. 2). Образование LiTaO3 подтверждается данными РФА (рис. 3, дифрактограмма 3). Процесс сопровождается потерей массы, связанной с удалением СО2. Потеря массы практически отсутствует при температуре выше ~1100°С.
Рис. 2.
Кривые термогравиметрии, дифференциальной термогравиметрии и дифференциальной сканирующей калориметрии танталсодержащего остатка с примесью цинка (концентрация цинка в LiTaO3 2.2 мас. %).
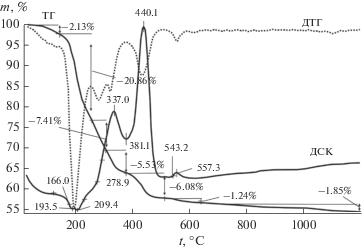
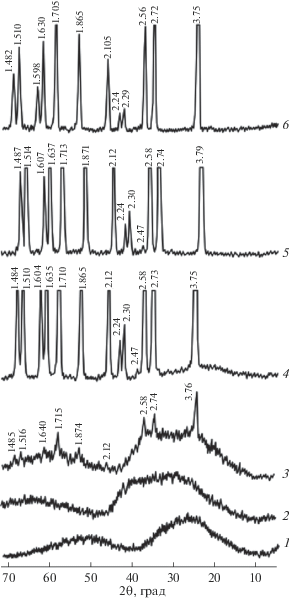
Рис. 3.
Дифрактограммы образцов цитратного танталсодержащего остатка, содержащих примесь цинка (LiTaO3〈2.2 мас. % Zn〉) и прокаленных при 380 (1), 500 (2), 550 (3), 850 (4), 1000 (5), 1200°С (6).
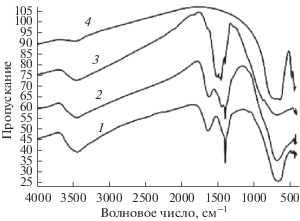
Методом РФА в данном случае не представляется возможным доказать наличие карбоната лития в продуктах термолиза, полученных при прокаливании цитратного остатка при разных температурах. Однако этот факт может быть установлен путем анализа ИК-спектров cпеков.
На рис. 4 в спектрах солей карбоновых кислот отсутствуют интенсивные полосы в области ~1700 см–1, относящиеся преимущественно к валентным колебаниям двойных связей С=О групп –СООН–, но имеются полосы в областях ~1300–1400 и ~1550–1610 см–1, относящиеся соответственно к симметричным и антисимметричным валентным колебаниям ионизированных групп ‒СОО– [24, 25]. В образце, выдержанном при ~380°С (рис. 4, кривая 1), фиксируются полосы поглощения при частотах ~1384 и 1618 см–1, подтверждающие присутствие в нем группы СОО–. При 500°С (рис. 4, кривая 2) эти полосы сохраняются, но появляется полоса поглощения ~1434 см–1, относящаяся к группе ${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}$ [26], что в свою очередь свидетельствует об образовании карбоната лития в диапазоне температур ~380–500°С. Аналогичные полосы (~1444 и 1502 см–1) имеют место в ИК-спектрах и при ~550°С (рис. 4, кривая 3). Однако в этом случае доля карбонат-иона увеличивается, а карбоксила значительно уменьшается. При температурах ~850°С и выше (рис. 4, кривая 4) эти полосы не наблюдаются. Доказательством образования карбоната лития в области температур ~500–550°С является также наблюдаемое в микроскоп МБС-1 образование пузырьков CO2 при действии на образцы соляной кислоты.
Рис. 4.
ИК-спектры цитратного танталсодержащего остатка, прокаленного при 380 (1), 500 (2), 550 (3), 850°С (4).
На рис. 3 представлены дифрактограммы образцов цитратного остатка, прокаленных при различных температурах на воздухе, с концентрацией легирующей примеси в танталате лития ~2.2 мас. % Zn. Видно, что после прокалки остатка при ~380 и 500°С продукт остается рентгеноаморфным (рис. 3, дифрактограммы 1 и 2). При ~550°С (рис. 3, дифрактограмма 3) на фоне аморфного продукта фиксируется образование фазы LiТаO3 (карточка 88-0290). По данным РФА, при выдержке образца в течение 1 ч при ~850°С, а также ~1000°С наряду с фазой LiТаO3 обнаруживается фаза ZnO (карточка 79-2205) (рис. 3, дифрактограммы 4–5).
Установлено, что ZnO присутствует в образцах LiTaO3〈Zn〉 при содержании ~2.2 мас. % Zn и выше в диапазоне температур прокаливания ~800–1000°С. С увеличением содержания Zn количество фазы ZnO увеличивается, что прослеживается по возрастанию пиков на дифрактограммах: рефлекс с d = 2.47 Å (рис. 5, дифрактограммы 2–4).
Рис. 5.
Дифрактограммы образцов цитратного танталсодержащего остатка, полученных при 1000 (1–4), 1200°С (5), содержащих 1.0 (1), 2.2 (2), 3.5 (3), 5.0 мас. % Zn (4, 5).
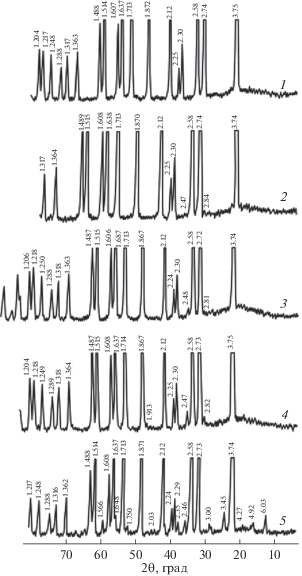
В то же время, прокалка образца LiTaO3〈2.2 мас. % Zn〉 при ~1200°С позволяет получить однофазный продукт, о чем свидетельствуют данные РФА (рис. 3, кривая 6).
Для образца LiTaO3〈1.0 мас. % Zn〉 однофазность достигается уже при ~1000°С (рис. 5, кривая 1).
В образцах LiTaO3〈Zn〉 с концентрацией Zn ~ ~ 5.0 мас. %, прокаленных при ~1200°С, на дифрактограмме 5 (рис. 5) наряду с рефлексами, характерными для фазы LiTaO3, фиксируются пики с 6.03, 4.92, 3.45 Å, характерные для соединения ZnLiNbO4 (карточка 89-879), которое, по-видимому, изоструктурно ZnLiTaO4. Данные химического анализа показали, что содержание тантала в различных образцах легированной шихты LiTaO3〈Zn〉 составляет ~76.5–76.9 мас. %, лития ~2.9–3.0 мас. %. Это соответствует заданному мольному отношению Li/Та. Содержание фтора в образцах LiTaO3〈Zn〉 находится ниже предела чувствительности используемого метода пирогидролиза (т.е. [F] < 0.001 мас. %). По данным спектрального анализа, концентрация катионных примесей в шихте LiTaO3〈Zn〉 составляет (мас. %): Mo, Zr, Al, Ti, Co < 5 × 10–4; Mg, Mn, Ni, Cu, V < 2 × 10–4; Fe, Cr, Pb, Sn < 3 × 10–4; Ca ≤ 1 × 10–3; Si ≤ 2 × 10–3, что свидетельствует о достаточно высокой чистоте синтезированной шихты.
Согласно результатам, представленным в таблице, можно сделать вывод о том, что легирующая примесь цинка при выбранных условиях проведения экспериментов по золь–гель-синтезу шихты LiTaO3〈Zn〉, в соответствии с погрешностями используемых методов анализа, практически количественно переходит в LiТаO3.
ЗАКЛЮЧЕНИЕ
Впервые разработан метод золь–гель-синтеза гомогенно легированной в широком диапазоне концентраций шихты танталата лития (LiTaO3〈Zn〉) заданного состава с использованием цитратных прекурсоров, содержащих литий, тантал и цинк. Установлено, что технологический режим получения однофазной гомогенно легированной шихты LiTaO3〈Zn〉, в конечном итоге, зависит от концентрации цинка. Так, для концентрации [Zn] ≈ ≈ 1 мас. % необходимо прокаливание гомогенной смеси прекурсоров при ~1000°С, а для концентрации [Zn] ≈ 2.2 мас. % – при ~1200°С.
Полученные результаты служат основой промышленной технологии получения новых оптических кристаллических и функциональных керамических материалов на основе LiTaO3〈Zn〉. Причем предполагается, что кристаллы LiTaO3〈Zn〉 будут обладать повышенной оптической стойкостью, высокой оптической и концентрационной однородностью, а новые функциональные керамические пьезоэлектрические материалы на основе танталата лития – улучшенными акустическими и пьезоэлектрическими характеристиками.
Следующим этапом данной работы будет выращивание сегнетоэлектрических кристаллов LiTaO3〈Zn〉 и получение новой функциональной керамики на основе танталата лития, а также исследование их характеристик в зависимости от концентрации цинка.
Список литературы
Lines M.E., Glass A.M. Principles and Applications of Ferroelectrics and Related Materials. Oxford: Clarendon Press, 1977. 680 p.
Кузьминов Ю.С. Ниобат и танталат лития – материалы для нелинейной оптики. М.: Наука, 1975. 224 с.
Кузьминов Ю.С. Электрооптический и нелинейно–оптический кристалл ниобата лития. М.: Наука, 1987. 264 с.
Volk T., Wohleke M. Lithium Niobate. Defects, Photorefraction and Ferroelectric Switching. Berlin: Springer, 2008. 250 p.
Yang J., Mao Q., Shang J., Hao H., Li Q., Huang C., Zhang L., Sun J. Preparation and Characterization of Thick Stoichiometric Lithium Tantalate Crystals by Vapor Transport Equilibration Method // Mater. Lett. 2018. V. 232. № 1. P. 150–152. https://doi.org/10.1016/j.matlet.2018.08.105
Tang F., Long S., Yang X., Yang M., Quan J., Lin S., Ma D., Zhu Y., Wang B. Optimization of Pyroelectric Figures of Merit via Magnesia Doping in Lithium Tantalate Single Crystal // J. Phys. D: Appl. Phys. 2018. V. 51. № 39. P. 395101. https://doi.org/10.1088/1361-6463/aad88d
Vyalikh A., Zschornak M., Kohler T. Analysis of the Defect Clusters in Congruent Lithium Tantalite // Phys. Rev. Mater. 2018. V. 2. № 1. P. 013804. https://doi.org/10.1103/PhysRevMaterials.2.013804
Pryakhina V.I., Greshnyakov E.D., Lisjikh B.I., Akhmatkhanov A.R., Alikin D.O., Shur V.Ya., Bartasyte A. As-grown Domain Structure in Lithium Tantalate with Spatially Nonuniform Composition // Ferroelectrics. 2018. V. 525. № 1. P. 47–53. https://doi.org/10.1080/00150193.2018.1432926
Buzady A., Unferdorben M., Toth G. Refractive Index and Absorption Coefficient of Undoped and Mg-Doped Lithium Tantalate in the Terahertz Range // J. Infrared Millimeter Terahertz Waves. 2017. V. 38. № 8. P. 963–971. https://doi.org/10.1007/s10762-017-0393-y
Lee K-S., Ko D.-K., Yu N.E. Temperature-Dependent Sellmeier Equation at Terahertz Frequency Range for 1 mol. % MgO-doped Stoichiometric Lithium Tantalate // Jpn. J. Appl. Phys. 2017. V. 56. № 4. P. 040303. https://doi.org/10.7567/JJAP.56.040303
Gorelik V., Sidorov N., Vodchits A. Optical Properties of Lithium Niobate and Lithium Tantalate Crystals with Impurities and Defects // Phys. Wave Phenomena. 2017. V. 25. № 1. P. 10–19. https://doi.org/10.3103/S1541308X17010022
Xiaoling Z., Ming Y., Menqxue L. Comparison of Broadband Second-Harmonic Generation in Periodically Poled Stoichiometric Lithium Tantalate with Different Magnesium Oxide Doping Concentrations // J. Opt. Adv. Mater. 2016. V. 18. № 7–8. P. 613–617.
Ichioka H., Furuya S., Asaka T., Nakano H., Fukuda K. Crystal Structures and Enhancement of Photoluminescence Intensities by Effective Doping for Lithium Tantalate Phosphors // Powder Diffraction. 2015. V. 30. № 4. P. 326–332. https://doi.org/10.1017/S0885715615000688
Окатов М.А. Справочник технолога-оптика. Спб.: Политехника, 2004. 679 с.
Маслобоева С.М., Палатников М.Н., Арутюнян Л.Г., Иваненко Д.В. Методы получения легированной шихты ниобата лития для выращивания монокристаллов // Изв. СПбГТИ(ТУ). 2017. № 38(64). С. 34–43.
Маслобоева С.М., Сидоров Н.В., Палатников М.Н., Арутюнян Л.Г., Чуфырев П.Г. Cинтез и исследование строения оксида ниобия(V), легированного катионами Mg2+ и gd3+ // Журн. неорган. химии. 2011. Т. 56. № 8. С. 1264–1268.
Палатников М.Н., Бирюкова И.В., Маслобоева С.М., Макарова О.В., Кравченко О.Э., Яничев А.А., Сидоров Н.В. Cравнение структуры и оптической однородности кристаллов LiNbO3〈Mg〉, выращенных из шихты различного генезиса // Неорган. материалы. 2013. Т. 49. № 7. С. 765–770. https://doi.org/10.7868/S0002337X13060080
Маслобоева С.М., Елизарова И.Р., Кадырова Г.И., Арутюнян Л.Г. Cинтез и свойства гомогенно легированных Nb2O5〈Dy〉 и шихты состава LiNbO3〈Dy〉 // Неорган. материалы. 2014. Т. 50. № 8. С. 867–873. https://doi.org/10.7868/S0002337X14080132
Маслобоева С.М., Арутюнян Л.Г., Палатников М.Н. Новый подход к получению легированной шихты ниобата лития для выращивания монокристаллов // Журн. неорган. химии. 2018. Т. 63. № 4. С. 421–426. https://doi.org/10.7868/S0044457X18040050
Палатников М.Н., Сидоров Н.В., Калинников В.Т. Сегнетоэлектрические твердые растворы на основе оксидных соединений ниобия и тантала: синтез, исследование структурного упорядочения и физических характеристик. Санкт-Петербург: Наука, 2001. 2002 (переиздание). 302 с.
Маслобоева С.М., Елизарова И.Р., Арутюнян Л.Г., Калинников В.Т. Cинтез и исследование шихты танталата лития, легированной редкоземельными элементами // Докл. Академии наук. 2015. Т. 460. № 4. С. 427–431. https://doi.org/10.7868/S0869565215040143
Маслобоева С.М., Дубошин Г.Н., Арутюнян Л.Г. Исследования получения гептафтортанталата калия из фторидно-сернокислых растворов // Вестн. МГТУ. 2009. Т. 12. № 2. С. 279–285.
Фарбун И.А., Романова И.В., Териковская Т.Е., Дзанашвили Д.И., Кириллов С.А. Комплексо-образование при синтезе оксида цинка из цитратных растворов // Журн. прикл. химии. 2007. Т. 80. № 11. С. 1773–1778.
Werde K.V., Mondelaers D., Vanhoyland G., Nelis D., Van Bael M.K., Mullens J. Thermal Decomposition of the Ammonium Zine Acetate Citrate Precursor for Aqueous Chemical Solution Depositions of ZnO // J. Mater. Sci. 2002. V. 37. № 1. P. 81–88.
Харитонов Ю.Я., Алиханова З.М. Инфракрасные спектры поглощения некоторых комплексных соединений уранила с остатками окси-кислот // Радиохимия. 1964. Т. 6. № 6. С. 702–713.
Nyquist R.A. Infrared Spectra of Inorganic Compounds. N.Y., London: Academic Press, 1971. 496 p.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы