Неорганические материалы, 2020, T. 56, № 4, стр. 415-421
Фосфаты циркония и d-переходных металлов как катализаторы для селективной дегидратации метанола в диметиловый эфир
И. О. Глухова 1, *, Е. А. Асабина 1, В. И. Петьков 1, Е. Ю. Миронова 2, Н. А. Жиляева 2, А. М. Ковальский 3, А. Б. Ярославцев 2
1 Национальный исследовательский университет им. Н.И. Лобачевского
603950 Нижний Новгород, Гагарина пр., 23, Россия
2 Институт нефтехимического синтеза Российской академии наук им. А.В. Топчиева
119991 Москва, Ленинский пр., 29, Россия
3 Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский пр., 4, Россия
* E-mail: IO-Glukhova@yandex.ru
Поступила в редакцию 12.03.2019
После доработки 30.09.2019
Принята к публикации 07.11.2019
Аннотация
Фосфаты состава M0.5(1 + x)FexZr2 – x(PO4)3 (M – Ni, Cu, Mn; 0 ≤ x ≤ 0.5) исследованы как катализаторы конверсии метанола в температурном интервале 200−450°C. Показано, что в данном ряду наиболее активными и селективными катализаторами получения диметилового эфира являются Ni0.5Zr2(PO4)3 и Cu0.65Fe0.3Zr1.7(PO4)3. Показатель выхода диметилового эфира на синтезированных материалах сопоставим с известными промышленными катализаторами.
ВВЕДЕНИЕ
Диметиловый эфир (ДМЭ) используется как сырье в химической промышленности для производства уксусной кислоты [1], олефинов [2], топлив [3]. Кроме того, ДМЭ сам по себе рассматривается в качестве перспективного дизельного топлива [4–6] для двигателей внутреннего сгорания и имеет цетановое число, близкое к оптимальному 55–60 ед. [7]. К преимуществам ДМЭ также относят высокую окислительную стабильность и низкую концентрацию вредных выбросов [8–10].
Для получения ДМЭ чаще всего используют процесс дегидратации метанола
(1)
$2{\text{C}}{{{\text{H}}}_{3}}{\text{OH}} \leftrightarrow {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OC}}{{{\text{H}}}_{{\text{3}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Одновременно с дегидратацией протекают и побочные реакции, включая термолиз метанола (2) и образование диоксида углерода при паровом риформинге ((3), (4))
(2)
$2{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH }} \leftrightarrow {\text{ }}2{\text{CO}} + 4{{{\text{H}}}_{2}},$(3)
${\text{C}}{{{\text{H}}}_{3}}{\text{OH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{C}}{{{\text{O}}}_{2}} + 3{{{\text{H}}}_{2}},$(4)
${\text{CO}} + {{{\text{H}}}_{2}}{\text{O}} \leftrightarrow {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{2}}.$Отсутствие связей C−C в молекуле обуславливает сравнительно низкие температуры конверсии метанола по сравнению с этанолом и другими спиртами [11, 12].
Для синтеза ДМЭ чаще всего используют твердые гетерогенные катализаторы, так как они легче отделяются и регенеруют. Известен ряд твердокислотных катализаторов этого процесса [12–19]. Среди них можно выделить цеолит ZSM-5 и γ-Al2O3, которые обеспечивают высокую селективность и конверсию сырья при сравнительно невысокой стоимости. Основным недостатком указанных материалов является их низкая активность (А = = 0.9–3.0 ммоль/(ч г) при 300°C [20]), что побуждает поиск новых катализаторов риформинга метанола.
В последнюю четверть века показана каталитическая активность в ряде каталитических процессов каркасных фосфатов, принадлежащих к структурным типам NaZr2(PO4)3 (NZP/NASICON) и Sc2(WO4)3 (SW) [21–32]. Данные структуры имеют сходный способ укладки каркасобразующих полиэдров − октаэдры и фосфатные тетраэдры соединены общими атомами кислорода, однако отличаются расположением полиэдров в каркасе. Такие соединения могут быть описаны общей формулой ${\text{A}}_{x}^{{{\text{I,II}}}}{\text{B}}_{y}^{{{\text{III}}}}{\text{C}}_{z}^{{{\text{IV}}}}$(DO4)3, где A − щелочные, щелочноземельные, d-переходные металлы; B − металл в степени окисления 3+, C − металл в степени окисления 4+, D – поливалентный элемент (P, Si, V, S); коэффициенты x, y, z находятся в интервале 0 ≤ x(y, z) ≤ 2.0 согласно стехиометрии соединения. Позиции A, B, C и D могут быть заняты различными катионами, что позволяет широко варьировать состав фосфатов, тем самым изменяя количество и силу кислотных центров Льюиса, Бренстеда и окислительно-восстановительных центров. Такая особенность в сочетании с термической стабильностью каркасных фосфатов делает их перспективными катализаторами дегидрирования, дегидратации спиртов и синтеза некоторых органических продуктов [33].
Исследования риформинга спиртов показали каталитическую активность каркасных фосфатов как в кислотно-основных реакциях (дегидратация) [20, 26, 28, 29, 32], так и в окислительно-восстановительных превращениях (дегидрирование) [27, 28, 30, 31]. Некоторые катализаторы со структурой NZP- и SW-семейств использовались для получения водорода из метанола [34, 35], в том числе и в процессах мембранного катализа [36, 37].
Настоящая работа посвящена исследованию фосфатов каркасного строения M0.5(1 + x)FexZr2 – x(PO4)3 (M – Mn, Cu, Ni; 0 ≤ x ≤ ≤ 0.5) в процессах дегидратации метанола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Процедура получения фосфатов M0.5(1 + x)FexZr2 – x(PO4)3 (M – Ni, Cu; x = 0, 0.3, 0.5) методом Печини описана в работах [31, 38]. В качестве исходных реагентов взяты водные растворы NiSO4 ⋅ 7H2O (99.0%, Реахим), CuCl2 (приготовлен растворением CuO (99.0%, Реахим) в соляной кислоте), Fe(NO3)3 (98.0%, Реахим), ZrOCl2 ⋅ 8H2O (99.0%, Реахим), NH4H2PO4 (99.0%, Реахим). Этиленгликоль (ЭГ, 98.0%, Реахим) выступает как промотирующий агент создания слабых взаимодействий между частицами, в то время как лимонная кислота (ЛК, 99.0%, Реахим) обладает хелатным эффектом.
Для синтеза методом Печини ЭГ и водный раствор NH4H2PO4 медленно приливают к водным растворам солей никеля, меди, железа и циркония в стехиометрических соотношениях. Свежеприготовленные гели сушат при 90°С, затем отжигают при 350°С в течение 5 ч и 600, 650, 700°С в течение по меньшей мере 48 ч на каждой стадии. После каждого отжига материал диспергировали для ускорения твердофазных реакций. Использование ЭГ и ЛК позволяет получить целевой продукт при более низких температурах по сравнению с традиционным золь–гель-синтезом.
Золь–гель-синтез [39] в щелочной среде использовался для получения фосфатов Mn0.5(1 +x)FexZr2 –x(PO4)3 (x = 0, 0.1, 0.3). Образцы, полученные при высоких значениях pH 9–10, были более кристалличными по сравнению с фосфатами, полученными в кислой среде (pH 2). Водные растворы марганца (Mn(CH3COO)2 ⋅ 4H2O (99.5%, ACROS Organics)), железа и циркония были смешаны в стехиометрических количествах, затем к смеси был добавлен раствор дигидрофосфата аммония. Необходимый уровень pH в конечной смеси достигался добавлением NH3 (99.5%, Реахим). Полученные гели сушили при 90°C и отжигали без доступа воздуха при 600, 650, 670, 700°C по меньшей мере в течение 48 ч на каждой стадии.
Фазовый состав полученных образцов определяли методом РФА на дифрактометре Shimadzu XRD-6000 (30 кВ и 30 мА) с использованием CuKα-излучения (λ = 1.54178 Å) в интервале 2θ 10°−60°.
Микрофотографии сложных фосфатов получены на сканирующем электронном микроскопе JEOL JSM 7600F с катодом Шоттки. Микроскоп оборудован энергодисперсионным спектрометром Oxford Instruments X-Max 80 (Premium) с дрейфующим полупроводниковым кремниевым детектором.
Значение удельной поверхности и пористости катализаторов измерены низкотемпературной капиллярной адсорбцией азота на анализаторе Micromeritics ASAP 2020N. Образцы были предварительно дегазированы при 350°С в течение 1 ч.
Для исследования реакции конверсии метанола был использован трубчатый реактор (длина 21.5 см, эффективный диаметр 0.9 см). Потоки водорода и аргона контролировались с помощью регуляторов массового расхода, температура реакции – с помощью термопар, размещенных вдоль внешней поверхности реактора [40].
0.3 г катализатора смешивали с гранулированным кварцем (фракция 1–3 мм) и помещали между двумя слоями чистого кварца. Перед проведением каталитических испытаний образцы активировали в токе смеси H2 (5%)/Ar (20 см3/мин) при 350°C в течение 3 ч. Испытания катализаторов проводились в интервале температур 200−450°C с газом-носителем аргоном (потоковая скорость 20 см3/мин). Пары метанола, охлажденного до 2°C, смешивались с аргоном и поступали в реактор. Газообразные продукты реакции анализировались на хроматографе LHM 8MD с детектором по теплопроводности и колонкой с Порапаком-Т (газ-носитель гелий). Оксиды углерода (II) и (IV) анализировались на этом же хроматографе на колонке с активированным углем. Содержание водорода определялось на хроматографе Chrom-4 (газ-носитель Ar) с детектором по теплопроводности и колонкой с неподвижной фазой СаА-цеосорб.
Степень конверсии метанола Xi (об. %), селективность Si (об. %) и выход продуктов Y определялись с помощью следующих соотношений:
(5)
${{X}_{i}} = {{\left( {{{\varphi }_{0}}--{\text{ }}{{\varphi }_{1}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{\varphi }_{0}}--{\text{ }}{{\varphi }_{1}}} \right)} {{{\varphi }_{0}}}}} \right. \kern-0em} {{{\varphi }_{0}}}} \times 100,$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
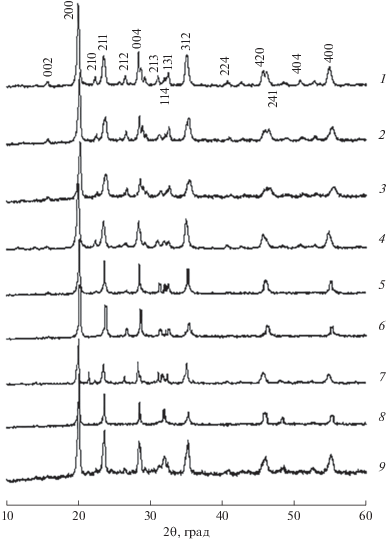
Результаты рентгенофазового анализа материалов состава M0.5(1 +x)FexZr2 – x(PO4)3 (M – Ni, Cu; x = 0, 0.3, 0.5 и M – Mn; x = 0, 0.1, 0.3) (рис. 1) свидетельствуют о том, что образцы были однофазными и кристаллизовались в структурном типе Sc2(WO4)3. Рентгенограммы фосфатов индицированы в моноклинной симметрии, пр. гр. P21/n.
Рис. 1.
Рентгенограммы фосфатов: Ni0.5Zr2(PO4)3 (1), Ni0.65Fe0.3Zr1.7(PO4)3 (2), Ni0.75Fe0.5Zr1.5(PO4)3 (3), Cu0.5Zr2(PO4)3 (4), Cu0.65Fe0.3Zr1.7(PO4)3 (5), Cu0.75Fe0.5Zr1.5(PO4)3 (6), Mn0.5Zr2(PO4)3 (7), Mn0.55Fe0.1Zr1.9(PO4)3 (8), Mn0.65Fe0.3Zr1.7(PO4)3 (9).
Согласно результатам электронной микроскопии, полученные материалы состоят из агломератов от 0.1 до 10 мкм. Микрозондовый анализ показал, что полученные образцы гомогенны, а их составы соответствовали теоретическим. Удельная площадь поверхности изученных образцов составляла от 16 м2/г (для Cu0.65Fe0.3Zr2(PO4)3) до 83 м2/г (для Mn0.55Fe0.1Zr1.9(PO4)3) (табл. 1). Замещение Zr4+ на Fe3+ ведет к агломерации частиц исследуемых образцов. Это объясняется понижением температуры плавления материалов, что способствует их спеканию.
Таблица 1.
Удельная площадь поверхности и оцененный на ее основании средний размер частиц для катализаторов состава M0.5(1 + x)FexZr2 – x(PO4)3
| Состав | Удельная площадь поверх-ности по методу БЭТ, м2/г | Средний размер частиц, нм |
|---|---|---|
| Ni0.5Zr2(PO4)3 | 37 ± 2 | 160 |
| Ni0.65Fe0.3Zr1.7(PO4)3 | 16 ± 1 | 370 |
| Ni0.75Fe0.5Zr1.5(PO4)3 | 24 ± 1 | 250 |
| Cu0.5Zr2(PO4)3 | 45 ± 2 | 130 |
| Cu0.65Fe0.3Zr1.7(PO4)3 | 16 ± 1 | 370 |
| Cu0.75Fe0.5Zr1.5(PO4)3 | 21 ± 1 | 290 |
| Mn0.55Fe0.1Zr1.9(PO4)3 | 83 ± 4 | 72 |
| Mn0.65Fe0.3Zr1.7(PO4)3 | 50 ± 3 | 119 |
Для всех изученных катализаторов основным продуктом конверсии был ДМЭ, при высоких температурах также наблюдалось образование CO, CO2, H2. Максимальная (до 95%) конверсия метанола достигалась при использовании Ni0.5Zr2(PO4)3, в то время как наименее эффективным – X ~ 60% – оказался марганецсодержащий образец (рис. 2). Следует отметить, что селективность по ДМЭ для всех катализаторов при высоких температурах понижается (рис. 3). При этом повышается скорость процессов дегидрирования метанола и парового риформинга, протекающих по уравнениям (2)–(4). Выход водорода для исследуемого процесса сопоставлен с выходом ДМЭ на примере медьсодержащих катализаторов (x = 0 и 0.3, рис. 4). С ростом температуры наблюдается уменьшение выхода ДМЭ и увеличение концентрации водорода в продуктах конверсии, обусловленное протеканием реакций (2)–(4). Также наблюдается увеличение концентрации водорода при введении в состав катализатора железа, способного катализировать окислительно-восстановительные процессы.
Рис. 2.
Температурные зависимости степени конверсии метанола на катализаторах Ni0.5Zr2(PO4)3 (1), Ni0.65Fe0.3Zr1.7(PO4)3 (2), Ni0.75Fe0.5Zr1.5(PO4)3 (3), Cu0.5Zr2(PO4)3 (4), Cu0.65Fe0.3Zr1.7(PO4)3 (5), Cu0.75Fe0.5Zr1.5(PO4)3 (6), Mn0.5Zr2(PO4)3 (7).
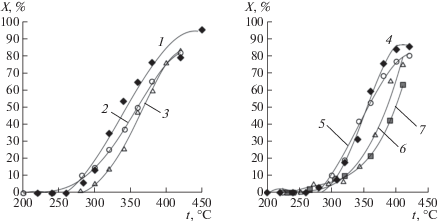
Рис. 3.
Селективность катализаторов по ДМЭ: Ni0.5Zr2(PO4)3 (1), Ni0.65Fe0.3Zr1.7(PO4)3 (2), Ni0.75Fe0.5Zr1.5(PO4)3 (3), Cu0.5Zr2(PO4)3 (4), Cu0.65Fe0.3Zr1.7(PO4)3 (5), Cu0.75Fe0.5Zr1.5(PO4)3 (6), Mn0.5Zr2(PO4)3 (7).
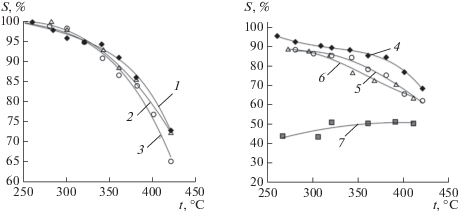
Рис. 4.
Температурные зависимости выхода продуктов риформинга метанола на фосфатах Cu0.5Zr2(PO4)3 и Cu0.65Fe0.3Zr1.7(PO4)3.
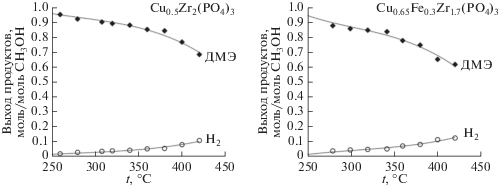
Для всех катализаторов концентрация монооксида углерода сохранялась на низком уровне. Кроме ДМЭ и водорода в заметных количествах выделялся лишь диоксид углерода. Это обусловлено тем, что начинающийся при достаточно низких температурах процесс дегидратации метанола (реакция (1)) обеспечивает достаточно высокую концентрацию водяных паров для протекания процессов парового риформинга метанола (реакция (3)).
Для всех катализаторов прослеживается закономерное снижение селективности по отношению к реакции (1) при замещении части циркония на железо. Видимо, это обусловлено тем, что гетерогенное замещение циркония на катионы железа повышает активность этих катализаторов в процессах дегидрирования [35]. Также для никель- и медьсодержащих материалов высокая селективность при низких температурах существенно понижается при высоких за счет более активного протекания побочных процессов. Еще более низкая селективность во всем диапазоне температур проявляется для катализаторов, содержащих марганец. Это обусловлено активностью этих переходных металлов в окислительно-восстановительных процессах дегидрирования метанола и его паровой конверсии [41].
Полученные катализаторы на основе фосфатов никеля-циркония и меди-циркония конкурентоспособны с промышленными катализаторами конверсии метанола. Так, по каталитической активности они превосходят известные оксидные и фосфатные катализаторы, изученные в работах [20, 42–44], и уступают лишь цеолиту H-ZSM-5 [45]. По селективности они немного уступают лишь алюмосиликатным и алюмофосфатным системам [20, 42].
ЗАКЛЮЧЕНИЕ
Фосфатные катализаторы с Zr4+ и d-переходными металлами (Ni, Cu, Mn) синтезированы золь–гель-методом и методом Печини. Все изученные материалы проявили высокую активность в реакции дегидратации метанола и образовании ДМЭ. Наиболее высокие значения конверсии метанола и селективности по ДМЭ достигались на фосфатах Ni0.5Zr2(PO4)3 и Cu0.65Fe0.3Zr1.7(PO4)3. По данным показателям они сопоставимы с лучшими из описанных в литературе катализаторов.
Список литературы
Müller M., Hübsch U. Dimethyl Ether // Ullmann’s Encyclopedia of Industrial Chemistry, seventh ed. 2005. Weinheim: Wiley-VCH, 308 p.
Pérez-Uriarte P., Ateka A., Gayubo A.G., Cordero-Lanzac T., Aguayo A.T., Bilbao J. Deactivation Kinetics for the Conversion of Dimethyl Ether to Olefins over a HZSM-5 Zeolite Catalyst // Chem. Eng. J. 2017. V. 311. P. 367–377. https://doi.org/10.1016/j.cej.2016.11.104
Wang Z., He T., Li J., Wu J., Qin J., Liu G., Han D., Zi Z., Li Z., Wu J. Design and Operation of a Pilot Plant for Biomass to Liquid Fuels by Integrating Gasification, DME Synthesis and DME to Gasoline // Fuel. 2016. V. 186. P. 587–596. https://doi.org/10.1016/j.fuel.2016.08.108
Sorenson S.C., Mikkelsen S.V. Performance and Emissions of a 0.273 Liter Direct Injection Diesel Engine Fuelled with Neat Dimethyl Ether // SAE Trans. 1995. V. 104. № 4. P. 80–90. http://www.jstor.org/stable/44615066
Wang D., Zhu G., Li Zh., Xia C. Polyoxymethylene Dimethyl Ethers as Clean Diesel Additives: Fuel Freezing and Prediction // Fuel. 2019. V. 237. P. 833–839. https://doi.org/10.1016/j.fuel.2018.10.014
Park S.H., Lee C.S. Applicability of Dimethyl Ether (DME) in a Compression Ignition Engine as an Alternative Fuel // Energy Convers. Manage. 2014. V. 86. P. 848–863. https://doi.org/10.1016/j.enconman.2014.06.051
Ogawa T., Inoue N., Shikada T., Inokoshi O., Ohno Y. Direct Dimethyl Ether (DME) Synthesis from Natural Gas // Stud. Surf. Sci. Catal. 2004. V. 147. P. 37–384. https://doi.org/10.1016/S0167-2991(04)80081-8
Arcoumanis C., Bae C., Crookes R., Kinoshita E. The Potential of Dimethyl Ether (DME) as an Alternative Fuel for Compression-Ignition Engines: A Review // Fuel. 2008. V. 87. P. 1014–1030. .https://doi.org/10.1016/j.fuel.2007.06.007
Fleisch T.H., Basu A., Sills R.A. Introduction and Advancement of a New Clean Global Fuel: The Status of DME Developments in China and beyond // J. Nat. Gas Sci. Eng. 2012. V. 9. P. 94–107. https://doi.org/10.1016/j.jngse.2012.05.012
Fleisch T.H., McCarthy C., Basu A., Udovich C., Charbonneau P., Slodowske W., Mikkelsen S.V., McCandless J. A New Clean Diesel Technology: Demonstration of ULEV Emissions on a Navistar Diesel Engine Fueled with Dimethyl Ether // SAE Trans. 1995. V. 104. P. 42–53. www.jstor.org/stable/44615063
Ramos F.S., Duarte de Farias A.M., Borges L.E.P., Monteiroc J.L., Fraga M.A., Sousa-Aguiar E.F., Appel L.G. Role of Dehydration Catalyst Acid Properties on One-Step DME Synthesis over Physical Mixtures // Catal. Today. 2005. V. 101. P. 39–44. https://doi.org/10.1016/j.cattod.2004.12.007
Il’in A.B., Orekhova N.V., Ermilova M.M., Yaroslavtsevet A.B. Catalytic Activity of LiZr2(PO4)3 Nasicon-Type Phosphates in Ethanol Conversion Process in Conventional and Membrane Reactors // Catal. Today. 2016. V. 268. P. 29–36. https://doi.org/10.1016/j.cattod.2015.12.017
Xu M., Lunsford J.H., Goodman D.W., Bhattacharyya A. Synthesis of Dimethyl Ether (DME) from Methanol over Solid-Acid Catalysts // Appl. Catal., A. 1997. V. 149. P. 289–301. https://doi.org/10.1016/S0926-860X(96)00275-X
Ng K.L., Chadwick D., Toseland B.A. Kinetics and Modelling of Dimethyl Ether Synthesis from Synthesis Gas // Chem. Eng. Sci. 1999. V. 54. P. 3587–3592. https://doi.org/10.1016/S0009-2509(98)00514-4
Fu Y., Hong T., Chen J., Auroux A., Shen J. Surface Acidity and the Dehydration of Methanol to Dimethyl Ether // Thermochim. Acta. 2005. V. 434. P. 22–26. https://doi.org/10.1016/j.tca.2004.12.023
Vishwanathan V., Jun K.W., Ron H.S. Vapour Phase Dehydration of Crude Methanol to Dimethyl Ether over Na-modified H-ZSM-5 Catalysts // Appl. Catal., A. 2004. V. 276. P. 251–255. https://doi.org/10.1016/j.apcata.2004.08.011
Yaripour F., Mollavali M., Mohammad Jam S., Atashi H. Catalytic Dehydration of Methanol to Dimethyl Ether Catalyzed by Aluminum Phosphate Catalysts // Energy Fuels. 2009. V. 23. P.1896–1900. https://doi.org/10.1021/ef800856c
Fazlollahnejad M., Taghizadeh M., Eliassi A., Bakeri G. Experimental Study and Modeling of an Adiabatic Fixed-Bed Reactor for Methanol Dehydration to Dimethyl Ether // Chin. J. Chem. Eng. 2009. V. 17. P. 630–634. https://doi.org/10.1016/S1004-9541(08)60255-4
Lytkina A.A., Orekhova N.V., Yaroslavtsev A.B. Catalysts for the Steam Reforming and Electrochemical Oxidation of Methanol // Inorg. Mater. 2018. V. 54. № 13. P. 1315–1329. https://doi.org/10.1134/S0020168518130034
Суханов М.В., Ермилова М.М., Орехова Н.В., Терещенко Г.Ф., Петьков В.И., Щелоков И.А. Каталитические свойства цирконийсодержащих фосфатов каркасного строения в дегидратации метанола // Вестник ННГУ. 2007. № 1. С. 89–94.
Ziyad M., Arsalane S., Kacimi M., Coudurier G., Millet L.-M., Jacques C., Védrine J.C. Behavior of Silver-thorium Phosphate AgTh2(PO4)3 in Butan-2-ol Conversion // Appl. Catal., A. 1996. V. 147. P. 363–373. https://doi.org/10.1016/S0926-860X(96)00162-7
Йенеалем С.Н., Гульянова С.Г., Чехлова Т.К., Тимакин А.Г., Ермилова М.М., Петьков В.И. Каталитическая активность и селективность двойных фосфатов циркония и 3d-переходных металлов в конверсии изопропанола // Журн. физ. химии. 2000. Т. 74. № 12. С. 2281–2283.
Brik Y., Kacimi M., Bozon-Verduraz F., Ziyad M. Characterization of Active Sites on AgHf2(PO4)3 in Butan-2-ol Conversion // Microporous Mesoporous Mater. 2001. V. 43. P. 103–112. https://doi.org/10.1016/S0926-860X(96)00162-7
Садыков В.А., Павлова С.Н., Заболотная Г.В., Чайкина М.В., Максимовская Р.И., Цыбуля С.В., Бургина Е.Б., Зайковский В.И., Литвак Г.С., Фролова Ю.В., Кочубей Д.И., Кривенцов В.В., Паукштис Е.А., Коломийчук В.Н., Лунин В.В., Кузнецова Н.Н., Агравал Д., Рой Р. Разработка научных основ технологии синтеза высокодисперсных каркасных цирконийфосфатов – катализаторов процессов изомеризации парафинов и их селективного окисления // Кинетика и катализ. 2001. Т. 42. № 3. С. 432–441.
Суханов М.В., Ермилова М.В., Орехова Н.В., Петьков В.И., Терещенко Г.Ф. Каталитические свойства фосфата циркония и двойных фосфатов циркония и щелочных металлов со структурой NaZr2(PO4)3 // Журн. прикл. химии. 2006. Т. 79. № 4. С. 622–626. https://doi.org/10.1134/S1070427206040215
Пылинина А.И., Михаленко И.И., Ермилова М.М., Орехова Н.В., Петьков В.И. Дегидратация бутиловых спиртов на медьсодержащих ортофосфатах циркония // Журн. физ. химии. 2010. Т. 84. № 3. С. 465–470. https://doi.org/10.1134/S0036024410030106
Петьков В.И., Суханов М.В., Ермилова М.М., Терещенко Г.Ф. Разработка и создание насыпных и мембранных катализаторов на основе фосфатов и молибдатов каркасного строения // Журн. прикл. химии. 2010. Т. 83. № 3. С. 465–470. https://doi.org/10.1134/S1070427210100022
Ильин А.Б., Новикова С.А., Суханов М.В., Ермилова М.М., Орехова Н.В., Ярославцев А.Б. Каталитическая активность фосфатов со структурой NASICON при дегидратации и дегидрировании этанола // Неорган. материалы. 2012. Т. 48. № 4. С. 466–470. https://doi.org/10.1134/S002016851204005X
Ermilova M.M., Sukhanov M.V., Borisov R.S., Orekhova N.V., Pet’kov V.I., Novikova S.A., Il’in A.B., Yaroslavtsev A.B. Synthesis of the New Framework Phosphates and Their Catalytic Activity in Ethanol Conversion into Hydrocarbons // Catal. Today. 2012. V. 193. P. 37–41. https://doi.org/10.1016/j.cattod.2012.02.029
Поварова Е.И., Пылинина А.И., Михаленко И.И. Каталитическое дегидрирование пропанола-2 на Cu, Co, Ni-содержащих Na–Zr-фосфатах // Журн. физ. химии. 2012. Т. 86. № 6. С. 1041–1047. https://doi.org/10.1134/S0036024412060210
Асабина Е.А., Орехова Н.В., Ермилова М.М., Петьков В.И., Глухова И.О., Жиляева Н.А., Ярославцев А.Б. Синтез и каталитические свойства M0.5(1 + x)FexTi2 – x(PO4)3 (M – Co, Ni, Cu; 0 ≤ х ≤ 2) в реакциях превращения метанола // Неорган. матер. 2015. Т. 51. № 8. С. 864–869. https://doi.org/10.7868/S0002337X15080047
Мошарева М.А., Ильин А.Б., Жиляева Н.А., Новикова С.А., Ярославцев А.Б. Каталитическая активность материалов на основе сложных фосфатов гафния со структурой NASICON в реакциях конверсии этанола // Рос. нанотехнол. 2017. Т. 12. № 9–10. С. 48–53. https://doi.org/10.1134/S199507801705007X
Shahbazi-Alavi H., Nazemzadeh S.H., Ziarati A., Safaei-Ghomi J. Nano-NiZr4(PO4)6 as a Superior Catalyst for the Synthesis of Propargylamines under Ultrasound Irradiation // Z. Naturforsch., B. 2018. V. 73. № 3–4. P. 185–189. https://doi.org/10.1515/znb-2017-0178
Pylinina A.I., Mikhalenko I.I. Catalytic Activity of Thermally Treated Li3Fe2(PO4)3 in the Conversion of Butan-1-ol // Mendeleev Commun. 2012. V. 22. № 3. P. 150–151. https://doi.org/10.1016/j.mencom.2012.05.013
Il’in A.B., Ermilova M.M., Orekhova N.V., Cretin M., Yaroslavtsev A.B. Conversion of Aliphatic C1-C2 Alcohols on In, Nb, Mo-Doped Complex Lithium Phosphates and HZr2(PO4)3 with NASICON-type Structure // J. Alloys Compd. 2018. V. 748. P. 583–590. https://doi.org/10.1016/j.jallcom.2018.03.099
Tereshchenko G.F., Orekhova N.V., Ermilova M.M., Malygin A.A., Orlova A.I. Nanostructured Phosphorus-Oxide-Containing Composite Membrane Catalysts // Catal. Today. 2006. V. 118. № 1–2. P. 85–89. https://doi.org/10.1016/j.cattod.2005.12.014
Ilin A.B., Orekhova N.V., Ermilova M.M., Yaroslavtsev A.B. Catalytic Activity of LiZr2(PO4)3 Nasicon-type Phosphates in Ethanol Conversion Process in Conventional and Membrane Reactors // Catal. Today. 2016. V. 268. P. 29–36. https://doi.org/10.1016/j.cattod.2015.12.017
Ramírez A.E., Solarte N.J., Singh L.H., Coaquira J.A.H., Gaona J. S. Investigation of the Magnetic Properties of SrFe12O19 Synthesized by the Pechini and Combustion Methods // J. Magn. Magn. Mater. 2017. V. 438. P. 100–106. https://doi.org/10.1016/j.jmmm.2017.04.042
Alcaraz L., Isasi J., Díaz-Guerra C. Effects of Preparation Method and pH Variation on the Structural Characteristics and Luminescence Properties of Y0.9Er0.1VO4 and Y0.9Er0.1V0.9Cr0.1O4 Nanopowders // J. Lumin. 2015. V. 165. P. 105–114. https://doi.org/10.1016/j.jlumin.2015.04.038
Hayer F., Bakhtiary-Davijany H., Myrstad R., Holmen A., Pfeifer P., Venvik H.J. Characteristics of Integrated Micro Packed Bed Reactor-heat Exchanger Configurations in the Direct Synthesis of Dimethyl Ether // Chem. Eng. Process. 2013. V. 70. P. 77–85. https://doi.org/10.1016/j.cep.2013.03.021
Mironova E.Y., Lytkina A.A., Ermilova M.M., Efimov M.N., Zemtsov L.M., OrekhovaN.V., Karpacheva G.P., BondarenkoG.N., Muraviev D.N., Yaroslavtsev A.B. Ethanol and Methanol Steam Reforming on Transition Metal Catalysts Supported on Detonation Synthesis Nanodiamonds for Hydrogen Production // Int. J. Hydrogen Energy. 2015. V. 40. № 8. P. 3557–3565. https://doi.org/10.1016/j.ijhydene.2014.11.082
Yaripour F., Baghaei F., Schmidt I., Perregaard J. Synthesis of Dimethyl Ether from Methanol over Aluminium Phosphate and Silica–titania Catalysts // Catal. Commun. 2005. V. 6. № 8. P. 542–549. https://doi.org/10.1016/j.catcom.2005.05.003
Vishwanathan V., Roh H.S., Kim J.W., Jun K.W. Surface Properties and Catalytic Activity of TiO2–ZrO2 Mixed Oxides in Dehydration of Methanol to Dimethyl Ether // Catal. Lett. 2004. V. 96. № 1–2. P. 23–28. https://doi.org/10.1023/B:CATL.0000029524.94392.9f
Абасов С.И., Бабаева Ф.А., Кулиев Б.Б., Пириев Н.Н., Рустамов М.И. Особенности превращения метанола и диметилового эфира в углеводороды на модифицированных цеолитах Y и ZSM-5 // Теорет. и эксперим. химия. 2013. Т. 49. № 1. С. 55–59. https://doi.org/10.1007/s11237-013-9295-9
Khandan N., Kazemeini M., Aghaziarati M. Dehydration of Methanol to Dimethyl Ether Employing Modified H-ZSM-5 Catalysts // Iran. J. Chem. Eng. 2009. V. 6. № 1. P. 3–11.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


