Неорганические материалы, 2020, T. 56, № 4, стр. 452-458
Синтез композитов в системе SiO2–ZrO2, исследование их физико-химических и каталитических свойств
А. Н. Мурашкевич 1, *, О. А. Алисиенок 1, Е. С. Новик 1, Ю. А. Титова 2, 3, О. В. Федорова 2, Г. Л. Русинов 2, 3, В. Н. Чарушин 2, 3
1 Белорусский государственный технологический университет
220006 Минск, ул. Свердлова, 13а, Беларусь
2 Институт органического синтеза им. И.Я. Постовского УрО Российской академии наук
620108 Екатеринбург, ул. С. Ковалевской/Академическая, 22/20, Россия
3 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: man@belstu.by
Поступила в редакцию 12.06.2019
После доработки 08.10.2019
Принята к публикации 20.10.2019
Аннотация
Синтезированы композиты SiO2–ZrO2 методами соосаждения, золь-золь и молекулярного наслаивания в интервале соотношений SiO2 : ZrO2 = (1–9) : 1, обладающие развитой удельной поверхностью, возрастающей при увеличении доли кремнийсодержащего компонента. С использованием методики адсорбции индикаторов Гаммета оценена концентрация кислотно-основных центров в интервале рK = 1.3–9.6, изменяющаяся от 68 до160 мкмоль/г. С использованием методов элементного анализа и ИК-спектроскопии установлено наличие на поверхности образцов кроме воды нитрат-ионов и диоксида углерода. Показано, что применение наноразмерных оксидов SiO2–ZrO2 в качестве гетерогенных катализаторов-промоторов хирального индуктора – трифторацетата (2S,4R)-4-гидроксипролил-(S)-1-фенилэтиламина – в асимметрической реакции Биджинелли позволило увеличить значения ее (энантиомерный избыток) с 39 до 68%, а выход продукта с 29 до 55%.
ВВЕДЕНИЕ
Индивидуальный оксид циркония известен как компонент высококачественной керамики [1], носителей и гетерогенных катализаторов [2], высокотемпературных топливных ячеек [3], стойких к повреждениям оптических покрытий [4], биокерамики [5]. Комбинация оксидов кремния и циркония в композитах позволяет получить материалы с более интересными для каталитических применений текстурными характеристиками и более широким диапазоном кислотно-основных свойств поверхности, что дает возможность использовать их в качестве эффективных катализаторов в ряде органических реакций [6–9] и проведении хемо- и стереоселективного синтеза [10, 11].
В системе SiO2–ZrO2 возможно формирование твердотельных материалов с различной морфологией: в виде соосажденных продуктов с гомогенизацией компонентов на молекулярном уровне [12, 13], композитов со структурой ядро/оболочка, обладающих качественно новыми свойствами, где цирконий образует упорядоченную систему активных каталитических центров [14]. Гидротермальная обработка композитов позволяет не только целенаправленно изменять структурно-сорбционные свойства, но и увеличить эффективность катализатора за счет образования новых активных центров на поверхности. В качестве исходных компонентов используют алкоксиды циркония и кремния [15], регулируя их реакционную способность использованием соответствующих комплексообразователей. Однако эти соединения токсичны, дороги и нестабильны в присутствии паров воды. В работе [16] показано, что последовательность смешения исходных растворов и соотношение Si/Zr определяют структурные, морфологические и текстурные свойства композиционных кремнезем-циркониевых ксерогелей. Наиболее однородное распределение кремния и циркония в композитах достигнуто авторами при молярном соотношении SiО2 : : ZrO2 = 2 : 1.
Наряду с необходимостью повышения дисперсности композитов в системе SiO2–ZrO2 и поиска условий формирования двойных оксидов, имеющих сложную морфологию, актуальной задачей является установление взаимосвязи кислотно-основных и текстурных свойств индивидуальных и смешанных оксидов с их каталитической активностью в реакциях органического синтеза. К настоящему времени сведения о природе и количестве кислотно-основных центров в смешанных оксидах системы SiO2–ZrO2 ограничены. В работах [12, 17–23] показано, что смешанные оксиды кремния-циркония благодаря образованию связей Si–O–Zr обладают сильными кислотными центрами при рK –11.4 и –13.8, т.е. обладают суперкислотностью.
Целью настоящей работы являлся синтез композитов в системе SiO2–ZrO2 из неорганических прекурсоров с различной морфологией, исследование их физико-химических свойств при варьировании соотношения компонентов, условий получения образцов и их каталитической активности в реакции Биджинелли.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Готовили 1%-ный (в пересчете на ZrO2) раствор ZrO(NO3)2 ⋅ 2H2O в воде в присутствии азотной кислоты. Затем смешивали ZrO(NO3)2 ⋅ 2H2O, H2O, H2O2 при массовом соотношении 1 : 13 : 1.3, смесь помещали в автоклав и выдерживали 24 ч при температуре 110°С до получения прозрачного золя диоксида циркония (≃3% ZrO2). Золь диоксида кремния получали из раствора гексафторкремниевой кислоты с концентрацией 12–14 мас. % с отношением F : Si = 5.1. Концентрация SiO2 в получаемом золе составляла 2.5–3.3 мас. %, диаметр частиц до 10 нм [24].
Синтез композитов SiO2–ZrO2 проводили смешением золя SiO2 с 1%-ным (в пересчете на ZrO2) раствором ZrO(NO3)2 ⋅ 2H2O, осаждение 20%-ным раствором (NH4)2CO3 до различных значений рН. Далее полученную суспензию перемешивали на магнитной мешалке, измеряли значения рН смеси, фильтровали и промывали. Часть отмытого продукта сушили при 120°С в течение 3 ч, другую часть оставляли в естественных условиях на воздухе. Некоторые влажные образцы перед сушкой подвергали гидротермальной обработке в автоклаве при 110°С в течение 3ч.
Получение композита по методике золь-золь проводили смешением золей оксидов кремния и циркония с последующим осаждением 20%-ным раствором К2CO3 до рН ≈8. Далее аналогично вышеописанному.
При получении композита ядро SiO2/оболочка ZrO2 в качестве кремнийсодержащего компонента использовали суспензию SiO2, полученную из раствора жидкого стекла аналогично [25], а в качестве цирконийсодержащего компонента – золь ZrO2 (3.0 маc. %). Синтез композита ядро SiO2/оболочка ZrO2 проводили в следующей последовательности: доводили pH суспензии SiO2 раствором НNO3 : H2O = 1 : 5 до значения pH 1.5, прибавляли золь ZrO2, перемешивали на магнитной мешалке в течение 10 мин. Затем раствором NH4OH : H2O = 1 : 5 поднимали рН суспензии до значений 5 или 6, перемешивали 10 мин, затем фильтровали и промывали. Полученный продукт сушили при 120°С или в естественных условиях.
Удельную поверхность образцов определяли методом адсорбционной гравиметрии, в качестве адсорбата использовали раствор фенола в н-гептане, концентрацию фенола определяли методом интерферометрии с помощью ЛИР-2.
ИК-спектры записывали на ИК-Фурье-спектрометре NEXUS NICOLET со спектральной шириной щели 2 см–1. Масса навески исследуемого композита составляла около 1 мг, что соответствует 0.1% от массы таблетки KBr (“х. ч.”).
Рентгенофазовый анализ проводили на дифрактометре ДРОН-3 (излучение СuKα, Ni-фильтр) при комнатной температуре в диапазоне углов 2θ = = 11°–70° со скоростью 2 град/мин.
Исследование кислотно-основных свойств поверхности синтезированных образцов проводили индикаторным методом по адсорбции красителей различного типа из водных или спиртовых растворов. Была использована серия из 9 индикаторов с различными значениями рК (1.3–9.6), каждый из которых позволяет фрагментарно оценить содержание реакционных групп на поверхности в довольно узком интервале кислотности (табл. 1). Использованные нами индикаторы позволяют установить наличие в исследованных образцах кислотных и основных центров умеренной силы и слабокислотных. Изучение спектральных характеристик индикаторов, а также количественное определение адсорбирующегося красителя проводили спектрофотометрическим методом на спектрофотометрах КФК-3 или Metertech SP 8001 при толщине кюветы 1 см. Сорбцию проводили из 10–4 М растворов индикаторов. Точную навеску образца (около 0.02 г), выбранную исходя из минимальной ошибки при количественных определениях и технических возможностей прибора, помещали в пробирку, приливали 5 мл раствора красителя и перемешивали в течение 2 ч. Оптическую плотность раствора, отделенную от исследуемого образца, измеряли при длине волны λ, соответствующей максимуму поглощения индикатора. Количество адсорбированного индикатора находили с использованием калибровочных графиков.
Таблица 1.
Кислотно-основные индикаторы и их характеристики
| № | Индикатор | рKа | λ, нм |
|---|---|---|---|
| 1 | Бриллиантовый зеленый | 1.30 | 630 |
| 2 | Фуксин основной | 2.10 | 555 |
| 3 | Метиловый оранжевый | 3.46 | 477 |
| 4 | Бромфеноловый синий | 4.10 | 439 |
| 5 | Метиловый красный водорастворимый | 5.00 | 430 |
| 6 | Бромкрезоловый пурпурный | 6.40 | 431 |
| 7 | Бромтимоловый синий | 7.30 | 431 |
| 8 | Феноловый красный | 8.00 | 431 |
| 9 | Фенолфталеин | 9.60 | 553 |
Для измерения температур плавления продуктов реакции Биджинелли применяли комбинированный столик Boetius, элементный анализ проводили на анализаторах Perkin Elmer 2400 II и EuroVector EA3000. Высокоэффективную жидкостную хроматографию продуктов реакции Биджинелли проводили, используя хиральную колонку YMC-Pack, Chiral-NEA-R 250 × 4.6 мм (10 мкм, детектирование при 254 нм, скорость потока элюента 1 мл/мин, элюент – ацетонитрил : вода 35 : 65). Асимметрическую реакцию Биджинелли проводили в соответствии с [26].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтезированы 3 группы образцов, в силу особенностей метода отличающихся условиями формирования композитов, их дисперсностью и концентрацией кислотно-основных центров. В табл. 2 образцы 1–4 получали методом соосаждения при варьировании соотношения SiO2 : ZrO2 = (1–9) : 1. В образцах 5а и 5б в качестве кремнеземсодержащего компонента использовали раствор тетраэтоксисилана (ТЭОС) в этиловом спирте. Наблюдалась тенденция увеличения дисперсности получаемых композитов при росте количества кремнийсодержащего компонента и увеличении рН дисперсионной среды. Гидротермальная обработка (ГТО) влажного продукта и использование полиэтиленгликоля (ПЭГ) позволили получить наиболее высокие значения удельной поверхности, сравнимые с данными других исследователей. По данным элементного анализа, композиты содержат от 41 до 45 мас. % кремния и циркония, а также 26–30 мас. % воды, количество которой слабо зависит от соотношения кремния и циркония. Все композиты содержат заметные количества углекислого газа на поверхности, о чем свидетельствует присутствие в них 0.25–0.67% углерода. Это подтверждается и данными ИК-спектроскопии (рис. 1). Кроме того, в композитах присутствует остаточное количество нитрат-анионов, судя по содержанию в них примерно 1–2% азота (табл. 3).
Таблица 2.
Индивидуальные оксиды циркония, кремния и соосажденные композиты на их основе
| Образец | SiO2 : ZrO2 | рН | Условия термообработки |
Добавки | Sуд, м2/г | ΣС, мкмоль/г |
|---|---|---|---|---|---|---|
| 1 | 1 : 1 | 8.0 | t = 120°С, τ = 2 ч | – | 123 | – |
| 2 | 5 : 1 | 8.2 | t = 120°С, τ = 2 ч | – | 179 | – |
| 3а 3б 3в |
2.5 : 1 | 6.0 | t = 120°С, τ = 2 ч | – | 180 | – |
| 8.0 | – | 206 | – | |||
| +ПЭГ | 288 | 68 | ||||
| 4 | 9 : 1 | 6.0 | t = 120°С, τ = 2 ч | Осадитель (NH4)2CO3 + NH4OH |
138 | 71 |
| 5а 5б |
1.4 : 1 | 8.0 | t = 120°С, τ = 2 ч | ТЭОС, спирт | 130 | 73 |
| 3 : 1 | 8.0 | 140 | 83 | |||
| 6 | 1 : 1 | 8.0 | t = 120°С, τ = 2 ч | – | 97 | – |
| ГТО (t = 150°С, τ = 3 ч) | 197 | 138 | ||||
| 7 | 1 : 1 | 10.3 | ГТО (t = 150°С, τ = 3 ч) | – | 267 | 68 |
| t = 120°С, τ = 2 ч | 98 | – | ||||
| 8 | 4 : 1 | 8.0 | ГТО (t = 150°С, τ = 3 ч) | – | 196 | – |
| 9 | 0 : 1 | 6.1 | t = 120°С, τ = 3 ч | – | 90 | 85 |
| 10 | 1 : 1 | 8.1 | t = 120°С, τ = 3 ч | – | 79 | 96 |
| Естественные условия | – | 96 | ||||
| 11 | 2 : 1 | 8.1 | t = 120°С, τ = 3 ч | – | 137 | 100 |
| Естественные условия | – | 93 | ||||
| 12 | 4 : 1 | 8.1 | t = 120°С, τ = 3 ч | – | 115 | 101 |
| Естественные условия | – | 99 | ||||
| 13 | 1 : 0 | 2.0 | t = 120°С, τ = 3 ч | – | 141 | 65 |
Рис. 1.
ИК-спектры образцов: SiO2 : ZrO2 = 1 : 1, ГТО 3 ч (1); золь SiO2 : золь ZrO2 = 2 : 1 (2), ядро SiO2 /оболочка ZrO2 = 2 : 1 (3), ZrO2, ГТО 3 ч (4).
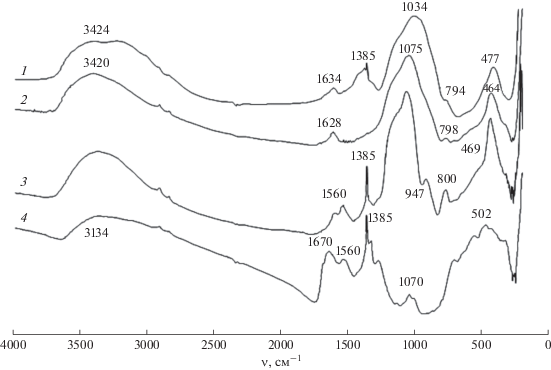
Таблица 3.
Состав композитов SiO2–ZrO2 (номера образцов соответсвуют табл. 2)
| Образец | Данные элементного анализа, % | Содержание, % | ||||
|---|---|---|---|---|---|---|
| C | H | N | (Si + Zr) | СО2 | Н2О | |
| 1 | 0.56 | 3.38 | 1.53 | 41.51 | 2.05 | 30.42 |
| 2 | 0.25 | 3.60 | 1.63 | 42.82 | 0.91 | 31.32 |
| 3а | 0.44 | 3.19 | 1.57 | 45.11 | 1.61 | 28.70 |
| 3б | 0.24 | 3.14 | 1.28 | 45.05 | 0.88 | 28.26 |
| 4 | 0.70 | 2.90 | 1.00 | 45.01 | 3.08 | 26.10 |
| 5а | 0.66 | 3.15 | 1.60 | 44.19 | 2.42 | 28.35 |
| 5б | 0.67 | 2.93 | 1.88 | 44.57 | 2.46 | 26.37 |
В серии образцов 9–13 из табл. 2, где варьировали соотношение оксидов кремния и циркония от индивидуальных оксидов до соотношения SiO2 : : ZrO2 = 4 : 1, установлена более слабая зависимость дисперсности от количества кремнийсодержащего компонента, вероятнее всего, из-за природы используемого осадителя. При получении образцов 1–4 величину рН повышали раствором карбоната аммония, образцы 9–13 получали с использованием раствора карбоната калия. Как видно из табл. 2 (образцы 6–13), наблюдается увеличение концентрации кислотно-основных центров поверхности в исследованном интервале рК в смешанных оксидах SiO2–ZrO2 по сравнению с индивидуальными. Это, возможно, связано с рядом явлений в смешанных оксидах: взаимное замещение катионов кремния и циркония, влияние электростатических потенциалов на замещаемом катионе, изменения в матрицах, необходимые для баланса стехиометрии.
Серия образцов, представленная в табл. 4, показала возможность получения композита наиболее высокой дисперсности при использовании в качестве исходных компонентов золей оксидов кремния и циркония. Наибольшие концентрации кислотно-основных центров в данной серии характерны для индивидуального диоксида циркония (образец 1, табл. 4) и образца 5, в котором ядро диоксида кремния покрыто оболочкой из диоксида циркония. Близость концентраций кислотно-основных центров образцов, высушенных в естественных условиях и при 120°С, свидетельствует о том, что выбранные условия удаления физически адсорбированной воды обеспечивают сохранение предельно гидратированного состояния образцов. Согласно данным рентгенофазового анализа, все синтезированные образцы были рентгеноаморфными.
Таблица 4.
Свойства диоксида циркония и композитов SiO2–ZrO2, приготовленных с использованием золя диоксида циркония
| № | SiO2 : ZrO2 | Условия обработки | Sуд, м2/г | рН | ΣС, мкмоль/г |
|---|---|---|---|---|---|
| 1 | 0 : 1 | Естественные условия | 170* | 0.7 | 141 |
| 2 | 0 : 1 | t = 120°С | 92 | 8.1 | – |
| 3 | 2 : 1 (золь-золь) | 248 | 8.1 | 90 | |
| 4 | 2 : 1 (ядро/оболочка) | 127 | 5.1 | – | |
| Естественные условия | – | 98 | |||
| 5 | 2 : 1 (ядро/оболочка) | t = 120°С | 116 | 6.1 | 154 |
| Естественные условия | – | 162 |
В ИК-спектрах образцов (рис. 1) присутствуют полосы поглощения в областях 3134–3420 и 1628–1670 см–1, принадлежащие деформационным колебаниям молекул адсорбированной и координационно связанной воды. Однако по сравнению с диоксидом кремния диоксид циркония сильнее удерживает воду из-за наличия сильной кислотности Льюиса, обусловленной наличием координационно ненасыщенных поверхностных атомов циркония. В спектрах композитов присутствует полоса (или несколько полос) поглощения в области 1380 см–1, обусловленная наличием на поверхности образцов сорбированного углекислого газа и нитрат-аниона. Широкая полоса поглощения в области 1070 см–1 смещается по мере увеличения в композите диоксида циркония в низкочастотную область по сравнению со спектром индивидуального оксида кремния.
Некоторые из синтезированных композитов были исследованы в качестве гетерогенного катализатора-промотора к известному хиральному индуктору – трифторацетату (2S,4R)-4-гидроксипролил-(S)-1-фенилэтиламина в асимметрической реакции Биджинелли (табл. 5). В присутствии всех исследованных соосажденных композитов SiO2–ZrO2 наблюдается повышение эффективности действия хирального индуктора – значения ee (энантиомерного избытка) повышаются с 39 до 56–68%, при этом степень увеличения энантиоселективности реакции наиболее существенно зависит от соотношения Si : Zr. Исследованные композиты различаются величиной удельной поверхности, которая изменяется от 130 до 288 м2/г, мало отличаются по суммарному содержанию активных центров – 68–83 мкмоль/г. Следует отметить, что для композита, наиболее активно проявившего функции гетерогенного промотора в реакции Биджинелли, характерно самое высокое содержание углекислого газа (по данным элементного анализа, табл. 3), что иногда связывают с существованием брендстедовских основных центров, образованных атомами кислорода адсорбированного углекислого газа. Величина удельной поверхности практически не влияет на значения ее, что можно объяснить тем, что в отличие от исходных реагентов хиральный индуктор непосредственно с поверхностью оксида не взаимодействует. В пользу этого предположения свидетельствует отсутствие заметных изменений в ИК-спектре хирального индуктора, сорбированного на поверхности оксидов SiO2–ZrO2. Значительное увеличение выхода продукта реакции Биджинелли (с 29 до 55%) было отмечено c ростом соотношения Si : Zr в оксидах SiO2–ZrO2. Наиболее высокий выход продукта получен в присутствии оксида SiO2–ZrO2, с соотношением Si : Zr = 9 : 1, полученного из золя SiO2 (образец 4, табл. 2), который обеспечивает и лучшую энантиоселективность реакции (еe 68%).
Таблица 5.
Результаты асимметрической реакции Биджинелли в присутствии хирального индуктора и гетерогенного промотора SiO2–ZrO2
| Образец | Характеристики гетерогенного промотора | еe (R), % | Выход, % | ||
|---|---|---|---|---|---|
| SiO2 : ZrO2 | Sуд, м2/г | ΣС, мкмоль/г | |||
| 4 | 9 : 1 | 138 | 71 | 68 | 55 |
| 5б | 3 : 1 | 140 | 83 | 58 | 27 |
| 3в | 2.5 : 1 | 288 | 68 | 60 | 16 |
| 5а | 1.4 : 1 | 130 | 73 | 56 | 12 |
| – | Без катализатора | 39 | 29 | ||
Примечание. Номера образцов соответствуют табл. 2; хиральный индуктор: 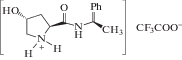 .
.
Таким образом, применение наноразмерных оксидов SiO2–ZrO2 в качестве гетерогенных промоторов хирального индуктора в асимметрической реакции Биджинелли оказалось оправданным и позволило увеличить значение ее с 39 до 68%, а выход с 29 до 55%.
ЗАКЛЮЧЕНИЕ
Синтезированы композиты SiO2–ZrO2 с соотношением SiO2 : ZrO2 = (1–9) : 1, обладающие развитой удельной поверхностью, возрастающей при увеличении доли кремнийсодержащего компонента. С использованием методики адсорбции индикаторов Гаммета оценена величина кислотно-основных центров в интервале рK = 1.3–9.6, изменяющаяся от 68 до160 мкмоль/г. С помощью элементного анализа и ИК-спектроскопии установлено наличие на поверхности образцов кроме воды нитрат-ионов и диоксида углерода. Показано, что наноразмерные композиты SiO2–ZrO2 обладают более высокой концентрацией активных центров по сравнению с индивидуальными оксидами.
Определен режим сушки композитов, обеспечивающий сохранение высокой концентрации активных центов поверхности и предельно гидратированного состояния образцов. В присутствии композитов SiO2–ZrO2 наблюдается повышение эффективности действия хирального индуктора (ее с 39 до 68%, выход с 29 до 55%), при этом соотношение Si : Zr является определяющим факторам.
Наноразмерные композиты SiO2–ZrO2 могут представлять интерес в качестве гетерогенных катализаторов других асимметрических реакций.
Список литературы
Хахалкин В.В. Формирование структуры и свойства горячепрессованной керамики ZrO2–MgO: дис. … канд. техн. наук по специальности 05.16.09 – материаловедение. Томск. 2011. 178 с.
Haw J.F., Zhang J., Shimizu K., Venkatraman T. N., Luigi D.P., Song W., Barich D.H., Nicholas J.B. NMR and Theoretical Study of Acidity Probes on Sulfated Zirconia Catalysts // J. Am. Chem. Soc. 2000. V. 122. P. 12561–12570.
Badwal S.P.S. Yttria Tetragonal Zirconia Polycrystalline Electrolytes for Solid State Electrochemical Cells // Appl. Phys. A. 1990. V. 50. P. 449–462.
Mansour N., Mansour K., Stryland E.W.V., Soileau M.J. Diffusion of Color Centers Generated by Two Photon Absoption at 532 nm in Cubic Zirconia // J. Appl. Phys. 1990. V. 67. P. 1465–1477.
Li J., Hastings G.W. Oxide Bioceramics: Inert Ceramic Materials in Medicine and Dentistry. L., N.Y.: Chapman & Hall, 1998. P. 340.
Ward A.J., Pujari A.A., Costanzo L., Masters A.F., Maschmeyer T. The One-Pot Synthesis, Characterisation and Catalytic Behavior of Mesoporous Silica-Sulfated Zirconia Solids // Catal. Today. 2011. V. 178. P. 187–196.
Chen X.-R., Ju Y.-H., Mou C.-Y. Direct Synthesis of Mesoporous Sulfated Silica-Zirconia Catalysts with High Catalytic Activity for Biodisel via Esterification // J. Phys. Chem. C. 2007. V. 111. P. 18731–18737.
Zhuang Q., Miller J.M. ZrO2/SiO2 Mixed Oxides as Catalysts for Alcohol Dehydration // Appl. Catal. A. 2001. V. 209. P. 1–6.
Gomez R., Lopez T., Tzompantzi F., Garciafigueroa E., Acosta D.W., Novaro O. Zirconia/Silica-Gel Catalysts: Effect of the Surface Heterogeneity on the Selectivity of 2-propanol Decomposition // Langmuir. 1997. V. 13. P. 970–973.
Krivtsov I.V., Titova Yu. A., Ilkaeva M.V., Avdin V.V., Fedorova O.V., Khainakov S.A., Garcia J.R., Rusinov G.L., Charushin V.N. Catalysts for Enantioselective Biginelli Reaction Based on the Composite Silica-Zirconia Xerogels, Prepared Using Different Zirconium Sources // J. Sol-Gel Sci. Technol. 2014. V. 69. P. 448–452
Titova Yu.A., Gruzdev D.A., Fedorova O.V., Alisienok O.A., Murashkevich A.N., Krasnov V.P., Rusinov G.L., Charushin V.N. New Chiral Proline-Based Catalysts for Silicon and Zirconium Oxides-Promoted Asymmetric Biginelli Reaction // ChHC. 2018. V. 54. № 4. P. 417–427.
Bosman H.J.M., Kruissink E.S., J. Van der Spoel, F. Van der Brink. Characterization of the Acid Strength of SiO2–ZrO2 Mixed Oxides // J. Catal. 1994. V. 148. P. 660–672.
Santos M.A.F., Lôbo I.P., Cruz R.S. Synthesis and Characterization of Novel ZrO2–SiO2 Mixed Oxides // Mater. Res. 2014. V. 17. № 3. P. 700–707.
Siddiquey I.A., Furusawa T., Sato M., Bahadur N.M., Uddin Md.N., Suzuki N. A Rapid Method for the Preparation of Silica-Coated ZrO2 Nanoparticles by Microwave Irradiation // J. Ceram. Int. 2011. № 37. P. 1755–1760.
Zhan Z., Zeng H.C. A Catalust-Free Approach for Sol-Gel Synthesis of Highly Mixed ZrO2–SiO2 Oxides // J. Non-Cryst. Solids. 1999. V. 243. P. 26–38.
Krivtsov I.V., Ilkaeva M.V., Avdin V.V., Zherebtsov D.A. Properties and Segregation Stability of the Composite Silica-Zirconia Xerogels Prepared via “Acidic” and “Basic” Precipitation Routes // J. of Non-Cryst. Solids. 2013. V. 362. P. 95–100.
Soled S., McVicker G.B. Acidity of Silica-Substituted Zirconia // Catal. Today. 1992. V. 14 . P. 189–194.
Слинкин А.А., Клячко А.Л., Шпиро Е.С., Капустин Г.И., Кучерова Т.Н., Стахеев А.Ю., Ермолов Л.В. Текстура, структура, поверхностные и каталитические свойства силикагеля, модифицированного методом химического смешения // Кинетика и катализ. 1991. Т. 32. Вып. 3. С. 725–732.
Клячко А.Л., Бруева Т.Р., Капустин Г.И., Кучеров А.В., Ермолов Л.В., Слинкин А.А. Текстура, структура, поверхностные и каталитические свойства силикагеля, модифицированного методами химического смешения // Кинетика и катализ. 1991. Т. 32. Вып. 3. С. 733–739.
Слинкин А.А., Харсон М.С., Дергачев А.А., Удальцова Е.А., Ермолов Л.В. Текстура, структура, поверхностные и каталитические свойства силикагеля, модифицированного методом химического смешения // Кинетика и катализ. 1991. Т. 32. Вып. 4. С. 934–939.
Кондратенко Н.Е., Барвинок Г.М., Сычев М.М., Шуров А.Ф., Малыгин Н.Д. Исследование материалов системы ZrO2–SiO2, полученных золь-гель-методом // Неорган. материалы. 1991. Т. 27. № 2. С. 300–305.
Дьяконов С.С., Лыгин В.И., Шалумов Б.С., Шепалин К.Л., Кузнецов А.И., Костина В.М., Расторгуев Ю.И. ИК-спектроскопическое исследование высокодисперсного силикагеля, легированного диоксидом циркония // Изв. АН СССР. Неорган. материалы. 1984. Т. 20. № 1. С. 97–101.
Miki Niwa, Naonobu Katada, Yuichi Murakami Generation of Acid Sites by SiO2 Deposition on Groups IVB Metal Oxides // J. Catal. 1992. V. 134. P. 340–348.
Murashkevich A.N., Alisienok O.A., Maksimovskikh A.I., Fedorova O.V. Synthesis and Thermoanalytical Study of SiO2–TiO2 Composites Modified with Macrocyclic Endoreceptors // Inorg. Mater. 2016. V. 52. № 3. P. 336–343.
Murashkevich A.N., Alisienok O.A., Zharskii I.M. Physicochemical and Photocatalytic Properties of Nanosized Titanium Dioxide Deposited on Silicon Dioxide Microspheres // Kinet. Catal. 2011. V. 52. № 6. P. 809–816.
Fedorova O.V., Titova Yu.A., Vigorov A.Yu., Toporova M.S., Alisienok O.A., Murashkevich A.N., Krasnov V.P., Rusinov G.L., Charushin V.N. Asymmetric Biginelli Reaction Catalyzed by Si, Ti and Al Oxides // Catal. Lett. 2016. V. 146. № 2. P. 493–498.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


