Неорганические материалы, 2020, T. 56, № 5, стр. 475-482
Электрохимические свойства угольных электродов, модифицированных наночастицами Fe4[Fe(CN)6]3, K2Со[Fe(CN)6] и их аналогов, содержащих в структуре натрий
В. В. Чернявина 1, *, А. Г. Бережная 1, О. О. Тененика 1
1 Южный федеральный университет
344006 Ростов-на-Дону, ул. Б. Садовая, 105/42, Россия
* E-mail: vchernyavina@yandex.ru
Поступила в редакцию 17.07.2019
После доработки 20.11.2019
Принята к публикации 26.11.2019
Аннотация
Синтезированы гексацианоферраты железа, кобальта и их аналоги (МHCF) как наноматериалы для изготовления композитных электродов состава С/MHCF. Исследованы структурные характеристики и элементный состав полученных соединений методами рентгенофазового анализа и энергодисперсионного микроанализа с использованием комплексного аналитического прибора на сканирующем электронном микроскопе VEGA II LMU и системы микроанализа INCA ENERGY450/XT с детектором X-Act DDD. Установлено, что композитные электроды, содержащие до 20% МHCF, имеют лучшие электрохимические характеристики по сравнению с угольным электродом. Внедрение натрия в структуру гексацианоферратов железа и кобальта приводит к наименьшему снижению удельной емкости композитных электродов при высоких скоростях заряда–разряда и уменьшает сопротивление переноса заряда.
ВВЕДЕНИЕ
В настоящее время материалы на основе наночастиц гексацианоферратов переходных металлов (MHCF) привлекают особое внимание. Актуальность изучения наночастиц MHCF заключается в особенностях их строения, а именно, цеолитной структуры, благодаря которой наночастицы не подвергаются растворению при окислении или восстановлении. Кроме того, при протекании окислительно-восстановительных реакций катионы, размер которых меньше размера пор цеолитной структуры HCFM, могут свободно диффундировать в пустоты кристаллической решетки и выходить из нее [1–3]. Совокупность таких свойств позволяет рассматривать эти соединения как материалы для изготовления композитных электродов электрохимических конденсаторов (ЭХК) [4].
ЭХК привлекают внимание исследователей благодаря их высоким мощностным характеристикам и стабильности при циклировании. Также необходимо отметить их экологичность, компактность, простоту обслуживания, низкую стоимость и способность работать в очень широком интервале температур (от –50 до +60°С) [5–7].
Аккумулирование и хранение заряда в электрохимических конденсаторах происходит в двойном электрическом слое, возникающем на границе раздела фаз электрод/электролит, поэтому электродные материалы должны удовлетворять ряду критериев, среди которых высокая электронная проводимость, развитая удельная поверхность, доступность пористой структуры для ионов и молекул электролита, низкая плотность, легкость в формовании и т.д. Большинству перечисленных требований удовлетворяют углеродные материалы, которые находятся в центре внимания на протяжении последних лет [8–10]. Однако ЭХК с углеродными электродами имеют низкую плотность энергии по сравнению с батареями и топливными элементами [11]. В связи с этим все исследования направлены на решение этой проблемы путем либо увеличения удельной емкости материалов электродов, либо расширения окна рабочего напряжения [9, 12].
Перспективным направлением повышения удельной энергии ЭХК является модификация положительного электрода, что приводит к увеличению его емкости и создает возможность более полного заряда отрицательного электрода. В результате увеличиваются общая емкость и рабочее напряжение системы, что приводит к увеличению запасаемой электрохимическим конденсатором энергии [13, 14].
Целью данной работы являлось исследование электрохимических свойств композитных электродов, модифицированных наночастицами Fe4[Fe(CN)6]3, K2Со[Fe(CN)6] и их аналогов, содержащих в структуре натрий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез MHCF проводили методом соосаждения при комнатной температуре. Для получения FeHCF равные объемы растворов солей железа с концентрациями 0.1 М FeCl3 и 0.05 М K4[Fe(CN)6] одновременно прикапывали к 40 мл бидистиллированной воды при постоянном перемешивании. После добавления растворов суспензию непрерывно перемешивали в течение 2 ч при комнатной температуре. Образовавшийся осадок отфильтровывали, промывали бидистиллированной водой и сушили в вакууме при комнатной температуре.
В результате получили ярко-синий осадок берлинской лазури состава Fe4[Fe(CN)6]3 (FeHCF). Cинтез КСоHCF проводили аналогичным способом: прикапывали к 40 мл дистиллированной воды растворы 0.1 М CoSO4 и 0.05 М К4[Fe(CN)6], получили малорастворимую комплексную соль зеленого (травяного) цвета K2Со[Fe(CN)6] (КСоHCF). Для внедрения катионов натрия в структуру FeHCF и КСоHCF в процессе синтеза использовали 40 мл раствора 0.1 М Na2SO4, получили соединения, которые обозначили как NaFeHCF и NaКСоHCF.
Рабочие электроды изготавливали путем смешивания соли, активированного угля, поливинилиденфторида (PVDF) в N-метилпирролидоне до образования суспензии, которую наносили на никелевую фольгу и сушили при 60°С до постоянного веса. Удельная масса активного материала на электроде составляла 7–8 мг/см2.
Дифрактограммы полученных соединений MHCF регистрировали в интервале углов 2θ = = 5°–60° на дифрактометре ДРОН-7 (Россия, 2008) с использованием отфильтрованного CuKα-излучения (λ = 0.154056 нм) при комнатной температуре. Расчет размера частиц D проводили для характерного отражения 111 по формуле Шеррера [15]
где D – размер частицы (Å), K = 0.9 – константа Шеррера, λ = 1.5406 – длина волны (Å), FWHM – ширина пика на полувысоте (град), θ – угол дифракции (град).Исследование микроструктуры и элементного состава образцов выполнено на растровом электронном микроскопе VEGA II LMU (фирмы Tescan) с системой энергодисперсионного микроанализа INCA ENERGY 450/XT (детектор Silicon Drift).
Электрохимические измерения проводили на потенциостате-гальваностате Р-30J (ООО “Элинс”, Россия) в стандартной трехэлектродной ячейке в 1 М водном растворе сульфата натрия. В качестве электрода сравнения использовали насыщенный хлорсеребряный электрод, противоэлектродом служил стеклоуглерод.
По результатам циклической вольтамперометрии рассчитали удельную емкость по формуле
Расчет удельной емкости по гальваностатическому методу заряда–разряда проводили по формуле
где I, ΔЕ, Δτ – ток, интервал напряжений и время заряда или разряда соответственно.Импедансные измерения проводили на импедансметре Z–Pack–2 (Electrochemical Instruments, Россия) в двухэлектродной ячейке с одинаковыми электродами при потенциале 0 В в интервале частот от 10 мГц до 500 кГц.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
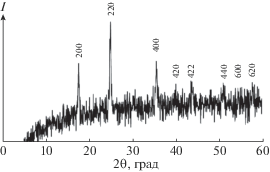
На рис. 1 представлена дифрактограмма вещества КCoHCF, где наблюдается соответствие наиболее выраженных пиков интенсивности его аналогам, полученным ранее [16].
Дифрактограммы, полученные для других синтезированных соединений, имеют подобный вид, что подтверждает их гранецентрированную кубическую структуру. Размер наночастиц исследованных соединений, рассчитанный по уравнению (1), существенно отличается. В случае FeHCF и NaFeHCF он составляет 7 и 11 нм соответственно, для соединений КCoHCF и NaКСоHCF имеет одинаковое значение 37 нм.
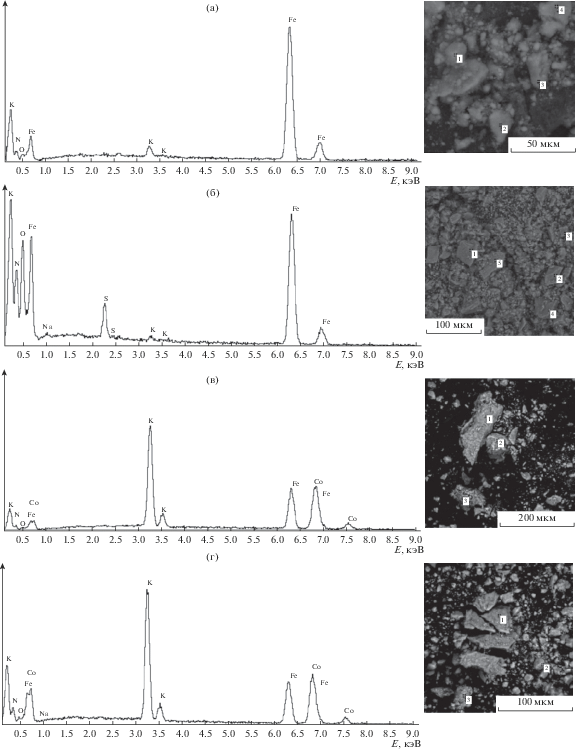
Для уточнения поверхностного химического состава и однородности распределения соответствующих элементов проводили СЭМ–EDX-исследование в разных точках поверхности (рис. 2). Спектры EDX показывают присутствие элементов N, O, K, Na, Fe, Co и подтверждают внедрение натрия в структуру гексацианоферратов железа и кобальта (рис. 2б, 2г).
Рис. 2.
СЭМ-снимки и спектры EDX для полученных соединений FeHCF (а), NaFeHCF (б), КCoHCF (в), NaКСоHCF (г).
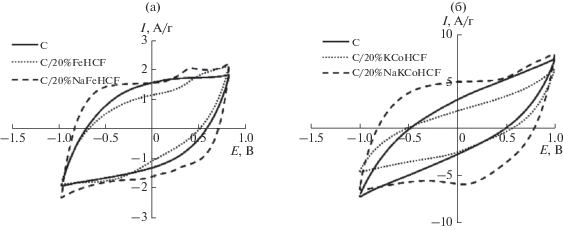
На рис. 3 представлены циклические вольтамперограммы, полученные при v = 2 мВ/с. Для угольного электрода наблюдается прямоугольная форма кривой, в случае композитных электродов появляются обратимые пики, связанные с протеканием окислительно-восстановительной реакции FeIII/FeII, а также интеркаляции/деинтеркаляции ионов Na+ в материал электрода по следующим механизмам [17, 18]:
Рис. 3.
Циклические вольтамперные кривые, снятые при v = 2 мВ/с на угольном электроде и композитных электродах С/20%FeHCF, С/20%NaFeHCF (а) и С/20%KCoHCF, С/20%NaKCoHCF (б).
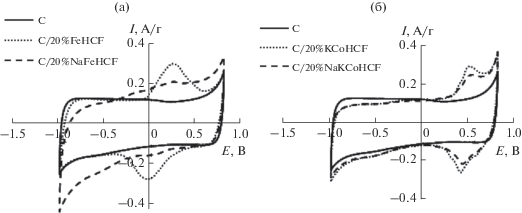
Разница потенциалов катодного и анодного пиков для композита С/20% FeHCF составляет 0.28 В, в то время как для С/20%KCoHCF и С/20%NaKCoHCF она имеет меньшее значение – 0.09 В, что указывает на лучшую обратимость окислительно-восстановительного процесса. Очевидно, это связано с большим размером наночастиц KCoHCF и NaKСоHCF. В результате образуются открытые каркасы с большими диффузионными каналами, что способствует быстрой интекаляции–деинтеркаляции ионов Na+ [19]. В случае материалов FeHCF и NaFeHCF размер наночастиц меньше, поэтому возникают диффузионные ограничения, обратимость процесса ухудшается.
Удельная емкость для угольного электрода при v = 2 мВ/с составляет 65 Ф/г (рис. 4). В случае композитов С/20%FeHCF и С/20%КCoHCF Суд увеличивается до 111 Ф/г. Для материалов С/20%NaFeHCF и С/20%NaKCoHCF, содержащих в структуре катионы натрия, удельная емкость составляет 108 и 96 Ф/г соответственно. С увеличением v до 25 мВ/с наблюдается уменьшение Суд, нарушается прямоугольная форма циклической кривой для угольного электрода и композита С/20%FeHCF (рис. 5а).
Рис. 4.
Зависимость удельной емкости угольного электрода и композитных электродов от скорости развертки потенциала v = 2–100 мВ/с.
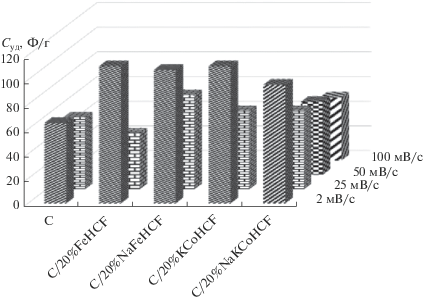
Рис. 5.
Циклические вольтамперные кривые, снятые на угольном электроде и композитных электродах С/20%FeHCF, С/20%NaFeHCF при v = 25 мВ/с (а) и С/20%KCoHCF, С/20%NaKCoHCF при v = 100 мВ/с (б).
Введение катионов натрия в структуру FeHCF способствует меньшему падению Суд, для С/20%NaFeHCF при v = 25 мВ/с сохраняется прямоугольная форма. Удельная емкость для С/20%FeHCF и С/20%NaFeHCF составляет 45 и 76 Ф/г соответственно (рис. 4 и 5а). Для электрода С/20%NaKCoHCF наблюдается сохранение прямоугольной формы циклической кривой при увеличении скорости развертки до 100 мВ/с (рис. 5б). С ростом скорости развертки потенциала до 25 мВ/с происходит наибольшее падение Суд, при дальнейшем увеличении v до 100 мВ/с значение Суд практически не меняется и составляет 51–59 Ф/г (рис. 4).
Гальваностатические заряд–разрядные кривые при удельном токе Iуд = 0.1 А/г для всех электродов имеют симметричный вид и разную форму (рис. 6а, 6б).
Рис. 6.
Гальваностатические заряд-разрядные кривые для угольного и композитных электродов, полученные при Iуд = 0.1 (а, б) и 0.5 А/г (в, г) в 1 М растворе Na2SO4.
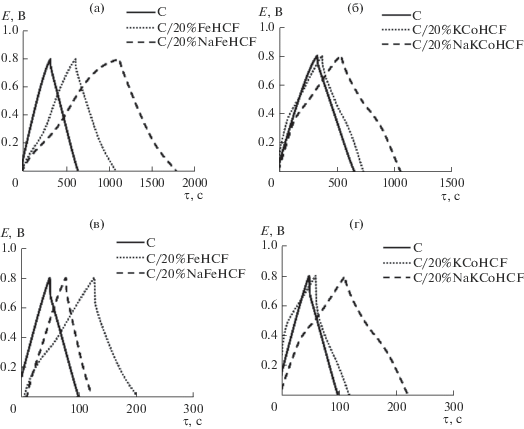
Для угольного электрода наблюдается заряжение только двойного электрического слоя, вид кривых композитных электродов зависит от природы материала и указывает на протекание псевдоемкостных процессов.
Потенциальное плато, наблюдаемое на заряд-разрядных кривых для композитов, связано с протеканием окислительно-восстановительной реакции FeIII/FeII, а также с интеркаляцией/деинтеркаляцией катионов натрия в структуру материалов (рис. 6а, 6б). Симметричный вид кривых указывает на хорошую обратимость окислительно-восстановительного процесса [20].
Анализ данных, представленных в табл. 1 показывает, что наибольшая удельная емкость при Iуд = 0.1 А/г наблюдается для композитных электродов С/NaFeHCF и С/NaКCoHCF и составляет Суд = 77–78 Ф/г. Падение напряжения ΔЕ для этих материалов имеет наименьшее значение. С увеличением удельного тока заряда–разряда до Iуд = 0.5 А/г происходит уменьшение Суд и рост ΔЕ для всех материалов.
Таблица 1.
Зависимость удельной разрядной емкости Суд и падения напряжения ΔE от удельного тока заряда–разряда для угольного и композитных электродов
| Электрод | Суд, Ф/г | ΔЕ, мВ | Суд, Ф/г | ΔЕ, мВ |
|---|---|---|---|---|
| 0.1* | 0.5* | |||
| С | 56 | 44 | 38 | 120 |
| С/20%FeHCF | 67 | 41 | 45 | 167 |
| С/20%NaFeHCF | 77 | 17 | 53 | 104 |
| С/20%КCoHCF | 75 | 28 | 44 | 177 |
| С/20%NaКCoHCF | 78 | 10 | 69 | 38 |
Следует отметить, что для композитов С/20%NaFeHCF и С/20%NaКCoHCF происходит улучшение электрохимических свойств за счет введения катионов натрия в структуру, что проявляется в уменьшении падения напряжения и наименьшем снижении Суд с ростом тока заряда–разряда (табл. 1). Гальваностатические кривые заряда–разряда при Iуд = 0.5 А/г для материалов С/20%NaFeHCF и С/20%NaКCoHCF имеют симметричный вид (рис. 6в, 6г). В случае С/20%FeHCF и С/20%КCoHCF при высоких токах Iуд ≥ 0.5А/г наблюдаются несимметричные кривые заряда–разряда. Наилучшие электрохимические характеристики получены для С/20%NaКCoHCF, что подтверждает результаты циклической вольтамперометрии.
На рис. 7 показаны графики Найквиста, полученные для угольного и композитных электродов С/20%FeHCF, С/20%NaFeHCF, С/20%КCoHCF, С/20%NaКCoHCF, в которых полукруг и скачок появляются в области высоких и низких частот соответственно. Точка пересечения действительной оси отвечает общему или эквивалентному последовательному сопротивлению R1, которое складывается из суммы всех сопротивлений: контактного сопротивления между частицами в углеродном материале (наличие связующего), сопротивления между коллектором тока (никелевой подложкой) и углеродным покрытием, в качестве основного сопротивления выступает диффузионное сопротивление на границе электрод/электролит.
Рис. 7.
Диаграммы Найквиста, полученные при 14 мГц–500 кГц для угольного и композитных электродов при Е = 0 В.
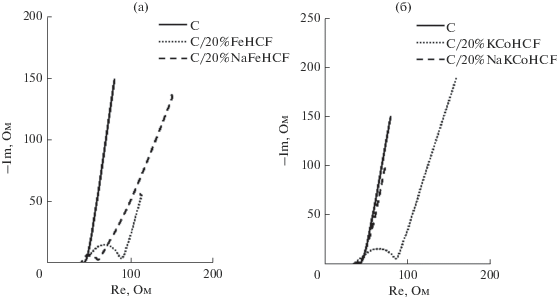
В области низких частот наблюдается скачок сопротивления, отвечающий наклонной линии диффузионного импеданса Варбурга.
Сопротивление R2 определяется как вторая точка пересечения полукруга на действительной оси и в основном рассматривается как сопротивление переноса заряда на границе раздела электрод/электролит.
Анализ результатов импедансных измерений показывает, что сопротивление R1, основной вклад в которое вносит сопротивление электролита, изменяется в пределах 35.2–43.3 Ом. Наибольшее значение наблюдается для материала С/20%FeHCF, что, возможно, связано с увеличением вклада других составляющих R1, а именно: внутреннего сопротивления материала электрода и контактного сопротивления на границе раздела активный материал/токоприемник.
Сопротивление переноса заряда R2 имеет наибольшее значение для композитов С/20%FeHCF, С/20%КCoHCF и составляет 43.3 и 44.5 Ом соответственно. Введение натрия в структуру материалов приводит к уменьшению сопротивления переноса заряда. Для электрода С/20%NaFeHCF R2 уменьшается до 20.4 Ом, а в случае С/20%NaКCoHCF R2 = 6.2 Ом и приближается к значению, полученному для угольного электрода – 3.4 Ом. Уменьшение R2 свидетельствует о быстром переносе заряда на границе раздела между материалом электрода C/20%NaKCоHCF и электролитом и протекании окислительно-восстановительного процесса с наибольшей скоростью. Переносы электрона и катиона натрия взаимосвязаны [21].
ЗАКЛЮЧЕНИЕ
Установлено улучшение электрохимических свойств композитных электродов по сравнению с угольным электродом за счет протекания фарадеевских реакций. Для композитных электродов С/20%КCoHCF и С/20%NaКCoHCF разность потенциалов анодного и катодного пиков составляет 0.09 В, что указывает на лучшую обратимость окислительно-восстановительного процесса по сравнению с материалами С/20%FeHCF и С/20%NaFeHCF. С помощью элементного анализа поверхности доказано внедрение натрия в структуру материалов. Введение катиона натрия в С/20%FeHCF и С/20%КCoHCF увеличивает удельную емкость композитных электродов при высоких скоростях развертки и снижает сопротивление переноса заряда.
Таким образом, композитные электроды можно рассматривать как перспективный материал для положительных электродов в электрохимических конденсаторах.
Список литературы
Jia Z., Wangab J., Wang Y. Electrochemical Sodium Storage of Copper Hexacyanoferrate with a Well-Defined Open Framework for Sodium Ion Batteries // RSC Adv. 2014. № 4. P. 22768–22774. https://doi.org/10.1039/c4ra02559h
Giorgetti M., Berrettoni M., Filipponi A., Kulesza P., Marassi R. Evidence of Four-Body Contributions in the EXAFS spectrum of Na2Co[Fe(CN)6] // Chem. Phys. Lett. 1997. V. 275. № 1–2. P. 108–112. https://doi.org/10.1016/S0009-2614(97)00724-0
Wessels C., Huggins R., Cui Y. Copper Hexacyanoferrate Battery Electrodes with Long Cycle Life and High Power // J. Nat. Commun. 2011. V. 2. № 550. https://doi.org/10.1038/ncomms1563
He Y., Zhang P., Wang M., Wang F., Tan D., Li Y., Zhuang X., Zhang F., Feng X. Nano-Sandwiched Metal Hexacyanoferrate/Graphene Hybrid Thin Films for In-Plane Asymmetric Micro-Supercapacitors with Ultrahigh Energy Density // Mater. Horiz. 2019. № 6. P. 1041–1049. https://doi.org/10.1039/C9MH00063A
Padolfo A., Hollenkamp A. Carbon Properties and Their Role in Supercapacitors // J. Power Sources. 2006. V. 157. № 1. P. 11–27. https://doi.org/10.1016/j.jpowsour.2006.02.065
Bonnefoia L., Simona P., Fauvarquea J.F., Sarrazinb C., Sarraub J.F., Dugasta A. Electrode Compositions for Carbon Power Supercapacitors // J. Power Sources. 1999. V. 80. № 1–2. P. 149–155. https://doi.org/10.1016/S0378-7753(99)00069-5
Рычагов А.Ю., Вольфкович Ю.М., Воротынцев М.А., Квачева Л.Д., Конев Д.В., Крестинин А.В., Кряжев Ю.Г., Кузнецов В.Л., Кукушкина Ю.А., Мухин В.М., Соколов В.В., Червонобродов С.П. Перспективные электродные материалы для суперконденсаторов // Электрохимическая энергетика. 2012. Т. 12. № 4. С. 167–180.
Frackowiak E., Béguin F. Carbon Materials for the Electrochemical Storage of Energy in Capacitors // Carbon. 2001. V. 39. P. 937–950. https://doi.org/10.1016/S0008-6223(00)00183-4
Вольфкович Ю.М., Михалин А.А., Бограчев Д.А., Сосенкин В.Е. Углеродные электроды с большой псевдоемкостью для суперконденсаторов // Электрохимия. 2012. Т. 48. № 4. С. 467–477.
Грызлов Д.Ю., Рычагов А.Ю., Скундин А.М., Кулова Т.Л. Исследование активированного угля серии Р2 компании ENER G2 в качестве материала для суперконденсаторов с неводным электролитом // Электрохимическая энергетика. 2015. Т. 15. № 4. С. 160–166. https://doi.org/10.18500/1608-4039-2015-15-4-160-166
Lee W.J., Hwang T.H., Hwang J.O., Kim H.W., Lim J., Jeong H.Y., Shim J., Han T.H., Kim J.Y., Choi J.W., Kim S.O. N-Doped Graphitic Self-Encapsulation for High Performance Silicon Anodes in Lithium-Ion Batteries // Energy Environ. Sci. 2014. V. 7. № 2. P. 621–626. https://doi.org/10.1039/c3ee43322f
Jayalakshmi M., Balasubramanian K. Simple Capacitors to Supercapacitors – An Overview // Int. J. Electrochem. Sci. 2008. № 3. P. 1196–1217.
Conway B.E. Electrochemical Capacitors: Scientific Fundamentals and Technological Applications. L.: Kluwer, 1999. 698 p.
Burke A. Ultracapacitors: Why, How, and Where is the Technology // J. Power Sources. 2000. V. 91. № 1. P. 37–50. https://doi.org/10.1016/S0378-7753(00)00485-7
Pabst W., Gregorová E. Characterization of Particles and Particle Systems. Prague: ICT, 2007. 122 p.
You Y., Wu X.L., Yin Y.X., Guo Y.G. High-Quality Prussian Blue Crystals as Superior Cathode Materials for Room-Temperature Sodium-Ion Batteries // J. Energy Environ. Sci. 2014. V. 7. № 5. P. 1643–1647. https://doi.org/10.1039/C3EE44004D
Sun H., Sun H., Wang W., Jiao H., Jiao S. Fe4[Fe(CN)6]3: A Cathode Material for Sodium-Ion Batteries // RSC Adv. 2014. V. 4. № 81. P. 42991–42995. https://doi.org/10.1039/C4RA07531E
Omarova M., Koishybay A., Yesibolati N., Mentbayeva A., Umirov N., Ismailov K., Adair D., Babaa M.-R., Kurmanbayeva I., Bakenov Z. Nickel Hexacyanoferrate Nanoparticles as a Low Cost Cathode Material for Lithium-Ion Batteries // Electrochim. Acta. 2015. V. 184. P. 58–63. https://doi.org/10.1016/j.electacta.2015.10.031
Pasta M., Colin W., Liu N., Nelson J., McDowell M., Huggins R., Toney M., Cui Y. Full Open-Framework Batteries for Stationary Energy Storage // Nat. Commun. 2014. V. 5. 3007. https://doi.org/10.1038/ncomms4007
Lu K., Song B., Gao X., Dai H., Zhang J., Ma H. High-Energy Cobalt Hexacyanoferrate and Carbon Micro-Spheres Aqueous Sodium-Ion Capacitors // J. Power Sources. 2016. V. 303. P. 347–353. https://doi.org/10.1016/j.jpowsour.2015.11.031
Lu K., Li D., Gao X., Dai H., Wang N., Ma H. An Advanced Aqueous Sodium-Ion Supercapacitor with a Manganous Hexacyanoferrate Cathode and a Fe3O4/rGO Anode // J. Mater. Chem. A. 2015. V. 3. № 31. P. 16013–16019. https://doi.org/10.1039/C5TA04244E
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы