Неорганические материалы, 2020, T. 56, № 5, стр. 571-580
Структурно-морфологические характеристики и растворение карбонатгидроксиапатита, полученного в присутствии пролина
О. А. Голованова 1, *, С. А. Герк 1
1 Омский государственный университет им. Ф.М. Достоевского
644077 Омск, пр. Мира, 55-А, Россия
* E-mail: golovanoa2000@mail.ru
Поступила в редакцию 11.07.2019
После доработки 15.10.2019
Принята к публикации 20.10.2019
Аннотация
Проведен синтез карбонатсодержащего гидроксиапатита из прототипа синовиальной жидкости человека в присутствии пролина. Показано, что полученные порошки содержат от 61 до 71 мас. % аминокислоты. Выявлено, что наличие пролина в модельном растворе не влияет на состав твердой фазы и размеры формирующихся кристаллитов, но изменяет кристалличность и удельную поверхность образцов. При высоких концентрациях аминокислоты отмечается формирование плохоокристаллизованных композитов, состоящих из меньших по размеру нанокристаллитов. Установлено, что растворение образцов в 0.9%-ном NaCl и ацетатном буфере является двухстадийным процессом. Наиболее растворимыми в слабокислых растворах являются осадки, содержащие аминокислоту.
ВВЕДЕНИЕ
В настоящее время большое внимание уделяется разработке материалов, предназначенных для использования при реконструкции костных дефектов, образующихся в результате изменений (остеопороз, коксит, деформирующий артроз и т.д.), травм, хирургических вмешательств [1–4]. Наиболее перспективны в данном случае материалы на основе фосфатов кальция, так как они характеризуются высокой биосовместимостью по отношению к костной ткани человека [5–8]. Это свойство используют при создании костных имплантатов, которые могут быть либо полностью изготовлены из фосфатов кальция, либо иметь поверхность, покрытую данными соединениями [9–12].
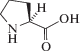
Важным принципом при создании материалов для имплантации является воспроизведение характеристик натуральной костной ткани [1, 2]. Известно, что гидроксиапатит (ГА) является основным неорганическим компонентом костной ткани и несет основную механическую нагрузку, а коллаген придает эластичность и гибкость [13–15]. Последний представляет собой полипептидную цепь, состоящую из повторяющихся триплетов аминокислот. Главными аминокислотами, входящими в состав коллагена, являются глицин, пролин (рис. 1), гидроксипролин и гидроксилизин [12, 15]. Обладая конформационно жесткой структурой, пролин сильно изгибает пептидную цепь. Участки белков с высоким содержанием пролина часто формируют вторичную структуру полипролиновой спирали II типа.
Чередующиеся остатки молекулы пролина и гидроксипролина способствуют созданию стабильной трехспиральной структуры коллагена, придающей молекуле прочность. Кроме того, пролин предупреждает старение, сохраняя прочность костей, гибкость суставов, эластичность связок, поддерживает упругость сосудистой стенки, придает гладкость коже.
С другой стороны, пролин обладает наибольшей цитопротекторной активностью в условиях повышенных концентраций неорганических ионов в среде (солевой стресс) и пониженных температур (температурный стресс) [16]. В условиях стресса пролин проявляет также осмопротекторное действие, регулируя водный баланс клетки. Однако имеющиеся на сегодняшний день данные о взаимодействии пролина с фосфатами кальция немногочисленны и противоречивы [16–19]. С практической точки зрения, подобные сведения требуются для совершенствования существующих материалов с использованием пролина, востребованных в фармакологии, медицине, косметологии, а также для создания новых композитов на основе пролина и фосфатов кальция [13], что и определяет актуальность настоящего исследования.
Целью работы является установление влияния пролина на морфологию, кристалличность и резорбционные свойства карбонатгидроксиапатита (КГА), синтезированного из модельных растворов суставной синовиальной жидкости (синовии) человека.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез КГА осуществлен из модельной среды, приближенной по ионно-электролитному составу, pH и ионной силе к синовиальной жидкости человека, по методике [14]. Эксперименты проведены из раствора при 50-кратном пересыщении по осадкообразующим ионам Са2+ и ${\text{НРО}}_{{\text{4}}}^{{{\text{3}}--}}$ относительно физиологического значения данного параметра для синовии (табл. 1). Для приготовления модельных растворов использовали соли (CaCl2 · 2H2O, Na2HPO4 · 12H2O, MgCl2 · 6H2O, NaHCO3, KCl, Na2SO4, NaCl) квалификации “ч. д. а.” Содержание пролина (pro, NH(CH2)3СНCOOН, пирролидин-α-карбоновая кислота) (рис. 1) в модельном растворе варьировали от 0.013 до 0.052 моль/л с шагом 0.013 моль/л, при этом приняты обозначения: 0 (образец 1), 0.013 (2), 0.026 (3), 0.039 (4) и 0.052 моль/л (5). Раствор, содержащий катионы, приливали к раствору с анионами и аминокислотой со скоростью 5 мл/мин. Корректировку кислотности модельной системы проводили 10%-ным раствором HCl до значения pH 7.40 ± ± 0.05. Время кристаллизации осадков составляло 7 суток и было установлено в ходе предыдущих экспериментов. По истечении указанного времени полученные осадки отделяли от раствора фильтрованием, промывали водой, сушили при 80°C до постоянной массы для полного удаления химически не связанной воды, взвешивали и далее исследовали с помощью группы химических и физико-химических методов.
Таблица 1.
Средние молярные концентрации неорганических ионов синовиальной жидкости человека (рН 7.40 ± ± 0.05, ионная сила раствора – 0.172 ммоль/л) [14]
| Компонент | Ca2+ | Na+ | Мg2+ | К+ | Cl– | ${\text{HCO}}_{{\text{3}}}^{{{\text{2}}--}}$ | ${\text{HPO}}_{{\text{4}}}^{{{\text{3}}--}}$ | ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}}$ |
|---|---|---|---|---|---|---|---|---|
| С, ммоль/л | 2.53 | 140 | 1.1 | 4.6 | 103 | 27 | 4.38 | 11.4 |
Количественное определение содержания пролина в твердой фазе осуществлялось по разности начальных и конечных концентраций аминокислоты и осадкообразующих ионов в модельном растворе. Остаточные концентрации аминокислоты в жидкой фазе исследовались спектрофотометрическим методом (фотоколориметр КФК–2, λ = 670 нм, ГОСТ 18309-72) [14].
Фазовый состав полученных порошков исследовали с помощью рентгенофазового анализа (дифрактометр D8 Advance Bruker). Съемку проводили с использованием CuKα-излучения (λ = = 0.15406 нм) с позиционно-чувствительным детектором Lynxeye при следующих режимах измерения: шаг сканирования 0.05°, время накопления сигнала 4 с в точке, щель расходимости 0.5, напряжение и ток накала 40 кВ и 40 мА соответственно, область сканирования 2θ 5°–80°. Для идентификации фаз использовали базу данных ICDD PDF для порошковой дифракции. Расчет размеров кристаллитов (областей когерентного рассеяния (ОКР)) проводили с использованием программы TOPAS 3.0 (Bruker) [14].
ИК-спектры осадков регистрировали на спектрофотометре ФСМ-2202. Пробы готовили прессованием в таблетки с KBr. Микроструктуру и микротекстуру порошков исследовали с помощью сканирующей электронной микроскопии (СЭМ, микроскоп JSM-6610LV, JEOL) с применением детектора вторичных электронов при ускоряющем напряжении 10 кВ.
Термический анализ проводили на синхронном термическом анализаторе STA-449C NETZSCH. Пробы прокаливали в платиновых тиглях на воздухе от 25 до 1000°C со скоростью 10°C/мин. Количественные данные массовых потерь при отжиге получены с помощью программного обеспечения Proteus 7.10.
Удельная поверхность образцов исследована по методике одноточечной адсорбции азота при 77.4 К на адсорбционном приборе “Сорбтометр” производства ООО “Катакон” (Россия). Расчет полученных величин Sуд выполнен по методу БЭТ.
Для моделирования активной и пассивной фаз резорбции проведено растворение образцов при постоянном перемешивании в ацетатном буфере (pH 5.5) и в 0.9%-ном растворе хлорида натрия (рН ≈ 7). По методу прямой потенциометрии фиксировали значения pCa в растворе с помощью иономера И-160М. Полученные зависимости обрабатывали с помощью регрессионного анализа (программный пакет SigmaPlot 12.5) [8, 20].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В основе синтеза ГА из прототипа синовиальной жидкости лежит следующая реакция:
(1)
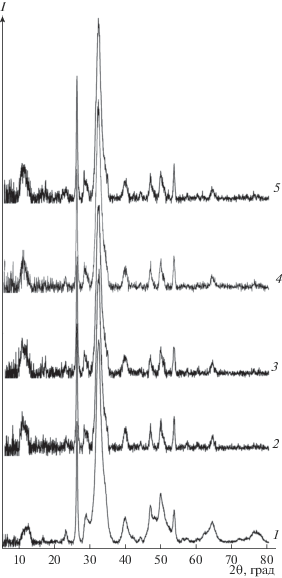
$\begin{gathered} 10{\text{CaC}}{{{\text{l}}}_{2}} + 6{{{\text{M}}}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{4}} + 8{\text{MOH}} \Rightarrow \\ \Rightarrow \,\,{\text{C}}{{{\text{a}}}_{{10}}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{6}}{{\left( {{\text{OH}}} \right)}_{2}}{\kern 1pt} \downarrow + {\text{ }}20{\text{MCl}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $Анализ дифрактограмм синтезированных порошков показал, что в случае введения в модельный раствор пролина, как и при его отсутствии, происходит формирование кристаллической фазы ГА (рис. 2, табл. 2). Однако на рентгенограммах ГА–пролин в отличие от порошка, полученного без аминокислоты, присутствуют более интенсивные фоновые сигналы (в интервале 5°–20° 2θ), а интенсивности основных максимумов 002, 121 и 112 ГА снижены в три раза, что указывает на низкую степень кристалличности полученных образцов и увеличение в них содержания аморфной фазы.
Таблица 2.
Параметры решетки, размеры кристаллитов и удельная поверхность образцов КГА
| Образец | a, Å | с, Å | с/а | V, Å3 | D, нм | Sуд, м2/г |
|---|---|---|---|---|---|---|
| 1 2 3 4 5 |
9.459 ± 0.002 9.426 ± 0.004 9.420 ± 0.004 9.420 ± 0.004 9.422 ± 0.004 |
6.874 ± 0.002 6.874 ± 0.004 6.879 ± 0.004 6.882 ± 0.004 6.877 ± 0.004 |
0.727 0.729 0.730 0.730 0.730 |
532.6 528.9 528.6 528.7 528.8 |
21.58 22.57 21.07 21.06 22.65 |
130 ± 7 116 ± 6 111 ± 6 114 ± 6 112 ± 6 |
| Костная ткань [14] | 9.410 | 6.891 | 0.732 | 528.4 | 5–10 | – |
В кристаллической решетки порошков ГА–пролин по сравнению с беспримесной фазой наблюдается уменьшение параметра а, а величина с практически не изменяется (табл. 2). В связи с этим для образцов, синтезированных в присутствии пролина, характерны большее соотношение параметров с/а и меньший объем элементарной ячейки, что приводит к образованию кристаллов пластинчатой формы. По структурным характеристикам и размерам кристаллитов порошки ГА–пролин близки к нестехиометрическим карбонатапатитам костной ткани человека [21].
В литературе описано различное влияние пролина на процессы кристаллизации из раствора. В зависимости от условий эксперимента и состава твердой фазы аминокислота может выступать в роли ингибитора процессов роста кристаллов [22], катализатора процесса зародышеобразования, в основном за счет хелатообразования [23, 24], также возможно частичное замещение ОН-групп в структуре ГА на анионы аминокислоты (0.2 молекулы) [25]. В нашем случае наличие пролина в модельном растворе практически не влияет на содержание минерального компонента в осадках и на размеры их кристаллитов (табл. 2). Размер ОКР вдоль [002] составляет 21–23 нм. При этом масса порошков закономерно увеличивается за счет повышения в их составе доли аминокислоты. Каждый осадок содержит 61–71 мас. % аминокислоты, присутствующей в растворе при синтезе (табл. 3).
Таблица 3.
Масса твердой фазы и содержание в ней пролина
| Образец | Масса осадка, г | C(pro) в осадке, % |
|---|---|---|
| 1 | 2.0394 | – |
| 2 | 2.1836 | 61.3 |
| 3 | 2.3112 | 65.3 |
| 4 | 2.4254 | 61.3 |
| 5 | 2.5454 | 71.0 |
Полученные результаты можно объяснить специфическим строением пролина. Данная неполярная алифатическая аминокислота существует в растворе в виде цвиттер-иона ${\text{NH}}_{{\text{2}}}^{ + }$(CH2)3СНCOO– и содержит гидрофобный радикал – пирролидиновое кольцо, которое придает пролину максимальную конформационную жесткость [26, 27]. За счет наличия пятичленного цикла у пролина в отличие от других аминокислот наименее выражены протонодонорные свойства катиона $--{\text{NH}}_{{\text{2}}}^{ + }$ и более сильным акцептором протонов является карбоксильная группировка –COO– (более электроотрицательна) [28, 29]. Вследствие этого наибольшей адсорбционной активностью обладает анион кислоты, и по этой причине на поверхности ГА адсорбируется меньшее ее количество по сравнению с другими неполярными конформационно подвижными аминокислотами [14, 23].
На ИК-спектрах образцов (рис. 3) наблюдаются пики, характерные для карбонатсодержащего ГА, а именно: валентные и деформационные колебания в Н2О–ν(Н2О) 3400–3440 см–1 и δ(Н–О–Н) 1610–1650 см–1; асимметричные валентные и деформационные колебания в ${\text{РО}}_{{\text{4}}}^{{{\text{3}}--}}$ – υ3(Р–О) 1030–1090 см–1, υ4(О–Р–О) 605–564 см–1 и υ2(О–Р–О) 470–475 см–1; дублет асимметричных валентных колебаний связи ν3(С–О) 1410–1480 см–1 и деформационное колебание ν2(О–С–О) 875–879 см–1 в ${\text{СО}}_{{\text{3}}}^{{{\text{2}}--}},$ указывающие на механизм замещения фосфатных тетраэдров карбонат-ионами в структуре полученных КГА по В-типу.
Рис. 3.
ИК-спектры образцов 1–5 (внизу на спектре – полосы поглощения колебаний связей неорганических групп, вверху – органических групп).
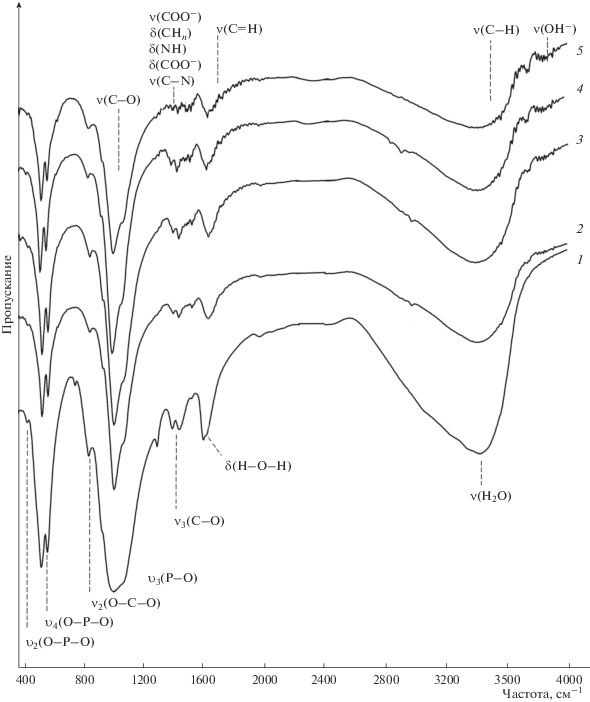
На присутствие пролина в составе твердой фазы указывают моды колебаний органических группировок, см–1: 1032–1037 – валентные ν(С–О) пиранового цикла; 1422–1440 – симметричные валентные νs(СОО–); 1460 – деформационные метильных δ(СН) и метиленовых δ(СН2) групп; 1507–1543 – деформационные δ(NH) и δ(СОО–), валентные ν(C–N) амид II; 2800–3600 – валентные ν(С–H); 3420–3600 – ν(ОН–), ассоциированные внутримолекулярными водородными связями [19]. Видно, что в диапазоне частот 900–4000 см–1 происходит наложение полос поглощения связей минеральных и органических составляющих. В интервале частот до 900 см–1, где присутствуют только моды неорганического компонента, на спектрах образцов КГА–пролин в отличие от фазы без добавки (рис. 3, спектр 1) можно отметить значительное уменьшение интенсивности дублета полосы поглощения связей υ2(О–Р–О) в ${\text{РО}}_{{\text{4}}}^{{{\text{3}} - }}$ (564–610 см–1), что косвенно указывает на низкую кристалличность полученных осадков. С увеличением содержания пролина в порошках на ИК-спектрах становится меньше полоса 3400–3600 см–1 группировок ν(ОН–) структурной воды КГА и характеризующих наличие межмолекулярных связей “вода–вода”, при этом возрастает число мод колебаний связей группировок аминокислоты. Это можно объяснить тем, что пролин относится к иминокислотам, содержащим средний по объему и значению гидрофобности пирролидиновый боковой радикал (объем 113 Å3 – в 3.7 раза больше объема молекул воды, гидрофобность – 0.711), в котором отсутствует N–H-группа, способная служить донором водородной связи. Вследствие этого в растворе пролин связывает ограниченное количество молекул воды за счет акцепторных свойств СОО– [29–31]. Кроме того, в процессе кристаллизации часть карбоксильных групп связана с положительно заряженными участками поверхности КГА. Малоподвижные неполярные (малополярные) гетероциклы могут притягиваться друг к другу за счет межмолекулярных сил, образуя ассоциаты.
Таким образом, с увеличением содержания пролина в составе твердой фазы, с одной стороны, уменьшается количество структурно связанной воды, с другой – отмечается пространственная стабилизация ее молекул. Полученная корреляция хорошо согласуется с данными работы [31], в которой показано применение в качестве количественной меры воды содержания аминокислоты в тканях растений.
Исследование текстуры и морфологии образцов проведено методами БЭТ и СЭМ. Установлено, что присутствие пролина в модельной среде не влияет на размеры ОКР формирующихся кристаллитов и приводит лишь к незначительному изменению площади удельной поверхности порошков (табл. 2). Независимо от содержания аминокислоты в составе твердой фазы площадь удельной поверхности всего лишь на 13–18 м2/г меньше величины для чистого КГА (табл. 2). Возможно, пролин из-за тяжелого гидрофобного бокового радикала имеет максимальные конформационные ограничения и взаимодействует с КГА в основном за счет карбоксильной группы. Несмотря на возможное образование новых центров кристаллизации – хелатных комплексов, ассоциативных цепей пролина, активный рост кристаллов в пространстве ограничен из-за малоподвижных гетероциклов и структурной стабилизации воды и происходит в определенном направлении согласно конформационной ориентации пролиновых цепей.
Таким образом, возможные вторичные процессы кристаллизации, с одной стороны, и стерические ограничения в растворах с пролином – с другой, позволяют получить твердую фазу с хорошими поверхностными характеристиками. Увеличение содержания аминокислоты в составе порошков, согласно данным РФА и ИК-спектроскопии, отражается на их кристалличности.
Полученные данные согласуется с анализом морфологии частиц порошков. Установлено, что наличие в модельной среде пролина не оказывает значительного влияния на форму и размеры частиц порошков. Частицы КГА–пролин, как и чистой фазы КГА, образуют агрегаты размером до 200 мкм, имеющие чешуйкоподобную форму. Образцы, содержащие аминокислоту, менее пористые, возможно, из-за меньшей кристалличности минерального компонента (рис. 4).
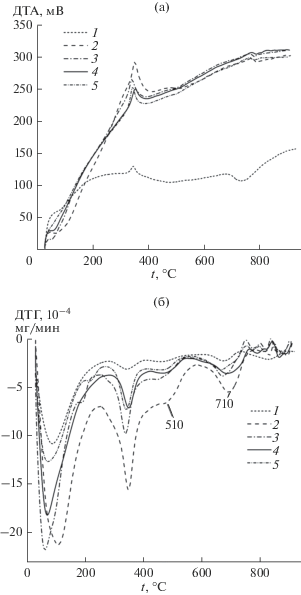
Для исследования закономерностей термопревращений образцов проведен термический анализ в температурном интервале 25–1000°С. Вид кривых ТГ, ДТГ и ДТА для композитов КГА–pro близок по форме к таковым для образца, полученного без пролина (рис. 5).
На кривых ДТА можно выделить 4 этапа термопреобразования в температурном интервале 25–1000°С [32–36]. На первом этапе (I, 25-280/ 25-242 (270)°С, образцы 1/2, 3 (4, 5), ΔН > 0) происходит удаление химически не связанной воды, разложение легколетучих примесей.
Второй этап (II, 280-470/240-410 (464)°С, образцы 1/3–5 (2), ΔН < 0) сопровождается удалением пролина (tпл = 205–221°С) и дегидратацией адсорбированной воды по схеме:
(2)
$\begin{gathered} \text{[}{\text{КГА}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}] \cdot m{{{\text{Н}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{тв}}}}} \to \\ \to \,\,{\text{КГА}} \cdot n{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{тв}}}}} + m{{{\text{Н}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{г}}}} + Q. \\ \end{gathered} $На третьем этапе (III, 470-750/410(464)–750(784)°С, образцы 1/3–5 (2), ΔН < 0) происходит десорбция кристаллизационной и химически связанной воды. Схематично процессы удаления воды можно представить в виде
(3)
${\text{КГА}} \cdot n{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{тв}}}}} \to {\text{КГ}}{{{\text{А}}}_{{{\text{тв}}}}} + m{{{\text{Н}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{г}}}} + Q.$На четвертом этапе (IV, 750-1000/750(784)-1000°С, образцы 1/3–5 (2), ΔН > 0) происходит преобразование КГА в стехиометричную фазу ГА (4) или β-Са3(РО4)2 (5):
(4)
$\begin{gathered} {\text{С}}{{{\text{а}}}_{{{\text{10}}}}}{{\left( {{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{\text{,С}}{{{\text{О}}}_{{\text{3}}}}} \right)}_{6}}{{\left( {{\text{ОН}}} \right)}_{2}} \to \\ \to \,\,{\text{С}}{{{\text{а}}}_{{10}}}{{\left( {{\text{Р}}{{{\text{О}}}_{4}}} \right)}_{6}}{{\left( {{\text{ОН}}} \right)}_{2}} + 6{\text{С}}{{{\text{О}}}_{2}}{\kern 1pt} \uparrow --\,\,Q, \\ \end{gathered} $(5)
$\begin{gathered} {\text{С}}{{{\text{а}}}_{{\text{9}}}}{{\left( {{\text{Р}}{{{\text{О}}}_{{\text{4}}}}} \right)}_{{{\text{6}}--x--y}}}{{\left( {{\text{НР}}{{{\text{О}}}_{{\text{4}}}}} \right)}_{у}} \times \\ \times \,\,{{\left( {{\text{С}}{{{\text{О}}}_{{\text{3}}}}} \right)}_{x}}{{\left( {{\text{ОН}}} \right)}_{{{\text{2}}--у\,{\text{тв}}}}}\xrightarrow{{800^\circ {\text{C}}}} \\ \to {\text{3}}\beta {\text{ - С}}{{{\text{а}}}_{{\text{3}}}}{{\left( {{\text{Р}}{{{\text{О}}}_{{\text{4}}}}} \right)}_{{{\text{2}}\,{\text{тв}}}}} + х{\text{С}}{{{\text{О}}}_{{{\text{2}}\,{\text{г}}}}} + {\text{2}}{{{\text{Н}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{г}}}}--Q. \\ \end{gathered} $Выявлено, что вид термических кривых композитов КГА–pro близок к образцу чистого КГА (рис. 5). При их разложении на этапах II–IV выделяется в три раза больше теплоты. Это может быть связано как с бóльшим содержанием удаляемых компонентов в составе проб, так и с наиболее прочной их связью с твердой поверхностью. Кривые ДТА композитов более пологие (рис. 5а).
Интервалы температур деструкции составляющих примерно одинаковы у порошков КГА и КГА–pro. Однако удаление химически связанной воды на третьем этапе из образцов, содержащих аминокислоту, происходит в два этапа (пики при 510 и 710°С).
В целом, присутствие аминокислоты мало влияет на термическую устойчивость образцов и значения экстремумов близки. Термическое преобразование образцов, синтезированных в присутствии пролина, сопровождается наибольшими термическими эффектами на II и III этапах термопреобразований. Это может быть связано со стабилизацией воды в составе композитов, полученных в присутствии pro, и согласуется с данными ИК-спектроскопии. Также наблюдается увеличение общей потери массы за счет удаления пролина и кристаллизационной воды (табл. 4) [37].
Таблица 4.
Потеря массы (Δm) на четырех этапах термопреобразований твердых образцов 1–5 при варьировании исходной концентрации пролина
| Этап | t*, °С | Δm, % | t*, °С | Δm, % | t*, °С | Δm, % | t*, °С | Δm, % | t*, °С | Δm, % |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||||||
| I | 25 | 7.10 | 25 | 6.94 | 25 | 8.53 | 25 | 8.49 | 25 | 6.52 |
| II | 280 | 2.34 | 242 | 4.85 | 242 | 3.31 | 270 | 2.43 | 272 | 2.28 |
| III.1 | 470 | 2.50 | 464 | 1.22 | 410 | 1.68 | 410 | 1.52 | 408 | 1.54 |
| III.2 | 476 | 1.69 | 554 | 1.80 | 556 | 2.12 | 556 | 1.72 | ||
| IV | 750 | 1.24 | 784 | 0.36 | 750 | 0.47 | 750 | 0.66 | 756 | 0.49 |
| I + IV | 25–950 | 13.18 | 25–950 | 15.06 | 25–950 | 15.79 | 25–950 | 15.22 | 25–950 | 12.55 |
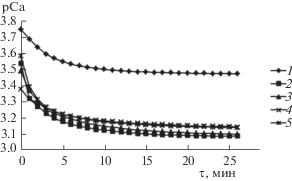
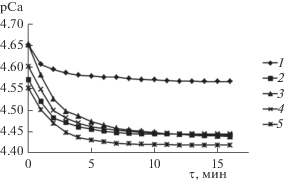
Для характеристики биоактивности образцов проведено их растворение в растворителях, подобранных с учетом условий резорбции in vivo. Исследование растворения образцов в ацетатном буферном растворе (рН 5.5) проведено для моделирования активной фазы резорбции остеокластами (рис. 6).
Для определения скорости растворения осадков все кинетические кривые проанализированы с помощью регрессионного анализа [8, 20]. Установлено, что процесс растворения порошков стадийный. На начальном участке кривых зависимость концентрации ионов кальция в растворе от времени C(τ) = $ - \lg {{C}_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}}$ описывается линейной функцией. Истинная скорость для линейной зависимости определяется как тангенс угла наклона прямой [38].
Следующая стадия процесса растворения порошков в ацетатном буфере характеризуется экспоненциальной зависимостью
где С0 – условная начальная концентрация, Сm – концентрация насыщения, b – коэффициент, τ – время.Данная зависимость соответствует кинетике первого порядка [38]. В качестве количественной меры скорости растворения на данном этапе можно рассматривать условную начальную концентрацию.
На линейном и экспоненциальном участках полученной зависимости (табл. 5) скорость растворения образцов, синтезированных в присутствии пролина, выше, чем у образца без добавки. Но при этом скорость растворения образцов практически не зависит от варьирования концентрации аминокислоты в исходном растворе. Изоэлектрическая точка пролина, при которой аминокислота в растворе существует в виде нейтрально заряженного цвиттер-иона, составляет 6.3 [39]. При подкислении раствора происходит разрушение связей между Ca2+ и COO– и образование катионной формы аминокислоты, как следствие – повышение растворимости осадков [14].
Таблица 5.
Кинетические характеристики растворения образцов в ацетатном буфере
| Образец | τ, мин | υ, 10–7 мин–1 | τ, мин | υ, 10–6 мин–1 |
|---|---|---|---|---|
| на начальном участке | на конечном участке | |||
| 1 | 1–15 | 0.091 ± 0.008 | 16–26 | 0.91 ± 0.3 |
| 2 | 1–16 | 1.9 ± 0.2 | 17–24 | 8.1 ± 3.1 |
| 3 | 1–18 | 1.7 ± 0.2 | 19–31 | 7.8 ± 3.9 |
| 4 | 1–18 | 1.1 ± 0.1 | 19–31 | 7.1 ± 2.4 |
| 5 | 1–17 | 1.5 ± 0.2 | 18–32 | 7.1 ± 1.6 |
Изучение растворения образцов в изотоническом 0.9%-ном растворе NaCl (рН ≈ 7.4) проведено для моделирования пассивной фазы резорбции имплантата в организме человека (рис. 7).
Регрессионный анализ показал, что в растворе 0.9%-ного NaCl скорость резорбции образцов, содержащих пролин, выше, чем у КГА без добавок (табл. 6). На начальном этапе с большей скоростью за более короткий промежуток времени растворяются образцы с концентрацией пролина выше 0.039 моль/л. На экспоненциальном участке скорости растворения не зависят от концентрации аминокислоты. Эти данные можно объяснить тем, что связи Ca2+–COO– могут ослабляться за счет уменьшения акцепторных свойств карбоксильной группы. При увеличении рН раствора до 7.4 (рН > рI) происходят понижение электронной плотности на атоме углерода карбоксильной группы и ослабление электростатического притяжения между ионами Ca2+ и COO– [24]. В результате скорость растворения образцов, полученных в присутствии аминокислоты, возрастает.
Таблица 6.
Кинетические характеристики растворения образцов в 0.9%-ном NaCl
| Образец | τ, мин | υ, 10–7 мин–1 | τ, мин | υ, 10–8 мин–1 |
|---|---|---|---|---|
| на начальном участке | на конечном участке | |||
| 1 | 1-8 | 2.5 ± 0.4 | 9-28 | 2.7 ± 4.3 |
| 2 | 1-7 | 8.0 ± 1.6 | 8-20 | 3.6 ± 3.8 |
| 3 | 1-12 | 7.2 ± 1.2 | 13-23 | 3.6 ± 7.7 |
| 4 | 1-6 | 12.0 ± 2.5 | 7-13 | 3.5 ± 1.4 |
| 5 | 1-6 | 11.0 ± 2.0 | 7-13 | 3.8 ± 6.8 |
ЗАКЛЮЧЕНИЕ
В работе синтезирован КГА из прототипа синовиальной жидкости в присутствии пролина. Полученные порошки содержат от 61 до 71 мас. % аминокислоты. Показано, что наличие пролина в модельном растворе не оказывает влияния на размеры формирующихся кристаллов КГА, а приводит к изменению степени кристалличности и незначительному изменению площади удельной поверхности образцов.
По структурным характеристикам и размерам кристаллитов порошки КГА–пролин близки к нестехиометрическим карбонатапатитам костной ткани человека. С увеличением содержания пролина в составе твердой фазы, с одной стороны, уменьшается количество структурно связанной воды, с другой – отмечается пространственная стабилизация ее молекул. Образцы, содержащие аминокислоту, менее пористые и более термически устойчивы.
Выявлено, что растворение образцов в 0.9%-ном растворе NaCl и ацетатном буферном растворе является двухстадийным процессом. Образцы, синтезированные из среды, содержащей пролин, растворяются быстрее и за более короткий промежуток времени. Содержание аминокислоты в образцах влияет только на начальный этап их растворения в растворе 0.9%-ного NaCl.
Список литературы
Баринов С.М., Комлев В.С. Биокерамика на основе фосфатов кальция. М.: Наука, 2005. 204 с.
Barinov S.M., Komlev V.S. Calcium Phosphate Based Bioceramics for Bone Tissue Engineering. Zurich: Trans Tech, 2008. 170 p.
Карякина Е.В., Персова Е.А. Особенности ремоделирования костной ткани при воспалительных и дегенеративных заболеваниях тазобедренного сустава // Саратовский науч.-мед. журн. 2009. Т. 5. № 2. С. 227–230.
Popov V.K., Komlev V.S., Chichkov B.N. Calcium Phosphate Blossom for Bone Tissue Engineering // Mater. Today. 2014. V. 17. № 2. P. 96–97.
Komlev V.S., Barinov S.M., Bozo I.I. et al. Bioceramics Composed of Octacalcium Phosphate Demonstrate Enhanced Biological Behavior // ACS Appl. Mater. Interfaces. 2014. V. 6. № 19. P. 16610–16620.
Петракова Н.В. Влияние условий синтеза и спекания нанопорошков гидроксиапатита на формирование микроструктуры и свойств керамики: Дис. … канд. тех. наук. М., 2014. 143 с.
Epple M., Ganesan K., Heumann R. et al. Application of Calcium Phosphate Nanoparticles in Biomedicine // J. Mater. Chem. 2010. V. 20. № 1. P. 18–23.
Вересов А.Г., Путляев В.И., Третьяков Ю.Д. Химия неорганических материалов на основе фосфатов кальция // Журн. Рос. хим. общ-ва им. Д.И. Менделеева. 2004. Т. 48. № 4. C. 52–63.
Izmailov R.R., Golovanova O.A. Adhesive and Morphological Characteristics of Carbonate Hydroxyapatite Prepared from a Model Human Synovial Fluid on Titanium Alloys // Inorg. Mater. 2014. V. 50. № 6. P. 592–598.
Golovanova O.A., Zaits A.V. Biomimetic Coating of a Titanium Substrate with Silicon-Substituted Hydroxyapatite // Inorg. Mater. 2018. V. 54. № 11. P. 1124–1130.
Gerk S.A., Golovanova O.A., Sharkeev Yu.P. Synthesis of a Two-Phase Nanopowder from Prototype Human Synovial Fluid and the Use of the Nanopowder for the Preparation of Coatings on Titanium Plates // Inorg. Mater. 2016. V. 52. № 9. P. 1021–1028.
Баринов С.М. Керамические и композиционные материалы на основе фосфатов кальция для медицины // Успехи химии. 2010. № 1. С. 15.
Green D.W., Goto T.K., Kim K.S., Jung H.S. Calcifying tissue Regeneration via Biomimetic Materials Chemistry // J. R. Soc. Interface. 2014. № 11. P. 1–11.
Gerk S.A., Golovanova O.A., Odazhiu V.N. Structural, Morphological, and Resorption Properties of Carbonate Hydroxyapatite Prepared in the Presence of Glycine // Inorg. Mater. 2018. V. 54. № 3. P. 305–314.
Bye J.W. Meliga S., Ferachou D., Cinque G., Zeitler J.A., Falconer R.J. Analysis of the Hydration Water around Bovine Serum Albumin Using Terahertz Coherent Synchrotron Radiation // J. Phys. Chem. A. 2013. V. 118. №. 1. P. 83–88.
Торбенко В.П., Касавина Б.С. Функциональная биохимия костной ткани. М.: Медицина, 1977. 272 с.
Кухта В.К., Олецкий З.И., Таганович А.Д. Биологическая химия. М.: БИНОМ, 2008. 668 с.
Федотова М.В., Дмитриева О.А. Структура гидратных оболочек групп $--{\text{NH}}_{{\text{2}}}^{ + }$ и –COO– цвиттер-иона L-пролина по данным 1D-RISM-метода интегральных уравнений // ЖФХ. 2014. Т. 88. № 5. С. 801–804.
Fedotova M.V., Dmitrieva O.A. Characterization of Selective Binding of Biologically Relevant Inorganic Ions with the Proline Zwitterion by 3D-RISM Theory // New J. Chem. 2015. V. 39. № 11. P. 8594–8601.
Измайлов Р.Р., Голованова О.А. Биорезорбируемость гранулированного композита на основе карбонатгидроксилапатита и желатина в средах с различными значениями рН // Вестн. Омского ун-та. 2015. № 2. С. 61–65.
Сафронова Т.В., Путляев В.И. Медицинское неорганическое материаловедение в России: кальцийфосфатные материалы // Наносистемы: физика, химия, математика. 2013. Т. 4. № 1. С. 24–47.
Golovanova O.A., Korol’kov V.V. Thermodynamics and Kinetics of Calcium Oxalate Crystallization in the Presence of Amino Acids // Crystallogr. Rep. 2017. V. 62. № 5. P. 787–796.
Солоненко А.П., Голованова О.А. Изучение адсорбции глутаминовой кислоты на брушите // Химия в интересах устойчивого развития. 2013. Т. 21. № 2. С. 227–233.
Голованова О.А., Томашевский И.А. Кинетика и термодинамика образования соединений ионов кальция с аминокислотами, их строение и устойчивость // Журн. физ. химии. 2019. Т. 93. № 1. С. 11–22.
Герк С.А., Голованова О.А. Вариации аминокислотного состава костных тканей человека // Химия в интересах устойчивого развития. 2013. Т. 21. № 3. С. 299–304.
Кузнецова Е.С., Ульянов А.В., Буряк А.К. Сравнительный анализ адсорбции стереоизомеров гидрокси- и дигидроксипролина на графитированной термической саже // Физикохимия поверхности и защита материалов. 2009. Т. 45. № 3. С. 271–276.
Иванов А.С. Основные принципы конформационного разнообразия белков для медико-биологов // Биомедицинская химия. 2011. Т. 57. № 1. С. 31–60.
Fleming D.E., Bronswijk W., Ryall R.L. A Comparative Study of the Adsorption of Amino Acids on to Calcium Minerals Found In Renal Calculi // Clin. Sci. 2001. V. 101. P. 159–168.
Рубин М.А. Влияние пролина на конформационную стабильность полипептидных цепей коллагенов: Автореф. … канд. физ.-мат. наук. М., 2008. 24 с.
Давыдова Е.А. Гидратные структуры пролина и гидроксипролина в растворе и сульфокатионообменнике КУ-2Х8: Дис. … канд. хим. наук. Воронеж, 2006. 151 с.
Кириллов А.Ф., Козьмик Р.А., Даскалюк А.П., Кузнецова Н.А., Харчук О.А. Оценка содержания пролина в растениях при воздействии засухи и засолении // Докл. по экологическому почвоведению. 2013. № 1(18). С. 194–202.
Tõnsuaadu K., Peld M., Bender V. Thermal Analysis of Apatite Structure // J. Therm. Anal. Calorim. 2003. V. 72. P. 363–371.
Старикова В.В., Рудченко С.О. Оптимизация свойств композита на основе гидроксиаптита и хитозана путем вариации состава и режимов термообработки // Вестн. Харьковского ун-та. 2010. Вып. 14. С. 35–39.
Голощапов Д.Л., Кашкаров В.М., Румянцева Н.А., Середин П.В., Леньшин А.С., Агапов Б.Л., Домашевская Э.П. Получение нанокристаллического гидроксиапатита методом химического осаждения с использованием биогенного источника кальция // Конденс. среды и межф. границы. 2011. Т. 13. № 4. С. 427–441.
Селифанова Е. И., Чепнова Р.К., Коблова О.Е. Термогравиметрическое изучение L-α-аминокислот // Изв. Саратовского ун-та. Сер. Химия. Биология. Экология. 2008. Т. 8. Вып. 2. С. 23–28.
Нуркеев С.С., Казова Р.А.. Ахметбекова А. Физико-химические исследования термических превращений минералов фосфоритов // Вестн. КазНТУ им. К.И. Сатпаева. 2005. № 3(47). С. 82–87.
Koloskov O.O., Levina E.O., Mai B.D., Vener M.V. Classical MD Simulations of the IR Spectra of Amino Acids with Neutral Residues in Water. Reassignment of the Band around 2300 cm–1 // Сорбционные и хроматографические процессы. 2016. Т. 16. С. 556–562.
Романовский Б.В. Основы химической кинетики. М.: Экзамен, 2006. 416 с.
Tavafoghi J.M., Yao G., Cerruti. M. The Importance of Amino Acid Interactions in the Crystallization of Hydroxyapatite // J. R. Soc. Interface. 2013. № 10. P. 1–14.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы