Неорганические материалы, 2020, T. 56, № 5, стр. 528-532
Извлечение катионов цезия и стронция из растворов ионитами на основе фосфатов титана(IV)
Р. И. Корнейков 1, *, В. И. Иваненко 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение “Кольский научный центр Российской академии наук”
184209 Мурманской обл., Апатиты, Академгородок, 26а, Россия
* E-mail: korneikov@chemy.kolasc.net.ru
Поступила в редакцию 08.04.2019
После доработки 22.10.2019
Принята к публикации 20.11.2019
Аннотация
Показана возможность эффективного применения сорбционных материалов на основе гидрофосфатов оксотитана(IV) при извлечении радионуклидов цезия и стронция из жидких радиоактивных отходов, близких по химическому составу к морской воде. Определены оптимальные условия совместного извлечения катионов цезия и стронция (значение рН, отношение жидкой и твердой фаз, температура). Двойной фосфат титана(IV) и сорбированного компонента, формирующийся после термической обработки отработанного сорбента, обеспечивает надежную иммобилизацию радионуклидов.
ВВЕДЕНИЕ
В процессе эксплуатации атомных энергетических установок гражданских и военных судов образуются высокосолевые жидкие радиоактивные отходы (ЖРО), близкие по химическому составу к морской воде с общим солесодержанием до 30 г/л [1]. Основной вклад в активность ЖРО вносят радионуклиды 134, 137Cs и 90Sr [1–4]. Для дезактивации таких растворов перспективны сорбционные методы [5, 6]. Сорбенты должны обладать высокими ионообменными характеристиками и обеспечивать надежную иммобилизацию сорбированных компонентов. Используемые для дезактивации ЖРО иониты на основе феррацианидов переходных металлов и иониты на основе диоксида марганца(III, IV) не способны к коллективному извлечению 134, 137Cs и 90Sr, поскольку избирательны только к радионуклидам цезия и стронция соответственно [7]. Более того, эти иониты не обеспечивают надежную иммобилизацию радиоактивного материала при хранении, что может способствовать возникновению чрезвычайных ситуаций. Таким образом, используемые в технологических процессах сорбенты не в полной мере отвечают предъявляемым к ним требованиям, что делает актуальным поиск новых высокоэффективных ионообменных материалов.
Среди ионообменников интерес представляют неорганические материалы на основе соединений титана(IV) [8–12], и прежде всего гидрофосфаты оксотитана(IV) с мольным соотношением P : Ti(IV) ≤ 1, которые способны извлекать радионуклиды из высокосолевых растворов, обеспечивать компактность, надежную иммобилизацию и безопасность при длительном хранении. Однако условия эффективного применения этих ионитов изучены недостаточно. Целью данной работы является поиск условий эффективного сорбционного извлечения микроколичеств катионов цезия и стронция из высокосолевых растворов ионообменными матрицами на основе фосфатов титана(IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
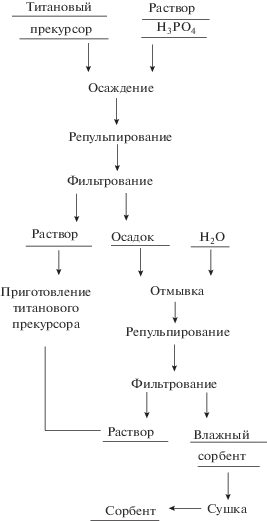
Синтез сорбентов на основе оксогидроксофосфатов титана(IV) осуществляли в соответствии с разработанной авторами методикой [13] из титансодержащих сернокислотных растворов (титановый прекурсор) непосредственным осаждением гидратированной фосфатотитановой матрицы ортофосфорной кислотой. Дальнейшая отмывка осадка водой от маточного электролита и сушка приводили к получению целевого продукта (рис. 1).
Рис. 1.
Принципиальная схема получения гидратированного гидрофосфата оксотитана(IV) осаждением ортофосфорной кислотой из титанового прекурсора.
Содержание фосфора в синтезированных сорбентах анализировали фотоколориметрически с молибдатом аммония (фотоэлектроколориметр Leki-1107), содержание титана определяли атомно-абсорбционным и фотоколориметрическим (с пероксидом водорода) методами. Содержание воды, гидроксо- и гидрофосфатных групп устанавливали сопоставлением результатов химического, дифференциального термического и термогравиметрического анализов. Удельную поверхность воздушно-сухого исходного сорбента, средний диаметр и объем пор определяли методом термической десорбции азота на электронном измерителе удельной поверхности TriStar II 3020 фирмы Micrometritics. Распределение по размерам частиц находили методом лазерной дифракции на анализаторе SALD-201 фирмы Shimadzu. Содержание сорбированных катионов металлов определяли методом пламенной фотометрии и атомно-абсорбционным методом (прибор AAS-30 фирмы Karl Zeiss). При химическом анализе использовали масс-спектрометрическую систему с индуктивно-связанной плазмой (ИСП-МС) с динамической реакционной системой ELAN 9000 DRC-e фирмы Perkin Elmer, а также плазменный эмиссионный спектрометр ICPS-9000 фирмы Shimadzu. Для дифференциального термического анализа твердых фаз использовали низкочастотный термографический регистратор НТР-70 с программным нагревательным устройством ПРТ-1000М. Эталоном служил прокаленный Al2O3. Термогравиметрический анализ проводили с помощью тензорных весов ВТ-1000. Температуру измеряли платина-платинородиевыми термопарами в комплекте с потенциометром ПП-63. Скорость нагрева составляла 10°С/мин.
Процесс гетерогенного катионного замещения на синтезированных сорбентах проводили в статических условиях при различных равновесных значениях рН, температуре, отношении жидкой и твердой фаз (Ж : Т) в соответствии с уравнением
где R – гидратированная матрица сорбента, H+ – протоны функциональных групп, замещаемые катионом сорбируемого металла Mz+. В качестве равновесных значений рН принимали стационарные во времени значения, полученные с использованием иономера И-130.2М.1 с точностью ±0.02. Индикаторным электродом служил селективный по отношению к ионам водорода электрод марки ЭСЛ-43-07, вспомогательным – хлорсеребряный электрод Ag/AgCl марки ЭВЛ-1М3. Коэффициенты распределения (Kd) рассчитывали по уравнению где А – процентное содержание сорбированного катиона металла, α – отношение объема жидкой фазы к массе сорбента.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтезированные сорбенты на основе оксогидроксофосфатов титана(IV) имеют состав TiO2 – x – y(OH)2y(НPO4)x ⋅ nH2O (x = 0.3–1.0, y = = 0–0.5, n = 1.3–6.3, P : Ti(IV) ≤ 1) и содержат конституционную воду в виде гидрофосфатных и гидроксогрупп, а также координационную в виде аква-лигандов. Воздушно-сухие сорбенты являются рентгеноаморфными [14].
В работе изучены процессы сорбции катионов Cs+ и Sr2+ при их совместном присутствии на сорбенте состава TiOНРО4 · 2.72Н2О при различных условиях (температура, отношение жидкой и твердой фаз) (табл. 1). Сорбционный материал предварительно подвергали ситованию через сито с размером ячейки 0.04 мм. Удельная поверхность образца Sуд составила 65.58 м2/г, средний диаметр d и объем V пор – 22.59 нм и 0.44 см3/г соответственно. Диапазон среднего размера частиц сорбента – от 2 до 11 мкм.
Таблица 1.
Сорбционное извлечение Cs+ и Sr2+ образцом состава TiOНРО4 · 2.72Н2О в зависимости от температуры и отношения фаз Ж : Т из раствора состава (г/л): NaCl – 30, Cs+ – 1.1 × 10–3, Sr2+ – 15.3 × 10–3 (рН сорбции 4.2)
| Условия | Остаточное содержание, мг/л | Извлечение, % | Кd, мл/г | ||||
|---|---|---|---|---|---|---|---|
| Ж : Т | t, °С | Cs+ | Sr2+ | Cs+ | Sr2+ | Cs+ | Sr2+ |
| 100 | 20 | 0.163 | 7.03 | 85 | 54 | 575 | 117 |
| 100 | 70 | 0.134 | 5.25 | 88 | 66 | 733 | 194 |
| 50 | 20 | 0.055 | 4.22 | 95 | 72 | 950 | 129 |
При введении сорбентов в раствор (исходное значение рН раствора ~6), содержащий катионы Cs+ и Sr2+, происходит понижение рН до ~2 вследствие ионного обмена. Равновесное значение рН раствора (4.2) получали введением соды (Na2СО3).
Из табл. 1 видно, что повышение температуры при сорбции катионов металлов до 70°С практически не влияет на степень извлечения цезия и стронция. По-видимому, это связано с несущественным изменением эффективного радиуса катионов металлов вследствие их дегидратации. Уменьшение отношения фаз Ж : Т от 100 до 50 также не приводит к существенному повышению эффективности сорбции катионов металлов.
В работе проведены исследования по извлечению катионов металлов в зависимости от рН раствора (рис. 2 и табл. 2).
Рис. 2.
Зависимости степени извлечения катионов металлов от значения рН сорбции (Ж : Т = 100, t = = 20°С) на сорбенте состава TiOНРО4 · 2.72Н2О: 1 – катионы Cs+, 2 – катионы Sr2+.
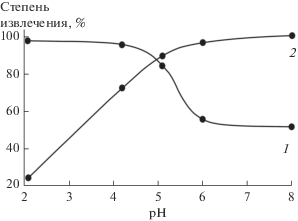
Таблица 2.
Коэффициенты распределения Cs+ и Sr2+ на образце состава TiOНРО4 · 2.72Н2О в зависимости от рН сорбции (t = 20°С, Ж : Т = 100) из раствора состава (г/л): NaCl – 30, Cs+ – 1.1 × 10–3, Sr2+ – 15.3 × 10–3
| Катион | Кd, мл/г | ||||
|---|---|---|---|---|---|
| 2 | 4 | 5 | 6 | 8 | |
| Cs+ | 2800 | 575 | 530 | 125 | 104 |
| Sr2+ | 31 | 118 | 840 | 2400 | 49 250 |
Видно, что при рН 2 эффективно извлекаются катионы цезия, в то время как катионы стронция практически не сорбируются. По-видимому, это связано с конкуренцией со стороны протонов, которая выше в этой области рН по отношению к более гидратированным катионам металлов (Sr2+). При повышении рН раствора до 8 извлечение цезия понижается, а стронция существенно возрастает. Возможно, это связано, с одной стороны, с отсутствием конкуренции со стороны ионов водорода, с другой – с усилением подвижности протонов ионообменных групп сорбента. В результате повышается степень извлечения более гидратированных катионов металлов.
В работе проведены исследования постадийного сорбционного извлечения цезия и стронция при разных равновесных значениях рН (табл. 3).
Из анализа полученных данных следует, что последовательное извлечение цезия и стронция фосфатом титана(IV) при pH 2 и 8 приводит к практически полному выделению катионов Cs+ и Sr2+. Однако для более глубокой очистки раствора необходимо проведение трех стадий при t = 20°С:
стадия 1 – сорбция катионов Cs+ при отношении Ж : Т = 100, рН 2, Kd = 2.8 × 103 мл/г;
стадия 2 – дополнительное извлечение катионов Cs+ при Ж : Т = 300, рН 2, Кd = 2.5 × 103 мл/г;
стадия 3 – извлечение катионов Sr2+ при Ж : Т = = 100, рН 8, Кd = 1.9 × 104 мл/г.
Недостатком такого режима является извлечение катионов металлов при разных условиях – равновесных значениях рН. Оптимальное значение рН раствора, при котором происходит достаточно высокое одновременное извлечение катионов Cs+ и Sr2+ (~85%), составляет 5 при Ж : Т = 100 и t = 20°С (рис. 2). Значения Kd для катионов Cs+ и Sr2+ при этих условиях равны 530 и 840 мл/г соответственно.
Термическая обработка в интервале от 600 до 650°С насыщенных сорбированными катионами металлов образцов приводит к образованию соединений с кристаллической структурой минералоподобного типа, которые обеспечивают надежную иммобилизацию и безопасность при длительном хранении высокотоксичного сорбата [14].
В работе проведены исследования по сорбционному извлечению катионов Cs+ и Sr2+ из модельного раствора, соответствующего составу морской воды [15], при различных рН (табл. 4). В табл. 5 представлены результаты анализа химического состава сорбента TiOНРО4 ∙ 2.72Н2О после сорбции катионов металлов из модельного раствора.
Таблица 4.
Сорбция Cs+ и Sr2+ сорбентом состава TiOНРО4 · 2.72Н2О в зависимости от рН (Ж : Т = 100, t = 20°С) из раствора состава (г/л): Na+ – 10.7, Cl– – 19.35, K+ – 0.42, Ca2+ – 0.41, Мg2+ – 1.35, Cs+ – 0.85 × 10–3, Sr2+ – 10 × 10–3
| рН сорбции | Остаточное содержание, мг/л | Извлечение, % | Кd, мл/г | |||
|---|---|---|---|---|---|---|
| Cs+ | Sr2+ | Cs+ | Sr2+ | Cs+ | Sr2+ | |
| 2 | 0.10 | 9.80 | 88 | – | 750 | – |
| 5 | 0.21 | 2.29 | 75 | 77 | 300 | 340 |
| 8 | 0.41 | 0.27 | 52 | 97.3 | 107 | 3600 |
Таблица 5.
Состав сорбентов после сорбции из раствора, соответствующего составу морской воды (исходный состав: TiO2 – 36.9, Р2О5 – 35.8, Н2О – 27.3%)
| рН сорбции | Состав отработанных сорбентов, % | ||||
|---|---|---|---|---|---|
| TiO2 | Р2О5 | Н2О | Nа2О | МxО* | |
| 2 | 36.6 | 36.2 | 22.6 | 2.1 | 2.5 |
| 8 | 33.4 | 32.7 | 17.6 | 7.8 | 8.5 |
Из табл. 4 видно, что в присутствии катионов металлов с близкими размерами ионного радиуса, способных конкурировать при сорбции, извлечение катионов цезия и стронция снижается по сравнению с результатами исследований по сорбции из трехкомпонентного раствора (рис. 2, табл. 2). В кислой области хорошо извлекается цезий, в слабощелочной – стронций. При рН 8 происходит незначительная деструкция сорбента в результате гидролиза по уравнению
(3)
${\text{TiOHP}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \Leftrightarrow {\text{TiO}}{{\left( {{\text{OH}}} \right)}_{2}} + {{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}}.$Протоны образованных гидроксильных групп также могут принимать участие в ионообменном процессе при сорбции катионов металлов.
Из табл. 5 видно, что при повышении рН сорбции с 2 до 8 происходит увеличение содержания в твердой фазе более гидратированных катионов металлов. Вероятно, это также связано с отсутствием конкуренции со стороны ионов водорода в растворе и усилением подвижности протонов ионогенных групп сорбента. В результате наблюдается снижение степени селективности матрицы по отношению к менее гидратированным катионам металлов.
Оптимальным значением рН при совместном извлечении Cs+ и Sr2+ из модельного раствора, близкого по химическому составу к морской воде, как и в предыдущих экспериментах, является рН 5 (извлечение составляет ~80%). Проведение последующих двух стадий доочистки обеспечит полное извлечение катионов цезия и стронция из раствора.
Экспериментально полученные результаты свидетельствуют о высокой эффективности применения аморфных фосфатотитановых ионитов при совместном извлечении катионов цезия и стронция из сложных многокомпонентных растворов, в отличие от матриц на основе феррацианидов переходных металлов и на основе диоксида марганца(III, IV), не способных к групповой сорбции указанных катионов металлов.
Использование фосфатотитановых сорбентов, модифицированных цирконием или ниобием, будет способствовать повышению эффективности извлечения катионов высокотоксичных металлов из многокомпонентных систем.
ЗАКЛЮЧЕНИЕ
Таким образом, показана перспективность использования сорбентов на основе оксогидроксофосфатов титана(IV) для извлечения 134, 137Сs и 90Sr из высокосолевых растворов, близких по составу к морской воде. Определены оптимальные условия использования фосфатотитановых матриц (рН 5, Ж : Т = 100, t = 20°С), которые обеспечивают эффективное совместное извлечение радионуклидов цезия и стронция в присутствии высоких концентраций фоновых компонентов. Термическая обработка насыщенного радионуклидами отработанного оксогидроксофосфата титана(IV) обеспечивает надежную иммобилизацию радиоактивного сорбата и безопасность при хранении в течение длительного времени.
Список литературы
Вишняков Ю.М., Малышев С.П., Пчелинцев В.М., Хорошев В.Г. Малогабаритная станция комплексной переработки жидких радиоактивных отходов // Судостроение. 1999. № 3. С. 44–48.
Рябчиков Б.Е. Очистка жидких радиоактивных отходов. М.: ДеЛи принт, 2008. 516 с.
Abdel-Karima A.M., Zaki A.A., Elwana W., El-Naggar M.R., Gouda M.M. Experimental and Modeling Investigations of Cesium and Strontium Adsorption onto Clay of Radioactive Waste Disposal // Appl. Clay Sci. 2016. № 132–133. P. 391–401.https://doi.org/10.1016/j.clay.2016.07.005
Mansy M.S., Hassana R.S., Selim Y.T., Kenawy S.H. Evaluation of Synthetic Aluminum Silicate Modified by Magnesia for the Removal of 137Cs, 60Co and 152 + 154Eu from Low-Level Radioactive Waste // Appl. Radiat. Isot. 2017. № 130. P. 198–205.https://doi.org/10.1016/j.apradiso.2017.09.042
Ярославцев А.Б. Ионный обмен на неорганических сорбентах // Успехи химии. 1997. Т. 66. № 7. С. 641–660.
Локшин Э.П., Иваненко В.И., Удалова И.А., Калинников В.Т. Физико-химическое обоснование использования TiOHPO4 для очистки жидких радиоактивных отходов // Радиохимия. 2003. Т. 45. № 4. С. 357–361.
Милютин В.В., Некрасова Н.А., Козлитин Е.А. Селективные неорганические сорбенты в современной прикладной радиохимии // Тр. Кольского науч. центра. Спецвыпуск отделения “Химия и материаловедение”. 2015. № 5. С. 418–421.
Elghniji K., Saad M.E.K., Araissi M., Elaloui E., Moussaoui Y. Chemical Modification of TiO2 by ${{{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }} \mathord{\left/ {\vphantom {{{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }} {{\text{HPO}}_{4}^{{2 - }}}}} \right. \kern-0em} {{\text{HPO}}_{4}^{{2 - }}}}$ Anions Using the Sol-Gel Route with Controlled Precipitation and Hydrolysis: Enhancing Thermal Stability // Mater. Sci.-Poland. 2014. V. 32. № 4. P. 617–625. https://doi.org/10.2478/s13536-014-0237-6
Ortiz-Oliveros H.B., Flores-Espinosa R.M., Ordonez-Regil E., Fernandez-Valverde S.M. Synthesis of α‑Ti(HPO4)2 · H2O and Sorption of Eu(III) // Chem. Eng. J. 2014. V. 236. P. 398–405. https://doi.org/10.1016/j.cej.2013.09.103
Garcı’a-Glez J., Trobajo C., Khainakov S.A., Amghouz Z. α-Titanium Phosphate Intercalated with Propylamine: an Alternative Pathway for Efficient Europium(III) Uptake into Layered Tetravalent Metal Phosphates // Arabian J. Chem. 2017. № 10. P. 885–894. https://doi.org/10.1016/j.arabjc.2016.07.013
Baig U., Khan Rao R.A., Khan A.A., Sanagi M.M., Gondal M.A. Removal of Carcinogenic Hexavalent Chromium from Aqueous Solutions Using Newly Synthesized and Characterized Polypyrrole – Titanium(IV) Phosphate Nanocomposite // Chem. Eng. J. 2015. V. 280. P. 494–504. https://doi.org/10.1016/j.cej.2015.06.031
Trublet M., Maslova M.V., Rusanova D., Antzutkin O.N. Mild Syntheses and Surface Characterization of Amorphous TiO(OH)(H2PO4) · H2O Ion-Exchanger // Mater. Chem. Phys. 2016. V. 183. P. 467–475.https://doi.org/10.1016/j.matchemphys.2016.09.002
Иваненко В.И., Локшин Э.П., Авсарагов Х.Б., Мельник Н.А., Калинников В.Т. Способ получения сорбента на основе фосфата титана: Патент РФ № 2246985, опубл. 27.02.2005, Бюл. № 6.
Иваненко В.И., Корнейков Р.И., Локшин Э.П. Иммобилизация катионов металлов титанофосфатными сорбентами // Радиохимия. 2016. Т. 58. № 2 С. 140–146.
Хорн Р. Морская химия (структура воды и химия гидросферы). М.: Мир, 1972. 400 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


