Неорганические материалы, 2020, T. 56, № 5, стр. 533-537
Cинтез треххлористого титана
Е. Н. Кузин 1, *, Н. Е. Кручинина 1, П. И. Чернышев 1, Н. С. Визен 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: e.n.kuzin@mail.ru
Поступила в редакцию 14.07.2019
После доработки 15.11.2019
Принята к публикации 18.11.2019
Аннотация
Проведены исследования по получению растворов треххлористого титана в процессе восстановления водных растворов тетрахлорида титана металлическим алюминием. Установлено, что водные растворы тетрахлорида титана имеют более высокую реакционную способность по отношению к металлическому алюминию в сравнении с чистым тетрахлоридом титана. Наибольшей стабильностью обладают растворы, полученные из водных растворов тетрахлорида титана с концентрацией 25–40%. Определено влияние температуры и времени проведения процесса восстановления водных растворов тетрахлорида титана на выход треххлористого титана. Исследована возможность получения водных растворов треххлористого титана при использовании в качестве исходного сырья отходов алюминия (шлак мусоросжигательного завода). В результате экспериментов получены комплексные образцы растворов треххлористого титана, которые могут быть использованы в качестве катализатора или реагента для процессов водоочистки.
ВВЕДЕНИЕ
Полимерные материалы используют в медицине, автомобилестроении, пищевой, строительной и текстильной отраслях промышленности.
В процессе производства полимерных производных винила и олефинов используют катализаторы Циглера-Натта, представляющие собой комплексы, получаемые при взаимодействии переходных металлов (например, TiCl4 и TiCl3) с алкилами металлов (Al и пр.) [1–5]. Помимо этого, треххлористый титан используют в других направлениях органического синтеза [6] для получения наночастиц диоксида титана [7–9]. Кроме того, в последнее время появляется информация о перспективах использования треххлористого титана в процессах очистки сточных вод от растворенных органических веществ [10] и соединений хрома(VI) [11].
Хлорид титана(III) – дорогой и достаточно специфичный реагент, стоимость которого в значительной степени зависит от его чистоты и способа получения. Согласно принятой технологии, треххлористый титан получают восстановлением тетрахлорида титана водородом при температуре 500–800°С по реакции [12]
(1)
$2{\text{TiC}}{{{\text{l}}}_{4}} + {{{\text{H}}}_{2}} \to 2{\text{TiC}}{{{\text{l}}}_{3}} + 2{\text{HCl}}{\kern 1pt} \uparrow .$Для нужд полимерной промышленности треххлористый титан получают восстановлением тетрахлорида титана различными органическими соединениями металлов (например, Al) [13, 14].
В качестве лабораторного способа получения треххлористого титана используют реакцию восстановления жидкого тетрахлорида титана различными металлами: натрием при температуре 270°С, алюминием и магнием при 400°С и титаном при 250°С. Все реакции протекают в жестких условиях при повышенном давлении [12, 15, 16]:
(3)
${\text{TiC}}{{{\text{l}}}_{4}} + {\text{Na}} \to {\text{TiC}}{{{\text{l}}}_{3}} + {\text{NaCl}},$(4)
$3{\text{TiC}}{{{\text{l}}}_{4}} + {\text{Al}} \to 3{\text{TiC}}{{{\text{l}}}_{3}} + {\text{AlC}}{{{\text{l}}}_{3}},$(5)
$2{\text{TiC}}{{{\text{l}}}_{4}} + {\text{Mg}} \to 2{\text{TiC}}{{{\text{l}}}_{3}} + {\text{MgC}}{{{\text{l}}}_{2}}.$В результате ряда предварительных экспериментов было установлено, что химические свойства водных растворов тетрахлорида титана существенно отличаются от свойств концентрированного TiCl4. Так, в процессе предварительного изучения была выявлена возможность получения растворов треххлористого титана при взаимодействии металлического алюминия или магния с водными растворами тетрахлорида титана (1–15 мас. % по Ti).
В результате предварительных экспериментов [17] было подтверждено, что водные растворы хлорида титана(IV) не восстанавливаются газообразным водородом в мягких условиях [15, 16].
Основной задачей данной работы являлось изучение процесса получения треххлористого титана из водных растворов тетрахлорида титана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Установлено, что скорость реакции восстановления водных растворов тетрахлорида титана алюминием или магнием сильно зависит от их дисперсности. Так, например, пудра и порошок алюминия или магния реагировали настолько интенсивно, что происходило выплескивание реакционной смеси из реактора (вскипание реакционной смеси, выделение газообразного водорода). Окончательным решением стало использование металлического алюминия в форме гранул (более дешевый и распространенный металл по сравнению с магнием).
Алюминиевые гранулы (квалификация “ос. ч.”) обрабатывались водными растворами тетрахлорида титана (“х. ч.”, производство г. Пермь). Водные растворы тетрахлорида титана получали медленным растворением концентрированного TiCl4 в подкисленной воде (рН ~ 1.0) в реакторе с рубашкой охлаждения.
Суммарное содержание металлов определяли на атомно-эмиссионном спектрометре с магнитной плазмой (СВЧ) “СпектроСкай”.
Оценку степени превращения TiCl4 в TiCl3 проводили путем титрования полученного раствора треххлористого титана бихроматом калия с последующим измерением остаточной концентрации ионов Cr6+ (спектрофотометрическое определение с дифенилкарбазидом на приборе DR 2800 HACH USA):
(6)
$\begin{gathered} {{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}} + 6{\text{TiC}}{{{\text{l}}}_{3}} + 14{\text{HCl}} \to \\ \to \,\,2{\text{CrC}}{{{\text{l}}}_{3}} + 6{\text{TiC}}{{{\text{l}}}_{4}} + 2{\text{KCl}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Содеожание треххлористого титана в образцах сравнивали с затратами химически чистого треххлористого титана, для аналогичного титра бихромата калия. Данный метод позволяет с высокой точностью определять содержание треххлористого титана в пробе за счет близких значений потенциалов Ti3+/Cr6+ [12].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
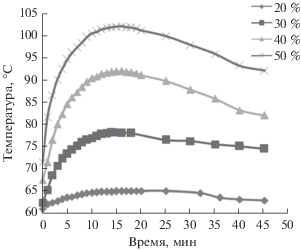
На первом этапе было изучено влияние температуры на скорость растворения гранул алюминия (избыток) в 40%-ном водном растворе тетрахлорида титана. Данные о кинетике восстановления тетрахлорида титана металлическим алюминием в зависимости от температуры реакции приведены на рис. 1.
Рис. 1.
Влияние температуры на скорость восстановления TiCl4 в 40%-ном водном растворе металлическим алюминием.
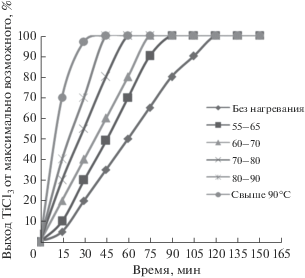
Видно, что восстановление водного раствора тетрахлорида титана металлическим алюминием начинается даже при отсутствии нагревания, однако скорость процесса невелика. При повышении температуры реакционной смеси скорость восстановления значительно возрастает.
При температуре свыше 105°С происходит изменение цвета реакционной смеси с черно-фиолетового на белый. Данный процесс обусловлен протеканием реакции гидролитического разложения треххлористого титана с последующим быстрым окислением Ti(OH)3 кислородом воздуха при контакте раствора со средой до орто- и метатитановой кислот [3]:
(7)
${\text{TiC}}{{{\text{l}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{Ti}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}}{\kern 1pt} \downarrow + {\text{ }}3{\text{HCl}}{\kern 1pt} \uparrow ,$(8)
$2{\text{Ti}}{{\left( {{\text{OH}}} \right)}_{3}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 2{{{\text{H}}}_{{\text{4}}}}{\text{Ti}}{{{\text{O}}}_{4}}{\kern 1pt} \downarrow + {\text{ }}{{{\text{H}}}_{2}}{\kern 1pt} \uparrow ,$(9)
$2{\text{Ti}}{{\left( {{\text{OH}}} \right)}_{3}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{О}}}_{2}} \to 2{{{\text{H}}}_{{\text{2}}}}{\text{Ti}}{{{\text{O}}}_{{\text{3}}}}{\kern 1pt} \downarrow + {\text{ }}{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Процесс восстановления тетрахлорида титана алюминием экзотермичен и смесь самопроизвольно разогревается в процессе реакции. Данные по изменению температуры в процессе синтеза при использовании растворов TiCl4 различной концентрации приведены на рис. 2.
Саморазогрев реакционной смеси идет на убыль, когда прореагировало приблизительно 75% Al (по реакции (4)), температура смеси и скорость реакции снижаются. При снижении температуры на 20–25% от максимально достигнутой становится заметным вклад реакции образования хлорида алюминия
(10)
$6{\text{HCl}} + 2{\text{Al}} \to 2{\text{AlC}}{{{\text{l}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} \uparrow .$При этом начинается процесс гидролитического разложения исходного TiCl4 и полученного TiCl3 по реакциям (7) и (11), что подтверждается данными химического анализа на содержание Ti3+:
(11)
${\text{TiC}}{{{\text{l}}}_{{\text{4}}}} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 4{\text{HCl}}{\kern 1pt} \uparrow + {\text{ Ti}}{{\left( {{\text{OH}}} \right)}_{4}}{\kern 1pt} \downarrow .$Протекающие реакции разложения треххлористого титана обусловлены действием температуры и возрастанием рН среды в результате нейтрализации гидролизной соляной кислоты металлическим алюминием с образованием AlCl3 и других хлорсодержащих комплексов алюминия (Al(OH)2Cl–Al(OH)Cl2–Al2(OH)5Cl) [18].
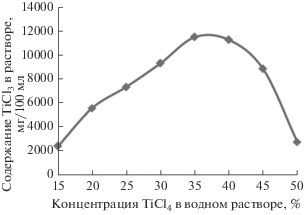
В ходе экспериментов установлено, что степень восстановления тетрахлорида титана зависит от концентрации исходного раствора. Данные по содержанию TiCl3 в полученных растворах представлены на рис. 3.
Видно, что процесс восстановления протекает в широком диапазоне концентраций исходного раствора TiCl4, что свидетельствует о наличии в растворах негидролизированных форм TiCl4. Данные рис. 3 свидетельствуют о том, что наиболее активно реакция восстановления протекает в растворах TiCl4 с концентрацией от 25 до 40%, а полученные растворы обладают наибольшей стабильностью и не разлагаются (гидролизуются/окисляются) в течение месяца. Растворы с концентрацией свыше 40% загустевали и приобретали белый оттенок (признак разложения), а в растворах с концентрацией ниже 25% частичный гидролиз соединений Ti (реакции (7), (8)) наблюдался уже в начале синтеза.
Заключительным этапом исследования являлась оценка возможности использования дешевого техногенного сырья в виде отходов (шлаков) мусоросжигательного завода, прошедших стадию промывки и предварительной сепарации магнитных металлов.
Шлак представляет собой гранулы размером от 3 до 30 мм (рис. 4) с насыпной плотностью около 3.1 г/см3.
Был определен химический состав отходов: алюминий – 96%, медь – 1%, прочие примеси (сталь, стекло, зола) – 3%. Цена на данный шлак в среднем в 3–4 раза ниже, чем на лом или отходы алюминия, что делает его недорогим сырьем для исследуемого процесса. Химический состав растворов (в пересчете на соли), полученных при взаимодействии шлака мусоросжигательного завода и 40%-ного водного раствора TiCl4, приведен в табл. 1.
Таблица 1.
Содержание основных компонентов в растворе
| Компонент | TiCl3 | AlCl3 | CuCl2 | FeCl2 |
|---|---|---|---|---|
| Содержание, % | 28.1 | 9.2 | 0.5 | 0.35 |
Реакция восстановления протекала значительно более интенсивно по сравнению с алюминиевыми гранулами за счет большей площади контакта рыхлых гранул шлака.
Полученный TiCl3, вероятно, не пригоден для аналитических целей. Возможность использования данного продукта в процессах производства полимеров должна оцениваться по результатам предварительных экспериментов. Однако, несмотря на наличие примесей, в процессе очистки сточных вод от растворенных органических соединений [10] и ионов хрома(VI) [11] полученный раствор может стать недорогой и эффективной альтернативой традиционным реагентам (FeSO4 и пр.), а наличие в составе соединений алюминия существенно повышает коагуляционную активность реагента.
ЗАКЛЮЧЕНИЕ
Изучены закономерности процесса восстановления тетрахлорида титана алюминием в водных растворах. Установлено, что в водных растворах хлорида титана(IV) присутствуют негидролизованные формы, способные к реакциям восстановления. Отмечено, что ключевыми параметрами процесса являются температура и концентрация водного раствора тетрахлорида титана. Максимальной стабильностью обладают растворы, полученные из водных растворов тетрахлорида титана с концентрацией 25–40%. При нарушении условий возможно разложение продукта уже на стадии синтеза в результате реакций гидролиза и окисления.
Изучены условия проведения процесса восстановления, обеспечивающего получение раствора TiCl3 – ценного катализатора производства полимеров и перспективного реагента для процессов очистки сточных вод от соединений хрома(VI). В процессе восстановления растворов тетрахлорида титана металлическим алюминием происходит образование комплексного реагента, сочетающего в себе коагуляционные (соединения алюминия и титана) и восстановительные свойства (треххлористый титан). Синергетический эффект от действия комплексных алюминий-титановых реагентов был подтвержден лабораторными испытаниями на сточных водах различного состава [19–22], что значительно расширяет сферу применения треххлористого титана, полученного по исследованной технологии. Получены данные, доказывающие возможность использования отходов мусоросжигания в производстве реагента для водоочистки.
Работа выполнена в рамках программы поддержки молодых ученых-преподавателей РХТУ им. Д.И. Менделеева. (Заявка З-2020-013.)
Список литературы
Химическая энциклопедия / Под ред. Кнунянц И.Л. Т. 4. М.: Сов. энциклопедия, 1995. 639 с.
Kamnul Hasan A.T.M., Fang Y., Liu B., Terano M. Surface Analytical Approach to TiCl3-Based Ziegler–Natta Catalysts Combined with Microstructure Analysis of Polymer // Polymer. 2010. V. 51. № 16. P. 3627–3635. https://doi.org/10.1016/j.polymer.2010.05.053
Costa M.A.S., Silva A.L.S.S., Coutinho F.M.B., de Santa Maria L.C., Pereira R.A. Highly Active and Stereospecific Catalyst Based on β-TiCl3 for Propylene Polymerization // Polymer. 1996. № 37. P. 869–873. https://doi.org/10.1016/0032-3861(96)87267-3
Xie K., Xu J., Liu P. Effect of Ligands in TiCl3 (OAr) Catalysts for Ethylene Polymerization: Computational and Experimental Studies // Appl. Surf. Sci. 2018. № 461. P. 175–181. https://doi.org/10.1016/j.apsusc.2018.04.258
Xia S., Fu Z., Huang B., Xu J., Fan Z. Ethylene/1-hexene Copolymerization with MgCl2-Supported Ziegler–Natta Catalysts Containing Aryloxy Ligands. Part I: Catalysts Prepared by Immobilizing TiCl3(OAr) onto MgCl2 in Batch Reaction // J. Mol. Catal. A: Chem. 2012. № 355. P. 161–167. https://doi.org/10.1016/j.molcata.2011.12.010
Ranjan Chakraborty R., Ghosh P. TiCl3 Catalyzed One-pot Protocol for the Conversion of Aldehydes into 5‑substituted 1H-tetrazole // Tetrahedron Lett. 2018. V. 59. № 40. P. 3616–3619. https://doi.org/10.1016/j.tetlet.2018.08.050
Leal J.H., Cantu Y., Gonzalez D.F., Parsons J.G. Brookite and Anatase Nanomaterial Polymorphs of TiO2 Synthesized from TiCl3 // Inorg. Chem. Commun. 2017. V. 84. P. 28–32. https://doi.org/10.1016/j.inoche.2017.07.014
Xue B., Sun T., Mao F., Sun L.-C., Yang W., Xu Z.-D., Zhang X. Facile Synthesis of Mesoporous Core-Shell TiO2 Nanostructures from TiCl3 // Mater. Res. Bull. 2013. V. 46. № 9. P. 1524–1529. https://doi.org/10.1016/j.materresbull.2011.05.019
Cassaignon S., Koelsch M., Jolivet J.-P. From TiCl3 to TiO2 Nanoparticles (Anatase, Brookite and Rutile): Thermohydrolysis and Oxidation in Aqueous Medium // J. Phys. Chem. Solids. 2007. V. 68. № 5–6. P. 695–700. https://doi.org/10.1016/j.jpcs.2007.02.020
Hussain S., Awad J., Sarkar B., Chow Christopher W.K., Duan J., Leeuwen J. Coagulation of Dissolved Organic Matter in Surface Water by Novel Titanium(III) Chloride: Mechanistic Surface Chemical and Spectroscopic Characterization // Sep. Purif. Technol. 2019. V. 213. P. 213–223.
Kuzin E.N., Chernyshev P.I., Vizen N.S., Krutchinina N.E. The Purification of the Galvanic Industry Wastewater of Chromium(VI) Compounds Using Titanium(III) Chloride // Russ. J. Gen. Chem. 2018. V. 88. № 13. P. 2954–2957.
Лучинский Г.П. Химия титана. М.: Химия, 1971. 471 с.
Coutinho F.M.B., Costa T.H.S., Santa Maria L.C., Pereira R. Influence of the Method of Synthesis on the Properties of TiCl3 // Eur. Polym. J. 1992. V. 28. № 6. P. 695–698. https://doi.org/10.1016/0014-3057(92)90045-4
Auriemma F., Busico V., Corradini P., Trifuoggi M. A Reinvestigation of β-TiCl3–I. Preparation and Structural Characterization // Eur. Polym. J. 1992. V. 28. № 5. P. 513–518. https://doi.org/10.1016/0014-3057(92)90126-m
Горощенко Я.Г. Химия титана. Киев: Наук. думка, 1970. 415 с.
Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. М.: Химия, 2000. 480 с
Кузин Е.Н., Кручинина Н.Е. Исследование процесса гидролиза и химической активности водных растворов TiCl4 // Неорган. материалы. 2019. Т. 55. № 8. С. 885–889.
Драгинский В.Л., Алексеева Л.П., Гетманцев С.В. Коагуляция в технологии очистки природных вод. М.: Научное издание, 2005. 576 с.
Кузин Е.Н., Кручинина Н.Е. Получение комплексных коагулянтов на основе минеральных концентратов и их использование в процессах очистки воды // Обогащение руд. 2019. № 3. С. 43–48.
Shon H.K., Vigneswaran S., Kim I.S., Cho J., Kim G.J., Kim J.B., Kim J.-H. Preparation of Titanium Dioxide (TiO2) from Sludge Produced by Titanium Tetrachloride (TiCl4) Flocculation of Wastewater // Environ. Sci. Technol. 2007. V. 41. № 4. P. 1372–1377. https://doi.org/10.1021/es062062g
Shon H.K., Vigneswaran S., Kandasamy J., Zareie M.H., Kim J.B., Cho D.L., Kim J.-H. Preparation and Characterization of Titanium Dioxide (TiO2) from Sludge Produced by TiCl4 Flocculation with FeCl3, Al2(SO4)3 and Ca(OH)2 Coagulant Aids in Wastewater // Sep. Sci. Technol. 2009. V. 44. № 7. P. 1525–1543. https://doi.org/10.1080/01496390902775810
Zhao Y.X., Gao B.Y., Shon H.K., Cao B.C., Kim J.-H. Coagulation Characteristics of Titanium (Ti) Salt Coagulant Compared with Aluminum (Al) and Iron (Fe) Salts // J. Hazard. Mater. 2011. V. 185. № 2–3. P. 1536–1542. https://doi.org/10.1016/j.jhazmat.2010.10.084
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы