Неорганические материалы, 2020, T. 56, № 5, стр. 498-506
Влияние условий синтеза на фазовый состав и структуру микросфер на основе никеля, полученных экзотермическим синтезом из глицин-нитратного раствора
К. Б. Подболотов 1, 3, 4, *, А. А. Хорт 2, 3, 5, Н. Ю. Мельник 1, А. А. Шегидевич 4
1 Физико-технический институт Национальной академии наук Беларуси
220141 Минск, ул. Купревича, 10, Беларусь
2 Институт тепло- и массообмена Национальной академии наук Беларуси
220072 Минск, ул. П. Бровки, 15, Беларусь
3 Национальный исследовательский технологический университет Московский институт стали и сплавов
119049 Москва, Ленинский пр., 4, Россия
4 Белорусская государственная академия авиации
220096 Минск, ул. Уборевича, 77, Беларусь
5 KTH Royal Institute of Technology
Stockholm, Brinellvägen, 8, Sweden
* E-mail: k.podbolotov@yahoo.com
Поступила в редакцию 26.06.2019
После доработки 18.09.2019
Принята к публикации 19.10.2019
Аннотация
Представлены сведения по влиянию состава и температуры нагрева на фазовый состав и структуру микросфер на основе никеля, полученных при использовании метода совмещения процессов экзотермического синтеза и пиролиза аэрозолей из глицин-нитратного раствора. Показано, что при оптимальных соотношении восстановителя и окислителя и температуре фазовый состав представлен Ni, Ni3N, NiO с количественным содержанием никеля до 98%. Структура получаемого материала представлена микросферами со средним диаметром 0.5–1.5 мкм с размерами кристаллитов 10–15 нм.
ВВЕДЕНИЕ
Создание новых материалов, характеризующихся нанокристаллической структурой, является одной из важных задач современного материаловедения. Преимущество использования наноматериалов объясняется проявлением у них уникальных свойств, связанных с тем, что половина, или даже больше атомов отдельной частицы находятся у ее поверхности, что обуславливает высокую реакционную и каталитическую способность [1–4].
Получение наноматериалов традиционными методами сталкивается с большими трудностями: длительностью подготовительных или основных операций, зачастую невозможностью использовать универсальные методики для синтеза, рекристаллизационными процессами при высокотемпературном синтезе и агрегацией частиц при измельчении. В последнее время активно развивается перспективное направление получения наноматериалов различных функциональных классов (керамики, металлов и металлокерамических композитов) с применением метода горения растворов [5–14].
Большой научный интерес представляет изучение процессов горения растворов в изолированных микрореакторах (микрокаплях в газовой фазе) и разработка эффективных методов синтеза материалов в виде полых микросфер, которые могут найти применение для экранирования электромагнитного излучения, катализа, в качестве добавок для модификации и формирования специальных свойств керамики, для аддитивных технологий и др. [6–8]. Отмечается рост исследований в области получения наноматериалов на основе металлов для создания ферромагнитных жидкостей, элементов памяти, для применения в биомедицине, катализе [9–14]. Получение нанокристаллических металлов представляет собой сложную материаловедческую задачу, поскольку они обладают весьма высокой химической активностью и легко окисляются при повышенных и даже нормальных температурах.
Получение методом горения растворов наноструктурированного порошка никеля и сплавов на его основе в различных условиях описаны в многочисленных работах [9–16], большинство из них посвящены получению пеноподобного высокопористого материала с неопределенной морфологией частиц.
Создание материалов с заданными формой и размерами частиц, имеющих нанокристаллическое строение, представляется важным направлением материаловедения. Использование метода пиролиза аэрозолей позволяет получать сферические частицы с относительно узким распределением по размерам, которого трудно достичь с помощью традиционных подходов самораспространяющегося высокотемпературного синтеза или горения растворов. Получение сферических частиц Ni/NiO данным методом описано в работах [17–22]. При этом в качестве восстанавливающего агента в [19, 20, 22] использован водород; в [17, 18, 21] исследуется влияние восстановителей (этанола, сахара, мочевины) и условий синтеза на морфологию и фазовый состав получаемого материала.
Авторами [23] описана методика синтеза полых сферических частиц порошков никеля и меди, а также их оксидов, основанная на совмещении методов пиролиза и горения растворов. При этом используется глицин–нитратная система при фиксированном соотношении восстановителя и окислителя, а также варьировании температуры печи в пределах 500–750°С. Показана применимость метода для получения полых микросфер на основе металлов (Ni, Cu и др.).
Целью настоящей работы является исследование концентрационных и термохимических условий для протекания процесса восстановления и формирования структуры нанокристаллических микросфер на основе никеля при использовании совмещенного метода синтеза горением растворов и пиролиза аэрозолей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
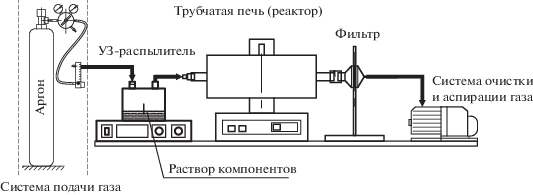
Схема установки, применяемой для реализации синтеза, приведена на рис. 1. Установка включает УЗ-генератор аэрозоля, систему подачи и фильтрации газа и трубчатую печь.
Для предотвращения окисления металлов при их получении в качестве газа-носителя аэрозоля и продувочного газа использовался аргон марки 4.8 (99.998%).
В качестве исходных компонентов применялись нитрат никеля (Ni(NO3)2 · 6H2O, 98.5%), а также аминоуксусная кислота (глицин, C2H5NO2, 98.5%).
Процесс синтеза при использовании глицина в общем случае можно описать следующим уравнением реакции:
(1)
$\begin{gathered} {\text{Ni}}{{\left( {N{{O}_{3}}} \right)}_{2}} + \left( {\frac{4}{3}\varphi } \right){{C}_{2}}{{H}_{5}}N{{O}_{2}} + 3\left( {\varphi - 1} \right){{O}_{2}} = \\ = \,\,{\text{Ni}} + \left( {\frac{8}{3}\varphi } \right)C{{O}_{2}} + \left( {\frac{{2\varphi + 3}}{3}} \right){{N}_{2}} + \left( {\frac{{10}}{3}\varphi } \right){{H}_{2}}O, \\ \end{gathered} $Соотношение восстановителя и окислителя влияет на процесс взаимодействия, так при φ = 1 предполагается стехиометрическое протекание реакции, при φ > 1 процесс идет с участием кислорода воздуха, а при его недостатке – с образованием углерода, монооксида углерода и других продуктов неполного окисления органических соединений. В реальных условиях стехиометрическое протекание реакции маловероятно; кроме того, присутствует кислород воздуха (адсорбированный, примесный и др.), поэтому часто принимают φ > 1.
Для реализации синтеза материалов на основе никеля экзотермическим методом с использованием аэрозоля готовили раствор, включающий нитрат никеля – окислитель и органическую составляющую (глицин) – восстановитель при отношении восстановителя к окислителю φ от 1.25 до 2.00. Содержание компонентов для приготовления раствора рассчитывалось исходя из условия получения 2.5 г металла и выбранного φ, в качестве растворителя использовалась деионизированная вода в количестве 100 мл. Приготовление раствора осуществлялось растворением в воде компонентов при температуре 20–25°С и постоянном перемешивании с помощью верхнеприводной мешалки (1000 об./мин) с последующей выдержкой раствора в течение 1 ч. Полученный раствор распылялся в камере УЗ-распылителя (АЛЬБЕДО ИН-7) в атмосфере аргона с расходом газа 2 л/мин. В качестве реактора использовалась трубчатая печь с длиной зоны нагрева 300 мм при диаметре кварцевой трубки реактора 25 мм. Температура в реакторе варьировалась от 600 до 1000°С. Фильтрация осуществлялась при помощи аспирации на фильтре Шотта с дополнительным стекловолоконным фильтром CHM GF1.
Порошок материала, осевшего на фильтре, исследовали методами рентгенофазового и полнопрофильного анализов, энергодисперсионного анализа, сканирующей электронной микроскопии.
Запись дифрактограмм проводилась на установке ДРОН-3 с ионизационной регистрацией рентгеновских лучей в диапазоне углов 2θ = 10°–100° с шагом 0.1° и накоплением импульсов в течение 2 с. Для идентификации кристаллических фаз использовали базу данных PDF-2004. Расчет областей когерентного рассеяния (ОКР), микронапряжений и обработка данных проводились при помощи пакета программ HighScore Plus 3.0.
Микроструктуру изучали с использованием сканирующего электронного микроскопа высокого разрешения TESCAN MIRA3 с рентгеноспектральным микроанализатором EDX X-Max.
Для термодинамического анализа процессов экзотермического синтеза в адиабатическом режиме использовалась универсальная программа АСТРА-4 (МГТУ им. Баумана), а также ИСМАН-ТЕРМО (ИСМАН РАН, г. Черноголовка). В данных программах реализован поиск равновесного состава гетерофазной многокомпонентной системы, который осуществляется путем нахождения локального экстремума энтропии при наличии ограничений (условие сохранения массы каждого элемента и полной внутренней энергии системы) при заданном исходном составе и термодинамическом режиме (изобарно-изотермическом, изохорно-изотермическом, адиабатическом и др.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Термодинамический анализ проводился в системе нитрат никеля–глицин без учета влияния воды при различном отношении восстановителя к окислителю, что позволяет определить максимальную температуру горения в адиабатических условиях и предполагаемый состав продуктов синтеза. Результаты расчета приведены в табл. 1.
Таблица 1.
Результаты расчета термодинамических параметров взаимодействия
| Отношение восстановителя к окислителю | Адиабатическая температура, °С | Объем газообразных продуктов при н.у., л | Состав продуктов синтеза | ||||||
|---|---|---|---|---|---|---|---|---|---|
| CO | CO2 | H2O | N2 | NH3 | Ni | C | |||
| атм | мас. доли | ||||||||
| 1.25 | 1426.0 | 52.2 | 0.162 | 0.194 | 0.444 | 0.195 | – | 0.190 | – |
| 1.50 | 1040.3 | 57.9 | 0.270 | 0.092 | 0.453 | 0.181 | – | 0.176 | – |
| 2.00 | 737.0 | 62.5 | 0.282 | 0.038 | 0.499 | 0.175 | 0.003 | 0.153 | 0.034 |
По данным расчета адиабатическая температура горения составляет 737–1426°С и при увеличении содержания восстановителя снижается из-за возрастания количества восстановителя, не вступающего в экзотермическое взаимодействие, и, соответственно, повышения затрат теплоты на его разложение.
Расчет показывает, что восстановление никеля возможно в полном объеме, в составе газообразных компонентов присутствуют в основном оксиды углерода (CO, CO2), вода и азот, а при φ = 2 образуется аммиак. Твердая фаза представлена никелем и углеродом (при φ = 2). Следует отметить, что в реальных условиях реакционное взаимодействие происходит в условиях обмена энергией и веществом с окружающей средой. При этом температурные параметры процесса и продукты взаимодействия могут отличаться от расчетных.
Механизм структурно-фазовых превращений в системе глицин–Ni(NO3)2 можно представить следующим образом: при нагревании смеси в системе происходит разложение нитрата никеля (≈300°С) и глицина (≈280°С, с плавлением), при этом образуются газообразные продукты – оксиды азота, монооксид углерода, аммиак, вода и летучие органические соединения, в твердой фазе остаются оксид никеля, углерод и конденсированные органические соединения. За счет разложения расплава глицина с интенсивным выделением большого числа газообразных продуктов, происходящего в процессе нагрева, смесь твердых компонентов вспучивается, образуя пористую пенообразную структуру. Загорание смеси происходит при воспламенении газовой фазы и далее переходит в режим горения за счет увеличения температуры ввиду сильноэкзотермической реакции окисления–восстановления между монооксидом углерода, органической составляющей, аммиаком и оксидами азота. В процессе горения в системе при отношении восстановителя к окислителю больше стехиометрического создается восстановительная атмосфера из монооксида углерода и органических соединений. За счет этого происходит восстановление образующегося в твердой фазе оксида никеля до металла. Поскольку температура процесса ниже температур плавления никеля и его оксида, а также за счет интенсивного газовыделения рекристаллизационные процессы практически не происходят и размеры образующихся кристаллитов весьма малы (порядка нескольких нм).
Материалы получали при отношении восстановителя к окислителю (φ) от 1.25 до 2.00, температура в реакторе составляла 700°С.
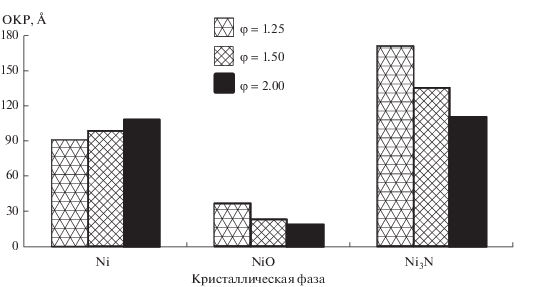
Результаты анализа рентгеновских дифрактограмм полученных материалов представлены на рис. 2. Из приведенных данных рентгенофазового и структурного анализа следует, что при увеличении φ от 1.25 до 2.00 доля металлической фазы никеля увеличивается от 23 до 85%, что говорит о протекании более полного взаимодействия в системе. Также фиксируется образование нитрида никеля с максимумом при φ = 1.50, что, видимо, связано с разложением органического восстановителя с образованием аммиака и/или атомарного азота с последующим их взаимодействием с восстановленным металлом. При увеличении φ, видимо, происходит повышение температуры взаимодействия ввиду большей концентрации восстановительного агента (органических составляющих и продуктов их термической деструкции) в системе, что способствует разложению нитрида и снижению его количества. При повышении температуры взаимодействия может происходить рост кристаллических зерен материала, определение ОКР (рис. 3) позволяет ориентировочно судить о размерах кристаллитов.
Рис. 2.
Данные рентгенофазового и профильного анализов синтезированного порошка никеля при различных φ.
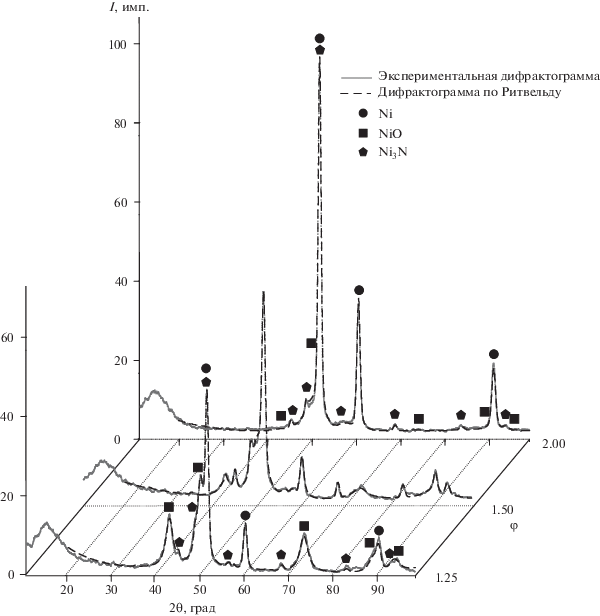
По данным расчета, ОКР частиц Ni в синтезированных материалах имеют размеры порядка 90–120 Å. При этом наблюдается слабая тенденция к увеличению ОКР Ni при повышении φ, что косвенно подтверждает предположение об увеличении температуры процесса и времени нахождения частиц Ni при этой температуре. Размер ОКР для оксида никеля при повышении φ снижается, что может быть связано с уменьшением времени существования частиц оксида от момента их образования до восстановления. При увеличении φ время нахождения частиц образующегося оксида никеля в зоне реакции уменьшается ввиду возросшего количества восстановителя и происходит образование металла, при этом температура процесса увеличивается. Рост кристаллитов определяется, в частности, временем их нахождения в зоне высокой температуры, которая в свою очередь определяется интенсивностью тепловыделения реакции. Таким образом, увеличение размера кристаллитов металла при снижении размера кристаллитов оксида определяется изменением температуры процесса синтеза.
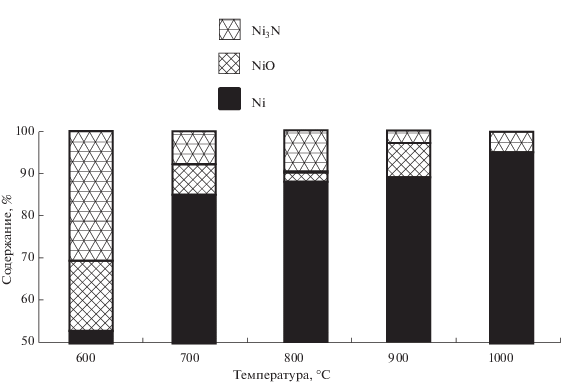
На температуру и интенсивность протекания экзотермического синтеза влияет подведение энергии извне. При этом в общем случае при повышении температуры подогрева скорость и температура горения возрастают. Таким образом, варьируя температуру в реакторе, можно управлять составом и структурой продуктов синтеза. Исследование влияния температуры на фазовый состав проводилось для смесей при φ = 2.00 и температуре реактора 600–1000°С. Данные рентгенофазового и профильного анализов (рис. 4) показывают, что при увеличении температуры в реакторе происходит усиление интенсивности дифракционных максимумов никеля, что говорит об образовании более крупнокристаллической и малодефектной структуры. Расчетные значения микронапряжений для фазы никеля при увеличении температуры от 600 до 1000°С показывают снижение показателя в % от модуля упругости в 7.5–10 раз. Расчет ОКР показывает, что при увеличении температуры происходит укрупнение кристаллитов никеля в материале от 2.0 до 15.0 нм (табл. 2). Следует отметить, что при содержании фазы менее 10% точное определение ОКР затруднено, поэтому результаты носят оценочный характер.
Рис. 4.
Данные рентгенофазового и профильного анализов материалов, полученных при различных температурах реактора.
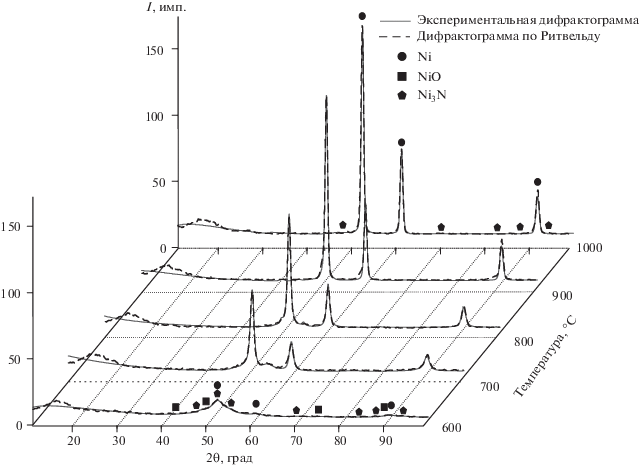
Таблица 2.
Результаты расчета микронапряжений и ОКР синтезированного материала в зависимости от температуры в реакторе
| Температура, °С | Микронапряжения, % | ОКР, Å | ||
|---|---|---|---|---|
| Ni | Ni | NiO | Ni3N | |
| 600 | 4.50–5.10 | 19–20 | 14–60 | 16–17 |
| 700 | 1.10–1.20 | 105–110 | 15–18 | 100–120 |
| 800 | 0.80–1.00 | 105–110 | н/о | 80–100 |
| 900 | 0.65–0.70 | 130–140 | 50–60 | 130–160 |
| 1000 | 0.50–0.60 | 140–150 | – | 25–30 |
Кроме того, повышение температуры обеспечивает более активное протекание процесса восстановления и количество примесных фаз оксида и нитрида никеля снижается (рис. 5). Минимальное количество примесных фаз наблюдается при температурах 800–1000°С, фаза оксида никеля при 1000°С полностью отсутствует. При 600°С в материале присутствует значительное количество оксида и нитрида никеля, что связано с неполнотой протекания процесса восстановления никеля из оксида. При этом, поскольку, вероятнее всего, процесс восстановления протекает за счет не только CO, но и NH3, на начальной стадии взаимодействия образуется стабильный при низких температурах нитрид никеля. Нитрид никеля при дальнейшем повышении температуры (выше 400°С) разлагается с образованием металла и выделением аммиака. Однако, поскольку теплоты реакции недостаточно для полного протекания синтеза и имеются большие потери теплоты на нагрев, испарение влаги, газовыделение и т.д., без подвода энергии извне реакционное взаимодействие затухает. Температура в реакторе 600°С не позволяет в полной мере компенсировать потери тепла, и реакция замедляется. Поэтому в материале фиксируется повышенное содержание оксида и нитрида никеля. При повышении температуры в реакторе степень восстановления оксида и разложения нитрида никеля значительно увеличивается, что отражается в увеличении содержания никеля в продуктах реакции более чем на 20%.
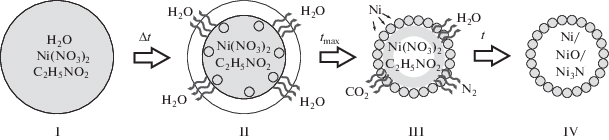
Формирование структур в виде полых микросфер при совмещении методов пиролиза аэрозоля и экзотермического синтеза можно представить схемой, показанной на рис. 6 [23]. При помещении частицы аэрозоля (стадия I) в тепловое поле с температурой, значительно превышающей температуру кипения растворителя, происходит быстрая потеря влаги с поверхности частицы (стадия II). При этом растворенные вещества формируют твердую оболочку, в которой при дальнейшем разогреве идут экзотермические химические процессы (стадия III) с формированием конечного продукта (стадия IV). Следует отметить, что стабилизация и формирование микросфер в процессе синтеза обеспечиваются высокой проницаемой пористостью оболочки для выхода образующихся газообразных веществ.
Исследование структуры полученных порошков (рис. 7) свидетельствует о формировании микросферических частиц полифракционного состава диаметром 0.5–5 мкм с преобладанием фракции 0.5–1.5 мкм.
Рис. 7.
Структура материала на основе никеля, полученного при температуре в реакторе 600 (а), 700 (б), 800 (в), 900 (г), 1000°С (д).

Проведенный элементный анализ показал, что содержание никеля в частицах, полученных при температурах 800–1000°С, составляет более 98%.
Можно отметить, что при температуре в реакторе 600°С формируются более мелкие сферические частицы, что объясняется неполнотой протекания процесса. При этом происходит удаление воды и сжатие капель аэрозоля с формированием пластичной при повышенных температурах оболочки меньшего диаметра из органо-солевой композиции. Частично протекают процессы экзотермического синтеза металла с выделением газообразных продуктов, однако температура 600°С недостаточна для поддержания процесса и реакции тормозятся тепловыми потерями. При охлаждении оболочка частиц затвердевает и формируются сферические частицы малого диаметра. При увеличении температуры в реакторе синтез протекает практически полностью с выделением большого количества газообразных продуктов, оболочка частиц, которая находится в пластическом состоянии, увеличивается до определенного предела и утончается. В оболочке формируются канальные поры, которые обеспечивают выравнивание давления внутри и снаружи, что предотвращает ее разрушение. При повышении температуры в реакторе более 700°С принципиальных отличий в формирующихся микросферических частицах и их размерах практически не наблюдается.
ЗАКЛЮЧЕНИЕ
Показана возможность получения материала, содержащего микросферы никеля с преобладающим диаметром 0.5–1.5 мкм, при совмещении процессов горения растворов и пиролиза аэрозолей. Размер образующихся кристаллитов (ОКР) никеля составляет 9–15 нм. Установлена зависимость фазового состава и размеров кристаллитов получаемого материала от соотношения восстановителя и окислителя, а также температуры в реакторе: при повышении содержания восстановителя количество образующегося никеля увеличивается, температура оказывает влияние на полноту протекания синтеза.
Повышение температуры в реакторе компенсирует тепловые потери и увеличивает степень выхода металла (возможно содержание никеля более 95%), кроме того, способствует снятию микронапряжений, однако при этом увеличивается размер кристаллитов. Оптимальными условиями синтеза для получения микросфер никеля с минимальными размерами кристаллитов являются отношение восстановителя к окислителю, равное 2.0, и температура в реакторе около 800°С.
Список литературы
Guozhong Cao, Ying Wang. Nanostructures and Nanomaterials: Synthesis, Properties & Applications. Imperial College Press, 2010. 448 p.
Masuo Hosokawa, Kiyoshi Nogi, Makio Naito, Toyokazu Yokoyama. Nanoparticle Technology Handbook. Elsevier Science, 2007. 644 p.
Беляков А.В. Методы получения неорганических неметаллических наночастиц. М.: РХТУ, 2003. 80 с.
Granqvist C.G., Buhrman R.A. Ultrafine Metal Particles // J. Appl. Phys. 1976. V. 47. № 5. P. 2200.
Рогачев А.С., Мукасьян А.С. Горение для синтеза материалов: введение в структурную макрокинетику. М.: Физматлит, 2013. 400 с.
Patil K.C. Chemistry of Nanocrystalline Oxide Materials: Combustion Synthesis, Properties and Applications. Singapore: World Scientific, 2008. 345 p.
Aruna S.T. Combustion Synthesis and Nanomaterials // Curr. Opinion Solid State Mater. Sci. 2008. № 12. P. 44–50.
Khort A.A., Podbolotov K.B. Preparation of BaTiO3 Nanopowders by the Solution Combustion Method // Ceram. Int. 2016. V. 42. № 14. P. 15343–15348.
Подболотов К.Б., Волочко А.Т., Хорт А.А. Получение нанопорошков металлов и композитов в режиме горения растворов // Перспективные материалы и технологии: монография. 2017. Т. 2. С. 171–189.
Cross A. Highly Active and Stable Ni-Cu Supported Catalysts Prepared by Combustion Synthesis for Hydrogen Production from Ethanol // Appl. Catal. A. 2018.
Новиков В.А., Фирсова И.А. Влияние содержания восстановителя в реакции растворного синтеза горением на параметры горения и свойства получаемых продуктов // Современные материалы, техника и технологии. 2017. № 6. С. 93–99.
Trusov G.V. High Porous Cellular Materials by Spray Solution Combustion Synthesis and Spark Plasma Sintering // J. Alloys Comp. 2018. V. 779. P. 557–565.
Росляков С.И., Ковалев Д.Ю., Рогачев А.С., Манукян Х., Мукасьян А.С. Горение растворов: динамика фазообразования при синтезе высокопористого никеля // Докл. Академии наук. 2013. Т. 449. № 3. С. 313–316.
Kumar A., Wolf E.E., Mukasyan A.S. Solution Combustion Synthesis of Metal Nanopowders: Nickel-Reaction Pathways // AIChE J. 2011. № 57. P. 2207–2214.
Kumar A., Wolf E.E., Mukasyan A.S. Solution Combustion Synthesis of Metal Nanopowders: Copper and Copper/Nickel Alloys // Reactors, Kinet. Catal. 2011. № 57. P. 3473–3479.
Shen X., Cao K., Jing M., Zhang C. Metal Fe, Ni and Fe–Ni Fine Fibers Derived from the Organic Gel-Thermal Reduction Process // J. Wuhan Univ. Technol. – Mater. Sci. Ed. 2007. № 22. P. 577–581.
Aghaali M.H., Firoozi S. Synthesis of Nanostructured fcc/hcp Hollow Ni Particles by Ultrasonic Spray Pyrolysis and Its Dry Reforming Catalytic Properties // Powder Technol. 2019. V. 356. P. 119–128.
Kim K.N., Kim S.G. Nickel Particles Prepared from Nickel Nitrate with and Without Urea by Spray Pyrolysis // Powder Technol. 2004. № 145. P. 155–162.
Nagashima K., Wada M., Kato A. Preparation of Fine Ni Particles by the Spray Pyrolysis Technique and Their Film Forming Properties in the Thick Film Method // J. Mater. Res. 1990. № 5. P. 2828–2834.
Ebin B., Gurmen S. Synthesis and Characterization of Nickel Particles by Hydrogen Reduction Assisted Ultrasonic Spray Pyrolysis (USP-HR) Method // KONA Powder Part. J. 2011. № 29. P. 134–140.
Kim J.H., Babushok V.I., Germer T.A., Mulholland G.W., Ehrman S.H. Cosolvent-Assisted Spray Pyrolysis for the Generation of Metal Particles // J. Mater. Res. 2003. № 18. P. 1614–1622.
Che S.L., Takada K., Takashima K., Sakurai O., Shinozaki K., Mizutani N. Preparation of Dense Spherical Ni Particles and Hollow NiO Particles by Spray Pyrolysis // J. Mater. Sci. 1999. № 34. P. 1313–1318.
Tarasov A. Spray Solution Combustion Synthesis of Metallic Hollow Microsphere // J. Phys. Chem. 2016. V. 130. № 13. P. 7165–7171.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы