Неорганические материалы, 2020, T. 56, № 6, стр. 690-695
Поликонденсация силикатов натриевого жидкого стекла в присутствии кластерных анионов бора [BnXn]2– (n = 10, 12; X = H, Cl)
В. К. Скачкова 1, *, Е. А. Малинина 2, Л. В. Гоева 2, А. В. Грачев 1, В. В. Авдеева 2, А. Ю. Шаулов 1, А. А. Берлин 1, Н. Т. Кузнецов 2
1 Федеральный исследовательский центр химической физики им. Н.Н. Семенова Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва,
Ленинский пр., 31, Россия
* E-mail: ver.skachkova@yandex.ru
Поступила в редакцию 03.07.2019
После доработки 16.10.2019
Принята к публикации 07.11.2019
Аннотация
Показано, что в системе силикаты жидкого стекла /кластерные анионы бора [BnXn]2– (n = 10, 12; X = H, Cl) (ЖС/[An]) в диапазоне 100–200°С протекают 2 конкурирующих процесса: формирование супрамолекулярной структуры за счет катион-анионных контактов силанольных групп силикатов с [An] при t ≤ 100°С и конденсация силанольных групп силикатов с образованием полисилоксановых цепей (t ≥ 180°С). Разница в температурных условиях данных процессов приводит к ингибированию процесса конденсации силикатов. Исследованы структурные особенности силикатной составляющей в системах ЖС/[An] в зависимости от содержания [An].
ВВЕДЕНИЕ
Ранее авторами статьи был опубликован ряд работ, посвященных исследованию супрамолекулярных систем, образованных при взаимодействии кластерного аниона [BnXn]2– (n = 10, 12; X = H, Cl) с силикатами, содержащими силанольные группы. Показано, что взаимодействие осуществляется за счет катион-анионных контактов силанольных групп силикатов жидкого стекла (ЖС) с кластерными анионами бора (далее обозначены как [An]) [1]. Исследовано влияние [An] различной природы на структурные особенности, термические и термомеханические свойства супрамолекулярных систем [2–5].
Системы ЖС/[BnXn]2– с деформационной устойчивостью до 600°С и содержанием бора до 45–50% перспективны для разработки нейтронопоглощающих материалов, эксплуатируемых в экстремальных условиях [6]. Вместе с тем, в системе ЖС/[An] силикаты с силанольными группами наряду с формированием супрамолекулярных структур при взаимодействии с [BnXn]2– способны участвовать в реакции поликонденсации с образованием полисилоксановых цепей. До последнего времени оставалось невыясненным влияние [An] на процесс поликонденсации силикатов, а именно, на структурные характеристики силикатной матрицы и силикатной составляющей в супрамолекулярной системе ЖС/[BnXn]2–, а также на ингибирование процесса поликонденсации силикатов. Эти задачи являются предметом исследования в данной статье.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования: 30%-ный раствор натриевого жидкого стекла (силикатный модуль 2.9; рН 10) [7]; декагидро-клозо-декаборат триэтиламмония (Et3NH)2[B10H10], синтезированный из декаборана-14 через стадию образования 1,6-бис(триэтиламин)декаборана по методике [8], декахлоро-клозо-декаборат триэтиламмония (Et3NH)2[B10Cl10], синтезированный по методике [9, 10] из Li2[B10Cl10] ⋅ nH2O. Додекагидро-клозо-додекаборат триэтиламмония (Et3NH)2[B12H12] получали в результате пиролиза раствора декаборана в триэтиламинборане по методике [11].
Композиции ЖС/[An] получали растворением соответствующей триэтиламониевой соли в водном растворе жидкого стекла на воздухе при комнатной температуре по методике, описанной в [1]. Растворы исходных композиций выдерживали при 95–100°C в течение 3–4 ч для удаления воды и образующегося в ходе реакции триэтиламина. Полученные твердые вещества дополнительно прогревали при 200○C в течение 2 ч. Термические свойства композиций ЖС/[An] исследовали на воздухе на дериватографе Netzsch 449F3 при скорости нагрева 10°С/мин.
ИК-спектры твердых образцов регистрировали на ИК-Фурье-спектрометре Vertex 70 фирмы BruckerGermany с разрешением 4 см–1. Для регистрации спектров использовали приставку МНПВО GladiATR фирмы PikeTechnologies, USA. Преобразование спектров МНПВО в спектры поглощения; а также коррекцию базовой линии проводили с помощью пакета программ Opus (Brucker, Germany).
Термомеханические свойства исследовали на воздухе на приборе ТМА-420 фирмы Netzsch (Германия) со сферическим индентером диаметром 3 мм, при нагрузке 50 г и скорости нагрева 10°С/мин. Для исследования использовали спрессованные образцы высотой ~1 мм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Реакции с участием силанольных групп силикатов, а также ингибирование процесса поликонденсации силикатов рассмотрены на примере композиции ЖС/[B10Cl10]2–. Ранее было показано, что взаимодействие (Et3NH)2[BnHn] (n = 10, 12) с силикатами натрия в присутствии NaOH, который входит в состав ЖС, сопровождается выделением триэтиламина с заменой катиона [Et3NH]+ в исходной соли (Et3NH)2[BnHn] на ионы Na+ [1, 5]. Аналогичная реакция с выделением триэтиламина и образованием Na2[B10Cl10] протекает и в системе ЖС/(Et3NH)2[B10Cl10].
В процессе удаления воды и триэтиламина из систем ЖС/(Et3NH)2[BnXn] при 100°С анион [BnXn]2– участвует в образовании специфических многоцентровых катион-анионных контактов с катионами силикатов натрия, содержащих силанольные группы (В–Xδ–….Нδ+–О–Si), что приводит к формированию супрамолекулярных структур ЖС/[An].
Для системы ЖС/[B10Cl10]2– (89/11 мас. %) формирование супрамолекулярных ансамблей в процессе удаления триэтиламина и воды при 95○C в течение 3 ч подтверждают данные ИК-спектроскопии, характеризующие положение полосы валентные колебания ν(SiO). Известно, что в процессе структурирования силикатов с участием силанольных групп данная полоса смещается в высокочастотную область [2, 12]. Для рассматриваемой системы ЖС/[B10Cl10]2– полоса ν(SiO) занимает положение при 980 см–1, в то время как для контрольного ЖС – 969 см–1. Следует отметить, что поликонденсация ЖС при 95°С в заметной степени не протекает [7], следовательно, смещение полосы ν(SiO) может быть связано только с образованием катион-анионных контактов в системе ЖС/[B10Cl10]2– при формировании супрамолекулярной структуры.
Рассмотрим конкурирующую с процессом формирования супрамолекулярных структур реакцию поликонденсации силикатов с участием силанольных групп в системе ЖС/[An]. Прежде всего следует отметить, что интенсивный процесс поликонденсации силикатов ЖС наблюдается при более высокой температуре (180–500°С) по сравнению с образованием супрамолекулярных структур (t ~ 100°С). Принципиальным остается вопрос, каким образом присутствие [An] влияет на процесс поликонденсации силикатов.
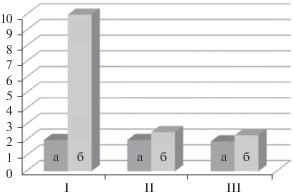
Для исходного ЖС при 180°С стартует процесс интенсивной конденсации с участием силанольных групп, сопровождающийся выделением воды и синтезом полисилоксановых цепей. Полисиликаты частично растворяются в выделяющейся воде с образованием вязкого раствора, который вспенивается под воздействием паров воды, выделяющихся при конденсации [7]. Данный процесс иллюстрирует диаграмма (рис. 1), на которой представлена высота пленок, полученных при 100–120°С, до и после прогрева при 200°С для исходного ЖС(I) и модифицированного (Et3NH)2[B10Cl10] (II, III). Из диаграммы следует, что введение в ЖС сравнительно небольших добавок (Et3NH)2[B10Cl10] (5 и 10 мас. %) приводит к ингибированию процесса вспенивания в условиях интенсивной поликонденсации силикатов ЖС при 200°С.
Рис. 1.
Изменение толщины пленок ЖС в результате вспенивания при 200°С в зависимости от содержания (Et3NH)2[B10Cl10]: I – 0, II – 5 и III – 10 мас. %; а – исходные пленки ЖС, б – пленки после термообработки (условия термообработки: подъем температуры от 120 до 200°С со скоростью 3°С/мин, выдержка при 200°С 30 мин).
В хорошем соответствии с данными по вспениванию образцов I и III находятся результаты их исследования методами ТГА и ДСК (рис. 2). Потеря массы для данных образцов связана в основном с удалением воды при конденсации силикатов, которая продолжается вплоть до 500°С. Как следует из рис. 2, потеря массы в диапазоне интенсивной поликонденсации ЖС для композиции, содержащей 10% (Et3NH)2[B10Cl10], приблизительно в 2 раза меньше по сравнению с исходным ЖС; при этом снижается и скорость процесса поликонденсации силикатов, о чем свидетельствует наклон кривой потерь массы, оба эти фактора препятствуют пенообразованию. Очевидно, что ингибирование процесса поликонденсации связано с уменьшением содержания силанольных групп в силикатной матрице за счет их участия в формировании супрамолекулярных структур при взаимодействии с [An] .
Рис. 2.
Кривые ТГА (а) и ДСК (б) для исходного ЖС (2) и смеси ЖС с 10 мас. % (Et3NH)2[B10Cl10] (1) (образцы в виде пленок, отлитых из водных растворов; сушка при 100–120°С; скачок на кривой ТГА для ЖС при 240°С является результатом интенсивного выброса паров воды).
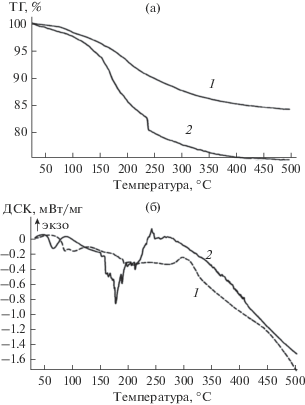
Сложный характер кривых ДСК в диапазоне 140–250°С для немодифицированного ЖС связан с одновременно протекающими эндо- и экзотермическими процессами (испарение воды, растворение силикатов и образование полисилоксановых структур). В присутствии [An] кривая ДСК в данном диапазоне имеет плавный вид, наблюдается лишь незначительное превалирование эндопроцесса, который, наиболее вероятно, характеризует удаление воды при конденсации силикатов.
Влияние структурных особенностей [An] на процесс ингибирования поликонденсации силикатов исследовали в присутствии кластерных анионов бора, различающихся электроотрицательностью периферийных атомов и структурой борного каркаса, следствием чего является различное распределение электронной плотности по борному каркасу [BnXn]2– (n = 10, 12; X = H, Cl). Структурные характеристики [An] определяют силу их межмолекулярных контактов, для относительной оценки которой может быть использована величина температуры размягчения исходных солей (tр). По данным термомеханического анализа (ТМА), tр для исходных солей (Et3NH)2[BnXn] возрастает в ряду [B12H12]2– < [B10H10]2– < [B10Cl10]2– и составляет 185 и 245○C для двух первых членов ряда, а (Et3NH)2[B10Cl10] не размягчается вплоть до начала деструкции при t = 420○C. Межмолекулярное взаимодействие оказывает прямое влияние на формирование супрамолекулярных структур в силикатной матрице, а следовательно, и на реакции конденсации силикатов с силанольными группами. При малых концентрациях [An] супрамолекулярные структуры распределены в ЖС в виде ассоциатов, в которых полиэдрический анион [BnXn]2– выполняет функцию сшивающего агента для реакционноспособных силикатов.
Влияние природы кластерных анионов бора [BnXn]2– на процессы в силикатной матрице с участием силанольных групп исследовали методом ТМА. Метод обладает высокой чувствительностью к процессу пластификации силикатов водой, выделяющейся при конденсации силанольных групп силикатов, не участвующих в формировании супрамолекулярных структур. На рис. 3 приведены кривые ТМА для композиций ЖС/[B10Cl10]2–, ЖС/[B10H10]2– и ЖС/[B12H12]2–, содержащих эквимольные добавки [An] (0.03 моля). Из сопоставления термомеханических свойств исходного ЖС и модифицированного [An] следует, что в условиях пластификации силикатов водой, выделяющейся при конденсации при t > 180○C, значения dL/L0 для композиций ЖС/[An] существенно меньше по сравнению с ЖС, что указывает на пониженное содержание в силикатной матрице свободных силикатов с силанольными группами, способными конденсироваться с выделением временного пластификатора воды. Таким образом, чем меньше величина dL/L0, тем бóльшая часть силанольных групп участвует в процессе образования супрамолекулярных структур.
Рис. 3.
Кривые ТМА для композиций ЖС/(Et3NH)2[BnXn], содержащих 0.03 мол. (Et3NH)2[B12H12] (1), (Et3NH)2[B10H10] (2), (Et3NH)2[B10Cl10] (3); исходного ЖС (4).
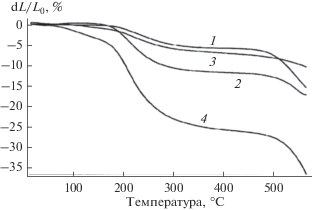
Сопоставление данных ТМА для двух систем, в состав которых входит кластерный анион с одинаковым борным каркасом, показало, что деформационная устойчивость ЖС/[B10Cl10]2– существенно выше по сравнению с ЖС/[B10H10]2–, соответственно, значения dL/L0 ниже (рис. 3). Очевидно, анион [B10Cl10]2– образует большее число энергетически более стабильных контактов с силикатами по сравнению с [B10H10]2–, а следовательно, сильнее ингибирует конденсацию силикатов.
Особого внимания заслуживает тот факт, что кривые ТМА для систем с наиболее активным в межмолекулярных контактах кластерным анионом [B10Cl10]2– и наименее активным [B12H12]2– в диапазоне 180–450○C близки. Во втором случае энергия межмолекулярных контактов в системе ЖС/[B12H12]2– реализуется за счет большего числа более слабых контактов как ближних, так и дальних, что обусловлено особенностями электронного строения аниона [B12H12]2–, в котором все экзополиэдрические атомы водорода обладают одинаковой активностью. Присутствие в супрамолекулярной структуре ЖС/[B12H12]2– контактов двух типов с различной энергией взаимодействия подтверждено данными ИК-спектров в работе [5]. В данной работе было также показано, что при разрушении дальних контактов в системе ЖС/[B12H12]2–в результате термообработки при t ≥ ≥ 400°С освобождаются низкомолекулярные силикаты, которые пластифицируют композицию, о чем свидетельствует увеличение значений dL/L0 при t ~ 450°С по данным ТМА (рис. 3, кривая 1).
На примере композиции ЖС/(Et3NH)2[B10H10] рассмотрим, каким образом увеличение концентрации [An] влияет на процесс поликонденсации силикатов. Выше была рассмотрена система ЖС/[An], для которой содержание (Et3NH)2[B10H10] в исходной смеси составляло 10 мас. % или 0.03 моля [B10H10]2–. По мере увеличения концентрации [An] в системе ЖС/[An] в силу концентрационных, а также стерических факторов уменьшается доля свободных силикатов, способных к реакции конденсации, что находит отражение в результатах ТМА. Так, с ростом содержания (Et3NH)2[B10H10] в исходной композиции от 15 до 30 и 40% значения dL/L0 при t = 300○C уменьшаются от 10 до 1 и 2%. Таким образом, в системе с высоким содержанием [An] отсутствует пластификация силикатов водой, выделяющейся при их конденсации, что может быть связано не только с малым содержанием реакционноспособных свободных силикатов, не участвующих в формировании супрамолекулярных структур, но и с распределением их в пространственно разветвленной сетчатой структуре, образованной супрамолекулярными ассоциатами.
Структурные особенности силикатной составляющей в супрамолекулярных системах ЖС/[An] с высоким содержанием кластерных анионов исследовали методом ИК-спектроскопии в области валентных колебаний связи Si–O. Известно, что в процессе поликонденсации силикатов, а также формирования супрамолекулярных структур полоса, характеризующая данные колебания, смещается в высокочастотную область [2, 12]. Согласно данным ИК-спектроскопии, по сравнению с исходным ЖС для систем ЖС/[B10H10]2– при содержании [An] 13.7 и 33.3 мас. % спектры смещены в высокочастотную область тем в большей степени, чем выше содержание [An] (рис. 4а). Тот факт, что смещение в высокочастотную область больше для системы с более высоким содержанием [An], позволяет предположить, что наибольший вклад в процесс структурирования вносит формирование супрамолекулярных структур, а не конденсация свободных силикатов с образованием полисилоксановых цепей, как это имеет место для исходных силикатов. На основании данных рис. 4б можно предположть, что реакции поликонденсации силикатов в системе ЖС/[An] при содержании [B10H10]2– 33.3 мас. % практически отсутствуют.
Рис. 4.
ИК-спектры систем ЖС/[B10H10]2– при содержании [An] 0 (1), 13.7 (2), 33.3 мас. % (3) (а); 33.3 мас. % после термообработки при 200 (1), 350 (2), 500°С (3) (б).
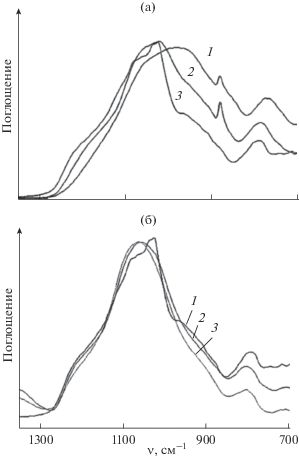
На рис. 4б приведены ИК-спектры систем ЖС/[B10H10]2– при содержании [An] 33.3 мас. % после термообработки при 200, 350 и 500°С. Для этой композиции положение полосы ν(SiO) в диапазоне ~1000–1150 см–1 практически не зависит от температуры прогрева, в то время как для исходного ЖС в аналогичных условиях наблюдается смещение данной полосы от 962 до 1040 см–1 по мере увеличения степени поликонденсации силикатов с повышением температуры до 500°С [2].
ЗАКЛЮЧЕНИЕ
В системах ЖС/[An] с высоким содержанием [An] и деформационной устойчивостью до 600°С реакционноспособные силикаты с силанольными группами участвуют преимущественно в формировании супрамолекулярных структур за счет катион-анионных контактов с [An]. Такие системы можно рассматривать как неорганические полимеры пространственно-разветвленной сетчатой структуры, в узлах которой находятся супрамолекулярные структуры силикаты/[An].
Системы ЖС/[An] при малом содержании [An] представляют собой силикатную матрицу, содержащую силикаты, способные при термическом воздействии к конденсации с образованием полисилоксановых цепей, в которой [An] распределен в виде ассоциатов с силикатами.
Список литературы
Гоева Л.В., Скачкова В.К., Авдеева В.В., Малини-на Е.А., Грачев А.В., Шаулов А.Ю., Берлин А.А., Кузнецов Н.Т. Взаимодействие натриевого жидкого стекла с декагидро-клозо-декаборатом триэтиламмония (Et3NH)2B10H10 // ЖНХ. 2014. Т. 59. № 2. С. 238–242.
Скачкова В.К., Гоева Л.В., Грачев А.В., Авдеева В.В., Малинина Е.А., Шаулов А.Ю., Берлин А.А., Кузнецов Н.Т. Термические и термоокислительные свойства декагидро-клозо-декаборатного аниона ${{{\text{B}}}_{{{\text{10}}}}}{\text{H}}_{{10}}^{{2--}}$ в силикатной матрице // Неорган. материалы. 2015. Т. 51. № 7. С. 803–807.
Скачкова В.К., Гоева Л.В., Грачев А.В., Авдеева В.В., Малинина Е.А., Шаулов А.Ю., Берлин А.А., Кузнецов Н.Т. Особенности термоокисления декагидро-клозо-декаборатного аниона ${{{\text{B}}}_{{{\text{10}}}}}{\text{H}}_{{10}}^{{2--}}$ в силикатной матрице // Неорган. материалы. 2015. Т. 51. № 5. С. 554–558.
Скачкова В.К., Гоева Л.В., Грачев А.В., Авдеева В.В., Малинина Е.А., Шаулов А.Ю., Берлин А.А., Кузнецов Н.Т. Термические и термомеханические свойства додекагидро-клозо-додекаборатов триалкиламмония (R3NH)2[B12H12] (R = Et, Вu)// ЖНХ. 2017. Т. 62. № 1. С. 81–86.
Скачкова В.К., Гоева Л.В., Грачев А.В., Кочнева И.К., Малинина Е.А., Шаулов А.Ю., Берлин А.А., Кузнецов Н.Т. Композиции на основе додекагидро-клозо-додекабората триэтиламмония (Et3NH)2[B12H12] и силикатов натриевого жидкого стекла // Неорган. материалы. 2017. Т. 53. № 2. С. 192–197.
Гоева Л.В., Малинина Е.А., Авдеева В.В., Кузнецов Н.Т., Скачкова В.К., Грачев А.В., Шаулов А.Ю., Берлин А.А. Борсодержащий нейтронозащитный материал: Пат. РФ № 2550156. 11.11.2015.
Корнеев В.И., Данилов В.В. Растворимое и жидкое стекло. Санкт-Петербург: Стройиздат СПб, 1996. С. 216.
Miller H.C., Miller N.E., Mueterties E.L. Sinthesis of Polyhedral Boranes // J. Am. Chem. Soc. 1963. V. 85. № 23. P. 3885–3886.
Knoth W.H., Miller H.C., Sauer J.C., Balthis J.H., Chia Y.T., Muetterties E.L. Chemistry of Boranes. IX. Halogenation of ${{{\text{B}}}_{{{\text{10}}}}}{\text{H}}_{{10}}^{{2--}}$ and ${{{\text{B}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2--}}$ // Inorg. Chem. 1964. № 3. P. 159–167.
Kravchenko E.A., Gippius A.A., Korlyukov A.A., Vologzhanina A.V., Avdeeva V.V., Malinina E.A., Ulitin E.O., Kuznetsov N.T. Secondary Interactions in Decachloro-closo-Decaborates R2[B10Cl10] (R = Et3NH+, Ph4P+, and [Ag(NH3)2]+): 35Cl NQR, PW-DFT, and X-ray studies // Inorg. Chim. Acta. 2016. V. 447. P. 22–31.
Greenwood N.N., Morris J.H. Novel Synthesis of the ${{{\text{B}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2--}}$ Anion // Proc. Chem. Soc. 1963. V. 11. P. 338–345.
Beard W.C. Infrared Studies of Aqueous Silicate Solutions // Adv. Chem. Ser. 1973. V. 121. P. 162.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


