Неорганические материалы, 2020, T. 56, № 8, стр. 914-922
Получение кристаллизационными методами особо чистого порошка Na2CO3 для выращивания низкофоновых сцинтилляционных кристаллов
И. И. Новоселов 1, О. В. Гилева 2, *, **, Д. С. Чой 2, К. А. Шин 2, В. Н. Шлегель 1, В. Д. Григорьева 1, М. Ю. Ли 2, 3, Й. Д. Ким 2, 3, Х. К. Пак 4
1 Институт неорганической химии им. А.В. Николаева СО Российской академии наук
630090 Новосибирск, пр. Академика Лаврентьева, 3, Россия
2 Центр подземной физики, Институт фундаментальных наук (CUP, IBS)
34126 Тэджон, Южная Корея
3 Университет науки и технологий (UST, IBS)
34113 Тэджон, Южная Корея
4 Университет Корё (Korea University)
30019 Седжонг, Южная Корея
* E-mail: gilevaolga@ibs.re.kr
** E-mail: gilyova_ov@mail.ru
Поступила в редакцию 30.10.2019
После доработки 03.03.2020
Принята к публикации 05.03.2020
Аннотация
Разработан метод получения особо чистого карбоната натрия. Основой метода является фракционная перекристаллизация Na2CO3 из его насыщенных растворов, перевода его в формиат натрия с последующей кристаллизацией из расплава. Для получения конечного продукта Na2CO3 очищенный формиат был подвержен пиролизу. Содержание Th и U в очищенном порошке было ниже 10 ppt, концентрации Mn, Co, Ba и Pb не превышали 3 ppb, Cu и Sr были на уровне десяти ppb, концентрация K составляла около 200 ppb. ИСП-МС-анализ показал, что чистота полученного порошка значительно превосходит таковую для коммерческих продуктов степени 99.997 и 99.999%. Полученный таким образом порошок карбоната натрия служит исходным материалом для выращивания сцинтилляционных монокристаллов, используемых в экспериментах по регистрации безнейтринного двойного бета-распада (0νββ) или поиску темной материи.
ВВЕДЕНИЕ
Использование сцинтилляционных кристаллических болометров служит мощным средством для осуществления таких низкофоновых экспериментов, как поиск безнейтринного двойного бета-распада (0νββ), и является единственным практическим способом определения абсолютной шкалы масс нейтрино и их природы – майорановской или дираковской [1–4]. Для успешной реализации такого эксперимента одним из ключевых этапов является разработка технологии получения сцинтилляционных монокристаллов высокого качества с экстремально низким радиоактивным внутренним фоном, в идеальном случае нулевым.
Эксперимент AMoRE (The Advanced Mo-based Rare process Experiment) – это международное сотрудничество по экспериментальному поиску безнейтринного двойного бета-распада ядра изотопа 100Мо. Проект осуществляется в несколько этапов, возможно, с использованием различных кристаллов: CaMoO4 (CMO), Li2MoO4 (LMO), PbMoO4 (PMO) и Na2Mo2O7 (NMO) [5]. В рамках других проектов по исследованию редких событий также исследуются такие кристаллы, как, например, Na2W2O7 (NWO) [6].
Настоящее исследование посвящено методу очистки карбоната натрия, который, наряду с порошком MoO3, используется в качестве исходного материала для синтеза кристаллов NMO. Димолибдат натрия является важным кандидатом для использования в проектах по поиску безнейтринного двойного бета-распада ядра 100Mo и темной материи в условиях криогенных температур, поскольку кристаллы Na2Mo2O7 имеют высокий световыход при низких температурах, сравнительно низкую гигроскопичность и высокое массовое содержание молибдена [7, 8].
В исследованиях по регистрации редких событий главным лимитирующим факторам является соотношение сигнал/фон, поэтому задача максимального снижения фона становится все более и более важной. Доминирующий вклад во внутренний радиоактивный фон детектора связан с содержанием в кристалле природных радиоактивных изотопов: Ra, 232Th и 238U. Продукты распада этих изотопов, 208Tl (Qβ = 5.001 кэВ) и 214Bi (Qβ = = 3.272 кэВ), имеют более высокие энергии β-перехода, чем изотоп 100Mo (Qβ = 3.034 кэВ), что приводит к наложению пиков в исследуемой области [8]. В исследованиях, посвященных изучению темной материи, среди прочих, изотоп 40K при γ-переходе в изотоп 40Ar излучает энергию 1.46 МэВ, становясь при этом источником радиоактивного фона. Одним из способов решить эти проблемы является тщательный выбор материалов, используемых в эксперименте, и их глубокая очистка от радиоактивных примесей K, Th, U и Ra.
В качестве исходных компонентов для выращивания кристаллов NMO используются порошки триоксида молибдена и карбоната натрия, которые предварительно должны быть очищены от Th и U до уровня 10 ppt, для остальных примесей: K, Ba, Sr, Pb, Fe и др. – до уровня 100 ppb. Кроме того, для хорошего смешивания размер частиц используемых порошков должен быть не более 500 мкм.
В случае MoO3 полная схема очистки, которая позволяет получать порошок требуемой чистоты, основана на последовательной двойной возгонке в вакууме с последующей доочисткой методами мокрой химии [9–12].
Для применения в низкофоновых высокочувствительных экспериментах, в случае коммерчески доступного карбоната натрия, сертификаты чистоты не содержат информацию о концентрации радиоактивных примесей, а производители не могут гарантировать постоянство примесного состава на уровне ppt от партии к партии, что обуславливает необходимость предварительного анализа и разработки метода очистки данного продукта.
Анализ литературных данных показывает, что производство и очистка Na2CO3 описаны во множестве патентных исследований, принадлежащих основным производителям США и СССР, вместе с тем, все они относятся к аммиачно-содовому способу Сольве или производству из грунтовых рассолов и их различных вариаций, различающихся техническим исполнением.
В последнее время в качестве исходного материала для карбонатного производства чаще используются природные грунтовые воды. Так, рассолы, содержащие смесь натриевых солей (карбонаты, бикарбонаты, хлориды, сульфаты и т.д.), смешиваются с насыщенным бикарбонатным раствором, далее подвергаются карбонизации для осаждения трона, который дополнительно очищают перед производством конечного продукта [13–15].
Производство по методу Сольве основано на синтезе сравнительно малорастворимого в воде бикарбоната натрия с помощью карбонизации хлоридных растворов, затем для получения конечного карбоната отфильтрованный осадок прокаливается [16–21].
В зависимости от технического исполнения процесса продукты могут отличаться насыпной плотностью от 0.5 до 1.1 кг/л и иметь различный гранулометрический состав с размером частиц вплоть до 1.18 мкм [22]. В то же время полученные с помощью этих двух методов порошки имеют степень чистоты, не превышающую 99.99%, и могут быть гарантированно очищенными только от наиболее распространенных примесей: Ca, Fe, Mg и т.д., тогда как удаление наиболее опасных радиоактивных примесей не подтверждено. Таким образом, задачей нашего исследования является разработка эффективного метода очистки и производства карбоната натрия для получения продукта со степенью чистоты, удовлетворяющей требованиям AMoRE-детектора.
Способ получения порошка особо чистого карбоната натрия с применением кристаллизационных методов очистки был разработан на базе лаборатории роста кристаллов Института неорганической химии им. А.В. Николаева (ИНХ СО РАН) в Новосибирске. Метод включал двукратную последовательную перекристаллизацию карбоната натрия из насыщенного раствора, синтез формиата натрия при взаимодействии карбоната с муравьиной кислотой и дальнейшую его кристаллизацию из расплава модифицированным методом Бриджмена.
Перекристаллизация из водных растворов – широко известный способ очистки, в котором не используются дополнительные реактивы, что сводит к минимуму возможность перекрестного загрязнения продукта. В модифицированном методе Бриджмена расплав интенсивно перемешивается, что сокращает шансы включения примесей внутрь закристаллизовавшейся части.
Кроме того, в настоящем исследовании с помощью масс-спектрометрии с индуктивно-связанной плазмой (МС-ИСП) проанализировано несколько образцов порошка карбоната натрия различной степени чистоты (от 99 до 99.999%) и от различных производителей (АО “Башкирская содовая компания”, Sigma Aldrich и Alfa Aesar), а также представлены результаты анализа чистоты продукта, полученного в соответствии с предложенным способом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и оборудование. Особо чистый карбонат натрия получали на базе лаборатории роста кристаллов ИНХ СО РАН (Новосибирск). Исходным материалом служил порошок гидрокарбоната натрия NaHCO3 (АО “Башкирская содовая компания”). В качестве вспомогательных материалов использовались муравьиная кислота (ГОСТ 5848-73), предварительно очищенная перегонкой без кипения, и деионизованная вода с удельным электрическим сопротивлением 20 MОм/см. Вся используемая лабораторная посуда была предварительно отмыта с использованием ультразвуковой ванны в горячей 1%-ной азотной кислоте и затем промыта деионизованной водой.
Концентрации примесей K, Mn, Co, Cu, Sr, Ba, Pb, Th и U были измерены с использованием МС-ИСП Agilent 7900 (Agilent Technologies, USA) на базе аналитической лаборатории Центра подземной физики в Корее (CUP, IBS). Содержание Fe, Ca, и Mg было установлено методом атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой (АЭС-ИСП) (iCAP-6500, Thermo Fisher Scientific, USA) на базе аналитического центра ИНХ СО РАН.
Рентгенофазовый анализ (РФА) был выполнен с помощью дифрактометра SHIMADZU XRD-7000 (CuKα-излучение с длиной волны 1.5418 Å, никелевый фильтр). Сканирование проводилось в непрерывном режиме со скоростью 2 град/мин и шагом 0.05°. Полученные дифракционные рефлексы сопоставляли с данными картотеки JCPDS. Средний размер кристаллитов определяли по уравнению Шеррера из интегрального уширения неперекрывающихся индивидуальных рефлексов, что позволяет получить результаты, не зависящие от распределения частиц образца по форме и размеру. Описание дифракционных рефлексов функцией Пирсона (PVII) и расчет размера кристаллитов выполнены в программе WinFit 1.2.1.
Методика эксперимента. Метод получения особо чистого карбоната натрия включал пять последовательных этапов: 1) прокаливание исходного гидрокарбоната натрия (NaHCO3), 2) двукратная перекристаллизация карбоната натрия (Na2CO3) из его насыщенных водных растворов, 3) синтез безводного формиата натрия (NaHCO2) путем взаимодействия с муравьиной кислотой, 4) кристаллизация формиата из расплава, 5) пиролиз формиата для получения конечного карбоната натрия.
В первую очередь исходный порошок гидрокарбоната натрия был прокален при 280°C с целью получения карбоната натрия, который затем был дважды перекристаллизован из его водных растворов [23, 24]. Для этого безводный порошок Na2CO3 растворяли в горячей воде до насыщения с последующим охлаждением. Полученные кристаллы после фильтрации отправляли на вторую стадию перекристаллизации, выход продукта после каждого этапа составлял около 60%. Основное количество примесей после первой кристаллизации оставалось в материнском растворе, поэтому его не использовали далее, в то время как маточный раствор после повторной кристаллизации может служить растворителем для последующих партий.
Далее взаимодействием растворов карбоната натрия и муравьиной кислоты, взятых в стехиометрических количествах, синтезировали формиат натрия. После полного высушивания в инертной атмосфере при 150°C получали безводный формиат для последующей кристаллизации из расплава.
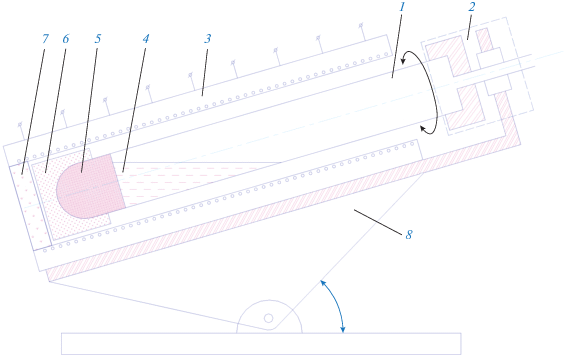
Процессы кристаллизации и термического разложения формиата натрия осуществляли в реакторах из кварцевого стекла. Перекристаллизацию из расплава проводили модифицированным методом Бриджмена во вращающейся трубе с внутренним диаметром 50 мм и общей длинной 800 мм, один конец трубы был запаян. Угол наклона трубы составлял 5°–20°, чтобы 10% поверхности фронта кристаллизации не покрывалось расплавом [25–27]. Скорость вращения трубы составляла 30 об./мин, скорость перемещения фронта – 5 мм/ч, температура нагрева – 260°C. Для каждого процесса загружали около 600 г формиата натрия. Всего проводили три последовательных кристаллизации для каждой партии. После каждой кристаллизации около 10% продукта с хвостовой части, где концентрируются примеси, отделяли. Вращение трубы и наличие свободной поверхности на фронте кристаллизации способствуют легкому извлечению закристаллизовавшегося формиата. Схематическое изображение аппарата для кристаллизации из расплава модифицированным методом Бриджмена представлено на рис. 1.
Рис. 1.
Схематическое изображение аппарата для кристаллизации NaHCO2 из расплава модифицированным методом Бриджмена: 1 – реактор из кварцевого стекла, 2 – узел вращения и создания контролируемой атмосферы, 3 – восьмизонный нагреватель, 4 – расплав формиата натрия, 5 – кристаллический формиат натрия, 6 – графитовый подшипник, 7 – тепловая заглушка, 8 – устройство изменения угла наклона.
Для получения карбоната натрия формиат подвергали ступенчатому пиролизу: при 400°C в условиях инертной (Не) атмосферы, при 650°C на воздухе. Конечный продукт представлял собой порошок с небольшим количеством комков, не превышающих 10% от общей массы. Комки легко отсеивались с помощью пластикового сита с размером ячеек 0.5 мм. Кроме того, воздействие таких высоких температур гарантирует полное удаление влаги, в том числе кристаллизационной воды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для контроля процесса очистки карбоната натрия исходный, промежуточные и конечный продукты были исследованы с помощью МС-ИСП. Результаты анализа представлены в табл. 1. Для выражения коэффициента очистки (K) использовали отношение концентрации примеси в исходном материале к таковой в конечном продукте. От исходного NaHCO3 к конечному Na2CO3 все промежуточные продукты имеют различные химические формулы, что затрудняет расчет коэффициента K, поэтому для адекватной оценки величины K все расчеты были выполнены с учетом весового содержания основного компонента Na2CO3.
Таблица 1.
Результаты МС-ИСП для схемы очистки карбоната натрия
| Образец | Содержание | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| K | Mn | Co | Cu | Sr | Ba | Pb | Th | U | |
| ppb | ppb | ppb | ppb | ppb | ppb | ppb | ppt | ppt | |
| Исходный продукт NaHCO3 | 850 | 150 | 3.2 | 23 | 2800 | 19 | 3 | <10 | 75 |
| Na2CO3 ⋅ 10H2O после двукратной перекристаллизации из водных растворов |
30 | 7.5 | 0.15 | 26 | 290 | 1.3 | 2.1 | <10 | <10 |
| К (приведенный к содержанию Na2CO3) | 16 | 11 | 12 | 0.5 | 5 | 8 | 1 | – | >4 |
| Синтезированный NaHCO2 | 140 | 15 | 0.22 | <100 | 590 | 11 | 14 | 35 | <15 |
| NaHCO2, конечная часть после первой кристаллизации | 290 | 60 | 1.6 | 130 | 710 | 20 | 9 | 43 | <10 |
| NaHCO2, конечная часть после второй кристаллизации | 170 | 13 | 0.46 | 100 | 100 | 5.4 | 7.2 | 28 | <10 |
| NaHCO2, конечная часть после третьей кристаллизации | 76 | 6 | 0.26 | 38 | 56 | 2.1 | 3.4 | 12 | <10 |
| NaHCO2, начальная часть после третьей кристаллизации | 110 | <1.8 | 0.072 | 9 | 2.7 | 0.01 | 0.52 | <10 | <10 |
| Конечный продукт Na2CO3 | 200 | 2.4 | 0.083 | 13 | 10 | 1.5 | 0.67 | <10 | <10 |
| К (приведенный к содержанию Na2CO3) | 6 | 90 | 60 | 3 | 400 | 19 | 7 | – | >10 |
В предыдущем опыте по очистке солей натрия [28] фракционная перекристаллизация из водных растворов показала высокий коэффициент разделения для многих примесей, в т. ч. для наиболее трудно отделимой примеси калия. Поскольку K и Na располагаются в одной группе Периодической системы Менделеева и обладают сходными химическими свойствами, их разделение представляет собой сложный процесс. Как бы то ни было, результаты, представленные в табл. 1, показывают, что после двукратной перекристаллизации карбоната натрия содержание K было снижено в 16 раз, Mn в 11 раз, Co в 12 раз, Sr в 6 раз, Ba 8 раз, U в 4 раза, а концентрация Th была ниже предела обнаружения метода. Медь и свинец, напротив, не удалялись. В случае меди наблюдалось даже некоторое загрязнение продукта. Трехкратная перекристаллизация не дала положительного эффекта, поэтому последующую очистку продолжили с использованием метода кристаллизации из расплава. Формиат натрия был выбран для проведения кристаллизации из расплава, при плавлении он не разлагается и не взаимодействует с кварцевым стеклом.
Как видно из табл. 1, полученный формиат натрия был загрязнен в процессе синтеза, вероятно, вследствие поступления примесей из муравьиной кислоты. В то время как третья последовательная перекристаллизация карбоната натрия из насыщенных растворов не дала заметного эффекта очистки, трехкратная кристаллизация из расплава показала значительное снижение содержания примесей на каждой ступени. Как отмечено выше, грязная хвостовая часть перекристаллизованного формиата отделялась от основной массы после каждого цикла и подвергалась МС-ИСП, а после третьего цикла была проанализирована также и начальная часть. Результаты анализа показывают, что, за исключением калия, содержание всех элементов-примесей было значительно снижено: Mn в 8 раз, Со в 3 раза, Cu в 5 раз, Sr в 80 раз, Ba в 9 раз, Pb в 20 раз, Th в 4 раза, концентрация урана была ниже предела обнаружения метода.
Таким образом, двукратная перекристаллизация из водных растворов показала высокую эффективность удаления K, однако Cu и Pb при этом не удалялись. Трехкратная кристаллизация из расплава формиата позволяет удалять медь и свинец, но содержание калия при этом не снижается. Оба метода эффективны для удаления Mn, Co, Sr, Ba, однако при перекристаллизации из водных растворов наблюдается предел снижения концентрации примесей. Кристаллизация из расплава формиата позволяет наиболее качественно, за исключением K, снизить содержание анализируемых примесей.
После полного термического разложения формиата натрия полученный порошок карбоната натрия был тщательно перемешан и проанализирован на содержание примесей. Коэффициенты очистки, представленные в табл. 1, показывают высокую эффективность предложенного метода очистки карбоната натрия от радиоактивных примесей. По отношению к исходному гидрокарбонату содержание Th и U в конечном продукте было снижено до предела обнаружения метода (10 ppt); для стронция был установлен наиболее высокий коэффициент очистки 400; концентрации K, Mn, Co, Cu, Ba, Pb были снижены в 6, 90, 60, 3, 20, 7 раз соответственно.
Применение многостадийной очистки, включающей перекристаллизацию как из водных растворов, так и из расплава, позволило существенно снизить содержание анализируемых примесей и получить продукт высокой степени чистоты.
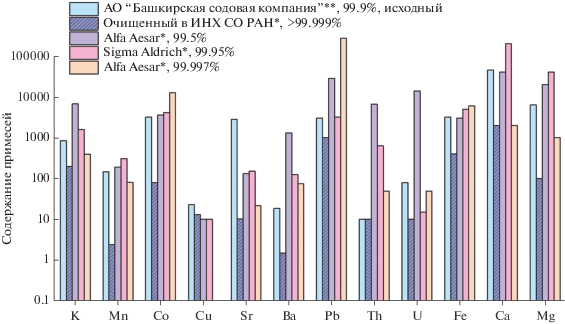
Для того чтобы подчеркнуть эффективность предложенного метода очистки и степень чистоты полученного продукта, также были проанализированы образцы карбоната натрия других производителей (табл. 2). Для лучшей визуализации результатов на рис. 2 представлена гистограмма сравнения содержания примесей в анализированных образцах. Наименьшее содержание лимитируемых примесей (K, Th и U) соответствует порошку карбоната натрия, полученному вышеописанным методом. Кроме того, наименьшее среди всех проанализированных образцов содержание бария в продукте может служить индикатором низкого радиевого загрязнения, что является не менее важным параметром для проекта AMoRE.
Таблица 2.
Содержание примесей в полученном продукте и коммерческих порошках
| Производитель | Степень чистоты | Содержание | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| K | Mn | Co | Cu | Sr | Ba | Pb | Th | U | Fe | Ca | Mg | ||
| ppb | ppb | ppb | ppb | ppb | ppb | ppb | ppt | ppt | ppm | ppm | ppm | ||
| АО “Башкирская содовая компания”** | >99.9%, puriss. spec. | 850 | 150 | 3 | 23 | 2800 | 18 | 3 | <10 | 80 | 3 | 45 | 6 |
| Alfa Aesar* | 99.5% | 6700 | 190 | 4 | <10 | 130 | 1300 | 28 | 66 000 | 14 000 | 3 | 40 | 20 |
| Alfa Aesar* | 99.997% | 400 | 81 | 13 | – | 22 | 75 | 270 | <50 | <50 | 6 | 2 | <1 |
| Sigma Aldrich* | 99.95% | 1600 | 310 | 4 | <10 | 150 | 12 | 3 | 630 | <15 | <5 | <200 | <40 |
| Sigma Aldrich (CA от производителя)* | 99.999% | 1900 | – | – | 1 | – | 100 | 1100 | – | – | 1 | 0.4 | – |
| Очищенный в ИНХ СО РАН* | >99.999% | 200 | 2 | 0.1 | 13 | 10 | 1 | 1 | <10 | <10 | 0.4 | 2.0 | 0.1 |
Примечание. СА – сертификат анализа; границы относительной погрешности измерения МС-ИСП такие же, как в табл. 1. * Na2CO3. ** NaHCO3.
Рис. 2.
Гистограмма сравнения чистоты порошков NaHCO3 и Na2CO3 от разных производителей (Na2CO3*, NaHCO3**).
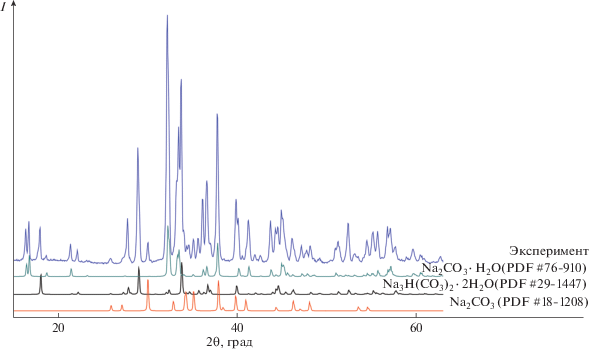
РФА образца (рис. 3) показал высокое соответствие пиков с данными картотеки для Na2CO3 (PDF, card 18-1208). Присутствие пиков Na2CO3 ⋅ · H2O (PDF, 76-910) и Na3H(CO3)2 ⋅ 2H2O (PDF, 29-1447) свидетельствует о взаимодействии образца с влагой воздуха, что диктует необходимость хранения продукта в запаянных под вакуумом пакетах. По уширению неперекрывающихся индивидуальных рефлексов было определено, что средний размер кристаллитов составил 50 нм (табл. 3).
ЗАКЛЮЧЕНИЕ
Разработанный способ получения особо чистого карбоната натрия с помощью методов перекристаллизации из насыщенного водного раствора и кристаллизации из расплава формиата модифицированным методом Бриджмена показал высокую эффективность очистки от анализированных примесей. Снижено содержание K в 6, Mn в 90, Co в 60, Cu в 3, Sr в 400, Ba в 20, Pb в 7, U в 10 раз. Удаление калия происходило только при перекристаллизация из растворов, а удаление Pb и Cu – только при кристаллизации из расплава. При перекристаллизации из водных растворов наблюдается предел снижения концентрации примесей. Кристаллизация из расплава формиата позволяет наиболее качественно, за исключением К, снизить содержание примесей.
Последовательность применяемых методов кристаллизации может быть изменена, тогда загрязнение промежуточного формиата натрия калием на этапе синтеза будет нивелировано последующей перекристаллизацией из водных растворов. При этом настойчиво рекомендуется использование муравьиной кислоты высокой степени чистоты.
Помимо высокой эффективности очистки, предложенный способ не требует использования большого количества дополнительных реактивов, остатки формиата натрия после кристаллизации из расплава могут быть вторично использованы в последующих циклах, а конечный продукт представляет собой мелкий сухой порошок без включения комков.
МС-ИСП-анализ показал, что среди других проанализированных коммерческих образцов полученный данным способом карбонат натрия содержит наименьший уровень лимитируемых радиоактивных примесей и может быть использован в качестве исходного материала для роста низкофоновых монокристаллов в рамках проекта AMoRE, а также в других проектах со схожими строгими требованиями к чистоте материалов.
Список литературы
Fukuda S., Fukud Y., Ishitsuka M. et al. Solar B 8 and Hep Neutrino Measurements from 1258 Days of Super-Kamiokande Data // Phys. Rev. Lett. 2001. V. 86. № 25. P. 5651–5655. https://doi.org/10.1103/PhysRevLett.86.5651
Mohapatra R.N., Antusch S., Babu K.S. et al. Theory of Neutrinos: A White Paper // Rep. Prog. Phys. 2007. V. 70. № 11. P. 1757–1867. https://doi.org/10.1088/0034-4885/70/11/R02
Arnold R., Augier C., Baker J.D. et al. Result of the Search for Neutrinoless Double-β Decay in 100Mo with the NEMO-3 Experiment // Phys. Rev. D. 2015. V. 92. № 7. P. 072011:1-23. https://doi.org/10.1103/PhysRevD.92.072011
Giuliani A., Poves A. Neutrinoless Double-Beta Decay // Adv. High Energy Phys. 2012. № 857016. https://doi.org/10.1155/2012/857016
Alenkov V. et al. Technical Design Report for the AMoRE 0νββ Decay Search Experiment // 2015. https://arxiv.org/pdf/1512.05957.pdf
Pandey I.R., Kim H.J., Lee H.S. et al. The Na2W2O7 Crystal: a Crystal Scintillator for Dark Matter Search Experiment // Eur. Phys. J. 2018. № 78. P. 973:1-7.https://doi.org/10.1140/epjc/s10052-018-6462-0
Pandey I.R. et al. Growth and Characterization of Na2Mo2O7 Crystal Scintillators for Rare Event Searches // J. Cryst. Growth. 2017. № 480. P. 62–66. https://doi.org/10.1016/j.jcrysgro.2017.09.031
Spassky D.A., Alenkov V.V., Buzanov O.A., Kornoukhov V.N. Molybdate Cryogenic Scintillators for Rare Events Search Experiments // Eds. Korzhik M., Gektin A. Engineering of Scintillation Materials and Radiation Technologies. Springer Proceedings in Physics. № 200. Cham: Springer, 2016. P. 242–258. https://doi.org/10.1007/978-3-319-68465-9_15
Gileva O. et al. Investigation of the Molybdenum Oxide Purification for the AMoRE Experiment // J. Radioanal. Nucl. Chem. 2017. V. 314. № 3. P. 1695–1700. https://doi.org/10.1007/s10967-017-5568-4
Shlegel V.N., Berge L., Boiko R.S. Purification of Molybdenum Oxide, Growth and Characterization of Medium Size Zinc Molybdate Crystals for the LUMINEU Program // EPJ Web Conf. 2014. V. 65. P. 03001:1-6. https://doi.org/10.1051/epjconf/20136503001
Хомяков А.В. и др. Примесная чистота препаратов МоО3 различных производителей // Неорган. материалы. 2016. Т. 52. № 3. С. 327–335. https://doi.org/10.1134/S0020168516030055
Аленков В.В. и др. Глубокая очистка изотопнообогащенных материалов для выращивания монокристаллов 40Са100МоО4 // Неорган. материалы. 2013. Т. 49. № 12. С. 1324–1327. https://doi.org/10.1134/S0020168513120029
Fairweather M.J., Rockandel M.A., Sadan A., Swinkels G.M. Process for the Recovery of Sodium Carbonate from Salt Mixtures // United States Cominco Ltd. (Vancouver, CA). Pat. № 4564508. 1986. http://www.freepatentsonline.com/4564508.html
Лукин П.M., Савельев A.Н., Савельев Н.И., Семенова O.A. Способ получения поваренной соли из естественного подземного рассола: Пат. № 2470862. Чувашский государственный университет имени И.Н. Ульянова (RU), 2012. http://www.freepatent.ru/ images/patents/147/2470862/patent-2470862.pdf
Wayne C. Hazen, Dale Lee Denham Jr., Rudolph Pruszko, David R. Baughman, Ralph B. Tacoma. Sodium Carbonate Recrystallization: Pat. № USOO6284.005B1. Environmental Projects, Inc., Casper, WY (US). 1998. https://patentimages.storage.googleapis.com/fb/fc/f2/ a2debad89c039b/US6284005.pdf
Pruiss C.E., Ford J. Process for Purification of Sodium Carbonate Crystals: Pat. № 3594119A. Cleveland, Tenn., assignors to Olin Mathieson Chemical Corporation. US 1971. https://patentimages.storage.googleapis.com/15/38/f0/76591bb3e9610f/US3594119.pdf
Geniesse D.J., Nordahl T.K., Hiatt K.B. Sodium Carbonate Monohydrate crystallization: Pat. № 2017/0029283 A1. Swenson Technology, Inc., Monee, IL. US 2017. http:// www.freepatentsonline.com/20170029283.pdf
Кустри Франсис М., Aнс Мишель. Способ получения кристаллов карбоната натрия: Пат. № 2466934. (RU). 2007. http://www.freepatent.ru/images/patents/112/2466934/patent-2466934.pdf
Мурский Г.Л., Невинчан O.M., Санду Р.A. Способ получения карбоната натрия Государственный орден трудового красного знамени научно-исследовательский институт химических реактивов и особо чистых химических веществ. Пат. № 2540659. 2013. http://www.freepatent.ru/images/img_patents/2/2540/2540659/patent-2540659.pdf
Crom K.D., Chiang Y.W., Gerven T.V., Santos R.M. Purification of Slag-derived Leachate and Selective Carbonation for High-quality Precipitated Calcium Carbonate synthesis // Chem. Eng. Res. Des. 2015. № 104. P. 180–190. https://doi.org/10.1016/j.cherd.2015.07.029
Steinhauser G. Cleaner Production in the Solvay Process: General Srategies and Recent Developments // J. Clean. Prod. 2008. V. 16. № 7. P. 833–841. https://doi.org/10.1016/j.jclepro.2007.04.005
Bakele W. New Developments in the Production of Heavy Soda-ash via Compacting Method // Powder Technology. 2003. V. 130. № 1–3. P. 253–256. https://doi.org/10.1016/S0032-5910(02)00201-2
Карякин, Ю.В., Ангелов И.И. Чистые химические вещества. Изд. 4-е, доп. и пер. М.: Химия, 1974. 408 с.
Seidell A. Solubilities of Inorganic and Metal Organic Compounds. Princeton: Van Nostrand Co., 1958.
Raugh F. Sodium Carbonate // Kirk-Othmer Encyclopedia of Chemical Technology (4th Edition). V. 1: A to Alkaloids. John N.Y.: Wiley & Sons, 2002. P. 522–528.
Киргинцев A.Н., Исаенко Л.И., Исаенко В.A. Распределение примесей при направленной кристаллизации. Новосибирск: Наука, 1977. 256 с.
Pillaca M. et al. Forced Convection by Inclined Rotary Bridgman Method for Growth of CoSb3 and FeSb2 Single Crystals from Sb-rich Solution // J. Cryst. Growth. 2017. № 475. P. 346–453. https://doi.org/10.1016/j.jcrysgro.2017.07.016
Shin K., Gileva O., Kim Y. et al. Reduction of Radioactivity in Sodium Iodide (NaI) Powder by Recrystallization Method // J. Radioanal. Nucl. Chem. 2018. № 317. P. 1329.https://doi.org/10.1007/s10967-018-6006-y
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы