Неорганические материалы, 2020, T. 56, № 8, стр. 865-872
Синтез наноструктурированного порошка Li4Ti5O12 глицин-нитратным и модифицированным глицин-нитратным методами
А. В. Жуков 1, *, С. В. Чижевская 1, Э. А. Стюф 1, Йе Ко Ко Хтун 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125480 Москва, ул. Героев Панфиловцев, 20, к. 1, Россия
* E-mail: a.zhukov@muctr.ru
Поступила в редакцию 29.11.2019
После доработки 05.02.2020
Принята к публикации 19.02.2020
Аннотация
Изучено влияние соотношения реагентов глицин : нитрат (G/N) и температуры термообработки на характеристики нанокристаллических порошков Li4Ti5O12, синтезированных из тетрабутилата титана и карбоната лития методом сжигания водно-органического прекурсора и его последующей термообработки. Установлено оптимальное соотношение G/N = 0.7, при котором содержание фазы Li4Ti5O12 после термообработки порошков в течение 2 ч при 700°С составляет 97%, а размер кристаллитов – 100 нм. Показано, что модифицирование глицин-нитратного метода путем введения в раствор лимонной кислоты (CitH3/ΣM = 0.37–0.56) позволяет повысить гомогенность компонентов в прекурсоре, что обеспечивает получение однофазных порошков.
ВВЕДЕНИЕ
Углеродные анодные материалы для литий-ионных батарей успешно используются в производстве портативной электроники. Но в электрохимических накопителях и электромобилях углеродные аноды не обеспечивают необходимые безопасность и производительность. Альтернативой углеродным материалам является пентатитанат лития Li4Ti5O12 (LTO), поскольку он отвечает требованиям безопасности, обладает высокой термической стабильностью и потенциально длительной стабильностью при цикловании. При интеркаляции ионов лития в кристаллическую решетку Li4Ti5O12 ее объем практически не увеличивается. Недостатки материала из Li4Ti5O12 – низкие значения коэффициента диффузии лития и удельной электрической проводимости – устраняются созданием дефектной структуры, уменьшением размера первичных частиц, допированием пентатитаната лития другими элементами, например углеродом. Повышению скорости диффузии Li+ в твердой фазе способствует увеличение межфазной поверхности [1, 2]. Улучшению ряда характеристик материала на основе LTO, в частности, повышению электронной проводимости, скорости диффузии, удельной емкости и стабильности при циклировании в последнее десятилетие посвящено множество работ [2], которые можно сгруппировать по принципу воздействия на материал: наноструктурирование, контроль морфологии, покрытие поверхности, допирование, создание композитов.
Обзор литературы по методам синтеза пентатитаната лития свидетельствует о том, что широко применяемый твердофазный метод из смеси TiO2 и Li2CO3 или LiOH требует высоких температур (выше 800°С) и длительной изотермической выдержки (12–24 ч) образцов. Однако несмотря на это, синтезированные порошки обычно имеют большой размер зерен и низкую удельную поверхность [2, 3].
Одним из методов, позволяющих синтезировать многокомпонентные порошки при более низких температурах, является глицин-нитратный метод [4–8]. При синтезе этим методом нанопорошков частично стабилизированного диоксида циркония установлено [9], что их свойства в основном определяются двумя факторами: соотношением реагентов глицин : нитрат (G/N) и температурой термообработки продукта сжигания прекурсора – “пепла”. На примере титаната стронция показано, что введение в нитратный раствор лимонной кислоты в качестве дополнительного комплексообразователя позволяет предотвратить выпадение осадка при приготовлении прекурсора [10] и тем самым обеспечить образование более однородного продукта.
Целью настоящей работы являлось установление влияния соотношения реагентов G/N и температуры термообработки “пепла” на характеристики порошков пентатитаната лития, синтезированных глицин-нитратным методом из тетрабутилата титана и карбоната лития, а также определение оптимального количества лимонной кислоты при синтезе Li4Ti5O12 модифицированным глицин-нитратным методом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходного соединения для синтеза Li4Ti5O12 использовали Li2CO3 “х. ч.”, тетрабутилат титана (С4H9O)4Ti “тех.”, глицин NH2CH2COOH “ч.”, лимонную кислоту C6H8O7 · H2O “х. ч.”, азотную кислоту HNO3 “ос. ч.”.
Синтез Li4Ti5O12 осуществляли следующим образом. Осадок, образовавшийся при гидролизе тетрабутилата титана дистиллированной водой, отделяли от раствора фильтрованием, промывали дистиллированной водой и растворяли в избытке концентрированной HNO3. К полученному раствору добавляли при перемешивании карбонат лития из расчета достижения соотношения Li : Ti = 4 : 5, лимонную кислоту (CitH3/ΣM = 0–1.85), а затем глицин в количестве, обеспечивающем соотношение его и суммарного количества нитрат-ионов в растворе G/N в интервале от 0.2 до 1.2:
(1)
${G \mathord{\left/ {\vphantom {G N}} \right. \kern-0em} N} = \frac{{n(Gly)}}{{n({\text{N}}{{{\text{O}}}_{3}})}},$Водно-органическую смесь упаривали в кварцевом стакане при температуре 80°С до состояния геля, который помещали в нагретую до 500°С муфельную печь на 5 мин. При этом происходило воспламенение, сопровождавшееся бурным выделением газообразных продуктов реакции и образованием твердого продукта реакции (“пепла”). С целью удаления соединений углерода, азота и формирования микроструктуры Li4Ti5O12 “пепел” подвергали термообработке в интервале температур 550–800°С (скорость нагрева 10°С/мин). Изотермическая выдержка во всех опытах составляла 2 ч.
Термообработку порошков проводили в муфельной печи KL 15/12 (ThermConcept). Рентгенофазовый анализ образцов, предварительно растертых в агатовой ступке, выполняли на дифрактометре D2 PHASER (Bruker) (Ni-фильтр, CuKα-изучение). Дифрактограммы снимали в интервале углов 10° ≤ 2θ ≤ 70° с шагом 0.02°. Фазы идентифицировали с использованием базы данных JCPDS PDF2. Морфологию порошков изучали на сканирующем электронном микроскопе Vega 3 (Tescan). Величину площади удельной поверхности определяли на приборе Quadrasorb SI/Kr (Quantachrome) методом низкотемпературной адсорбции азота.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе представляло интерес исследовать влияние соотношения реагентов G/N на характеристики порошков, синтезированных глицин-нитратным методом без добавки лимонной кислоты.
После термообработки при 500°С в зависимости от соотношения G/N синтезированные порошки (“пепел”) содержали разное количество соединений углерода, о чем свидетельствовали изменение их окраски с белой (G/N = 0.2) на серую (G/N = 0.4) и черную (G/N = 1.2).
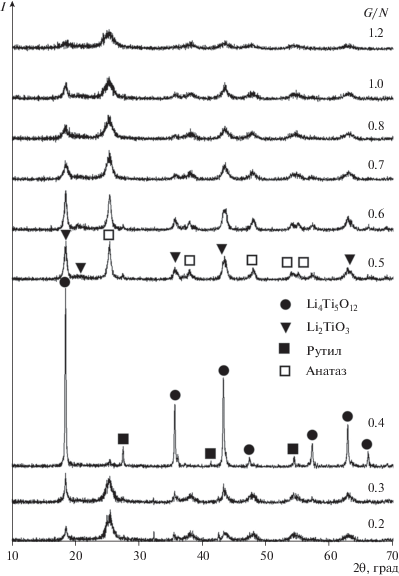
На рис. 1 представлены дифрактограммы порошков, синтезированных при разных значениях G/N (500°С).
Полученные результаты свидетельствуют о том, что, как и в случае диоксида циркония [9], молярное соотношение глицин : нитрат оказывает значительное влияние на фазовый состав образующихся фаз. Можно видеть, что при низких (0.2–0.3) и при высоких (≥0.7) соотношениях реагентов полученные порошки представляют собой плохо окристаллизованные вещества с небольшим (менее 17 мас. %) содержанием фазы целевого продукта Li4Ti5O12 (JCPDS № 49-0207) и высоким (55–70%) содержанием фазы анатаза (JCPDS № 73-1764). В образцах в небольшом количестве присутствует также фаза Li2TiO3 (JCPDS № 33-0831). С увеличением соотношения реагентов G/N до 0.5 содержание фаз Li4Ti5O12 и Li2TiO3 повышается до 25 и 35% соответственно, фазы анатаза снижается до 42%, появляется фаза рутила (JCPDS № 78-1509). Наибольшее содержание фазы Li4Ti5O12 (76%) наблюдалось в образцах, синтезированных при G/N = 0.4, когда, вероятно, достигается максимальная температура горения прекурсора (~600°C).
С целью изучения влияния температуры термообработки на фазовый состав порошков полученные при 500°С прекурсоры Li4Ti5O12 подвергали термообработке в интервале температур 550–800°С.
После термообработки при 550°С основными фазами в образцах являются Li2TiO3 и анатаз (при G/N = 0.4 основная фаза Li4Ti5O12). После термообработки при 600°С фаза анатаза исчезает и основными фазами являются Li2TiO3 и рутил. После термообработки при 650°С доминирующей фазой становится Li4Ti5O12, формирование которого практически завершается при 700°С, увеличение температуры термообработки до 800°С мало влияет на фазовый состав порошков.
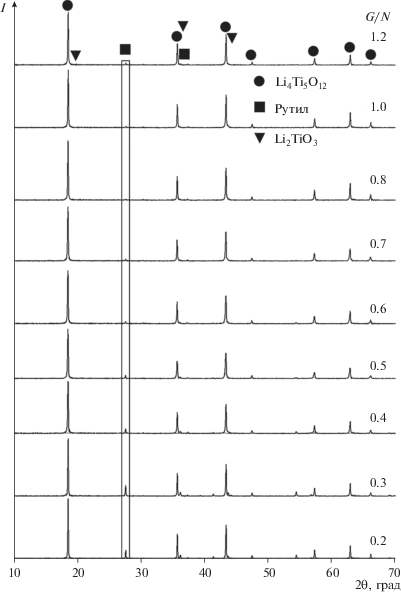
На рис. 2 приведены дифрактограммы образцов после термообработки при 700°С. В порошках, полученных при G/N = 0.2–0.6 и 1.2, присутствуют примеси фаз рутила и Li2TiO3, тогда как в образцах, полученных при G/N = 0.7–1.0, эти фазы практически отсутствуют.
Рис. 2.
Дифрактограммы порошков, синтезированных при разном соотношении реагентов G/N, после термообработки прекурсора при 700°С.
На рис. 3 представлена зависимость содержания фазы Li4Ti5O12 в образцах от соотношения реагентов G/N и температуры термообработки. Можно видеть, что содержание фазы Li4Ti5O12 в образцах коррелирует с указанными параметрами.
Рис. 3.
Влияние соотношения реагентов G/N и температуры термообработки прекурсоров на содержание в образцах фазы Li4Ti5O12.
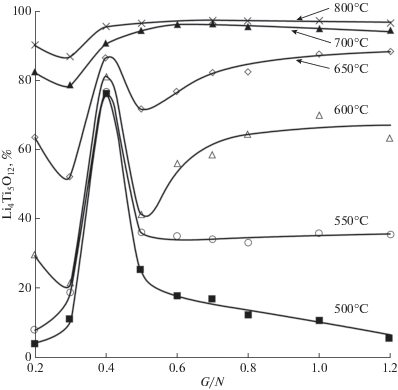
При G/N = 0.4 наблюдается экстремум, обусловленный формированием фазы Li4Ti5O12 в процессе горения вследствие разогрева системы до 600–650°С.
При соотношении G/N ≥ 0.5 и температуре ≥700°С содержание Li4Ti5O12 в порошке превышает 95%.
Анализ зависимостей свидетельствует о том, что оптимальным является соотношение G/N ~ 0.7, при котором после термообработки при 700°С содержание Li4Ti5O12 достигает 97% (в качестве примесных фаз в образце присутствуют рутил и Li2TiO3).
При более высоких соотношениях реагентов в выбранных условиях термообработки в образцах наблюдается снижение содержания Li4Ti5O12.
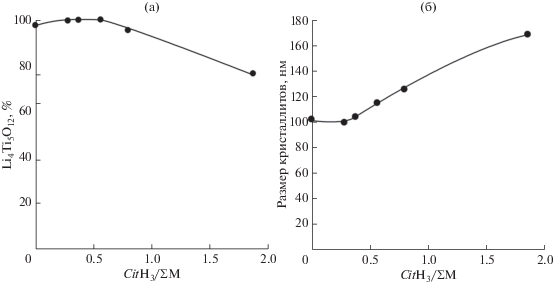
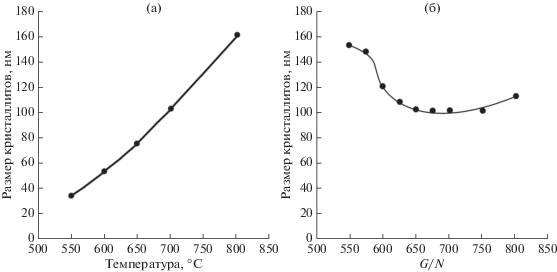
Как и следовало ожидать, средний размер кристаллитов фазы Li4Ti5O12 в образцах растет с повышением температуры термообработки прекурсора и при 700°С (G/N = 0.7) составляет 100 нм (рис. 4а). В порошках, синтезированных при разных соотношениях реагентов (700°C), с увеличением G/N от 0.2 до 0.7 размер кристаллитов снижается в 1.5 раза (рис. 4б).
Рис. 4.
Влияние температуры термообработки прекурсора (G/N = 0.7) (а) и соотношения реагентов G/N (б) на размер кристаллитов фазы Li4Ti5O12 в порошках после термообработки при 700°С (б).
По данным электронной микроскопии (рис. 5), образец Li4Ti5O12 (G/N = 0.7, 700°С) является нанокристаллическим материалом: пористые агломераты хлопьевидной формы длиной 20–80 и толщиной 1–2 мкм состоят из частиц размером 80–150 нм, которые плотно прилегают друг к другу.
Площадь удельной поверхности порошков (700°С), полученных при разных соотношениях реагентов, варьирует от 4.2 (G/N = 0.4) до 5.3 м2/г (G/N = 0.7).
В связи с тем, что при термообработке порошков в течение 2 ч в широком интервале температур не наблюдалось образования однофазного пентатитаната (из-за негомогенности системы при упаривании раствора наблюдалось выпадение белого осадка/геля полимеризованных соединений титана), представляло интерес модифицировать методику синтеза. Для предотвращения выпадения титана в осадок (удержания его в растворе) в качестве комплексообразователя использовали лимонную кислоту. Мольное соотношение лимонной кислоты к сумме катионов лития и титана (CitH3/ΣM) варьировали в интервале от 0 до 1.85.
Синтез порошков модифицированным глицин-нитратным методом осуществляли при соотношении реагентов G/N = 0.7 с последующей термообработкой прекурсора при 700°С (2 ч).
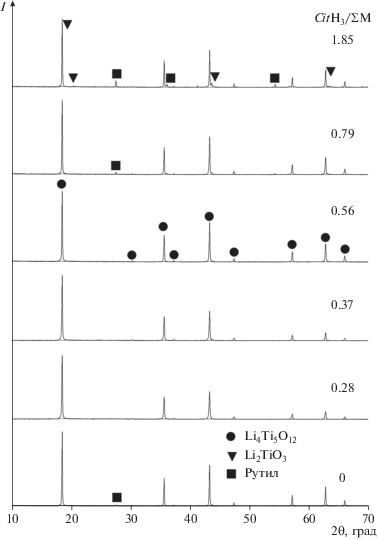
Установлено, что введение лимонной кислоты в нитратный раствор в соотношении CitH3/ΣM > 0.28 предотвращает выпадение титана в осадок.
На рис. 6 представлены дифрактограммы порошков пентатитаната лития, синтезированных модифицированным глицин-нитратным методом, при разном соотношении CitH3/ΣM. На дифрактограммах порошков, синтезированных при соотношениях CitH3/ΣM = 0.37–0.56, отсутствуют примесные фазы рутила и Li2TiO3. Увеличение содержания примесных фаз в образцах с соотношением CitH3/ΣM свыше 0.56 происходит, по-видимому, из-за снижения при твердофазном взаимодействии скорости диффузии компонентов системы вследствие неполноты сгорания органических реагентов. Содержание фазы Li4Ti5O12 в порошках, синтезированных при соотношениях CitH3/ΣM = = 0.37–0.56, близко к 100% (рис. 7а). При большем количестве лимонной кислоты наблюдаются снижение содержания фазы Li4Ti5O12 и рост размера кристаллитов со ~120 до 170 нм (рис. 7б).
Таким образом, порошки, синтезированные при G/N = 0.7 и соотношении CitH3/ΣM = 0.37–0.56, после термообработки при 700°С в течение 2 ч близки по содержанию Li4Ti5O12 к однофазным. На рис. 8 представлена морфология частиц образца пентатитаната лития, синтезированного в этих условиях. По данным электронной микроскопии, образцы пентатитаната лития состоят из сферических частиц размером 100–150 нм. Порошки являются более рыхлыми, чем синтезированные в сопоставимых условиях без добавления лимонной кислоты. Их удельная поверхность составляет 6 м2/г.
ЗАКЛЮЧЕНИЕ
Эксперименты по синтезу наноструктурированного пентатитаната лития глицин-нитратным методом подтвердили результаты ранее выполненных исследований: основными факторами, влияющими на состав и структурные характеристики Li4Ti5O12, являются соотношение реагентов глицин : нитрат (G/N) и температура термообработки порошка. При оптимальном соотношении G/N = 0.7 содержание фазы Li4Ti5O12 с размером кристаллитов 100 нм после термообработки порошков при 700°С в течение 2 ч составляет 97%.
Показано, что повышение гомогенности распределения компонентов в прекурсоре при введении в раствор лимонной кислоты в соотношениях CitH3/ΣM = 0.37–0.56 обеспечивает получение в указанных выше условиях термообработки однофазных порошков.
Список литературы
Whittingham M.S. Lithium Batteries and Cathode Materials // Chem. Rev. 2004. V. 104. P. 4271–4301. https://doi.org/10.1021/cr020731c
Zhao B., Ran R., Liu M., Shao Z. A Comprehensive Review of Li4Ti5O12-Based Electrodes for Lithium-Ion Batteries: The Latest Advancements and Future Perspectives // Mater. Sci. Eng., R. 2015. V. 98. P. 1–71. https://doi.org/10.1016/j.mser.2015.10.001
Zukalová M., Fabián M., Klusáčková M. et al. Li Insertion into Li4Ti5O12 Spinel Prepared by Low Temperature Solid State Route: Charge Capability vs Surface Area // Electrochim. Acta. 2018. V. 265. P. 480–487. https://doi.org/10.1016/j.electacta.2018.01.171
Wang J., Zhao H., Wen Y. et al. High Performance Li4Ti5O12 Material as Anode for Lithium-Ion Batteries // Electrochim. Acta. 2013. V. 113. P. 679–685. https://doi.org/10.1016/j.electacta.2013.09.086
Prakash A.S., Manikandan P., Ramesha K. et al. Solution-Combustion Synthesized Nanocrystalline Li4Ti5O12 as High-Rate Performance Li-Ion Battery Anode // Chem. Mater. 2010. V. 22. P. 2857–2863. https://doi.org/10.1021/cm100071z
Ashok A., Kumar A., Tarlochan F. Preparation of Nanoparticles via Cellulose-Assisted Combustion Synthesis // Int. J. Self-Propag. High-Temp. Synth. 2018. V. 27. P. 141–153. https://doi.org/10.3103/S1061386218030020
Wen W., Yao J.-C., Jiang C.-C., Wu J.-M. Solution-Combustion Synthesis of Nanomaterials for Lithium Storage // Int. J. Self-Propag. High-Temp. Synth. 2017. V. 26. P. 187–198. https://doi.org/10.3103/S1061386217030074
Kim G.-O., Hong J.-E., Ryu K.-S. Enhancement of High rate Performance and Diffusion Properties for Li4Ti5O12 Anode Materials by Carbon Additive // Mater. Res. Innovations. 2015. V. 19. P. 244–250. https://doi.org/10.1179/1433075X14Y.0000000237
Zhukov A.V., Chizhevskaya S.V., Klimenko O.M., Merkushkin A.O. Glycine-Nitrate Synthesis of Partially Yttrium-Stabilized Zirconium Nanopowders for Hard Ceramics // Glass Ceram. 2014. V. 70. P. 400–403.
Blennow P., Hansen K.K., Wallenberg L.R. et al. Synthesis of Nb-Doped SrTiO3 by a Modified Glycine-Nitrate Process // J. Eur. Ceram. Soc. 2007. V. 27. P. 3609–3612.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы