Неорганические материалы, 2021, T. 57, № 1, стр. 22-32
Моделирование кинетики роста вертикальных массивов углеродных нанотрубок на планарных подложках и алгоритма вычисления кинетических коэффициентов данного процесса
С. В. Булярский 1, *, А. В. Лакалин 1, М. С. Молоденский 1, А. А. Павлов 1, Р. М. Рязанов 2
1 Институт нанотехнологий микроэлектроники Российской академии наук
119991 Москва, Ленинский пр., 32А, Россия
2 Научно-производственный комплекс “Технологический центр”
124498 Зеленоград, Москва, пл. Шокина, 1, стр. 7, Россия
* E-mail: bulyar2954@mail.ru
Поступила в редакцию 01.04.2020
После доработки 10.09.2020
Принята к публикации 10.09.2020
Аннотация
Разработана физико-математическая модель роста углеродных нанотрубок и проведено сопоставление расчетов по этой модели с экспериментом. Экспериментальное выращивание массивов углеродных нанотрубок осуществлялось CVD-методом в потоке ацетилена, аммиака и аргона при температурах от 550 до 950°С. В качестве катализатора использовалась пленка никеля толщиной 4 нм на поверхности нитрида титана. Модель учитывает пиролиз углеводородов на поверхности наночастицы катализатора, формирование барьерного слоя на его поверхности, который замедляет и останавливает рост массива нанотрубок, взаимодействие вещества буферного слоя с углеродом в наночастице катализатора. При разработке модели рассмотрены механизмы протекания отдельных процессов и получены температурные зависимости кинетических коэффициентов, которые описывают рост нанотрубок. Именно эти зависимости обусловили хорошее совпадение расчетов с экспериментом.
ВВЕДЕНИЕ
В настоящее время широко ведутся работы по синтезу вертикальных массивов углеродных нанотрубок (УНТ) на кремниевых подложках, подготовленных методами планарной технологии [1]. Это связано с перспективами создания на их основе устройств наноэлектроники. Многочисленные эксперименты показывают тесную связь технологии синтеза со свойствами синтезированного массива УНТ и устройств на их основе. Поэтому надо понимать физико-химические механизмы, которые сопровождают рост массивов УНТ на кремниевых подложках.
Для синтеза используются подложки кремния, покрытые буферным слоем толщиной от 10 до 50 нм. Буферный слой чаще всего состоит из титана или нитрида титана, которые обладают проводящими свойствами [2]. В качестве катализатора используются, как правило, переходные металлы, которые наносятся на буферный слой в виде однокомпонентных или многокомпонентных покрытий [2–4]. Источником углерода являются ацетилен, метан, закись углерода и другие углеводороды. Таким образом, термодинамическая система, в которой растет массив УНТ, насчитывает большое количество компонентов, которые в процессе синтеза находятся в различных фазовых состояниях: газообразном, жидком и твердом. Соответственно, сам процесс синтеза состоит из ряда физико-химических процессов: пиролиза углеводородов, диффузии в газовой и жидкой фазах, растворения атомов в материале катализатора, пересыщения катализатора углеродом с последующим распадом твердого раствора на поверхности катализатора в виде растущей УНТ и других не менее важных процессов, которые оказывают влияние на кинетику роста нанотрубок [5, 6].
Обсуждение механизмов, которые сопровождают синтез УНТ, проводится достаточно широко [7–11]. Однако в большинстве случаев приводятся данные об условиях роста и результаты, к которым они приводят. Явления, сопровождающие рост нанотрубок, обсуждаются, как правило, в общем плане без необходимых вычислений. Существенно меньше работ посвящено моделированию механизмов роста [5, 6, 12–16]. Наиболее подробный анализ кинетики роста проведен в [5, 6, 16]. Однако и в этих работах некоторые параметры процессов подбираются путем сопоставления теоретической модели с экспериментальными результатами, что не всегда обосновано в полной мере.
Целью данной работы являются разработка и апробация модели роста массивов УНТ на планарных подложках с тонкопленочными катализаторами, которая опирается на систему кинетических уравнений, описывающих процесс синтеза нанотрубок, а также нахождение алгоритмов определения кинетических коэффициентов этих процессов.
ЭКСПЕРИМЕНТАЛЬНОЕ ВЫРАЩИВАНИЕ ВЕРТИКАЛЬНЫХ МАССИВОВ УНТ
Для анализа кинетики синтеза выбрана типовая система роста вертикальных массивов, а именно: тонкая пленка катализатора на кремниевой проводящей подложке с проводящим буферным слоем, которая является основой создания планарных наноэлектронных устройств с применением УНТ.
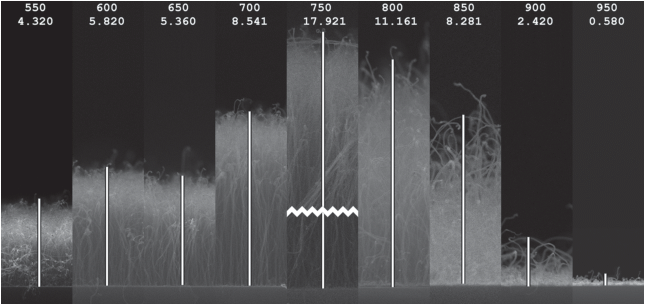
Формирование наночастиц катализатора и синтез многостенных углеродных нанотрубок (МУНТ) проводились на установке Nanofab 800 Agile. Пленки нитрида титана и никеля толщиной 20 и 4 нм наносились последовательно магнетронным способом на окисленные кристаллы кремния SiO2/Si (толщина слоя оксида кремния 200 нм). Установка позволяла контролируемо изменять общее давление в реакционной камере и потоки рабочих газов, причем каждого газа в отдельности. Эксперименты по росту вертикальных массивов нанотрубок проводились при следующих условиях. Формирование наночастиц катализатора осуществлялось при температуре 700°С в течение 20 мин в потоке аргона и аммиака. Синтез УНТ проходил в потоке смеси аргона, ацетилена и аммиака без включения плазмы в диапазоне температур от 550 до 950°С через каждые 50°С. В каждом случае длительность синтеза составляла 10 мин. Изображения массивов вертикальных нанотрубок, полученных при различных температурах синтеза, показаны на рис. 1.
Рис. 1.
Изображения массивов вертикальных нанотрубок, полученных при различных температурах синтеза (в верхней части каждого изображения указаны температура в °С и высота массива в мкм).
На рис. 2 представлена морфология растущих нанотрубок в виде изображений просвечивающего электронного микроскопа.
Наиболее совершенная структура нанотрубок наблюдается при температурах синтеза 700 и 750°С, при более низких температурах нанотрубки содержат большое количество дефектов, а при 800 и 850°С наблюдаются процессы двойникования.
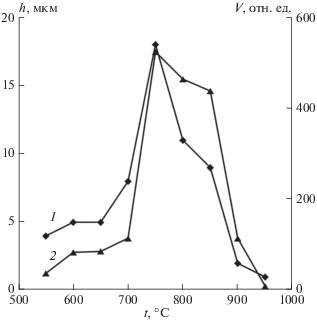
На рис. 3 показаны зависимости высоты массива и объема массива УНТ от температуры роста при общем давлении в реакторе 2 мм рт. ст. и потоках газов ацетилена, аргона, аммиака ${{J}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} = {{J}_{{{\text{Ar}}}}} = {{J}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$ = = 100 cм3/мин. Максимальные высоты массивов и количество углерода в них достигаются в области температур от 720 до 780°С.
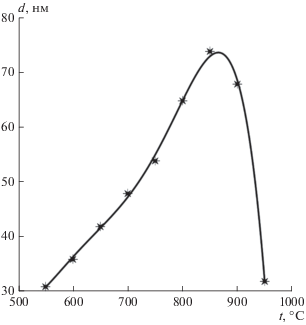
На рис. 4 представлена зависимость диаметра нанотрубок от температуры синтеза. С ростом температуры диаметр нанотрубок растет, что обусловлено увеличением количества углерода, поступающего в катализатор. При температурах выше 800°С буферный слой, состоящий из аморфного углерода и карбида титана, нарастает быстрее. Это тормозит поступление углерода в расплав катализатора и растущую трубку, поэтому ее диаметр уменьшается.
Рис. 4.
Зависимость диаметра УНТ от температуры синтеза: точки – эксперимент, сплошная линия – аппроксимация.
Представленные базовые эксперименты сравнивались с расчетами, которые приведены ниже.
МОДЕЛЬ ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ КАТАЛИТИЧЕСКОГО СИНТЕЗА УНТ
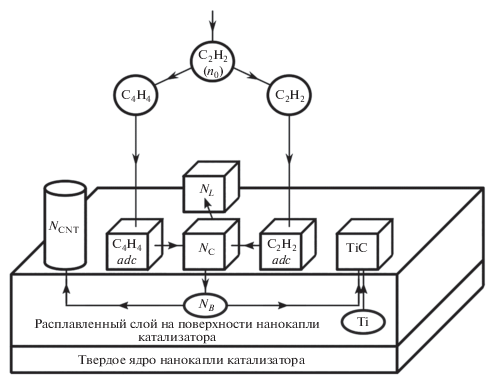
При разработке модели процессов каталитического синтеза УНТ принимались во внимание процессы, происходящие в газовой фазе, на поверхности наночастицы катализатора, растворение углерода в поверхностном расплавленном слое наночастицы катализатора, пересыщение расплава с распадом твердого раствора, приводящим к росту УНТ на поверхности катализатора, взаимодействие углерода с титаном, который находится в расплаве наряду с никелем, с образованием карбида титана. На рис. 5 схематично показаны основные процессы, протекающие на поверхности и внутри каталитической наночастицы, рассматриваемые в предлагаемой модели. Эти процессы описываются системой уравнений:
(1)
$\begin{gathered} \frac{{dN_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S}}}{{dt}} = \frac{1}{4}\sqrt {\frac{{8{{k}_{B}}T}}{{\pi {\kern 1pt} {{m}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}} {{n}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}\exp \left( { - \frac{{{{E}_{{a{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{k}_{B}}T}}} \right) \times \\ \times \,\,{{S}_{0}}\left( {1 - \frac{{N_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S}}}{{{{\alpha }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}} - \frac{{N_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S}}}{{{{\alpha }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}} \right. - \\ \left. { - \,\,\frac{{N_{{{\text{TiC}}}}^{S}}}{{{{\alpha }_{{{\text{TiC}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{\text{TiC}}}}}}} - \frac{{{{N}_{L}}}}{{{{\alpha }_{L}}{\kern 1pt} {{S}_{0}}{{n}_{{mL}}}}} - \frac{{{{N}_{{\text{C}}}}}}{{{{\alpha }_{{\text{C}}}}{{S}_{0}}{{n}_{{m{\text{C}}}}}}}} \right) - \\ - \,\,k_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{cat}}N_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S}; \\ \end{gathered} $(2)
$\begin{gathered} \frac{{dN_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S}}}{{dt}} = \frac{1}{4}\sqrt {\frac{{8{{k}_{B}}T}}{{\pi {\kern 1pt} {{m}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}} {{n}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}\exp \left( { - \frac{{{{E}_{{a{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}{{{{k}_{B}}T}}} \right) \times \\ \times \,\,{{S}_{0}}\left( {1 - \frac{{N_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S}}}{{{{\alpha }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}} - \frac{{N_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S}}}{{{{\alpha }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}} \right. - \\ \left. { - \,\,\frac{{N_{{{\text{TiC}}}}^{S}}}{{{{\alpha }_{{{\text{TiC}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{\text{TiC}}}}}}} - \frac{{{{N}_{L}}}}{{{{\alpha }_{L}}{\kern 1pt} {{S}_{0}}{{n}_{{mL}}}}} - \frac{{{{N}_{{\text{C}}}}}}{{{{\alpha }_{{\text{C}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{\text{C}}}}}}}} \right) - \\ - \,\,k_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{{cat}}N_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S}; \\ \end{gathered} $(3)
$\frac{{d{{N}_{{\text{C}}}}}}{{d\tau }} = k_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{cat}}N_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S} + k_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{{cat}}N_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S} - {{k}_{{cl}}}{{N}_{{\text{C}}}} - {{k}_{{sb}}}{{N}_{{\text{C}}}};$(5)
$\frac{{d{{N}_{B}}}}{{d\tau }} = {{k}_{{sb}}}{{N}_{{\text{C}}}} - {{k}_{t}}{{N}_{B}} - {{k}_{{{\text{TiC}}}}}{{N}_{B}}{{N}_{{{\text{Ti}}}}};$(6)
$\frac{{dN_{{{\text{TiC}}}}^{S}}}{{d\tau }} = {{k}_{{{\text{TiC}}}}}{{N}_{B}}{{N}_{{{\text{Ti}}}}};$Рис. 5.
Основные процессы, протекающие на поверхности и внутри каталитической наночастицы при синтезе УНТ, рассматриваемые в предлагаемой модели.
с начальными условиями:
Здесь $N_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S}$ – число молекул ацетилена C2H2, осевших на поверхности каталитической наночастицы; $N_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S}$ – число молекул винилацетилена C4H4, осевших на поверхности каталитической наночастицы; ${{N}_{{{\text{Ti}}}}}$ – количество атомов титана внутри каталитической наночастицы; $N_{{{\text{Ti}}}}^{0}$ – начальное количество атомов титана внутри каталитической наночастицы; $N_{{{\text{TiC}}}}^{S}$ – количество молекул карбида титана TiC в твердой фазе на поверхности каталитической наночастицы; ${{k}_{{{\text{TiC}}}}}$ – коэффициент образования молекул карбида титана; ${{N}_{{\text{C}}}}$ – число атомов углерода на поверхности каталитической наночастицы, появившихся в результате каталитического разложения молекул ацетилена и винилацетилена; ${{N}_{L}}$ – число атомов углерода, попавших в углеродистый слой на поверхности каталитической наночастицы; ${{N}_{B}}$ – количество атомов углерода в неупорядоченном поверхностном слое толщиной ${{\Delta }_{m}}$; ${{N}_{T}}$ – число атомов углерода, попадающих в нанотрубку из неупорядоченного поверхностного слоя; ${{n}_{{m{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ – поверхностная плотность монослоя молекул ацетилена на поверхности каталитической наночастицы (количество атомов на 1 cм2); ${{\alpha }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ – число монослоев (полагается ${{\alpha }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} = 1$); ${{n}_{{m{{{\text{C}}}_{4}}{{{\text{H}}}_{4}}}}}$ – поверхностная плотность монослоя молекул винилацетилена C4H4 на поверхности каталитической наночастицы; ${{\alpha }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}$ – число монослоев (полагается ${{\alpha }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}} = 1$); ${{n}_{{m{\text{TiC}}}}}$ – поверхностная плотность монослоя молекул карбида титана на поверхности каталитической наночастицы; ${{\alpha }_{{{\text{TiC}}}}}$ – число монослоев (полагается ${{\alpha }_{{{\text{TiC}}}}} = 1$); ${{n}_{{m{\text{C}}}}}$ – поверхностная плотность монослоя атомов свободного углерода на поверхности каталитической наночастицы, ${{\alpha }_{{\text{C}}}}$ – число монослоев (полагается ${{\alpha }_{{\text{C}}}} = 1$); ${{n}_{{mL}}}$ – поверхностная плотность монослоя атомов углерода в углеродистом слое на поверхности каталитической наночастицы, ${{\alpha }_{L}}$ – число монослоев (полагается ${{\alpha }_{L}} = 1$); ${{S}_{0}} = 2\pi {{R}^{2}}$ – площадь поверхности каталитической наночастицы (полусферы); $R$ – радиус каталитической наночастицы; ${{k}_{{{\text{TiC}}}}}{{N}_{B}}{{N}_{{{\text{Ti}}}}}$ – скорость образования карбида титана из атомов титана и углерода; $k_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{cat}}N_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S}$ – скорость каталитического разложения молекул ацетилена; $k_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{{cat}}N_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S}$ – скорость каталитического разложения молекул винилацетилена.
Уравнения (1) и (2) системы описывают образование на поверхности катализатора буферного слоя, который состоит из ацетилена и винилацетилена, адсорбированных на поверхности катализатора, карбида титана ($N_{{{\text{TiC}}}}^{S}$), который образуется из атомов титана и углерода, растворенных в катализаторе, аморфного углерода (${{N}_{L}}$) и свободного углерода (${{N}_{{\text{C}}}}$), образующихся в результате пиролиза углеводородов на поверхности катализатора. Адсорбированные углеводороды и свободный углерод способствуют росту УНТ, а аморфный углерод и карбид титана постепенно покрывают всю поверхность катализатора и препятствуют проникновению свободного углерода с поверхности в объем. В результате рост УНТ начинает замедляться.
Уравнение (3) описывает кинетику образования свободного углерода на поверхности катализатора, ур-е (4) – переход свободного углерода в аморфный слой на поверхности катализатора, ур-е (5) описывает изменение количества углерода в расплаве катализатора, (6) – образование карбида титана, (7) – захват углерода из катализатора в нанотрубку, ур-е (8) – баланс титана между его расплавом и карбидом.
Рассмотрим более подробно смысл кинетических коэффициентов, которые входят в уравнения, и оценим их величину.
В расплаве никеля растворяется углерод, который образуется при пиролизе ацетилена на поверхности катализатора. Расплав никеля взаимодействует с буферным слоем из нитрида титана, в результате чего титан растворяется в нем. Доля растворенного титана в расплаве никеля может достигать 10% [17]. Растворимость азота в твердом и жидком никеле незначительна, и его доля в расплаве составляет менее 0.0018% [17]. Поэтому последний процесс не учитывается.
Ацетилен в газовой фазе демонстрирует высокую склонность к полимеризации продуктов пиролиза [18]. При этом эффективность термического разложения ацетилена существенно ниже, чем эффективность пиролиза на катализаторе, энергия активации которого 0.6 эВ [19]. Она меньше энергии пиролиза в газовой фазе практически в три раза. Поэтому при расчетах мы будем принимать во внимание только пиролиз на катализаторе. В продуктах термического пиролиза в газовой фазе преобладают полимерные молекулы [18]. Как показывают экспериментальные результаты работы [18], концентрация винилацетилена в газовой смеси реактора при температурах синтеза УНТ не превышает 10% от концентрации ацетилена. Ацетилен и винилацетилен, которые в газовой фазе содержатся в наибольших количествах [18], адсорбируются на поверхности катализатора. Они участвуют в выделении свободного углерода и росте нанотрубок, поэтому в дальнейшем будем называть их реакционными. Энергии адсорбции составляют ${{E}_{{a{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ = 0.2 эВ для ацетилена и ${{E}_{{a{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}$ = 0.5 эВ [20] для винилацетилена. Газы в реакторе можно считать идеальными, так как общее давление в системе не превышает 2 мм рт. ст. Поэтому число столкновений молекул газов с поверхностью катализатора рассчитывается на основании формул классической молекулярной физики. Тогда вероятность адсорбции молекул на наночастице катализатора принимает вид
(9)
$\begin{gathered} {{P}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} = \frac{1}{4}\sqrt {\frac{{8{{k}_{B}}T}}{{\pi {\kern 1pt} {{m}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}} {{n}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}\exp \left( { - \frac{{{{E}_{{a{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{k}_{B}}T}}} \right), \\ {{P}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}} = \frac{1}{4}\sqrt {\frac{{8{{k}_{B}}T}}{{\pi {\kern 1pt} {{m}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}} {{n}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}\exp \left( { - \frac{{{{E}_{{a{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}{{{{k}_{B}}T}}} \right), \\ \end{gathered} $Вероятность адсорбции $\frac{1}{4}\sqrt {\frac{{8{{k}_{B}}T}}{{\pi {\kern 1pt} {{m}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}} {{n}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ × × $\exp \left( { - \frac{{{{E}_{{a{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{k}_{B}}T}}} \right)$имеет следующий физический смысл. Как известно, в идеальном газе количество ударов молекул о стенку в единицу времени на единицу поверхности равно $\nu = \frac{{n\left\langle v \right\rangle }}{4}$, где n – концентрация молекул в газе, $\left\langle v \right\rangle = \sqrt {\frac{{8{{k}_{B}}T}}{{\pi {\kern 1pt} m}}} $ – средняя скорость теплового движения молекулы. Поэтому произведение $\frac{1}{4}\sqrt {\frac{{8{{k}_{B}}T}}{{\pi {\kern 1pt} {{m}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}} {{n}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ равно количеству ударов молекул ацетилена на единицу поверхности каталитической наночастицы в единицу времени. Множитель $\exp \left( { - \frac{{{{E}_{{a{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{k}_{B}}T}}} \right)$ характеризует вероятность адсорбции одной молекулы ацетилена на каталитической наночастице. Таким образом, вероятность адсорбции равна количеству молекул ацетилена, “прилипающих” к единице поверхности каталитической наночастицы в единицу времени. Умножив вероятность адсорбции на площадь открытой части поверхности каталитической наночастицы ${{S}_{0}}\left( {1 - \frac{{N_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{S}}}{{{{\alpha }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}} \right.$ – $\frac{{N_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{S}}}{{{{\alpha }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}$ – $\frac{{N_{{{\text{TiC}}}}^{S}}}{{{{\alpha }_{{{\text{TiC}}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{\text{TiC}}}}}}}$ – $\frac{{{{N}_{L}}}}{{{{\alpha }_{L}}{\kern 1pt} {{S}_{0}}{{n}_{{mL}}}}}$ – $\left. {\frac{{{{N}_{{\text{C}}}}}}{{{{\alpha }_{{\text{C}}}}{\kern 1pt} {{S}_{0}}{{n}_{{m{\text{C}}}}}}}} \right)$, получим количество молекул ацетилена, “прилипающих” ко всей наночастице катализатора в единицу времени. Аналогичные соотношения имеют место и для молекул винилацетилена.
Рассмотрим процессы на поверхности катализатора. В первую очередь происходит дегидрогенизация молекул ацетилена и винилацетилена в результате их каталитического разложения, кинетические коэффициенты которых имеют вид:
(10)
$\begin{gathered} k_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{cat}} = k_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{0cat}}\exp \left( { - \frac{{E_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{cat}}}}{{{{k}_{B}}T}}} \right), \\ k_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{{cat}} = k_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{{0cat}}\exp \left( { - \frac{{E_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}^{{cat}}}}{{{{k}_{B}}T}}} \right), \\ \end{gathered} $Предэкспоненциальный множитель $k_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{0cat}}$ можно оценить исходя из изменения энтропии реакции образования атома углерода. Он пропорционален количеству адсорбированных атомов ацетилена, умноженному на энтропийный фактор. Константа равновесия реакции [21] выражается как
(11)
$k_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{{0cat}} = \exp ({{ - \Delta {{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{ - \Delta {{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}} {{{k}_{B}}}}} \right. \kern-0em} {{{k}_{B}}}}){{n}_{{m{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}2\pi {\kern 1pt} {{R}^{2}},$Реакцию с участием катализатора можно записать в виде С2H2 + 3Ni ↔ Ni3C + C + H2, энтропию химической реакции при средней температуре синтеза можно вычислить с помощью справочника [23]. Расчеты дают величину для энтропийного множителя $\exp ({{ - \Delta {{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{ - \Delta {{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}} {{{k}_{B}}}}} \right. \kern-0em} {{{k}_{B}}}})$ = 6 × 106, для аналогичного множителя винилацетилена получена величина 2 × 103.
Часть свободного углерода, который образовался на поверхности катализатора, растворяется в его объеме, а часть собирается в виде островков, которые образуют на поверхности аморфный углеродистый слой. Кинетический коэффициент этого процесса
где ${{A}_{{cl}}}$ – предэкспоненциальный множитель кинетического коэффициента, ${{E}_{{cl}}}$ – энергия миграции свободного углерода по поверхности катализатора и присоединения его к барьерному слою. В данной модели предполагается, что аморфный углеродистый слой является нерастворимым. Значение предэкспоненциального множителя ${{A}_{{cl}}}$ было взято из [5]. Согласно данным этой работы, при $T = 575^\circ {\text{C}}$ коэффициент равен ${{k}_{{cl}}} = 3 \times {{10}^{{ - 3}}}$ с–1 для ${{E}_{{cl}}} = 0$, отсюда ${{A}_{{cl}}} = {{k}_{{cl}}}$.Для того чтобы вычислить коэффициент распределения (${{k}_{{r{\text{C}}}}}$), будем считать, что на границе между слоем свободного углерода и катализатором существует равновесие. В этом случае имеет место равенство химических потенциалов в твердой (слой углерода) и жидкой фазах (расплав на поверхности катализатора):
(13)
$\begin{gathered} \mu _{{\text{C}}}^{S} = \mu _{{\text{C}}}^{{\text{o}}} + kT\ln \left( {\frac{{{{N}_{{\text{C}}}}}}{{N_{{\text{C}}}^{{sat}}}}} \right) = \\ = \,\,\mu _{{\text{C}}}^{L} = \mu _{{\text{C}}}^{{\text{o}}} + kT\ln \left( {{{\gamma }_{{\text{C}}}}x_{{\text{C}}}^{L}} \right), \\ \end{gathered} $(14)
$x_{{\text{C}}}^{L} = \frac{{{{a}^{3}}{{N}_{B}}}}{{2\pi {\kern 1pt} {{R}^{2}}{{\Delta }_{m}}}},$Коэффициент активности вычисляется из ликвидуса двойной диаграммы C–Ni в области 0–10% углерода. В этой области уравнение ликвидуса имеет вид [25, 26]:
(15)
${{T}_{L}} = \frac{{\Delta H_{m}^{{{\text{Ni}}}} + \theta {{{\left( {1 - x_{{\text{C}}}^{L}} \right)}}^{2}}}}{{\Delta S_{m}^{{{\text{Ni}}}} - R\ln (x_{{\text{C}}}^{L}) + b{{{\left( {1 - x_{{\text{C}}}^{L}} \right)}}^{2}}}},$Из формул (13)–(15) получаем коэффициент распределения углерода в расплаве никеля
(16)
${{k}_{{r{\text{C}}}}} = \frac{{{{N}_{В}}}}{{{{N}_{{\text{C}}}}}} = \frac{{{{\Delta }_{m}}}}{{{{n}_{{m{\text{C}}}}}{{a}^{3}}}}\exp \left( { - \frac{{{{\Omega }_{{\text{C}}}}}}{{{{{\text{k}}}_{B}}T}}} \right),$Кроме того, для растворения атома углерода в никеле без учета взаимодействия с поверхностью надо преодолеть энергию ${{E}_{{rb}}} = 0.88$ эВ, которую можно вычислить из кривой солидуса двойной диаграммы Ni–C в области малых концентраций углерода. Окончательно для вероятности перехода частицы в объем катализатора получаем
(17)
$\begin{gathered} {{k}_{{sb}}} = {{\nu }_{{\text{C}}}}\frac{{{{\Delta }_{m}}}}{{{{n}_{{m{\text{C}}}}}{{a}^{3}}}}\exp \left( { - \frac{{{{\Omega }_{{\text{C}}}}}}{{{{{\text{k}}}_{B}}T}}} \right) \times \\ \times \,\,\exp \left( { - \frac{{2{{a}^{3}}\sigma }}{R}\frac{1}{{{{{\text{k}}}_{B}}T}}} \right)\exp \left( { - \frac{{{{E}_{{rb}}}}}{{{{{\text{k}}}_{B}}T}}} \right), \\ \end{gathered} $,Помимо углерода, в расплавленном слое катализатора также присутствуют атомы титана, которые попадают в расплав из буферного слоя нитрида титана [2]. Углерод, проникая в катализатор, формирует карбиды никеля и титана. Карбид титана обладает высокой температурой плавления и является очень стабильным соединением, о чем свидетельствует большая теплота образования (–183 кДж/K) и большое изменение свободной энергии при образовании из элементов (–236 кДж/(K моль)) [28, 29]. Образование таких соединений идет активно и до полного истощения одного из компонентов. В отличие от карбида титана для карбида никеля эти величины малы, он легко разлагается на фронте формирования нанотрубки, поставляя углерод для ее роста. Так как углерод поступает в катализатор с поверхности, то именно на его поверхности формируется карбид титана, который первоначально образует островки. Эти островки входят в состав барьерного слоя, который препятствует дальнейшему поступлению углерода в каплю катализатора
(18)
$\begin{gathered} {{k}_{{{\text{TiC}}}}} = {{\nu }_{{{\text{Ti}}}}}\frac{{{{\Delta }_{m}}}}{{{{n}_{{m{\text{TiC}}}}}{{a}^{3}}}}\exp \left( { - \frac{{{{\Omega }_{{{\text{Ti}}}}}}}{{{{{\text{k}}}_{B}}T}}} \right) \times \\ \times \,\,\exp \left( { - \frac{{2{{a}^{3}}\sigma }}{R}\frac{1}{{{{{\text{k}}}_{B}}T}}} \right)\exp \left( { - \frac{{{{E}_{{{\text{TiC}}}}}}}{{{{{\text{k}}}_{B}}T}}} \right). \\ \end{gathered} $Количество растворенного титана можно определить с помощью коэффициента распределения, который рассчитывается по двойной диаграмме Ni–Ti аналогично коэффициенту растворения углерода в никеле по формулам (13)–(15). Параметр взаимодействия, который вычислен из ликвидуса этой диаграммы, равен ΩTi = –0.0001Т + + 1.9 эВ, энергия ${{E}_{{{\text{TiC}}}}} = 2.8$ эВ.
Рост УНТ осуществляется в результате пересыщения расплава углеродом и распада раствора, снимающего состояние пересыщения, с выделением углерода на поверхности, где его атомы агрегируются в УНТ. Величина кинетического коэффициента, описывающего рост нанотрубки, имеет вид
(19)
$\begin{gathered} {{k}_{t}} = 4\pi a{{D}_{{\text{C}}}}\frac{{{{2\pi R} \mathord{\left/ {\vphantom {{2\pi R} {(1.5{{d}_{0}})}}} \right. \kern-0em} {(1.5{{d}_{0}})}}}}{{2\pi {{R}^{2}}{{\Delta }_{m}}}} \times \\ \times \,\,\exp \left( { - \frac{{2{{a}^{3}}\sigma }}{R}\frac{1}{{{{{\text{k}}}_{B}}T}}} \right)\exp \left( { - \frac{{{{E}_{{{\text{CNT}}}}}}}{{{{{\text{k}}}_{B}}T}}} \right), \\ \end{gathered} $РАСЧЕТ КИНЕТИКИ РОСТА НАНОТРУБОК
Для вычисления количества углерода, которое поступает в растущую трубку, надо решить систему уравнений (1)–(8).
В выражениях (1)–(9) присутствуют концентрации молекул ацетилена ${{n}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ и винилацетилена ${{n}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}$ в газовой фазе. Эти концентрации зависят от условий проведения синтеза УНТ и определяются технологическими параметрами: общим давлением смеси газов в реакторе ${{p}_{{total}}}$ и расходами компонентов смеси ${{J}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}},{{J}_{{{\text{Ar}}}}},{{J}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$ (cм3/мин). Можно показать, что парциальное давление i-го компонента на входе в реактор $p_{{0\;i}}^{g}$ можно оценить по выражению $p_{{0i}}^{g} = \frac{{{{M}_{i}}{{J}_{i}}}}{{\sum\nolimits_{k = 1}^m {{{M}_{k}}{{J}_{k}}} }}{{p}_{{total}}}$, где Mi – молярная масса i-го компонента (i = C2H2, NH3, Ar). Тогда концентрация молекул ацетилена на входе реактора будет
(20)
$\begin{gathered} {{n}_{{0\;{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} = \frac{{p_{{0\;{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}^{g}}}{{{{k}_{B}}T}} = \\ = \frac{{{{M}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}{{J}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{M}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}{{J}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} + {{M}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}{{J}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}} + {{M}_{{{\text{Ar}}}}}{{J}_{{{\text{Ar}}}}}}}\frac{{{{p}_{{total}}}}}{{{{k}_{B}}T}}. \\ \end{gathered} $В результате пиролитического разложения ацетилена в газовой фазе образуются различные соединения, например, C4H4, C6H6, C2H4, CH4 и др. [18]. В рассматриваемом диапазоне температур наибольшее количество углерода (до 5%) содержится в молекулах винилацетилена C4H4, а в остальных молекулах его значительно меньше. Поэтому из всех продуктов пиролиза в газовой фазе будем рассматривать только винилацетилен, пренебрегая остальными. Пусть в результате пиролиза доля атомов углерода во всех молекулах винилацетилена равна ${{\eta }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}} = 0.05$. Соответственно, в оставшихся молекулах ацетилена доля углерода составит ${{\eta }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} = 0.95$ (${{\eta }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{2}}}}} + {{\eta }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}} = 1$). В одной молекуле ацетилена содержится ${{z}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} = 2$ атома углерода, а в одной молекуле винилацетилена – ${{z}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}} = 4$ атома. Тогда концентрация ацетилена в реакторе вблизи катализатора будет
(21)
${{n}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}} = \frac{{(2{{n}_{{0\;{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}){{\eta }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}}{{{{z}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}}},$а концентрация винилацетилена –
(22)
${{n}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}} = \frac{{(2{{n}_{{{\text{0}}\,\,{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}){{\eta }_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}{{{{z}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}}}.$Формулы (20)–(22) позволяют рассчитать концентрации ${{n}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$ и ${{n}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}}}}}$ в зависимости от значений параметров ${{p}_{{total}}}$, ${{J}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$, ${{J}_{{{\text{Ar}}}}}$, ${{J}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$, которые задаются в процессе синтеза УНТ.
Формирование наночастиц катализатора на поверхности буферного слоя зависит от температуры. Поэтому в расчетах учитывалась экспериментальная зависимость диаметра каталитической наночастицы от температуры синтеза. Многочисленные результаты показывают, что средний диаметр нанотрубки примерно равен диаметру наночастицы катализатора [31–34]. В связи с этим при расчетах диаметр нанотрубки принимался равным диаметру каталитической наночастицы. Экспериментальная зависимость этого диаметра приведена на рис. 4. Она аппроксимировалась аналитической функцией $d(T)$, которая учитывает поступление углерода в катализатор и его диффузию к месту образования нанотрубки, а затем применялась для вычисления радиуса нанотрубки.
На рис. 6 проведено сопоставление экспериментальной зависимости высоты массива УНТ от температуры синтеза в интервале температур 550–950°C и результатов расчетов. Кривая 1 – расчет согласно предлагаемой модели по формулам (1)–(8), (10)–(12), (17)–(22) в случае, когда предэкспоненциальные множители кинетических коэффициентов зависят от температуры. Для сравнения на рис. 6 приводится график, когда предэкспоненциальные множители кинетических коэффициентов постоянны (значения зафиксированы при температуре 750°C), – кривая 2. Видно небольшое различие в области низких температур, а в при высоких температурах кривые 1 и 2 практически совпадают. На рис. 6 также показаны расчеты высоты УНТ согласно модели Пурецкого [5] – кривая 3. Видно, что модель Пурецкого недостаточно точно описывает экспериментальные точки. По сравнению с кривыми 1 и 2 кривая 3 имеет бóльшую ширину на половине высоты.
Рис. 6.
Сравнение рассчитанных зависимостей высоты массива УНТ от температуры синтеза: 1 – расчет согласно предложенной модели по формулам (1)–(8), (10)–(12), (17)–(22); 2 – расчет согласно предложенной модели, когда предэкспоненциальные множители кинетических коэффициентов постоянны (значения зафиксированы при температуре 750°C); 3 – расчет согласно модели [5]; точки – экспериментальные данные.
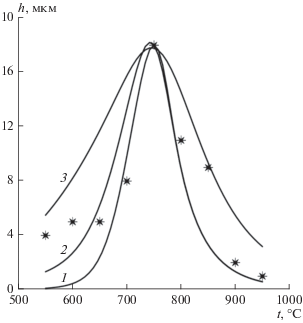
Сопоставление расчетов с экспериментом позволяет сделать вывод, что температурные зависимости всех физических величин, входящих в уравнения модели, играют существенную роль для описания кинетики роста нанотрубок.
ЗАКЛЮЧЕНИЕ
Разработана физико-математическая модель роста УНТ. В отличие от моделей предыдущих авторов она включает взаимодействие вещества буферного слоя с углеродом в наночастицах катализатора, которое приводит к увеличению скорости образования барьерного слоя на поверхности катализатора и остановке роста массива нанотрубок. Кроме того, учтен ряд важных факторов, которые оказывают доминирующее влияние на рост нанотрубок. Это касается значений кинетических коэффициентов. Например, в работе [5], в которой разработана достаточно адекватная модель роста нанотрубок, большинство кинетических коэффициентов подбиралось таким образом, чтобы расчеты наилучшим образом соответствовали экспериментальным результатам. Однако количество коэффициентов большое. Практика моделирования показывает, что этого согласия можно добиться различным сочетанием значений коэффициентов. Кроме того, механизмы протекания процессов, влияние различных факторов в реакционной камере остаются недостаточно ясными. Поэтому в данной работе последовательно применялся подход расчета кинетических коэффициентов исходя из модели протекающего процесса. При дальнейших расчетах коэффициенты не подгонялись. Такой подход не только позволил вскрыть механизмы отдельных процессов, но и дал возможность выяснить температурные зависимости кинетических коэффициентов. В конечном итоге именно эти зависимости позволили достичь наилучшего согласия расчетов и экспериментов, что доказывают результаты, приведенные на рис. 6.
Список литературы
Bulyarskiy S., Saurov A. Doping of Carbon Nanotubes. Cham: Springer International Publishing, 2017. https://doi.org/10.1007/978-3-319-55883-7
Булярский С.В., Зенова Е.В., Лакалин А.В., Молоденский М.С., Павлов А.А., Тагаченков А.М., Терентьев А.В. Влияние буферного слоя на формирование катализатора на основе тонкой пленки никеля для синтеза углеродных нанотрубок // ЖТФ. 2018. Т. 88. № 12. С. 1873–1879. https://doi.org/10.21883/JTF.2018.12.46791.50-18
Hu M.H., Murakami Y., Ogura M., Maruyama S., Okubo T. Morphology and Chemical State of Co-Mo Catalysts for Growth of Single-walled Carbon Nanotubes Vertically Aligned on Quartz Substrates // J. Catal. 2004. V. 225. № 1. P. 230–239. https://doi.org/10.1016/j.jcat.2004.04.013
Громов Д.Г., Булярский С.В., Дубков С.В., Павлов А.А., Скорик С.Н., Трифонов А.Ю., Шулятьев А.С., Шаман Ю.П., Кицюк Е.П., Дудин А.А., Сиротина А.П., Гаврилов С.А. Встраиваемый в технологию процесс CVD-роста УНТ с использованием каталитических тонких пленок Ct–Me–N–O // Микроэлектроника. 2017. Т. 46. № 2. С. 83–90. https://doi.org/10.7868/S054412691702003X
Puretzky A.A., Geohegan D.B., Jesse S., Ivanov I.N., Eres G. In Situ Measurements and Modeling of Carbon Nanotube Array Growth Kinetics During Chemical Vapor Deposition // Appl. Phys. A. 2005. V. 81. P. 223–240. https://doi.org/10.1007/s00339-005-3256-7
Булярский С.В., Лакалин А.В., Павлов А.А., Дудин А.А., Кицюк Е.П., Еганова Е.М., Сиротина А.П., Шаманаев А.А. Модель ограничения скорости роста углеродных нанотрубок на тонкопленочных катализаторах // ПЖТФ. 2017. Т. 43. № 8. С. 3–9. https://doi.org/10.21883/PJTF.2017.08.44528.16328
Dasgupta K., Joshi J.B., Banerjee S. Fluidized Bed Synthesis of Carbon Nanotubes – A review // Chem. Eng. J. 2011. V. 171. P. 841–869. https://doi.org/10.1016/j.cej.2011.05.038
Kumar M., Ando Y. Chemical Vapor Deposition of Carbon Nanotubes: a Review on Growth Mechanism and Mass Production // J. Nanosci. Nanotechnol. 2010. V. 10. № 6. P. 3739–3758. https://doi.org/10.1166/jnn.2010.2939
Tessonnier J.P., Su D.S. Recent Progress on the Growth Mechanism of Carbon Nanotubes: A Review // Chem. Sus. Chem. 2011. V. 4. P. 824–847. https://doi.org/10.1002/cssc.201100175
Saraswat S.K., Sinha B., Pant K., Gupta R.B. Kinetic Study and Modeling of Homogeneous Thermocatalytic Decomposition of Methane over a Ni–Cu–Zn/Al2O3 Catalyst for the Production of Hydrogen and Bamboo-shaped Carbon Nanotubes // Ind. Eng. Chem. Res. 2016. V. 55. P. 11672–11680. https://doi.org/10.1021/acs.iecr.6b03145
Krasnikov D.V., Bokova-Sirosh S.N., Tsendsuren T.O., Romanenko A.I., Obraztsova E.D., Volodin V.A., Kuznetsov V.L. Influence of the Growth Temperature on the Defective Structure of the Multi-walled Carbon Nanotubes // Phys. Status. Solidi. (B). 2018. V. 255. P. 1700255-6. https://doi.org/10.1002/pssb.201700255
Snoeck J.-W., Froment G.F., Fowles M. Kinetic Study of the Carbon Filament Formation by Methane Cracking on a Nickel Catalyst // J. Catal. 1997. V. 169. P. 250–262. https://doi.org/10.1006/jcat.1997.1635
Becker M.J., Xia W., Xie K., Dittmer A., Voelskow K., Turek Th., Muhler M. Separating the Initial Growth Rate from the Rate of Deactivation in the Growth Kinetics of Multi-walled Carbon Nanotubes from Ethane over a Cobalt-based Bulk Catalyst in a Fixed-bed Reactor // Carbon. 2013. V. 58. P. 107–115. https://doi.org/10.1016/j.carbon.2013.02.038
Gommes C., Blacher S., Bossuot Ch., Marchot P., Nagy J.B., Pirard J.-P. Influence of the Operating Conditions on the Production Rate of Multi-walled Carbon Nanotubes in a CVD Reactor // Carbon. 2004. V. 42. P. 1473–1482. https://doi.org/10.1016/j.carbon.2004.01.063
Shukrullah S., Mohamed N.M., Shaharun M.S., Naz M.Y. Parametric Study on Vapor-Solid-Solid Growth Mechanism of Multi-walled Carbon Nanotubes // Mater. Chem. Phys. 2016. V. 176. P. 32–43. https://doi.org/10.1016/j.matchemphys.2016.03.013
Douven S., Pirard S.L., Heyen G., Toye D., Pirard J.-P. Kinetic Study of Double-Walled Carbon Nanotube Synthesis by Catalytic Chemical Vapor Deposition over an Fe–Mo/MgO Catalyst Using Methane as the Carbon Source // Chem. Eng. J. 2011. V. 175. P. 396–407. https://doi.org/10.1016/j.cej.2011.08.066
Диаграммы состояния двойных металлических систем: Справочник: В 3 т.: Т. 3. Кн. I / Под общ. ред. Лякишева Н.П. М.: Машиностроение, 2001. 872 с.
Khan R.U., Bajohr S., Graf F., Reimert R. Modeling of Acetylene Pyrolysis under Steel Vacuum Carburizing Conditions in a Tubular Flow Reactor // Molecules. 2007. V. 12. № 3. P. 290–296. https://doi.org/10.3390/12030290
Song Y., Laursen S. Control of Surface Reactivity towards Unsaturated CAC Bonds and H over Ni-based Intermetallic Compounds in Semi-hydrogenation of Acetylene // J. Catal. 2019. V. 372. P. 151–162. https://doi.org/10.1016/j.jcat.2019.02.018
Fahmi A., Santen R.A. Density Functional Study of Acetylene and Ethylene Adsorption on Ni (111) // Surf. Sci. 1997. V. 371. P. 53–62. https://doi.org/10.1016/S0039-6028(96)00974-0
Жуховицкий А.А., Шварман Л.Ф. Физическая химия. М.: Металлургия, 1968. 550 с.
Булярский С.В. Углеродные нанотрубки: технология, управление свойствами, применение. Ульяновск: Стрежень, 2011. 478 с.
Волков А.И., Жарений И.М. Большой химический справочник. М.: Современная школа, 2005. 608 с.
Samsonov B.M., Malkov O.A. Thermodynamic Model of Crystallization and Melting of Small Particles // Centr. Eur. J. Phys. 2004. V. 2. № 1. P. 90–103. https://doi.org/10.2478/BF02476274
Свелин Р.А. Термодинамика твердого состояния. М.: Металлургия, 1968. 316 с.
Булярский С.В., Светухин В.В. Физические основы управления дефектообразованием в полупроводниках. Ульяновск: УлГУ, 2002. 386 с.
Булярский С.В., Кицюк Е.П., Лакалин А.В., Павлов А.А., Рязанов Р.М. Растворимость углерода в никелевом катализаторе при росте углеродных нанотрубок // Микроэлектроника. 2020. Т. 49. № 1. С. 27–32. https://doi.org/10.31857/S0544126920010056
Смитлз К.Д. Металлы. Справочник. М.: Металлургия, 1980. 447 с.
Дамаск А., Динс Дж. Точечные дефекты в металлах. М.: Мир, 1966. 292 с.
Siegel D.J., Hamilton J.C. Computational Study of Carbon Segregation and Diffusion within a Nickel Grain Boundary // Acta Mater. 2005. V. 53. P. 87–96. https://doi.org/10.1016/j.actamat.2004.09.006
Самсонов В.М., Хашин В.А. Термодинамические подходы к проблеме фазового состояния наночастиц // Конденсированные среды и межфазные границы. 2007. Т. 9. № 4. С. 387–391. http://www.kcmf.vsu.ru/resources/t_09_4_2007_010.pdf
Seah C.-M., Chai S.-P., Ichikawa S., Mohamed A.R. Growth of Uniform Thin-walled Carbon Nanotubes with Spin-Coated Fe Catalyst and the Correlation between the Pre-Growth Catalyst Size and the Nanotube Diameter // J. Nanopart. Res. 2013. V. 15. № 1. P. 1371-10. https://doi.org/10.1007/s11051-012-1371-x
Steplewska A., Borowiak-Palen E. Study on the Effect of the Metal-support (Fe-MgO and Pt-MgO) Interaction in Alcohol-CVD Synthesis of Carbon Nanotubes // J. Nanopart. Res. 2011. V. 13. № 5. P. 1987–1994. https://doi.org/10.1007/s11051-010-9952-z
Boskovic G., Ratkovic S., Kiss E., Geszti O. Carbon Nanotubes Purification Constrains Due to Large Fe–Ni/Al2O3 Catalyst Particles Encapsulation // Bull. Mater. Sci. 2013. V. 36. № 1. P. 1–7. https://www.ias.ac.in/article/fulltext/boms/036/01/0001-0007
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы