Неорганические материалы, 2021, T. 57, № 1, стр. 16-21
Синтез гексаборида лантана в хлоридно-оксидном расплаве
Д. О. Чухванцев 1, *, Е. С. Филатов 1, 2, Н. И. Шуров 1, Д. А. Роженцев 1
1 Институт высокотемпературной электрохимии УрО Российской академии наук
620990 Екатеринбург, ул. Академическая, 20, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: malogorka@yandex.ru
Поступила в редакцию 04.06.2020
После доработки 27.08.2020
Принята к публикации 02.09.2020
Аннотация
Доказана возможность синтеза порошка гексаборида лантана из хлоридно-оксидного расплава путем электрохимического соосаждения компонентов на инертном катоде. Определены основные температурные, концентрационные и токовые параметры процесса. Рентгеновским анализом определен фазовый состав порошка. Сканирующей электронной микроскопией установлена кубическая морфология и размеры полученного порошка. Гранулометрическим анализом определено распределение размера частиц в объеме.
ВВЕДЕНИЕ
Интерес исследователей к боридам редкоземельных металлов (РЗМ) обусловлен уникальным комплексом их свойств. Они характеризуется высокой температурой плавления, химической и термической стабильностью, высокой твердостью. Кроме этого, они обладают такими полезными свойствами, как низкая работа выхода электрона, устойчивое удельное сопротивление, низкий коэффициент линейного расширения в широком температурном диапазоне и способность поглощать тепловые нейтроны [1, 2].
В частности, гексаборид лантана нашел применение в катодах-компенсаторах стационарных плазменных двигателей космических аппаратов [3, 4]. Высокие эмиссионные характеристики гексаборида лантана позволяют использовать его в качестве катодного материала в эмиссионной электронике (электронные микроскопы и микроанализаторы), а также ускорителей заряженных частиц-циклотронов, синхрофазотронов, электронных пушек, в установках для сварки тугоплавких металлов электронным лучом в вакууме, в печах с электронным подогревом [5].
Известные способы получения гексаборидов лантаноидов можно условно разделить на химические и электрохимические, высокотемпературные (>1500°C), среднетемпературные (600–850°С) и низкотемпературные (200–400°С). Достаточно полный литературный обзор химических высокотемпературных методов синтеза гексаборидов РЗМ до 2013 г. представлен в работе Hasan et al. [6]. Для этих методов синтеза гексаборидов РЗМ необходимы специальные реакторы из дорогой высоколегированной жаропрочной стали с атмосферой защитного газа. Кроме этого, высокотемпературный синтез LnB6 путем химического восстановления оксидов Ln2O3 карбидом бора сопровождается крайне нежелательным загрязнением гексаборида углеродом. Низкотемпературные газофазные и автоклавные методы синтеза часто не позволяют получить строго однофазные порошки гексаборидов [7].
Электрохимический синтез гексаборидов РЗМ в расплавленных солях относится к среднетемпературным. Обзор электрохимических методов синтеза до 2008 г. представлен в работах [7, 8]. Развитие этого метода шло в направлении поиска солевых расплавов – растворителей, хорошо растворимых в воде: от оксидно-фторидных на основе LiF–Li2O к хлоридным, что позволяет легче и быстрее отмыть порошки гексаборидов от остатков соли.
В частности, в статье Uchida [9] указаны работы по электросинтезу гексаборидов РЗМ, в которых в качестве электролитов-растворителей использовали легкоплавкие и лучше растворимые в воде хлоридные расплавы LiCl–KCl, KCl–NaCl. В таких расплавах добавки оксидов бора и лантаноидов растворяются в очень малых количествах, не достаточных для электросинтеза. Поэтому приходится использовать в качестве исходного сырья намного более дорогие соли бора и лантаноидов, в частности фторид KBF4 и LnCl3, реже LnF3, как это сделано в работах [10–12].
Целью настоящей работы является поиск электролита на основе CaCl2 для электрохимического способа получения гексаборида лантана (LaB6) методом совместного электровосстановления бора и лантана из их оксидов, растворенных в расплаве. Хлорид кальция в качестве растворителя выбран из-за достаточно высокой растворимости в нем указанных оксидов в присутствии CaO [13, 14], его отличной растворимости в воде и безвредности для организма человека.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Подготовка эксперимента. В экспериментах были использованы предварительно подготовленные реактивы:
хлорид кальция – CaCl2 (квалификация “ч.”), сушили при 200°С под вакуумом, затем плавили в атмосфере аргона в корундовом тигле при 850°С;
оксид бора – B2O3 (квалификация “ч. д. а.”), сушили при 200°С под вакуумом, затем плавили в атмосфере аргона в корундовом тигле при 850°С;
оксид кальция – CaO (“ч. д. а.”), прокаливали при 600°С под вакуумом;
оксид лантана – La2O3 (“ч. д. а.”), прокаливали при 600°С под вакуумом.
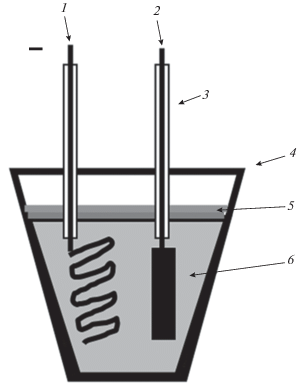
Реактивы были аттестованы с помощью химического анализа (табл. 1 ). До проведения эксперимента подготовленные соли хранились в плотно закрытых банках в инертном боксе. Для опытов была изготовлена электрохимическая ячейка (рис. 1), которая состояла из корундового тигля (4) емкостью 200 см3 с расплавленной солью (6), графитового анода (2) площадью 40 см2 и катода из молибденовой проволоки (1). Для защиты токоподводов катода и анода от окисления использовали корундовые трубки (3), которые во время опыта фиксировались специальными держателями.
Таблица 1.
Элементный анализ реактивов
| Определяемый элемент | C, ат. % | |||
|---|---|---|---|---|
| CaCl2* | CaO* | B2O3* | La2O3* | |
| B | – | – | 31 | – |
| Ba | 0.0002 | 0.2458 | 0.0007 | 0.1052 |
| Ca | 36 | 71 | 0.0220 | – |
| Cl | 63.9324 | – | – | – |
| Cr | – | 0.0005 | 0.0008 | 0.0005 |
| Cu | – | 0.0006 | – | 0.0005 |
| Fe | 0.0005 | 0.0009 | 0.0021 | 0.0007 |
| K | 0.0010 | 0.0028 | <0.001 | 0.0029 |
| Mg | 0.0042 | 0.0011 | – | 0.0018 |
| Mn | 0.0003 | – | 0.0001 | – |
| Na | 0.0261 | 0.0678 | 0.0034 | 0.0778 |
| Ni | 0.0007 | 0.0015 | – | 0.0019 |
| S | – | – | 0.0041 | – |
| Sn | 0.0015 | 0.0021 | – | 0.0050 |
| Sr | 0.0100 | 0.0415 | 0.0004 | 0.0400 |
| Ti | – | – | 0.0001 | – |
| Zn | 0.0231 | 0.0353 | 0.0004 | 0.0353 |
| Zr | – | – | 0.00004 | – |
| La | – | – | – | 85 |
Рис. 1.
Схема электрохимической ячейки: 1 – молибденовый катод, 2 – графитовый анод, 3 – защитные алундовые чехлы, 4 – корундовый тигель, 5 – оксид бора (B2O3), 6 – хлоридно-оксидный расплав.
Предварительные опыты для определения оптимальных условий синтеза показали, что минимальная плотность тока, при которой начинается образование LaB6, составляет 0.3 А/см2, выход по току в этом случае является минимальным. Оптимальной для этой системы оказалась плотность тока 0.4 А/см2.
Проведение эксперимента. Перед проведением эксперимента в корундовый тигель загружали измельченный CaCl2 с добавками по 5 мас. % порошков CaO и La2O3, помещали тигель в печь и разогревали ее до 850°С. После полного расплавления электролита на его поверхность загружали оксид бора, который и после расплавления из-за малой плотности находился на поверхности расплава (рис. 2). В разогретый расплав опускали электроды, как показано на рис. 1, и проводили сначала очистной электролиз для удаления следов влаги с постоянным током плотностью 0.4 А/см2 в течение 20 мин, а затем электроосаждение боридов при катодной плотности тока 0.4 А/см2 в течение 2 ч. После окончания электролиза катоды извлекали из электролита, катодный осадок отмывали от соли в кипящей дистиллированной воде, фильтровали, высушивали, полученный порошок взвешивали и подвергали различным методам анализа. В среднем получали около 5 г однородного порошка темно-фиолетового цвета (рис. 2) без видимых примесей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предполагаемые химические и электрохимические реакции, лежащие в основе синтеза гексаборида лантана. Напряжение разложения жидкого В2О3 при 1123 К (850°С), рассчитанное из термодинамических справочных данных [15], равно 1.71 B, а для La2O3 – 2.55 B. Разность потенциалов выделения бора и лантана на инертном катоде из разбавленных растворов оксидов в CaCl2 при допущении идеального поведения растворов равна 0.835 В.
Из законов электрохимической термодинамики следует, что первым на инертном катоде должен выделяться бор при потенциале примерно 1.71 В относительно кислородного электрода сравнения. Далее, по данным Uchida [9], даже при небольшом сдвиге катодного потенциала в отрицательную сторону происходит совместное выделение бора и лантана с образованием гексаборида LaB6, и этот потенциал много меньше потенциала выделения чистого лантана из его оксида за счет деполяризации инертного катода при образовании гексаборида. Подобную последовательность электродных процессов мы наблюдали [14] при выделении на катоде гексаборида CaB6 из расплава на основе CaCl2–CaO. В соответствии с классификацией Барабошкина [15], если потенциалы выделения элементов на катоде различаются более чем на 0.2 В, то процесс образования сплава или соединения происходит в кинетическом режиме и будет необратимым.
Известны [16, 17] соединения моноборатов лантаноидов Ln2O3 ∙ B2O3, их соединения чаще представляют в виде 2[LnBO3], которые растворяются в расплаве CaCl2 с одновременной диссоциацией
(1)
$~\left[ {{\text{LnB}}{{{\text{O}}}_{{\text{3}}}}} \right] \to {\text{L}}{{{\text{n}}}^{{{\text{3}} + }}} + {{[{\text{B}}{{{\text{O}}}_{{\text{3}}}}]}^{{{\text{3}} - }}}.$Для электроосаждения LnB6 на катоде потребуется 3 моля метабората 3〈 Ln2O3 ∙ B2O3 〉, который диссоциирует на ионы → 6[Ln3+] + 6[BO3]3–. Тогда брутто-реакцию катодного электроосаждения LаB6 можно представить следующей схемой:
(2)
$\begin{gathered} {\text{ }}6[{\text{L}}{{{\text{a}}}^{{3 + }}}] + 6{{[{\text{B}}{{{\text{O}}}_{{\text{3}}}}]}^{{3 - }}} + {\text{21}}{{{\text{е}}}^{ - }}~ \to \\ ~ \to \left\langle {{\text{Lа}}{{{\text{B}}}_{{\text{6}}}}} \right\rangle + {\text{5L}}{{{\text{а}}}^{{{\text{3}} + }}} + {\text{18}}[{{{\text{O}}}^{{{\text{2}} - }}}]. \\ \end{gathered} $Далее продукт реакции [O2–] вступает в реакцию взаимодействия с расплавленным {B2O3}ж на поверхности расплава CaCl2
(3)
$18[{{{\text{O}}}^{{2 - }}}] + 2.5{{\{ {{{\text{B}}}_{2}}{{{\text{O}}}_{{\text{3}}}}\} }_{{\text{ж}}}} \to 5{{[{\text{B}}{{{\text{O}}}_{3}}]}^{{3 - }}} + 10.5[{{{\text{O}}}^{{2 - }}}].$Таким образом, в расплав поступают новые порции ионов [BO3]3– для электролиза.
Оставшиеся ионы [O2–] из реакции (3) разряжаются на графитовом аноде
(4)
${\text{1}}0.{\text{5}}[{{{\text{O}}}^{{{\text{2}} - }}}]{\text{ }} + {\text{1}}0.{\text{5С}} \to {\text{1}}0.{\text{5}}\left( {{\text{СО}}} \right)_{{\text{г}}}^{ \uparrow }.$Из изложенного следует, что постоянное присутствие {B2O3}ж на поверхности расплава CaCl2 необходимо для непрерывного процесса получения LаB6 электролизом.
Аттестация полученного порошка. Выход по току, рассчитанный по формуле (5), составил 86.3%:
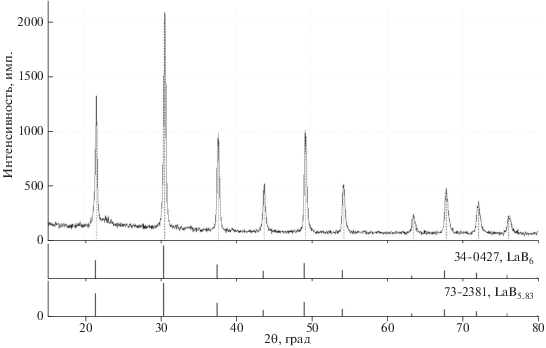
где n = 21 – число электронов, участвующих в электродном процессе; M = 203.7660 – молярная масса, г/моль; F = 26.8 – число Фарадея, А ч; mf =– масса фактически осажденного материала, г; τ = 2 – время проведения опыта, ч; I = 8 – сила тока, А.Рентгенофазовый анализ выполнялся на рентгеновском дифрактометре D/MAX-2200 методом сопоставления экспериментального и эталонных спектров из базы данных PDF-2 (излучение медное, кремниевый монохроматор, 2θ – 15°–800°, ширина щелей – 1 и 0.25 мм). Результаты анализа показали (рис. 3), что соотношение интенсивностей полностью совпало с данными PDF-2 для LaB6. На дифрактограмме порошка дублет линий разрешается даже при малых углах 2θ, т.е. состав однородный.
Рис. 4.
Процесс зародышеобразования кристаллов гексаборида лантана: а – зародыш конусообразной формы, б – образование ребер направления, в – образование правильно ограненного кристалла.

По результатам химического анализа полученного порошка (табл. 2) видно, что содержание бора и лантана приблизительно равно стехиометрической формуле LaB6. При этом присутствие таких примесей, как алюминий и железо, объясняется тем, что эксперимент проводился в корундовом тигле, в котором присутствуют эти примеси.
Таблица 2.
Результаты элементного анализа полученного порошка гесаборида лантана
| Элемент | Содержание, ат. % |
|---|---|
| B | 85.9 |
| Ca | 0.062 |
| Fe | 0.028 |
| La | 14 |
| Al | 0.01 |
Микроскопический анализ (рис. 5 и 6) показал, что динамика зарождения агломератов в основном происходит эпитаксиально, видны кристаллы, сросшиеся по плоскостям спайности (двойниковая ориентация). На гранях зарождаются кристаллы, имеющие как такую же ориентацию, так и отличающуюся, но кристаллографически связанную. При этом соединение отдельных кристаллов по спайности не является прочным, поскольку наблюдается дробление агломератов в ходе ультразвуковой обработки. Установлено, что зародышеобразование протекает по различным механизмам, когда форма образующегося кристалла может быть правильной (ограненной) и неправильной – в виде конусов.
На боковых поверхностях зародышей, исходно имеющих конусообразную форму, образуются ребра направления, которые кристаллографически связаны с подложкой. Этот процесс в итоге приводит к формированию кубически ограненного кристалла. На рис. 4 показаны стадии трансформации конусообразного зародыша. Нельзя исключить, что все кристаллы образуются именно по вышеописанному многостадийному механизму.
На рис. 5 видно, что грани неровные, несовершенные, ширина всего агломерата около 50 мкм.
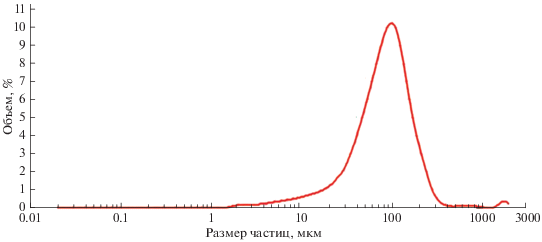
Гранулометрический анализ (рис. 6) показал, что размер полученного порошка находится в интервале от 2 мкм до 1 мм.
Проанализированы недостатки существующих способов синтеза гексаборида лантана и предложен новый сравнительно дешевый хлоридно-оксидный электролит, отличающийся отсутствием коррозионно-активных фторидных компонентов.
Выбраны оптимальны параметры по температуре, составу электролита и плотности тока.
Экспериментально показана возможность синтеза гексаборида лантана путем непрерывного первичного электровосстановления на инертной подложке из хлоридно-оксидного расплава.
Элементный анализ показал, что чистота порошка составляет ~99.9 ат. % по LaB6.
Показано, что полученные частицы имеют правильную кубическую морфологию.
Основная часть полученного после отмывки гексаборида лантана имеет размеры от 10 до 300 мкм.
Предложен механизм формирования гексаборидов из хлоридно-оксидного расплава.
Список литературы
Segawa K., Tomita A., Iwashita K., Kasaya M., Suzuki T., Kunii S. Electronic and Magnetic Properties of Heavy Rare-Earth Hexaboride Single Crystals // J. Magn. Magn. Mater. 1992. V. 104. № 2. P. 1233–1234. https://doi.org/10.1016/0304-8853(92)90563-4
Perkins C.L., Trenary M. X-ray Photoelectron Spectroscopy Investigation of the Initial Oxygen Adsorption Sites on the LaB6 Surface// Surf. Sci. 1999. V. 423. № 1. P. 222–228. https://doi.org/10.1016/S0039-6028(98)00936-4
Chen C.-M., Zhou W.-C., Zhang L.-T. Oriented Structure and Crystallography of Directionally Solidified LaB6–ZrB2 Eutectic // J. Am. Ceram. Soc. 1998. V. 81. № 1. P. 237–240. https://doi.org/10.1111/j.1151-2916.1998.tb02323.x
Taran A., Voronovich D., Plankovskyy S., Paderno V., Filipov V. Review of LaB6, Re-W Dispenser, and BaHfO3-W Cathode Development // TEEE Trans. Electron Devices. 2009. V. 56. № 5. P. 812–817. https://doi.org/10.1109/TED.2009.2015615
Goebel D., Chu E. High-Current Lanthanum Hexaboride Hollow Cathode for High-Power Hall Thrusters // J. Propul. Power. 2013. V. 30. № 1. P. 35–40. https://doi.org/10.2514/1.B34870
Hasan M., Sugo H., Kisi E. Low Temperature Carbothermal and Boron Carbide Reduction Synthesis of LaB6 // J. Alloys Compd. 2013. V. 578. P. 176–182. https://doi.org/10.1016/j.jallcom.2013.05.008
Wang L., Xu L., Ju Z., Qian Y. A Versatile Route for the Convenient Synthesis of Rare Earth and Alkaline Earth Hexaborides in Mild Temperatures // CrystEngComm. 2010. № 12. P. 3923–3928.
Kamaludeen M., Selvaray I., Visuvasan A., Jayavel R. LaB6 Crystals from Fused Salt Electrolysis // J. Mater. Chem. 1998. № 8. P. 2205–2207. https://doi.org/10.1039/A802895H
Uchida K. Cathodic Behavior in the Electrodeposition of LaB6 // Surf. Technol. 1978. V. 7. № 2. P. 137–143. https://doi.org/10.1016/0376-4583(78)90006-7
Bukatova, G., Kuznetsov S. Electrosynthesis of Gadolinium Hexaboride Nanotubes // J. Electrochem. Commun. 2005. V. 7. № 6. P. 637–641. https://doi.org/10.1016/j.elecom.2005.04.003
Bukatova G., Kuznetsov S., Gaune-Escard M. Electrochemical Synthesis of Rare-Earth Metal (Eu, Nd) Borides in Molten Salts // Russ. J. Electrochem. 2007. V. 43. № 8. P. 929–935. https://doi.org/10.1134/S1023193507080113
Kushkhov H., Mukozheva R., Vindizheva M., Abazova A., Tlenkopachev M. Electrochemical Synthesis of CeB6 Nanotubes // J. Mater. Sci. Chem. Eng. 2014. № 2. P. 57–62. https://doi.org/10.4236/msce.2014.210010
Chernov Ya., Filatov E., Shurov N., Smolenski V., Tkachev N. Synthesis of Calcium Hexaboride by Electrolysis of Molten Salt // Metall. Mater. Trans. B. 2019. V. 50. № 4. P.1745–1751. https://doi.org/10.1007/s11663-019-01626-9
Чернов Я.Б., Филатов Е.С., Закирьянова И.Д., Каримов К.Р., Антонов Б.Д. Взаимодействие в системе CaCl2–B2O3–CaO в расплавленном состоянии // Расплавы. 2015. № 6. C. 58–66.
Барабошкин А.Н. Электрокристализация металлов из расплавленных солей. М.: Наука, 1976. 280 с.
Alper A.M. Theory, Principles, and Techniques of Phase Diagrams/ / N. Y.; L.: Academ. Press, 1970. 280 p.
Галахов Ф.Я. Диаграммы состояния систем тугоплавких оксидов. М.: Наука, 1985. 284 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы