Неорганические материалы, 2021, T. 57, № 10, стр. 1073-1077
Теплоемкость и термическое расширение гафната самария
А. В. Гуськов 1, *, П. Г. Гагарин 1, В. Н. Гуськов 1, А. В. Хорошилов 1, К. С. Гавричев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
* E-mail: a.gus@igic.ras.ru
Поступила в редакцию 21.04.2021
После доработки 11.06.2021
Принята к публикации 11.06.2021
Аннотация
Определены температурные зависимости молярной теплоемкости в области 320–1350 K и параметра кристаллической решетки гафната самария со структурным типом пирохлора в интервале 298–1273 K. Оценены коэффициенты термического расширения.
ВВЕДЕНИЕ
Образование высокотемпературного двойного оксида – гафната самария со структурным типом пирохлора (Fd3m) – и его разупорядочение с переходом в структурный тип дефектного флюорита (Fm3m) при высоких температурах впервые были обнаружены в работе [1]. Более позднее изучение системы HfO2–Sm2O3 [2] подтвердило существование пирохлора Sm2Hf2O7. Было показано, что температура плавления Sm2Hf2O7 превышает 2713 K и, как установлено в [3], гафнат самария плавится инконгруэнтно при 2823 ± 25 K. Несколько иная температура плавления гафната самария (~2760 K) приведена в [4–6]. Однако эти температуры плавления следует отнести к твердому раствору стехиометрического состава Sm2O3 ⋅ 2HfO2, так как при ~2673 K происходит обратимый переход Sm2Hf2O7 (пирохлор) ↔ Sm2O3 ⋅ 2HfO2 (флюорит) [7–10], поэтому Т = 2673 K следует считать максимальной температурой существования Sm2Hf2 ± δO7 ± 2 – фазы переменного состава, образующейся в результате упорядочения структуры в области непрерывного ряда твердых растворов (Sm2O3)x⋅(2HfO2)1 –х при х = 0.5 ± δ с переходом в структурный тип пирохлора. Твердые растворы образуются в результате замещения Hf4+ на Sm3+ в узлах кубической решетки HfO2, при этом уменьшение заряда компенсируется возникновением кислородных вакансий [5, 6].
В работе [2] показано существование широкой области гомогенности Sm2Hf2O7 (22–43 мол. % Sm2O3 при 1550–2573 K) и определена зависимость параметра кубической решетки (в расчете на структуру флюорита) от состава: a(Å) = 5.128 + + 0.0045x (15 < x < 40) (x – мол. % Sm2O3). По данным [3], параметр кубической решетки пирохлора Sm2Hf2O7 равен 10.556 Å, а область гомогенности составляет 31–38 мол. % Sm2O3 (2373 K) с граничными значениями параметра а 10.506 и 10.628 Å соответственно.
В работах [4–6] приведены значения параметра решетки стехиометрического Sm2Hf2O7а = = 10.568 Å и энтальпии образования из элементов ΔfH° (298.15 K) = –4139.2 кДж/моль. Необходимо отметить, что Sm2O3 ⋅ 2HfO2, так же как и другие двойные оксиды циркония или гафния и лантаноидов, может образовывать наноразмерную метастабильную низкотемпературную фазу со структурой разупорядоченного флюорита, для перевода которой в стабильную кристаллическую структуру пирохлора необходим отжиг при температурах выше 1300–1800 K независимо от способа синтеза [11, 12].
Являясь высокотемпературным двойным оксидом, не имеющим структурных превращений во всем температурном интервале существования, гафнат самария вызывает интерес исследователей как вещество, перспективное для разработки различных керамических материалов, в том числе для термобарьерных и защитных покрытий газотурбинных энергетических установок [13–15], твердых электролитов топливных элементов [16, 17], материалов атомной промышленности [18, 19].
Практическое применение гафната самария в областях техники, где имеются особые требования к качеству материалов, требует подтверждения его химической инертности по отношению к контактным материалам и средам, что представляется сложной экспериментальной задачей, решаемой с помощью математического моделирования [15]. Для этого необходимо располагать термодинамическими параметрами гафната самария. Авторами [20] были измерены приращения энтальпии в области 730–1672 K методом калориметрии сброса и рассчитаны теплоемкость, энтропия и приращение энтальпии в интервале 298–1700 K. Эти эксперименты не затрагивают интервала 0–730 K и не являются прямыми измерениями по отношению к теплоемкости, поэтому требуют дополнительного подтверждения, особенно в интервале 298–730 K. Молярная теплоемкость Sm2Hf2O7 в графическом виде приведена в [21] в интервале 400–1100 K, однако представляется завышенной, по-видимому, из-за использования гелия в качестве инертной атмосферы, что было отмечено нами при изучении гафната гадолиния [22].
Термическое расширение гафната самария в интервале 298–1500 K методом высокотемпературной рентгеновской дифракции изучали в [23], было показано отсутствие структурных превращений и аномалий в этой области температур. Эти данные существенно отличаются от результатов, полученных методом дилатометрии в работе [24], и требуют дополнительного рассмотрения.
Целью настоящей работы является измерение молярной теплоемкости гафната самария Sm2Hf2O7 в области 320–1300 K и изучение температурной зависимости его параметра кристаллической решетки в интервале 300–1273 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гафнат самария получали совместным осаждением стехиометрической смеси гидроксидов гафния и самария в растворе аммиака (25–28 мас. % NH4OH, “ос. ч.”, ООО “Химмед”) из водных растворов хлоридов гафния и самария, полученных растворением сексвиоксида самария (99.99 мас. %) и диоксида гафния (99.99 мас. %, ООО “Ланхит”) в соляной кислоте (35–38 мас. %, ОСЧ 20-4, ООО “Химмед”). Для расчетов стехиометрических отношений компонентов использовали моляльные концентрации и весовой метод смешивания исходных компонентов, как в работе [22]. Полученный осадок обезвоживали при 368 K (95°С) и ступенчато отжигали с окончательным прокаливанием на воздухе при 1773 K. Подробное описание методики синтеза приведено в [25].
Синтезированный образец идентифицировали рентгенофазовым анализом (РФА) с помощью дифрактометра Bruker D8 Advance (CuKα-излучение, λ = 1.5418 Å, Ni-фильтр, LYNXEYE-детектор, геометрия на отражение) в интервале углов 2θ = 10°–80°. Состав образца определяли химическим анализом (оптико-эмиссионный спектрометр с индуктивно-связанной плазмой Agilent 725). Морфологию образца исследовали с помощью электронного микроскопа Gross Beam Zeiss NVision 40 (SEM and XPS). Молярную массу гафната самария 769.6958 г/моль рассчитывали из значений атомных масс элементов, рекомендованных в [26]. Теплоемкость при высоких температурах (320–1300 K) измеряли методом дифференциальной сканирующей калориметрии (ДСК) на приборе STA 449 F1 Jupiter (Netzsch). Методики измерений теплоемкости с помощью ДСК и сглаживания экспериментальных данных по температурной зависимости теплоемкости описаны в [27]. Температурную зависимость параметра кристаллической решетки при 298–1273 K с шагом 100 K определяли на воздухе с помощью 2θ-θ-рентгеновского дифрактометра SHIMADZU XRD-600 с приставкой НА-1001 (ИМЕТ РАН) на фильтрованном CuKα-излучении [28].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
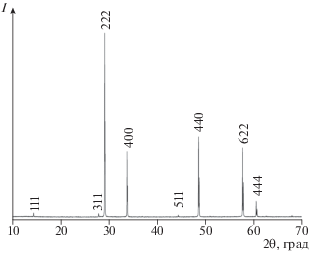
Для проведения исследований был приготовлен образец гафната самария состава Sm2Hf1.97O6.94 по данным химического анализа (величина индекса при кислороде рассчитана исходя из соотношения оксидов металлов). Как было показано ранее [29], такое отклонение от стехиометрического состава не может оказать существенного влияния на величину молярной теплоемкости и получаемые величины могут быть отнесены к составу с идеальной стехиометрией. Дифрактометрические исследования, результаты которых представлены на рис. 1, показали отсутствие посторонних фаз, хорошую закристаллизованность образца и подтвердили структурный тип пирохлора Fd3m. Рассчитанное значение параметра кубической решетки составило а = 10.580 Å, что соответствует величинам, приведенным в [3–6], близко к величине 10.574 Å [30] и хорошо совпадает со значением из работы [23]. Оценка размеров областей когерентного рассеяния по ширине дифракционных отражений показала, что их размеры превышают 100 нм и находятся вне интервала существования наноразмерных частиц. Это подтверждено электронно-микроскопическими исследованиями морфологии образца гафната самария (рис. 2).
Температурную зависимость молярной теплоемкости гафната самария в области 320–1300 K измеряли методом ДСК. Температурная кривая не содержит признаков структурных превращений во всей области измерений.
Высокотемпературная теплоемкость гафната самария (320–1300 K) хорошо описывается уравнением Майера–Келли [31]
(1)
$\begin{gathered} {{C}_{{p{\text{,}}m}}}({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{моль}}\,\,{\text{K}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{K}})}}) = 257.57 + 0.042597T - \\ - \,\,{{2\,871\,249} \mathord{\left/ {\vphantom {{2\,871\,249} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},~\,\,{{R}^{2}} = 0.9993. \\ \end{gathered} $Авторы работы [20] дифференцированием полученной экспериментальной зависимости инкремента энтальпии от температуры (730–1672 K) получили уравнение
(2)
$\begin{gathered} {{C}_{{p{\text{,}}m}}}({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{моль}}\,\,{\text{K}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{K}})}}) = 259.89 + \\ + \,\,0.043220T--{{3238900} \mathord{\left/ {\vphantom {{3238900} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $Величины теплоемкости, рассчитанные по уравнениям (1) и (2), отличаются в пределах ~1%, что свидетельствует об их взаимном соответствии и достоверности экспериментальных данных, полученных обоими методами.
Результаты высокотемпературных дифракционных измерений приведены в табл. 1. Температурная зависимость параметра решетки удовлетворительно описывается линейным уравнением
(3)
$\begin{gathered} а\,\,\left( {\text{{\AA}}} \right) = \left( {10.5474 \pm 0.0007} \right) + \\ + \,\,\left( {1.1537 \pm 0.0077} \right) \times {{10}^{{ - 4}}}Т,\,\,{{R}^{2}} = 0.9998. \\ \end{gathered} $Таблица 1.
Температурная зависимость параметра а, текущего коэффициента термического расширения (αi) и относительного термического расширения (TE), p = 101.3 кПa
| Т, K | a, Å | αi × 106, K–1 | TE, % |
|---|---|---|---|
| 298 | 10.580 | 10.905 | 0 |
| 299 | 10.583 | 10.902 | 0.03 |
| 473 | 10.602 | 10.88 | 0.21 |
| 573 | 10.613 | 10.87 | 0.31 |
| 673 | 10.624 | 10.86 | 0.42 |
| 773 | 10.636 | 10.85 | 0.53 |
| 873 | 10.648 | 10.84 | 0.64 |
| 973 | 10.660 | 10.82 | 0.76 |
| 1071 | 10.672 | 10.81 | 0.87 |
| 1173 | 10.683 | 10.80 | 0.97 |
| 1273 | 10.694 | 10.79 | 1.08 |
Расчет относительного коэффициента термического расширения (αr)
(4)
${{\alpha }_{r}}({{{\text{K}}}^{{ - 1}}}) = ({1 \mathord{\left/ {\vphantom {1 {{{a}_{{298}}}}}} \right. \kern-0em} {{{a}_{{298}}}}})\,\,({{da} \mathord{\left/ {\vphantom {{da} {dT}}} \right. \kern-0em} {dT}})$приводит к значению αr = 10.90 × 10–6 K–1, которое в изученном интервале 298–1273 K практически не зависит от температуры, так как уравнение (4) не содержит членов второй степени и выше. Значение текущего коэффициента термического расширения (αi)
(5)
${{\alpha }_{i}}({{{\text{K}}}^{{ - 1}}}) = ({1 \mathord{\left/ {\vphantom {1 {{{a}_{T}}}}} \right. \kern-0em} {{{a}_{T}}}})\,\,({{da} \mathord{\left/ {\vphantom {{da} {dT}}} \right. \kern-0em} {dT}})$приведено в табл. 1. Как видно, αi закономерно уменьшается с ростом температуры. Относительное термическое расширение (TE)
(6)
$TE\left( \% \right) = 100\,{{({{a}_{T}}--{{a}_{{298}}})} \mathord{\left/ {\vphantom {{({{a}_{T}}--{{a}_{{298}}})} {{{a}_{{298}}}}}} \right. \kern-0em} {{{a}_{{298}}}}}$также содержится в табл. 1 и может быть описано уравнением
(7)
$\begin{gathered} TE\left( \% \right) = {\text{ }} - 0.0762 \pm 0.0225 + \\ + \,\,0.0876 \pm 0.0028T,\,\,{{R}^{2}} = 0.9915. \\ \end{gathered} $Температурная зависимость параметра а была измерена в [23] в интервале 298–1500 K (рис. 3) и представлена в виде квадратного уравнения с аргументом T – 273 K, о чем авторы, по-видимому, забыли упомянуть.
Рис. 3.
Температурные зависимости параметра решетки Sm2Hf2O7 (пирохлор): 1 – настоящая работа, 2 – [23].
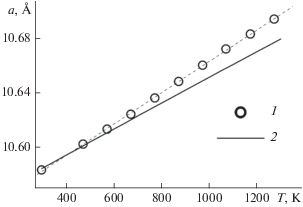
Несмотря на то что наклоны зависимостей параметра кристаллической решетки от температуры несколько отличаются, средняя величина относительного коэффициента термического расширения в интервале 298–1500 K, по данным [23], составляет ~9.8 × 10–6 K–1, что ниже нашего значения 10.90 × 10–6 K–1. Разница составляет ~10%, что, вероятнее всего, связано с экспериментальными погрешностями данного метода. В работе [23] отмечается, что неопределенность высокотемпературного дифракционного эксперимента составляет ~5%. Среднее значение коэффициента термического расширения в интервале 673–1373 K, по данным дилатометрии [24], составляет ~14.9 × 10–6 K–1 и заметно отличается от расчетов из температурной зависимости параметра кристаллической решетки. Такое различие, возможно, связано с разными способами синтеза: образцы в работе [24] были синтезированы под давлением 15 МПа в графитовых формах, однако в описании методики отсутствует упоминание о последующем отжиге образцов при нормальном давлении.
ЗАКЛЮЧЕНИЕ
Методом ДСК выполнены измерения молярной теплоемкости гафната самария со структурным типом пирохлора и показано отсутствие структурных превращений в области 320–1300 K. Теплоемкость Sm2Hf2O7 описывается уравнением Cp,m (Дж/(моль K)) = 257.57 + 0.042597T – ‒ 2871249/T 2. С помощью высокотемпературной рентгеновской дифракции определена температурная зависимость параметра кристаллической решетки гафната самария в интервале 298–1273 K и оценены коэффициенты термического расширения.
Список литературы
Isupova E.N., Glushkova V.B., Keler K.E. The HfO2–Sm2O3 System in SOLID PHAses in the HfO2-RICH REGION // Izv. Akad. Nauk SSSR. Neorg. Mater. 1968. V. 4. P. 1330–1331.
Duran P. The System Hafnia-Samaria // J. Am. Ceram Soc. 1979. V. 62. P. 9–12. https://doi.org/10.1111/j.1151-2916.1979.tb18794.x
Шевченко А.В., Лопато Л.М., Назаренко Л.В. Системы HfO2-оксиды самария, гадолиния, тербия и диспрозия при высоких температурах // Изв. АН СССР. Неорган. материалы. 1984. Т. 20. С. 1862–1866.
Папутский Ю.Н., Кржижановская В.А., Глушкова В.Б. Энтальпия образования гафнатов и цирконатов редкоземельных элементов // Изв. АН СССР. Неорган. материалы. 1974. Т. 10. С. 1551–1552.
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редких элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Andrievskaya E.R. Phase Equilibria in the Refractory Oxide Systems of Zirconia, Hafnia and Yttria With Rare-Earth Oxides // J. Europ. Ceram. Soc. 2008. V. 28. P. 2363–2388. https://doi.org/10.1016/jeurceramsoc.2008.01.009
Stanec C.R., Grimes R.W. Prediction of Rare-Earth A2Hf2O7 PYROCHLORE Phases // J. Am. Ceram. Soc. 2002. V. 85. P. 2139–2141. https://doi.org/10.1111/j.1151-2916.2002.tb00423.x
Rushton M.J.D., Grimes R.W., Stanek C. R., Owens S. Predicted Pyrochlore to Fluorite Disorder Temperature for A2Zr2O7 Compositions // J. Mater. Res. 2004. V. 19. P. 1603–1604. https://doi.org/10.1557/jmr.2004.0231
Subramanian M.A., Aravamudan G., Subba Rao G.V. Oxide pyrochlores – a review // Prog. Solid State Chem. 1983. V. 15. P. 55–143.https://doi.org/10.1016/0079-6786(83)90001-8
Jiang C., Stanek C.R., Sickafus K.E., Uberiaga B.P. First-Orinciples Prediction of Disordering Tendencies in Pyrochlore Oxides // Phys. Rev. B. 2009. V. 79. P. 104203. https://doi.org/10.1103/PhysRevB.79.104203
Popov V.V., Menushenkov A.P., Yaroslavtsev A.A. et al. Fluorite-Pyrochlore Phase Transition in Nanostructured Ln2Hf2O7 (Ln = La-Lu) // J. Alloys Compd. 2016. V. 689. P. 669–679. https://doi.org/10.1016/j.jallcom.2016.08.019
Гуськов В.Н., Гавричев К.С., Гагарин П.Г., Гуськов А.В. Термодинамические функции сложных оксидов лантаноидов на основе диоксида циркония – пирохлоров Ln2Zr2O7 (Ln = La, Pr, Sm, Eu, Gd) и флюоритов Ln2O3 ⋅ 2ZrO2 (Ln = Tb, Ho, Er, Tm) // Журн. неорган. химии. 2019. Т. 64. C. 1072–1088. https://doi.org/10.1134/S00444457X19100040
Vaßen R., Jarligo M.O., Steinke T. et al. Overview on Advanced Thermal Barrier Coatings // Surf. Coat. Technol. 2010. V. 205. P. 938–942. https://doi.org/10.1016/j.surfcoat.2010.08.151
Clarke D.R., Phillpot S.R. Thermal Barrier Coating Materials // Mater. Today. 2005. V. 8. P. 22–29.https://doi.org/10.1016/s1369-7021(05)70934-2
Poerschke D.L., Jackson R.W., Levi C.G. Silicate Deposit Degradation of Engineered Coatings in Gas Turbines: Progress Toward Models and Materials Solutions // Ann. Rev. Mater. Res. 2017. V. 47. P. 297–330. https://doi.org/10.1146/annurev-matsci-010917-105000
Yamamura H. Electrical Conductivity Anomaly Around Fluorite–Pyrochlore Phase Boundary // Solid State Ionics. 2003. V. 158. P. 359–365. https://doi.org/10.1016/s0167-2738(02)00874-3
Shlyakhtina A.V., Shcherbakova L.G. Polymophism and High-Temperature Conductivity of Ln2M2O7 (Ln = = Sm–Lu; M = Ti, Zr, Hf) pyrochlores // Solid State Ionics. 2011. V. 192. P. 200–204. https://doi.org/1016/j.ssi.2010.07.013
Risovany V.D., Zakharov A.V., Muraleva E.M. et al. Dysprosium Hafnate as Absorbing Material for Control Rods // J. Nucl. Mater. 2006. V. 355. P. 163–170. https://doi.org/10.1016/j.jnucmat.2006.05.029
Ewing R.C., Weber W.J., Lian J. Nuclear Waste Disposal–Pyrochlore (A2B2O7): Nuclear Waste Form for the Immobilization of Plutonium and “Minor” Actinides // J. Appl. Phys. 2004. V. 95. P. 5949–5971. https://doi.org/10.1063/1.1707213
Kandan R., Prabhakara Reddy B., Panneerselvam G., Mudali U.K. Enthalpy Measurements on Rare Earth Hafnates RE2O3 ⋅ 2HfO2 (s) (RE = Sm, Eu, Dy) // J. Therm. Anal. Calorim. 2017. V. 131. P. 2687–2692. https://doi.org/10.1007/s10973-017-6802-6
Lópes-Cota F.A., Cepeda-Sánchez N.M., Díaz-Guillén J.A. et al. Electrical and Thermophysical Properties of Mechanochemically Obtained Lanthanide Hafnates // J. Am. Ceram. Soc. 2017. V. 100. P. 1994–2004. https://doi.org/10.1111/jace.14712
Guskov V.N., Tyurin A.V., Guskov A.V. et al. Thermal Expansion and Thermodynamic Properties of Gadolinium Hafnate Ceramics // Ceram. Int. 2020. V. 46. P. 12822–12827. https://doi.org/10.1016/j.ceramint.2020.02.052
Kutty K.V.G., Rajagopalan S., Mathews C.K., Varadaraju U.V. Thermal Expansion Behaviour of Some Rare Earth Oxide Pyrochlore // Mater. Res. Bull. 1994. V. 29. P. 759–766https://doi.org/10.1016/0025-5408(94)90201-1
Mikuśkiewicz M., Migas D., Moskal G. Synthesis and Thermal Properties of Zirconate, Hafnate and Cerate of Samarium // Surf. Coat. Technol. 2018. V. 354. P. 66–75. https://doi.org/10.1016/j.surfcoat.2018.08.096
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. Термодинамические свойства и термическое расширение твердого раствора Tm2O3 ⋅ 2ZrO2 // Журн. неорган. химии. 2018. Т. 63. С. 1458–1464. https://doi.org/10.1134/S0044457X18110053
Wieser M.E. Atomic Weights of the Elements 2005 (IUPAC Techn. Rep.) // Pure Appl. Chem. 2006. V. 78. P. 2051–2066. https://doi.org/10.1351/pac200678112051
Рюмин М.А., Никифорова Г.Е., Тюрин А.В. и др. Теплоемкость и термодинамические функции La2Sn2O7 // Неорган. материалы. 2020. Т. 56. С. 102–109.
Коломиец Т.Ю., Тельнова Г.Б., Ашмарин А.А., Челпанов В.И., Солнцев К.А. Синтез и спекание субмикронных частиц Nd:YAG, полученных из карбонатных прекурсоров // Неорган. материалы. 2017. Т. 53. С. 899–900. https://doi.org/10.7868/S0002337X17080152
Gagarin P.G., Guskov A.V., Guskov V.N. et al. Dysprosium Orthotantalate Ceramics: Thermal Expansion and Heat Capacity // Ceram. Int. 2021. V. 47. P. 2892–2896. https://doi.org/10.1016/j.ceramint.2020.09072
Shlyakhtina A.V., Knotko A.V., Boguslavskii M.V. et al. Effect of Non-Stoichiometry and Synthesis Temperature on the Structure and Conductivity of Ln2 +xM2 −xO7 −x/2 (Ln = Sm-Gd; M = Zr, Hf; x = 0–0.286) // Solid State Ionics 2007. V. 17. P. 59–66. https://doi.org/10.1016/j.ssi.2006.11.001
Maier C.G., Kelley K.K. An Equation for Representation of High Temperature Heat Content Data // J. Am. Chem. Soc. 1932. V. 54. P. 3243–3246. https://doi.org/10.1021/ja01347a029
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы