Неорганические материалы, 2021, T. 57, № 10, стр. 1094-1101
Синтез и ионная проводимость твердых электролитов на основе фосфата лития-титана
Е. А. Курзина 1, И. А. Стенина 1, *, A. Dalvi 2, А. Б. Ярославцев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Birla Institute of Technology and Science
333031 Индия, Пилани
* E-mail: irina_stenina@mail.ru
Поступила в редакцию 06.05.2021
После доработки 22.06.2021
Принята к публикации 22.06.2021
Аннотация
Изучены процессы, протекающие в ходе твердофазного синтеза фосфата лития-титана, допированного германием. Установлено, что формирование LiTi2 –xGex(PO4)3 протекает через промежуточное образование пирофосфата титана с последующим его превращением в материалы со структурой NASICON, которое завершается при 1073 К. Для получения керамики с оптимальной проводимостью необходим отжиг при 1173 К. На основании полученных результатов разработана методика двухстадийного синтеза. Максимальными величинами ионной проводимости (3.9 × 10–5 См/см при 433 К) и минимальной энергией ее активации (46 ± 1 кДж/моль) характеризуются образцы LiTi2 –xGex(PO4)3 со степенью замещения титана 20–25% (х = 0.4–0.5). Можно полагать, что это является следствием достижения оптимального размера каналов, по которым осуществляется перенос лития.
ВВЕДЕНИЕ
В современном обществе быстро растет спрос на портативные переносные устройства. Нишу их энергоснабжения безраздельно занимают литий-ионные аккумуляторы [1–3]. Одним из ключевых материалов в этих устройствах являются электролиты [4–6]. В настоящее время в них преимущественно используются жидкие электролиты на основе органических растворителей и солей лития с объемным анионом [7, 8]. К их недостаткам следует отнести низкую безопасность в связи с возможностью прорастания дендритов и сложность утилизации. В качестве перспективного решения данных проблем рассматривается возможность использования полностью твердотельных аккумуляторов [9, 10].
В связи с этим повышенное внимание уделяется нескольким развивающимся направлениям, среди которых стоит отметить различного рода полимерные электролиты [11–13] и широкое разнообразие керамических материалов [14, 15]. Среди твердых электролитов с литий-ионной проводимостью также можно выделить несколько групп, в числе которых наряду с давно известными материалами на основе нитрида [16], β‑алюмината лития [17] существенно более интенсивно исследуются материалы со структурой граната [18–20], перовскита (например, на основе Li3xLa2/3 –xTiO3) [21–24], LISICON (на основе силиката лития) [25], различного рода оксинитриды (структура LIPON) [26, 27], сульфидные системы, включая аморфные стекла [28–31].
Отдельно выделим материалы со структурой NASICON (Na Super Ionic CONductor) на основе сложных фосфатов состава ${\text{M}}_{x}^{{\text{I}}}{{{\text{A}}}_{2}}{{({\text{B}}{{{\text{O}}}_{4}})}_{3}}$, образованных чередованием октаэдров трех-, четырех- или пятизарядных катионов АO6 и тетраэдров ВО4 (В – фосфор, кремний, ванадий и ниобий) [32, 33]. Интерес к этим материалам возник довольно давно после обнаружения высокой (до 10–1 См/см) натрий-ионной проводимости у сложных силикофосфатов натрия-циркония при 300°С. Проводимость таких материалов по ионам лития заметно ниже [14]. Несмотря на это, высокая практическая значимость сохраняет актуальность их исследования [34–36].
Наибольшее внимание привлекает фосфат лития-титана (LiTi2(PO4)3). Собственная литий-ионная проводимость этого материала при комнатной температуре достаточно мала (около 10–7 См/см), однако ее можно существенно повысить за счет частичного гетеровалентного замещения титана на трех- или пятивалентные катионы [37–40]. В литературе также высказывалось мнение о том, что частичное замещение титана на алюминий приводит к оптимизации размеров проводящих каналов в структуре Li1 +xAlxTi2 –x(PO4)3 [41].
Хороших результатов удается добиться и при допировании аналогичного материала на основе фоcфата лития-германия [42, 43]. Однако ввиду высокой стоимости германия подобные материалы вряд ли можно считать перспективными. В то же время привлекательной представляется возможность замещения титана на германий в связи с тем, что ионные радиусы германия и алюминия близки. Поэтому подобное замещение может привести к оптимизации размеров проводящих каналов. Кроме того, существенно меньший радиус германия по сравнению с титаном может создать заметные локальные искажения структуры, повышая ее дефектность.
Целью данной публикации являлась оптимизация методов синтеза LiGexTi2 –x(PO4)3 и исследование ионной проводимости полученных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фосфаты лития-титана, допированные германием, LiTi2 –xGex(PO4)3 (х = 0–2) синтезировали твердофазным методом из карбоната лития, оксидов титана и германия, гидрофосфата аммония. Исследование процессов, протекающих в ходе синтеза LiTi2 –xGex(PO4)3, и оптимизацию метода их получения проводили на примере LiTi1.8Ge0.2(PO4)3. Стехиометрическую смесь состава Li2CO3 + 3.6TiO2 + 0.4GeO2 + 6(NH4)2HPO4 перетирали в агатовой ступке и отжигали при температуре 773 К в течение 5 ч. Полученный прекурсор снова перетирали в агатовой ступке, прессовали в таблетки под давлением 5 × 109 Па и для предотвращения неконтролируемых потерь лития отжигали под “шубой” из того же порошка прекурсора и/или порошка прекурсора, содержащего 10%-ный избыток карбоната лития, в течение 5 ч при температурах 573–1273 К с шагом 100 К. Также синтез LiTi1.8Ge0.2(PO4)3 проводили в течение 5, 10 и 15 ч при температуре 1173 К.
Термогравиметрический анализ смеси реагентов для синтеза LiTi1.8Ge0.2(PO4)3 проводили на термовесах Netzsch TG 209 в платиновом тигле в температурном интервале 298–1173 К при скорости нагрева 10 К/мин на воздухе с последующим анализом отводимых газов с помощью масс-спектрометра Aeolos QMS 403C.
Съемку дифрактограмм осуществляли на дифрактометре Rigaku D/MAX 2200 (излучение CuKα). Рентгенофазовый анализ (РФА) проводили с использованием базы данных ICDD PDF-2.
Морфологию полученных образцов исследовали с помощью сканирующего электронного микроскопа (СЭМ) Carl Zeiss NVision 40, оснащенного рентгеноспектральным детектором Oxford X-Max, при ускоряющем напряжении 1 или 5 кВ.
Ионную проводимость измеряли с помощью измерителя-анализатора импеданса 2В-1 двухконтактным методом на цилиндрических таблетках исследуемых материалов с серебряными электродами в диапазоне частот от 10 Гц до 2 МГц. Температурный интервал 298–473 К с шагом 25 К. Анализ годографов импеданса проводили с использованием программы EIS Spectrum Analyser.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез керамики состава LiTi2–xGex(PO4)3. Для исследования превращений, протекающих в ходе синтеза образцов LiTi2 –xGex(PO4)3, изучен процесс термолиза смеси исходных реагентов с масс-спектрометрией отводимых газов. При термической обработке на воздухе смеси Li2CO3 + 3.6TiO2 + + 0.4GeO2 + 6(NH4)2HPO4 суммарный процесс можно описать следующим уравнением:
(1)
$\begin{gathered} {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} + 3.6{\text{Ti}}{{{\text{O}}}_{{\text{2}}}} + 0.4{\text{Ge}}{{{\text{O}}}_{2}} + 6{{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{2}}{\text{HP}}{{{\text{O}}}_{4}} + \\ + \,\,х{{{\text{O}}}_{2}} = 2{\text{LiT}}{{{\text{i}}}_{{1.8}}}{\text{G}}{{{\text{e}}}_{{{\text{0}}{\text{.2}}}}}{{{\text{(P}}{{{\text{O}}}_{4}})}_{3}} + {\text{C}}{{{\text{O}}}_{{2~}}} + \\ + \,\,(12 - {4 \mathord{\left/ {\vphantom {4 5}} \right. \kern-0em} 5}x){\text{N}}{{{\text{H}}}_{3}} + {4 \mathord{\left/ {\vphantom {4 5}} \right. \kern-0em} 5}x{\text{NO}} + (3 + {6 \mathord{\left/ {\vphantom {6 5}} \right. \kern-0em} 5}x){{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $При этом потеря массы происходит в несколько стадий (рис. 1а). Согласно данным масс-спектрометрии отводимых газов, около 373 К теряется небольшое (не превышающее 0.6% от общей потери массы) количество воды, сорбированной развитой поверхностью исходных реагентов, в первую очередь оксидов титана и германия (рис. 1б). При увеличении температуры до 403 К одновременно с резким возрастанием интенсивности ионных токов с массовыми числами (M/z), равными 44 (${\text{CO}}_{2}^{ + }$) и 18 (H2O+), происходит рост интенсивности таковых с M/z = 15 (NH+), 30 (NO+) (рис. 1б). При этом также можно отметить очень незначительное увеличение интенсивности ионного тока с M/z = 46 (молекулярный ион ${\text{NO}}_{2}^{ + }$ ) и тока кислорода (M/z = 32). Логично полагать, что наблюдаемый набор ионных токов соответствует взаимодействию диаммонийфосфата и карбоната лития. По всей видимости, выделяющийся аммиак частично окисляется кислородом воздуха с образованием преимущественно монооксида азота. Ввиду значительной концентрации кислорода в подаваемом воздухе относительное изменение его концентрации невелико. Катализатором этого превращения может служить платина, входящая в состав материала тигля, или оксид титана. При этом, если к 513 К интенсивность ионного тока, соответствующего выделению аммиака, заметно падает, то выделение значительных количеств монооксида азота продолжается вплоть до 773 К. Наиболее вероятно, что в ходе данной реакции протекает сорбция выделяющихся оксидов азота и СО2 на поверхности оксидов титана и/или германия с последующим их высвобождением.
Рис. 1.
Результаты термического анализа смеси Li2CO3 + 3.6TiO2 + 0.4GeO2 + 6(NH4)2HPO4: температурные зависимости потери массы (а) и ионных токов с массовыми числами 15, 18, 30, 44 (б).
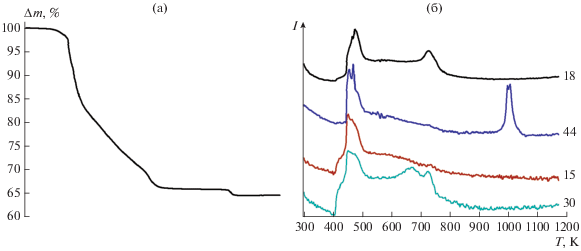
Отдельный вопрос вызывает потеря массы в интервале температур 988–1018 К. По данным масс-спектрометрии отводимых газов, в этом интервале температур наблюдается лишь выделение наиболее кислотных оксидов – СО2 и небольшого количества NO2. Вероятно, при этой температуре происходит спекание образующихся продуктов с высвобождением остатков наиболее прочно сорбированных газов. Следует также отметить, что в данном интервале температур происходит разложение карбоната лития. Однако сомнительно, чтобы его значимое количество могло остаться после взаимодействия со значительным избытком гидрофосфата аммония. Тем более, что в отсутствие оксидов титана (германия) СО2 нацело выделяется при низких температурах. Можно полагать, что в ходе дальнейшего синтеза LiTi1.8Ge0.2(PO4)3 диоксид углерода локализуется на ионах лития продуктов реакции, находящихся на их поверхности, и выделяется лишь в интервале температур 988–1018 К в ходе процесса спекания, сопровождающегося резким уменьшением площади поверхности материала.
Более детально разобраться в природе процессов, протекающих в ходе взаимодействия при отжиге смеси Li2CO3 + 3.6TiO2 + 0.4GeO2 + 6(NH4)2HPO4, позволяют данные РФА (рис. 2). Стоит отметить, что полное исчезновение рефлексов, соответствующих гидрофосфату аммония, наблюдается уже при 573 К. Основные линии продукта, отожженного при этой температуре, принадлежат остаткам диоксида титана (анатаз, PDF-2 № 21-1272) (рис. 2). Можно полагать, что остальные продукты при этом представлены аморфной смесью фосфатов и пирофосфатов лития и титана. Причем по мере нагревания кристаллизация пирофосфата титана (PDF-2 № 70-9482) и фосфата лития-титана LiTi2(PO4)3 (ICDD PDF-2 № 35-0754) происходит уже при температуре 673 К (рис. 2). При увеличении температуры постепенно происходит дальнейшее формирование LiTi2(PO4)3, рефлексы которого становятся доминирующими уже при 883 К (рис. 2).
Рис. 2.
Фрагменты дифрактограмм смеси состава Li2CO3 + 3.6TiO2 + 0.4GeO2 + 6(NH4)2HPO4 при 298 К (1) и отожженной в течение 5 ч при температурах 573 (2), 673 (3), 773 (4), 873 (5), 973 (6), 1073 (7), 1173 (8), 1273 К (9).
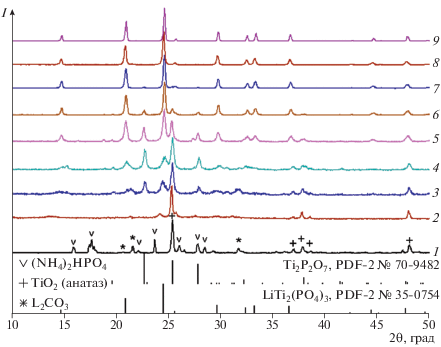
Стоит отметить, что выше 973 К основные примеси практически исчезают, что согласуется с высказанной гипотезой о спекании образца вблизи 1000 К. В то же время следовые количества пирофосфата титана сохраняютя даже при температуре прокаливания 1073 К (рис. 2). Основной причиной загрязнения продукта реакции фазой TiP2O7, по всей видимости, является неконтролируемая потеря лития.
Согласно данным СЭМ (рис. 3), полученная керамика представляет собой агломераты разного размера из спеченных частиц LiTi1.8Ge0.2(PO4)3, размер которых с увеличением температуры финального отжига несколько увеличивается. При этом наибольшей пористостью и, соответственно, меньшей относительной плотностью характеризуется образец, полученный в результате отжига при 1073 К.
Рис. 3.
СЭМ-изображения образцов LiTi1.8Ge0.2(PO4)3, полученных при 1073 (а), 1173 (б) и 1273 К (в).

Для получения плотной керамики желательно прессовать таблетки материала перед финальным отжигом из смеси, в которой основные стадии газовыделения уже пройдены. С учетом полученных данных синтез образцов LiTi2 –xGex(PO4)3 проводили в две стадии: реакционную смесь отжигали при 773 К, затем перетирали, прессовали в таблетки и подвергали заключительному отжигу. Кроме того, появление примеси пирофосфата титана может быть обусловлено частичным испарением оксида лития при высоких температурах. В ряде случаев преодолеть эту проблему удается при использовании в ходе синтеза “шубы” из этой же смеси [44]. При этом получали две серии образцов: исходные реагенты были взяты в строго стехиометрическом соотношении либо с использованием 10%-ного избытка карбоната лития.
Основные рефлексы на дифрактограммах всех полученных образцов соответствуют твердым растворам LiTi2 –xGex(PO4)3 и могут быть проиндицированы в гексагональной сингонии. На дифрактограммах образцов, синтезированных без избытка карбоната лития, также присутствуют линии пирофосфата титана, что указывает на недостаточность использования “шубы”. В то же время для образцов, полученных с 10%-ным избытком карбоната лития, появляется примесь Li4P2O7 (ICDD PDF-2 № 13-0440), максимальная интенсивность линий которой не превышает 2% от наиболее интенсивного рефлекса основной фазы. Это, напротив, свидетельствует о том, что избыток лития формирует собственную примесную фазу с фосфором.
В связи с этим для синтеза прессованных таблеток далее использовали реакционную смесь стехиометрического состава, а для получения “шубы” использовали 10%-ный избыток карбоната лития. Такая методика позволила получить однофазные прессованные образцы, дифрактограммы которых приведены на рис. 4.
Рис. 4.
Дифрактограммы образцов LiTi2 –xGex(PO4)3 и штрих-диаграмма LiTi2(PO4)3 (ICDD PDF-2 № 35-0754).
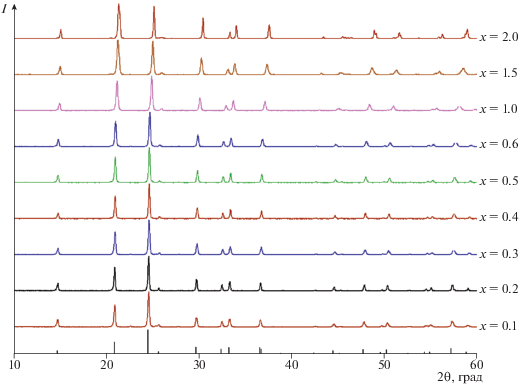
С увеличением содержания германия (х) в образцах LiTi2 –xGex(PO4)3 параметры а и с элементарной ячейки закономерно уменьшаются в связи с меньшим радиусом допанта (табл. 1, ионный радиус Ti4+ (к.ч. 6) составляет 0.61 Å, а Ge4+ (к.ч. 6) – 0.53 Å). Это указывает на образование твердых растворов на основе фосфата лития-титана. При этом зависимости параметров элементарной ячейки от состава достаточно хорошо описываются правилом Вегарда.
Таблица 1.
Параметры элементарной ячейки твердых растворов LiTi2 –xGeх(PO4)3
| х | a, Å | c, Å | V, Å3 |
|---|---|---|---|
| 0 | 8.5129(8) | 20.878(4) | 1310.31(2) |
| 0.1 | 8.4921(4) | 20.868(2) | 1303.29(2) |
| 0.2 | 8.4924(5) | 20.851(4) | 1302.32(2) |
| 0.3 | 8.4654(5) | 20.818(2) | 1292.01(1) |
| 0.4 | 8.4614(5) | 20.802(3) | 1289.79(3) |
| 0.5 | 8.4562(6) | 20.817(3) | 1289.13(8) |
| 0.6 | 8.4357(6) | 20.770(3) | 1279.99(8) |
| 1.0 | 8.3827(7) | 20.661(2) | 1257.33(2) |
| 1.5 | 8.3557(3) | 20.372(7) | 1231.77(1) |
| 2.0 | 8.3304(8) | 20.285(2) | 1219.09(4) |
Ионная проводимость образцов. Повышение температуры отжига от 1073 до 1173 К приводит к заметному росту ионной проводимости образцов за счет роста размера зерен и спекания материала. Однако дальнейшее повышение температуры отжига оказывается менее эффективным. Более того, если при высоких температурах проводимость образцов, полученных при 1273 К, заметно выше, чем таковых, отожженных при 1173 К, то при 300–400 К соотношение проводимостей для материалов с низкими степенями замещения титана оказывается обратным. Поскольку для применения в литий-ионных аккумуляторов низкотемпературный диапазон является более важным, то дальнейшее сопоставление проводимости проводилось для материалов с температурой отжига 1173 К. Кроме того, увеличение продолжительности высокотемпературного отжига с 5 до 10 и 15 ч приводит к получению материалов с одинаковыми в пределах ошибки измерения плотностью и проводимостью. Поэтому финальный отжиг проводился в течение 5 ч.
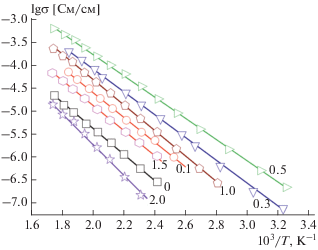
Температурные зависимости проводимости полученных образцов хорошо описываются линейными зависимостям в координатах уравнения Аррениуса (рис. 5), что отражает факт отсутствия фазовых переходов в исследуемых фосфатах.
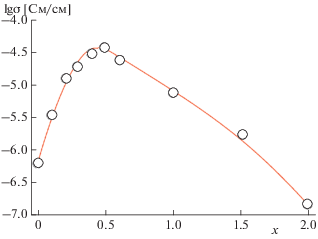
С ростом степени замещения ионов титана на германий ионная проводимость LiTi2 –xGex(PO4)3 сначала увеличивается, а затем вновь понижается, проходя через максимум при х = 0.4–0.5 (рис. 6). Можно полагать, что такая зависимость ионной проводимости LiTi2 –xGex(PO4)3 от содержания германия обусловлена изменением размеров каналов для транспорта ионов лития и, возможно, некоторым локальным разупорядочением лития вблизи малых ионов германия на начальных этапах.
Рис. 6.
Зависимость ионной проводимости керамических образцов LiTi2 –xGex(PO4)3 от состава при 433 К.
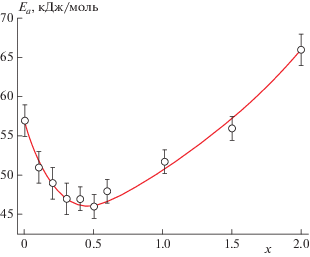
Известно, что во многих твердых электролитах существует т.н. эффект компенсации – чем выше ионная проводимость, тем меньше энергия ее активации. При этом минимальными значениями энергии активации характеризуются образцы с х = 0.4–0.5. Максимальные величины энергии активации достигаются для двойных фосфатов лития-германия (66 ± 2 кДж/моль) и лития-титана (57 ± 2 кДж/моль) (рис. 7).
ЗАКЛЮЧЕНИЕ
Проведенное исследование показывает, что синтез фосфата лития-титана, допированного германием, протекает через ряд последовательных процессов, включая взаимодействие гидрофосфата аммония с карбонатом лития, а затем с оксидами титана и германия через промежуточное формирование пирофосфата титана. Процесс синтеза завершается при 973 К, но последующий отжиг при более высоких температурах позволяет сформировать более плотную керамику с повышенной проводимостью, причем оптимальных результатов позволяет добиться двухстадийный синтез. Для проведения высокотемпературного отжига при 1173 К следует использовать прессованный образец стехиометрического состава, покрытый “шубой”, содержащей 10%-ный избыток лития.
Максимальными величинами ионной проводимости и минимальной энергией ее активации характеризуются образцы LiTi2 –xGex(PO4)3 со степенью замещения титана 20–25% (х = 0.4–0.5). Вероятно, это свидетельствует о достижении оптимального размера каналов, по которым осуществляется миграция лития.
Список литературы
Lu L., Han X., Li J., Hua J., Ouyang M. A Review on the Key Issues for Lithium-Ion Battery Management in Electric Vehicles // J. Power Sources. 2013. V. 226. P. 272–288.
Nitta N., Wu F., Lee J.T., Yushin G. Li-ion Battery Materials: Present and Future // Mater. Today. 2015. V. 18. P. 252–264.
Yaroslavtsev A.B., Stenina I.A., Golubenko D.V. Membrane Materials for Energy Production and Storage // Pure Appl. Chem. 2020. V. 92. № 7. P. 1147–1157.
Xu K. Electrolytes and Interphases in Li-Ion Batteries and Beyond // Chem. Rev. 2014. V. 114. P. 11503–11618.
Quartarone E., Mustarelli P. Review-Emerging Trends in the Design of Electrolytes for Lithium and Post-Lithium Batteries // J. Electrochem. Soc. 2020. V. 167. № 050508.
Stenina I.A., Yaroslavtsev A.B. Nanomaterials for Lithium-Ion Batteries and Hydrogen Energy // Pure Appl. Chem. 2017. V. 89. № 8. P. 1185–1194.
Li Q., Chen J., Fan L., Kong X., Lu Y. Progress in Electrolytes for Rechargeable Li-Based Batteries and Beyond // Green Energy Environ. 2016. V. 1. P. 18–42.
Бушкова O.В., Ярославцева Т.В., Добровольский Ю.А. Новые литиевые соли в электролитах для литий-ионных аккумуляторов (обзор) // Электрохимия. 2017. T. 53. C. 763–787.
Braga M.H., Subramaniyam C., Murchison A.J., Goodenough J.B. Nontraditional, Safe, High Voltage Rechargeable Cells of Long Cycle Life // J. Am. Chem. Soc. 2018. V. 140. P. 6343–6352.
Goodenough J.B., Braga M.H. Batteries for Electric Road Vehicles // Dalton Trans. 2018. V. 47. P. 645–648.
Yue L., Ma J., Zhang J., Zhao J., Chen L. All Solid-State Polymer Electrolytes for High-Performance Lithium Ion Batteries // Energy Storage Mater. 2016. V. 5. P. 139–164.
Hou W., Guo X., Shen X., Amine K., Lu J. Solid Electrolytes and Interfaces in All-Solid-State Sodium Batteries: Progress and Perspective // Nano Energy. 2018. V. 52. P. 279–291.
Voropaeva D.Yu., Novikova S.A., Yaroslavtsev A.B. Polymer Electrolytes for Metal-Ion Batteries // Russ. Chem. Rev. 2020. V. 89. № 10. P. 1132–1155.
Ярославцев А.Б. Основные направления разработки и исследования твердых электролитов // Успехи химии. 2016. Т. 85. № 11. С. 1255–1276.
Zhang Z., Shao Y., Lotsch B., Hu Y.-S., Li H., Janek J., Nazar L.F., Nan C.-W., Maier J., Armand M., Chen L. New Horizons for Inorganic Solid State Ion Conductors // Energy Environ. Sci. 2018. V. 11. P. 1945–1976.
Narimatsu E., Yamamoto Y., Takeda T., Nishimu-ra T., Hirosaki N. High Lithium Conductivity in Li1 – 2xCaxSi2N3 // J. Mater. Res. 2011. V. 26. P. 1133–1142.
Li H., Fan H., Wang B., Wang C., Zhang M., Chen G., Jiang X., Zhao N., Lu J., Zhang J. Mechanical and Electrical Properties of Lithium Stabilized Sodium Beta Alumina Solid Electrolyte Shaping by Non-Aqueous Gelcasting // J. Eur. Ceram. Soc. 2020. V. 40. P. 3072–3079.
Xu L., Li J., Deng W., Shuai H., Li S., Xu Z., Li J., Hou H., Peng H., Zou G., Ji X. Garnet Solid Electrolyte for Advanced All-Solid-State Li Batteries // Adv. Energy Mater. 2021. V. 11. № 2000648.
Sastre J., Priebe A., Döbeli M., Michler J., Tiwari A.N., Romanyuk Y.E. Lithium Garnet Li7La3Zr2O12 Electrolyte for All-Solid-State Batteries: Closing the Gap between Bulk and Thin Film Li-Ion Conductivities // Adv. Energy Mater. 2021. V. 7. № 2000425.
Kim A., Woo S., Kang M., Park H., Kang B. Research Progresses of Garnet-Type Solid Electrolytes for Developing All-Solid-State Li Batteries // Front. Chem. 2020. https://doi.org/10.3389/fchem.2020.00468
Catti M., Sommariva M., Ibberson R.M. Tetragonal Superstructure and Thermal History of Li0.3La0.567TiO3 (LLTO) Solid Electrolyte by Neutron Diffraction // J. Mater. Chem. 2007. V. 17. P. 1300–1307.
Zheng Z., Fang H., Liu Z., Wang Y. A Fundamental Stability Study for Amorphous LiLaTiO3 Solid Electrolyte // J. Electrochem. Soc. 2015. V. 162. P. A244–A248.
Zhang Y., Zheng Z., Liu X., Chi M., Wang Y. Fundamental Relationship of Microstructure and Ionic Conductivity of Amorphous LLTO as Solid Electrolyte Material // J. Electrochem. Soc. 2019. V. 166. P. A515–A520.
Lee S.J., Bae J.J., Son J.T. Structural and Electrical Effects of Y-doped Li0.33La0.56 –xYxTiO3 Solid Electrolytes on All-Solid-State Lithium Ion Batteries // J. Kor. Phys. Soc. 2019. V. 74. P. 73–77.
Deng Y., Eames C., Fleutot B., David R., Chotard J.-N., Suard E., Masquelier C., Islam M.S. Enhancing the Lithium Ion Conductivity in Lithium Superionic Conductor (LISICON) Solid Electrolytes through a Mixed Polyanion Effect // ACS Appl. Mater. Interfaces. 2017. V. 9. P. 7050–7058.
Hamon Y., Douard A., Sabary F., Marcel C., Vinatier P., Pecquenard B., Levasseur A. Influence of Sputtering Conditions on Ionic Conductivity of LiPON Thin Films // Solid State Ionics. 2006. V. 177. P. 257–261.
Lacivita V., Westover A.S., Kercher A., Phillip N.D., Yang G., Veith G., Ceder G., Dudney N.J. Resolving the Amorphous Structure of Lithium Phosphorus Oxynitride (Lipon) // J. Am. Chem. Soc. 2018. V. 140. P. 11029–11038.
Braga M.H., Murchison A.J., Ferreira J.A., Singh P., Goodenough J.B. Glass-Amorphous Alkali-Ion Solid Electrolytes and Their Performance in Symmetrical Cells // Energy Environ. Sci. 2016. V. 9. P. 948–954.
Kato Y., Hori S., Saito T., Suzuki K., Hirayama M., Mitsui A., Yonemura M., Iba H., Kanno R. High-Power All-Solid-State Batteries Using Sulfide Superionic Conductors // Nat. Energy. 2016. V. 1. P. 1–7.
Xie D., Chen S., Zhang Z., Ren J., Yao L., Wu L., Yao X., Xu X. High Ion Conductive Sb2O5-Doped B-Li3PS4 with Excellent Stability against Li for All-Slid-State Lithium Batteries // J. Power Sources. 2018. V. 389. P. 140–147.
Huang W., Cheng L., Hori S., Suzuki K., Yonemura M., Hirayama M., Kanno R. Ionic Conduction Mechanism of a Lithium Superionic Argyrodite in the Li–Al–Si–S–O system // Mater. Adv. 2020. V. 1. P. 334–340.
Goodenough J.B., Hong H.Y., Kafalas J.A. Fast Na+ Ion Transport in Skeleton Structures // Mater. Res. Bull. 1976. V. 11. P. 203-220.
Das A., Krishna P.S.R., Goswami M., Krishnan M. Structural Analysis of Al and Si Substituted Lithium Germanium Phosphate Glass-Ceramics Using Neutron and X-Ray Diffraction // J. Solid State Chem. 2019. V. 271. P. 74–80.
El-Shinawi H., Regoutz A., Payne D.J., Cussen E.J., Corr S.A. NASICON LiM2(PO4)3 Electrolyte (M = Zr) and Electrode (M = Ti) Materials for All Solid-State Li-Ion Batteries with High Total Conductivity and Low Interfacial Resistance // J. Mater. Chem. A. 2018. V. 6. P. 5296–5303.
Rusdi H., Mohamed N.S., Subban R.H.Y., Rusdi R. Enhancement of Electrical Properties of NASICON-Type Solid Electrolytes (LiSn2P3O12) via Aluminium Substitution // J. Sci. Adv. Mater. Devices. 2020. V. 5. P. 368–377.
Pareek T., Dwivedi S., Ahmad S.A., Badole M., Kumar S. Effect of NASICON-Type LiSnZr(PO4)3 Ceramic Filler on the Ionic Conductivity and Electrochemical Behavior of PVDF Based Composite Electrolyte // J. Alloys Compd. 2020. V. 824. № 153991.
Key B., Schroeder D.J., Ingram B.J., Vaughey J.T. Solution-Based Synthesis and Characterization of Lithium-Ion Conducting Phosphate Ceramics for Lithium Metal Batteries // Chem. Mater. 2012. V. 24. P. 287–293.
Свитанько А.И., Новикова С.А., Стенина И.А., Скопец В.А., Ярославцев А.Б. Микроструктура и ионный перенос в материалах Li1 +xTi2 −xMx(PO4)3 (M – Cr, Fe, Al) со структурой NASICON // Неорган. Матер. 2014. Т 50. № 3. С. 295–302.
Marcinek M., Syzdek J., Marczewski M., Piszcz M., Niedzicki L., Kalita M., Plewa-Marczewska A., Bitner A., Wieczorek P., Trzeciak T., Kasprzyk M., Łęzak P., Zukowska Z., Zalewska A., Wieczorek W. Electrolytes for Li-Ion Transport–Review // Solid State Ionics. 2015. V. 276. P. 107–126.
Yen P.-Y., Lee M.-L., Gregory D.H., Liu W.-R. Optimization of sintering Process on Li1 +xAlxTi2 –x(PO4)3 Solid Electrolytes for All-Solid-State Lithium-Ion Batteries // Ceram. Int. 2020. V. 46. P. 20529–20536.
Bucharsky E.C., Schell K.G., Hintennach A., Hoffmann M.J. Preparation and Characterization of Sol–Gel Derived High Lithium Ion Conductive NZP-Type Ceramics Li1 + xAlxTi2 – x(PO4)3 // Solid State Ionics. 2015. V. 274. P. 77–82.
Zhu Y., Zhang Y., Lu L. Influence of Crystallization Temperature on Ionic Conductivity of Lithium Aluminum Germanium Phosphate Glass-Ceramic // J. Power Sources. 2015. V. 290. P. 123–129.
Pershina S.V., Il’ina E.A., Druzhinin K.V., Farlenkov A.S. Effect of Li2O–Al2O3–GeO2–P2O5 Glass Crystallization on Stability versus Molten Lithium // J. Non-Cryst. Solids. 2020. V. 527. № 119708.
Стенина И.А., Кислицын M.Н., Пинус И.Ю., Архангельский И.В., Журавлев Н.А., Ярославцев А.Б. Фазовые превращения и катонная подвижность в двойных фосфатав лития–циркония со структурой НАСИКОН (Li1 ± xZr2 – xMx(PO4)3, M = Sc, Y,In,Nb,Ta) // Журн. неорган. химии. 2005. Т. 50. № 6. С. 985–990.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы