Неорганические материалы, 2021, T. 57, № 10, стр. 1144-1152
Синтез и термическое поведение мелкодисперсного порошкового огнегасящего агента на основе струвита
А. В. Пьянкова 1, *, Н. Б. Кондрашова 1, И. В. Вальцифер 1, А. Ш. Шамсутдинов 1, Э. Ю. Бормашенко 2
1 Институт технической химии УрО Российской академии наук – филиал Пермского федерального исследовательского центра УрО Российской академии наук
614013 Пермь, ул. Академика Королева, 3, Россия
2 Ариэльский университет, Факультет химической технологии
407000 Ариэль, Израиль
* E-mail: pyankova.a@itcras.ru
Поступила в редакцию 12.04.2021
После доработки 28.05.2021
Принята к публикации 04.06.2021
Аннотация
Дана оценка возможности применения струвита как компонента огнетушащего порошкового состава. Синтезирован мелкодисперсный кристаллогидрат (струвит) MgNH4PO4 ⋅ 6H2O в присутствии различных поверхностно-активных веществ. Установлены оптимальные условия получения мелкодисперсного кристаллогидрата, позволяющие исключить операцию измельчения и сохранить его кристаллическую структуру. Определено, что процесс термического разложения кристаллогидратов, синтезированных в присутствии поверхностно-активных веществ, сопровождается существенным эндотермическим эффектом, что будет способствовать снижению температуры очага возгорания.
ВВЕДЕНИЕ
Поиск и исследование новых эффективных и экологически чистых огнетушащих порошковых составов (ОПС), а также повышение эффективности существующих являются одними из приоритетных задач области пожаротушения [1, 2].
Повысить удельную эффективность ОПС можно за счет добавления в качестве их компонентов кристаллогидратов, в процессе термического разложения которых происходит дегидратация, сопровождаемая поглощением тепла [2, 3]. Это приводит к снижению температуры в зоне горения, а также к образованию негорючих газообразных соединений (паров воды), которые снижают концентрацию горючих газов, в результате чего обеспечивается высокая эффективность тушения [4].
В качестве кристаллогидрата в данной работе рассматривается 6-водный фосфат магния-аммония (МАФ, струвит) MgNH4PO4 ⋅ 6H2O, т.к. доступность получения струвита из сточных вод позволяет создать на его основе дешевые и экологически безопасные ОПС [4–6].
Тушение очага возгорания с использованием в качестве активного компонента струвита происходит в результате химического ингибирования пламени [7]. Термолиз струвита, сопровождающийся существенным эндотермическим эффектом, приводит к выделению большого количества газообразных продуктов, которые взаимодействуют с активными центрами пламени и газообразными веществами [8, 9]. Таким образом, поверхность огнетушащего компонента может выступать в качестве адсорбента, временно уводящего активные центры пламени из реакционной зоны [10, 11]. При этом эффективность описанных процессов возрастает с уменьшением размера частиц тушащего компонента [12]. Однако механическое измельчение кристаллогидрата до нужного размера может привести к деформации кристаллической решетки и потере кристаллизационной воды [13, 14].
В этой связи целесообразным становится исследование возможности исключения операции измельчения фосфатов (кристаллогидрата) при приготовлении ОПС. В частности, перспективным представляется регулирование размеров частиц пожаротушащего компонента в процессе его синтеза посредством введения поверхностно-активных веществ (ПАВ) [15, 16].
Поэтому целью работы явились разработка методики получения мелкодисперсного 6-водного МАФ (MgNH4PO4 ⋅ 6H2O), исследование влияния различных ПАВ на процессы зародышеобразования и роста частиц кристаллогидрата. В работе также дана сравнительная оценка охлаждающего эффекта при термолизе образцов, полученных с использованием различных ПАВ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве прекурсоров для получения струвита использовали 6-водный хлорид магния (MgCl2 ⋅ 6H2O, “х. ч.”, АО “Вектон”), гидрофосфат аммония (NH4)2HPO4, АО “Вектон”). рН среды устанавливали гидроксидом аммония (NH4OH, 25%-ный “ч. д. а.”, АО “Вектон”).
Рост кристаллогидратов и размер частиц регулировали введением в процессе синтеза различных ПАВ: анионного – додецилсульфата натрия NaC12H25SO4 (SDS, 98%, Aldrich), катионного – бромида цетилтриметиламмония C19H42BrN (СТАВ, 98%, Aldrich) и неионогенного – Tween 80 C64H124O26 (98%, Aldrich).
Синтез струвита осуществляли по следующей схеме: готовили растворы солей: 6-водного хлорида магния 0.1 М и гидрофосфата аммония 0.1 М, добавляли раствор аммиака до рH 9.5, растворы смешивали с помощью магнитной мешалки при температуре 25°С в течение 5 мин. Затем добавляли ПАВ в концентрации 0.01 М. Осадок отфильтровывали, промывали дистиллированной водой, сушили при температуре 25°С в течение суток. Процесс получения 6-водного МАФ (струвита) описывается уравнением [17]
(1)
$\begin{gathered} {\text{M}}{{{\text{g}}}^{{2 + }}} + {\text{N}}{{{\text{H}}}^{{4 + }}} + {\text{HPO}}_{4}^{{2 - }} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow \\ \leftrightarrow \,\,{\text{MgN}}{{{\text{H}}}_{{\text{4}}}}{\text{P}}{{{\text{O}}}_{4}}\cdot6{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \downarrow + \,{{{\text{H}}}^{ + }}. \\ \end{gathered} $Свойства синтезированных образцов были исследованы с применением различных физико-химических методов анализа.
Наблюдение за процессом роста кристаллов в присутствии различных ПАВ, а также определение размера частиц струвита и распределения их по размерам осуществляли на приборе OLYMPUS BX53M (Olympus, Japan) с системой цифровой фотомикроскопии c программным обеспечением для обработки оптических образов ImageScope M (Япония).
Структуру образцов изучали методами рентгенофазового анализа (РФА) и ИК-спектроскопии. РФА проводили на дифрактометре XRD-7000 (Shimadzu, Япония) при использовании CuKα-излучения (λср = 1.54 Å). Сканирование проводилось в угловых интервалах 2θ = 1.4°–10° и 10°–80° с шагом 0.01°–0.005°, время накопления сигнала 1.5–2 с. Спектры идентифицировали с использованием картотеки JSPDS. Средний размер кристаллитов определяли по формуле Селякова–Шеррера: d = Kλ/(βcosθ), где K = 0.89; λ = 1.54056 Å; β – полуширина рефлекса 100, рад.; θ – дифракционный угол рефлекса, град. ИК-спектры регистрировали в области 400–4000 см–1 на ИК-Фурье-спектрометре IFS – 66/S (фирмы Bruker, Германия).
Текстурные свойства частиц гексагидрата фосфата магния-аммония определяли методом низкотемпературной сорбции азота на приборе ASAP 2020 (Micromeritics, США) после дегазации исследуемого материала в вакууме при температуре 60°С в течение 3 ч. Удельную поверхность образцов (SБЭТ) и общий объем пор (Vtot) определяли методом БЭТ, распределение пор по размерам – по изотермам десорбции, используя метод BJH в интервале размеров пор 1.7–300 нм.
Термическое поведение синтезированных образцов исследовали методами термогравиметрического анализа (ТГА) и дифференциальной сканирующей калориметрии (ДСК) с помощью термогравиметрического анализатора TGA/DSC1 (METTLER-TOLEDO) на воздухе при скорости нагревания 10°С/мин в интервале температур 25–800°С.
Морфологию частиц струвита исследовали методом сканирующей электронной микроскопии (СЭМ) на приборе FEI Quanta FEG650 (ThermoFisher Scientific, Нидерланды).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С целью получения мелкодисперсного струвита без применения механического измельчения в работе предложено в процессе синтеза использовать различные ПАВ. Из литературных источников известно, что характер кристаллизации в присутствии ПАВ отличается от обычного процесса получения кристаллогидратов в водной среде [17]. При введении ПАВ в реакционную смесь скорость зародышеобразования кристаллов увеличивается с уменьшением поверхностного натяжения (σ) на границе твердое тело–жидкость, что способствует образованию большого числа субмикронных частиц [18].
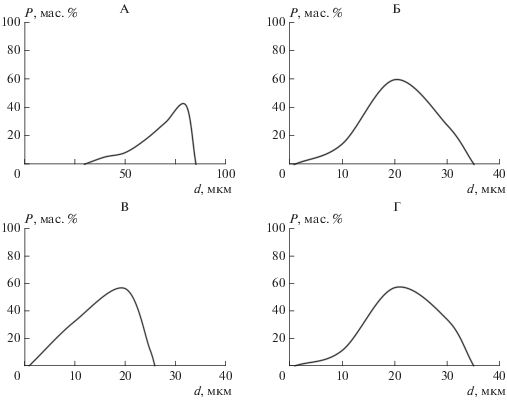
Исследование процесса кристаллизации проводили с помощью оптического микроскопа. На предметное стекло наносились смеси исходных реагентов в соотношениях, указанных выше. Время выдержки варьировалось от 1 до 30 мин. Были получены 4 серии образцов кристаллогидрата MgNH4PO4 ⋅ 6H2O: синтезированного без применения ПАВ (А), синтезированного в присутствии анионного SDS (Б), синтезированного в присутствии катионного CTAB (В), синтезированного в присутствии неионогенного Tween 80 (Г). Результаты экспериментов приведены на рис. 1.
Рис. 1.
Процесс роста частиц кристаллогидрата MgNH4PO4 ⋅ 6H2O в дистиллированной воде (образец А) (а, б), в присутствии SDS (Б) (в, г), в присутствии CTAB (В) (д, е), в присутствии Tween 80 (Г) (ж, з), время кристаллизации 1 (а, в, д, ж), 30 мин (б, г, в, з).

Как следует из рис. 1, введение ПАВ оказывает влияние как на процесс зародышеобразования и начальной кристаллизации (рис. 1a, 1в, 1д, 1ж), так и на последующий рост кристаллов (рис. 1б, 1г, 1е, 1з). Так, микрофотография образца А соответствует процессу медленной кристаллизации и характеризуется появлением кристаллов в форме трапеций и призм. Из микрофотографий образцов Б, В и Г следует, что процесс кристаллизации MgNH4PO4 ⋅ 6H2O протекает значительно быстрее и сопровождается образованием кристаллов в форме звездочек и дендритов. Из представленных снимков видно, что характер кристаллизации струвита в присутствии ионогенных (SDS и CTAB) и неионогенного ПАВ (Tween 80) различается.
Средний размер частиц образцов MgNH4PO4 ⋅ · 6H2O, полученных в присутствии ПАВ, составил 20 мкм, что в ~4 раза меньше размера частиц (агрегатов частиц) кристаллогидрата (~80 мкм), полученного по стандартной методике (рис. 2А, 2Б). Измерение размера и подсчет количества частиц осуществлялись с помощью оптического микроскопа автоматически (рис. 2).
Известно, что в силу анизотропии поверхностной энергии адсорбционное давление на различных гранях кристалла различается, в результате чего грани кристалла растут с разной скоростью [19]. ПАВ, адсорбируясь на поверхности кристаллов, могут изменять скорости образования и роста кристаллов как вследствие изменения поверхностной энергии на границе раздела фаз, так и вследствие торможения процесса массопередачи к поверхности кристалла.
На рис. 3 представлены СЭМ-снимки исследуемых образцов. Кристаллы струвита имеют клиновидную (рис. 3б) и короткопризматическую формы (рис. 3в). Можно наблюдать, что при введении ПАВ в процессе синтеза MgNH4PO4 ⋅ 6H2O кристаллические частицы обособляются, особенно в образцах полученных в присутствии ионогенных ПАВ (рис. 3б, 3в). В образце А, полученном традиционным способом, присутствуют агрегаты кристаллических структур (рис. 3а).
Влияние ПАВ на структуру кристаллогидрата MgNH4PO4 ⋅ 6H2O оценивали методами ИК-спектроскопии и РФА.
В ИК-спектрах синтезированных кристаллогидратов присутствуют все связи, характерные для структуры струвита независимо от присутствия и типа ПАВ.
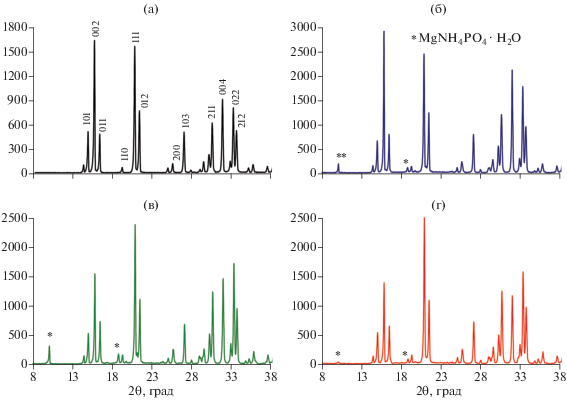
Более информативным методом исследования влияния ПАВ на структурные особенности синтезированных образцов является РФА. На рентгенограммах (рис. 4) образцов в присутствии всех рассматриваемых ПАВ, помимо основной фазы струвита, наблюдаются малоинтенсивные рефлексы при 2θ = 10.15° и 18.88°, соответствующие фазе моноводного фосфата магния-аммония. Более выраженные рефлексы, характерные для MgNH4PO4 ⋅ H2O, наблюдаются в образцах, синтез которых осуществлялся в присутствии ионогенных ПАВ (рис. 4б, 4в), особенно в присутствии катионогенного CTAB (рис. 4в).
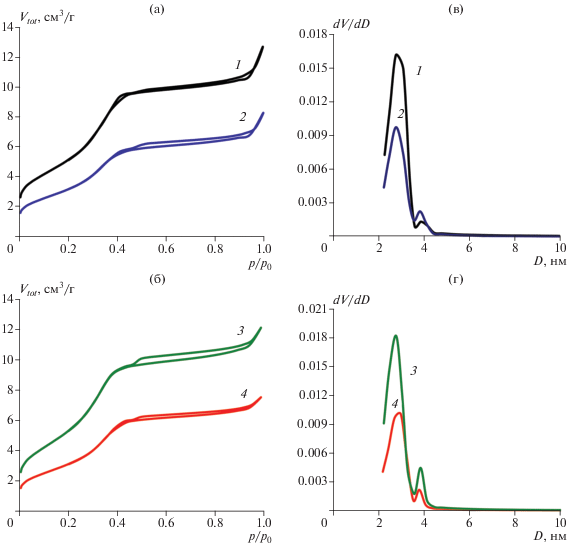
Рис. 5.
Изотермы сорбции (а, б), распределение пор по размерам (в, г) в образцах: А (1), Б (2), В (3), Г (4).
Согласно данным табл. 1, средний размер кристаллитов, определенный методом Селякова–Шерера, снижается при синтезе струвита в присутствии ПАВ, при этом от типа ПАВ, используемого в процессе синтеза кристаллогидратов, зависит незначительно.
Текстурные свойства кристаллогидратов, синтезированных в присутствии различных ПАВ, определенные методом низкотемпературной сорбции азота, приведены на рис. 5 и в табл. 1.
На рис. 5а, 5б можно видеть, что изотермы сорбции всех исследуемых образцов имеют форму IV в соответствии с классификацией IUPAC, характерную для мезопористых структур, с выраженной областью капиллярной конденсации азота в области относительных давлений 0.25–0.4. Незначительный гистерезис в образцах кристаллогидратов Б и В, полученных с применением ионогенных ПАВ–SDS (рис. 5а) и CTAB (рис. 5б), можно объяснить, согласно данным РФА, присутствием нецелевой фазы – моноводного фосфата магния-аммония (рис. 4б, 4в). В литературе гистерезис на кривых сорбции, а также бимодальное распределение пор по размерам (в нашем случае с максимумами при D1 = 2.8–3 нм и D2 = 3.8–3.9 нм) связывают с наличием конусовидных пор типа “чернильницы”, имеющих широкое основание и узкое “горло”. Из-за разницы размеров основания и “горлышка” процесс десорбции происходит с некоторой задержкой [20]. Возможно, формированию такого типа пор в исследуемых образцах способствует орторомбическая сингония кристаллов струвита.
Из данных, представленных в табл. 1, следует, что наибольшая удельная поверхность (26 м2/г) наблюдается в образце В, полученном в присутствии катионного CTAB. Скорее всего, в этом случае имеет место адсорбция за счет электростатического взаимодействия ионогенного ПАВ и растущих граней кристалла, что является дополнительным сдерживающим фактором роста частиц [21]. На рис. 2 показано, что в образце В, полученном в присутствии CTAB, распределение частиц по размерам определяется в наиболее узком диапазоне (до 25 мкм), в то время как в образцах Б и Г интервал распределения частиц по размерам значительно шире (до 35 мкм).
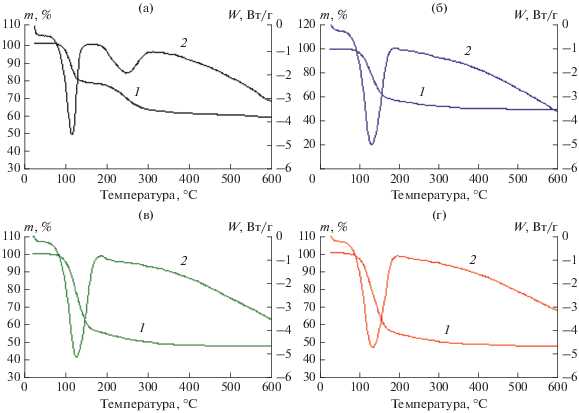
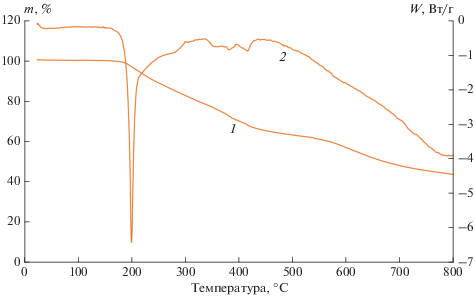
Сравнительную оценку суммарного содержания воды, сорбированной и кристаллизационной (%), а также охлаждающего эффекта в процессе термического разложения исследуемых кристаллогидратов провели методами ТГА и ДСК (рис. 6, табл. 2).
Таблица 2.
Данные термических испытаний образцов MgNH4PO4 ⋅ 6H2O
| Образец | Общая потеря массы, % | Начальная температура эффекта, °С | Конечная температура эффекта, °С | Тепловой эффект, Дж/г | |||
|---|---|---|---|---|---|---|---|
| А | 41.3 | I ст. | II ст. | I ст. | II ст. | I ст. | II ст. |
| 47 | 171 | 173 | 323 | –384 | –710 | ||
| Б | 49.8 | 52 | 191.1 | –1280.6 | |||
| В | 52.1 | 52 | 191.1 | –1313.6 | |||
| Г | 51.9 | 45 | 194.2 | –1361.9 | |||
Термическая деструкция образца А, согласно кривой ТГА, протекает ступенчато. На кривой ДСК этого образца отчетливо определяются 2 эндоэффекта с максимумами при ~111 и ~250°C. Процесс терморазложения в этом случае можно представить схемой:
Процесс термолиза образцов Б, В и Г, полученных при введении в процессе их синтеза различных ПАВ, значительно отличается от термодеструкции образца А. В этом случае термодеструкция кристаллогидратов протекает одностадийно:
На кривых ДСК образцов струвита, полученных с использованием ПАВ, определяется по 1 эндоэффекту (рис. 6б–6г) в диапазоне температур ~50–194°C (табл. 2). Количество поглощаемого тепла при этом в образцах Б, В и Г существенно (на 12, 15 и 19% соответственно) превышает тепловой эффект, определенный при разложении образца MgNH4PO4 ⋅ 6H2O, полученного без применения ПАВ (табл. 2).
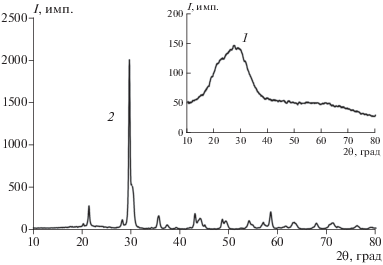
Также на кривых ДСК всех рассматриваемых образцов (рис. 6, кривые 2) можно наблюдать фазовый переход из аморфного состояния Mg2P2O7 в кристаллическое при температурах ~681–695°C (рис. 7, результаты РФА приведены на примере образца А). Температуры кристаллизации образцов струвита, полученных в присутствии ПАВ, ниже (образца Б – 691°С, В – 681°С, Г – 683°С), чем образца А, полученного традиционным способом (695°С).
Стоит отметить, что эндотермический эффект при разложении аммофоса, наиболее часто применяемого в средствах пожаротушения в настоящее время, значительно ниже (~900 Дж/г), чем у 6-водного МАФ, причем его разложение начинается при более высокой температуре (рис. 8).
Таким образом, кристаллогидраты МАФ с повышенной охлаждающей способностью могут рассматриваться как перспективные компоненты огнетушащих порошковых составов.
ЗАКЛЮЧЕНИЕ
Исследовано влияние введения различных ПАВ в процессе синтеза струвита на его структурно-текстурные свойства.
Показано, что введение ПАВ в маточный раствор способствует увеличению числа зародышей кристаллической фазы, а также повышению скорости кристаллизации. При этом размер образующихся агломератов частиц струвита (MgNH4PO4 ⋅ 6H2O) уменьшается в ~4 раза.
Методом СЭМ определено, что ПАВ препятствуют сращиванию кристаллов струвита.
Методом ИК-спектроскопии определено, что связи, характерные для структуры струвита, определяются во всех исследуемых образцах MgNH4PO4 ⋅ 6H2O, независимо от присутствия и типа ПАВ в процессе их синтеза.
С помощью РФА продемонстрировано, что в образцах кристаллогидратов, полученных в присутствии всех рассматриваемых ПАВ, помимо основной фазы струвита, определяется фаза моноводного фосфата магния-аммония. Средний размер кристаллитов в образцах, синтезированных в присутствии ПАВ, ниже, чем в образце MgNH4PO4 ⋅ 6H2O, полученном традиционным способом.
Методом низкотемпературной сорбции азота определены текстурные свойства кристаллогидратов. Показано, что изотермы сорбции исследуемых образцов имеют форму, характерную для организованных мезопористых структур, наблюдается узкое распределение пор по размерам.
Исследование термического поведения образцов продемонстрировало, что введение ПАВ в процессе синтеза струвита способствует увеличению количества поглощаемого тепла при его термодеструкции на 12–19% по сравнению с образцом, полученным традиционным способом, и на ~30% по сравнению с аммофосом.
Список литературы
Lapshin D.N., Kunin A.V., Semenov A.D. Influence of Chemical Impurities in Ammonium Phosphate and Ammonium Sulfate on the Properties of Abce Fire Extinguishing Dry Powders // Russian J. General Chem. 2016. V. 86. № 2. P. 439–449. https://doi.org/10.1134/S1070363216020444
Xiaomin N., Chow W.K., Guangxuan L. Discussions on Applying Dry Powders to Suppress Tall Building Fires // J. Appl. Fire Science. 2009. V. 18. № 2. P. 155–191. https://doi.org/10.2190/AF.18.2.d
Kuang K., Huang X., Liao G. A Comparison between Superfine Magnesium Hydroxide Powders and Commercial Dry Powders on fire Suppression Effectiveness // Process Safety Environ. Protection. 2008. V. 86. № 3. P. 182–188. https://doi.org/10.1016/j.psep.2007.11.002
Zhang S., Shi H.-S., Huang S.-W., Zhang P. Dehydration Characteristics of Struvite-K Pertaining to magnesium potassium phosphate cement System in Non-Isothermal Condition // J. Therm. Anal. Calorim. 2013. V. 111. № 1. P. 35–40. https://doi.org/10.1007/s10973-011-2170-9
Shih K., Yan H. The Crystallization of Struvite and its Analog (K-struvite) from Waste Streams for Nutrient Recycling // Environ. Mater. Waste. 2016. P. 665–686. https://doi.org/10.1016/B978-0-12-803837-6.00026-3
Siciliano A., Limonti C., Curcio G.M., Molinari R. Advances in Struvite Precipitation Technologies for Nutrients Removal and Recovery from Aqueous Waste and Wastewater // Sustainability. 2020. V. 12. № 18. P. 1–36. https://doi.org/10.3390/su12187538
Bichall J.D. On the Mechanism of Flame Inhibition by Alkali Metal Salts // Combust. Flame. 1970. V. 14. P. 85–96. https://doi.org/10.1016/S0010-2180(70)80013-X
Yan H., Shih K. Effects of Calcium and Ferric Ions on Struvite Precipitation: A new Assessment Based on Quantitative X-ray Diffraction Analysis // Water Res. 2016. V. 95. P. 310–318. https://doi.org/10.1016/j.watres.2016.03.032
Haiqiang L., Ruowena Z., Jiaxina G., Siuming L., Yuana H. A Good Dry Powder to Suppress High Building Fires // APCBEE Proc. 2014. V. 9. P. 291–295. https://doi.org/10.1016/j.apcbee.2014.01.052.
Gurchumelia L., Tsarakhov M., Machaladze T., Tkemaladze S., Bejanov F., Chudakova O. Elaboration of New Types, Environmentally Safe Fire-Extinguishing Powders and Establish the Conditions of Extinguish Optimum and Effective Use of Such Powders // Modern Chemistry & Applications. 2018. V. 6, № 2. P. 257–266. https://doi.org/10.4172/2329-6798.1000257
Dewitte M., Vrebosh J., Van Tiggelen A. Inhibition and Extinction of Premixed Flames by Dust Particle // Combust. flame. 1984. V. 18. № 4. P. 257–266. https://doi.org/10.1016/0010-2180(64)90079-3
Kunin A.V., Lapshin D.N., Il’in A.P., Smirnov S.A., Semenov A.D. Technology Development for the Production of Abce Fire Extinguishing Dry Powders // Russ. J. Gen. Chem. 2016. V. 86. № 2. P. 450–459. https://doi.org/10.1134/S1070363216020456
Song X.D. Applications of dry powder system // Fire Tech. Prod. Inform. 2002. V. 9. P. 3–6.
Krasnyansky M. Studies of Fundamental Physical-Chemical Mechanisms and Processes of Flame Extinguishing by Powder Aerosols // Fire Mater. 2008. V. 32. № 1. P. 27–37. https://doi.org/10.1002/fam.951
Sharma C., Desai M.A., Patel S.R. Effect of Surfactants and Polymers on Morphology and Particle Size of Telmisartan in Ultrasound – Assisted Anti – Solvent Crystallization // Chem. Papers. 2019. V. 73. № 7. P. 1685–1694. https://doi.org/10.1007/s11696-019-00720-1
Doyle J.D., Parsons S.A. Struvite Formation, Control and Recovery // Water Res. 2002. V. 36. P. 3925–3940. https://doi.org/10.1016/S0043-1354(02)00126-4
Chetan S., Meghal A.D., Sanjaykumar R.P. Effect of Surfactants and Polymers on Morphology and Particle Size of Telmisartan in Ultrasound‑Assisted Anti-Solvent Crystallization // Chem. Papers. 2019. V. 73. № 7. P. 1685–1694. https://doi.org/10.1007/s11696-019-00720-1
Hövelmann J., Stawski T.M., Freeman H.M., Besselink R., Mayanna S., Perez J.P., Hondow N.S., Benning L.G. Struvite Crystallisation and the Effect of Co2+ ions // Minerals. 2019. V. 9. № 9. P. 450–459. https://doi.org/10.3390/min9090503
Shchukin E.D., Pertsov A.V., Amelina E.A., Zelenev A.S. Interfaces between Condensed Phases // Wetting Stud. Interface Sci. 2001. V. 12. P. 165–259.
Sing K. The Use of Nitrogen Adsorption for the Characterization of Porous Materials // Colloids Surf., A. 2001. V. 187. P. 3–9. https://doi.org/10.1016/S0927-7757(01)00612-4
Fuerstenau D.W. The Adsorption of Surfactants at Solid/Water Interfaces // Chem. Biosurf. 1971. V. 1. P. 143–150. https://doi.org/10.1021/j100794a021
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы