Неорганические материалы, 2021, T. 57, № 11, стр. 1161-1173
Способы получения высокочистого мышьяка и его соединений
В. А. Федоров 1, Т. К. Менщикова 1, *, А. И. Варгунин 1, К. С. Никонов 1, М. Н. Бреховских 1, О. Е. Мыслицкий 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
* E-mail: fedorov@igic.ras.ru
Поступила в редакцию 08.04.2021
После доработки 19.07.2021
Принята к публикации 20.07.2021
Аннотация
Изложены результаты физико-химических и технологических основ, находящихся в патентной информации и научно-технических источниках, по получению высокочистых мышьяксодержащих соединений из различного сырья. Значительное внимание уделено переработке нетрадиционного сырья (продуктов детоксикации люизита, отходов цветной металлургии и производства вторичных полупроводниковых материалов АIIIBV). Получены и охарактеризованы образцы мышьяксодержащих веществ (элементный мышьяк, трихлорид и триоксид мышьяка, арсин) с содержанием лимитируемых примесей менее 1 × 10–4 мас. %.
ВВЕДЕНИЕ
Высокочистый мышьяк необходим для создания и производства современных полупроводниковых материалов типа АIIIBV и, прежде всего, арсенида галлия и его твердых растворов. Физико-химические свойства полупроводниковых и оптических материалов существенно зависят от чистоты исходных веществ. Необходимы вещества с минимальным суммарным содержанием лимитируемых микропримесей – не более 1 × 10–4 мас. %. Особенно жесткие требования предъявляются к мышьяку, используемому в технологии материалов для микроэлектроники, по содержанию примесей меди, цинка, кремния, углерода, серы, селена, теллура и кислорода. В этой связи разработка методов и технологии глубокой очистки мышьяка приобретает особую значимость.
Имеющиеся в литературе данные и наш опыт свидетельствуют о том, что получение высокочистого мышьяка представляет собой весьма сложную проблему [1, 2]. Главная трудность заключается в отсутствии прямых методов глубокой очистки непосредственно элементного технического мышьяка. Наибольшее распространение получили вопросы, связанные с синтезом мышьяксодержащих веществ (AsCl3, As(OR)3, AsH3), последующей их переработкой в высокочистые продукты и восстановлением или термическим разложением до элементного мышьяка и финишной сублимацией. Существующие технологические схемы являются весьма сложными и требуют обеспечения особых мер экологической безопасности.
В РФ отсутствуют рудные месторождения мышьяксодержащих источников, поэтому поиск и разработка альтернативной и технологической сырьевой базы имеет важное значение.
Целью настоящей работы являются поиск и отбор патентной информации и основополагающих литературных источников по способам получения, технологии (аппаратуре) высокочистых мышьяка и его соединений в ведущих странах: Россия (СССР), США, Япония, Германия и Китай. Обобщены источники информации за последние 15–20 лет по следующим проблемам:
– способы получения элементного мышьяка из различного сырья;
– способы получения высокочистого мышьяка и его соединений;
– устройства и аппаратура для выделения и глубокой очистки мышьяксодержащих веществ.
Значительное внимание уделено анализу методов получения высокочистых мышьяксодержащих соединений (AsCl3, AsH3 и As2О3), проблеме комплексной очистки высокочистого арсина и элементного мышьяка квалификаций 6N и 7N.
МЕТОДЫ ОЧИСТКИ МЫШЬЯКА И ЕГО СОЕДИНЕНИЙ
Сублимация. Для очистки технического мышьяка широко применяется сублимационный метод, основанный на различии в составах твердой фазы и образующегося из нее пара. Высокие значения давления насыщенного пара мышьяка позволяют осуществлять его очистку главным образом от труднолетучих примесей. Практическое применение находит сублимация в вакууме и в потоке инертного газа или водорода. Наиболее полно этот процесс рассмотрен в [3–7]. Предложены различные варианты проведения сублимации, например, однократный или многократный процессы в многосекционной ампуле. Сублимация мышьяка в токе водорода [8] особенно эффективна для удаления примеси серы. С целью повышения эффективности очистки от примесей халькогенов предложено [8] проводить очистку в токе водорода в присутствии арсина (5–15 об. % в газовой смеси) и при температуре от 975 до 1100 К в зоне испарения.
Действительно, очистка сублимационным способом технического мышьяка, выделяемого из традиционного и нетрадиционного сырья, дает возможность получить материал квалификации “ос. ч.” [4, 6, 9].
Кристаллизация. Для получения мышьяка в виде монолитных слитков с пониженным содержанием примесей может быть использован метод направленной кристаллизации из расплава. Применение кристаллизации из расплава в случае элементного мышьяка осложнено тем, что давление его паров в тройной точке превышает 30 атм при температуре 817°С [10]. В работе [10] изложены результаты исследований по разработке физико-химических и технологических основ получения элементного мышьяка высшей квалификации (99.99999 мас. %) из традиционного (сульфидная руда As2S3) и нетрадиционного (продуктов разложения химического оружия – люизита) сырья с применением в качестве финишной стадии глубокой очистки мышьяка направленной кристаллизацией из расплава. Физико-химические основы данного метода изложены в [11–15]. Процессы отгонки оксидов и сублимации проводили в кварцевой ампуле диаметром 12–15 мм с загрузкой до 130 г исходного мышьяка в две стадии. На первой стадии происходило удаление летучих оксидов мышьяка и остаточных газов (230–300°C). Далее ампулу вакуумировали и помещали в термический блок [9] установки сублимационной очистки. Процесс сублимации проводили при температуре в зоне испарения 500–550°C, зоне конденсации – 300–350°C. Для получения компактной загрузки ампулу помещали таким образом, чтобы происходило направленное формирование крупнокристаллического слитка, занимающего не менее 60% объема конденсатора. Направленную кристаллизацию расплава мышьяка осуществляли в ростовом блоке. При начальной скорости перемещения ампулы с расплавом мышьяка, равной 5–10 мм/ч, обеспечивалось формирование 1–2 монокристаллических блоков, рост которых протекал при эффективном оттеснении примесей границей кристалл–расплав.
В [15] показано, что предварительная сублимация в сочетании с кристаллизационной стадией позволяет получать крупнокристаллические слитки мышьяка со значением остаточного удельного сопротивлении γ4.2 = 8000−10 000, где γ4.2 определяется как R293 K/R4.2 К. Эти данные являются интегральной оценкой чистоты материала и свидетельствуют о низком содержании микропримесей в очищенном мышьяке. Для не электрически-активных примесей удельное сопротивление не будет являться показателем их концентраций.
В [9] приведена технологическая схема получения высокочистого мышьяка квалификации 7N направленной кристаллизацией расплавленного мышьяка марки 6N.
Получены слитки мышьяка длиной около 100 мм, каждый из которых состоял из 1–2 монокристаллических блоков. Величина γ4.2 находится в пределах 8000–12 000. Содержание примесей: Al, Fe, Na, Pb, S, Te – менее 1 × 10–6, Si – 1 × 10–7, Mn, Cu – 2 × 10–7, Cr – 5 × 10–7, Mg – 6 × 10–8, Zn – 3 × × 10–7 мас. %.
На основании изложенного можно заключить, что метод направленной кристаллизации дает возможность получать мышьяк уникальной чистоты (99.99999 мас. %), пригодный для наиболее прецизионных областей применения.
Получение высокочистого мышьяка из химических соединений. Современное состояние проблемы производства высокочистого мышьяка из различного сырья рассмотрено в обзорах [1, 11, 13]. Очистка триоксида мышьяка производится физико-химическими методами с последующим восстановлением до элементного мышьяка углем. В настоящее время этот способ практически не применяется.
Гидридный метод включает в себя синтез арсина [11], например гидролизом арсенида магния, его осушку и глубокую очистку, последующее восстановление или разложение до элементного мышьяка. Гидридная технология обеспечивает получение наиболее чистого элементного мышьяка.
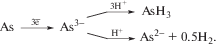
Данные по глубокой очистке технического мышьяка показывают, что только комбинация методов обеспечивает требуемую степень чистоты AsH3. Первая стадия очистки (рис. 1) осуществляется в условиях синтеза арсина [11], т.е. при гидролизе арсенида магния, при этом не образуются гидриды элементов VI группы и, следовательно, происходит очистка от примесей селена и серы. От примесей углеводородов арсин эффективно очищается низкотемпературной ректификацией или фракционной дистилляцией. На стадии абсорбционно-адсорбционной очистки углем БАУ селективно поглощаются гидриды серы, селена и теллура.
Рис. 1.
Номограмма поведения примесей при получении высокочистого AsH3: 1 – Н2О; 2 – углеводороды; 3 – S, Se, Te (сумма); 4 – металлы.
В настоящее время для получения высокочистого мышьяка на базе традиционного и нетрадиционного сырья наиболее отработана и эффективно функционирует в промышленном варианте хлоридная схема.
Исходный AsCl3 синтезируют из элементов или растворением As2O3 в HCl. Оптимальная схема очистки трихлорида мышьяка включает в себя следующие стадии: экстракцию примесей концентрированной HCl или предварительную дистилляцию, химико-термическую обработку при 800–1000°С, адсорбцию примесей на активированном угле БАУ в паровой фазе и двухстадийную ректификацию [1]. Восстановление AsCl3 осуществляется водородом. Процесс протекает с высоким выходом целевого продукта (до 99.9%) при 850–900°С в избытке водорода. Конденсат мышьяка затем дополнительно сублимируют в вакууме. В результате получают продукт с содержанием основного вещества 99.9999 мас. % (6N).
ПОЛУЧЕНИЕ ВЫСОКОЧИСТЫХ МЫШЬЯКСОДЕРЖАЩИХ СОЕДИНЕНИЙ
Триоксид мышьяка. В патентной литературе имеется информация о способах выделения технического As2O3 из различного сырья [14–23]. Так, в [14, 15] приведены способы переработки материалов, содержащих сульфиды мышьяка(III) и (V). Следует отметить промышленные способы получения достаточно чистого триоксида мышьяка из отходов переработки руд цветных металлов. Так, предложено [18] осуществлять процесс, включающий обжиг шихты в присутствии углерода в атмосфере кислорода воздуха при 700°С с последующей конденсацией продукта с содержанием основного вещества не ниже 99.7%.
В [23] представлены патентные исследования по способам и аппаратуре для получения высокочистого оксида мышьяка (As2O3), выделенного из отходов промышленного производства. Приведенные результаты полезны для разработки технологических схем получения высокочистого элементного мышьяка.
Способ получения As2O3 особой чистоты из технического продукта, извлекаемого из различного сырья, сублимацией в вакууме предложен в [19], причем процесс проводят в реакторе с тремя зонами с температурным градиентом в каждой. В [20] рекомендуется непрерывный процесс, отличающийся от предыдущего тем, что загрузку осуществляют в непрерывном режиме и обжиг проводят при давлении 150–500 мм рт. ст. и температуре 400–850°С. Степень извлечения триоксида мышьяка достигает 96.3%, чистота – 99.0%.
Производство As2O3 из арсенида галлия предложено в [23] с целью утилизации отходов полупроводникового производства GaAs. Анализ научно-технической информации [1, 13] показывает, что рациональной схемой получения высокочистого триоксида мышьяка 6N является гидролиз AsCl3 “ос. ч.”. Аналогичные результаты по высокому качеству As2O3 были получены в [21] путем разложения высокочистых триалкиларсенитов.
Изложенный выше анализ патентной и научно-технической информации дает возможность заключить: сублимация триоксида мышьяка в вакууме дает возможность получить товарный продукт чистотой 99.995 мас. %; наиболее перспективным способом является синтез As2O3 квалификации 99.9999 мас. % из промежуточных соединений (AsCl3 и As(OR)3 “ос. ч.”).
Трихлорид мышьяка особой чистоты находит широкое применение в производстве различных полупроводниковых материалов AIIIBV. Поэтому информация о способах получения и глубокой очистки AsCl3 имеет важное практическое значение [1]. Самым распространенным способом синтеза AsCl3 является жидкофазное гидрохлорирование As2O3 концентрированной HCl.
Различные модификации этого способа представлены в патентной литературе. Так, в [22] предлагается при растворении As2O3 в HCl добавлять концентрированную H2SO4 для связывания образующейся воды. Выход целевого продукта увеличивается с 73 до 95%.
В последнее время все большее распространение приобретают способы синтеза AsCl3 непосредственно из элементов. В [24] предложено синтезировать трихлорид мышьяка из элементов в жидком AsCl3 при температуре 18–30°С. Легко видеть, что имеется ряд существенных трудностей при реализации этого процесса. Присутствие влаги в исходном мышьяке служит причиной образования на его поверхности оксидной пленки, которая затрудняет диффузию хлора, тем самым значительно увеличивая продолжительность процесса. Следовательно, возникает необходимость удаления поглощенной влаги из образца перед операцией хлорирования.
Мышьяк целесообразно хлорировать газообразным хлором [25], трихлорид мышьяка обладает целым рядом преимуществ по сравнению с жидкофазным хлорированием порошкообразного мышьяка в среде трихлорида мышьяка или HCl.
Рассмотрим кратко способы глубокой очистки AsCl3 – ключевого промежуточного вещества при получении высокочистого мышьяка и его соединений.
Ректификация AsCl3. Физико-химические основы ректификационной очистки трихлорида мышьяка детально проанализированы в [25].
Дистилляционной очистке трихлорида мышьяка от лимитируемых примесей SiCl4, GeCl4 посвящены патенты [26, 27].
Адсорбционные методы очистки обладают высокой селективностью. Они нашли широкое применение в технологии получения AsCl3 особой чистоты. Наибольший интерес представляет парофазный вариант адсорбционной очистки, при котором снижается поглощение основного вещества, уменьшается вероятность загрязнения очищаемой основы (AsCl3) примесями, содержащимися в адсорбенте [25]. Наиболее селективным адсорбентом для трихлорида мышьяка является активированный уголь БАУ–А (ГОСТ 6217-74), вариант процесса – парофазный. В этом случае имеет место избирательное, по сравнению с ректификацией, извлечение примесей соединений элементов VI группы, металлов, хлорорганических веществ. Суммарное содержание указанных примесей после адсорбционной очистки не превышает 10–5–10–6 мас. %.
Экстракция. Обоснованным считается применение экстракционной очистки AsCl3 с помощью концентрированной HCl, особенно в тех случаях, когда содержание примесных элементов в исходном сырье велико 10–1–10–3%. Эффективной очистки экстракционным методом удается достичь благодаря высокому значению коэффициента распределения большинства примесей в системе AsCl3–HCl (соотношение 1 : 1, температура 20°С) и ограниченной растворимости HCl в AsCl3 [25]. Этот способ особенно эффективен для удаления примесей металлов, хлорорганических веществ и кремния на предварительных стадиях глубокой очистки AsCl3, предшествующих ректификации и адсорбции.
В работах [26–28] исследованы равновесия жидкость–пар, твердое тело–пар, жидкость–жидкость, кристалл–расплав в системах основное вещество–примесь. Полученные данные явились физико-химической основой для разработки процессов глубокой очистки летучих веществ: галогенидов, гидридов, металлорганичеких соединений, простых веществ.
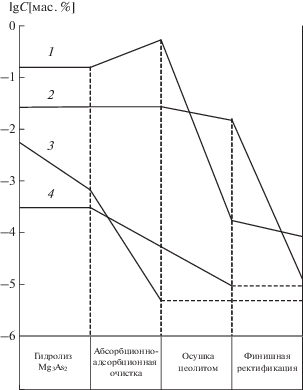
На рис. 2 представлена номограмма поведения примесей при очистке AsCl3. На стадии предварительной ректификации снижается концентрация примесей труднолетучих хлоридов металлов, а также хлорорганических веществ, легколетучих форм серы (SO2, SO2Cl2), кремния (SiCl4), в меньшей мере труднолетучих соединений кремния (Si2OCl6, Si2Cl6), селена (SeOCl2). Очистка AsCl3 ректификацией от хлористой серы (S2Cl2), мышьякорганических соединений малоэффективна. Удаление этих примесей достигается использованием адсорбционных методов и (ХТО) химико-термической обработки.
Рис. 2.
Номограмма поведения примесей при глубокой очистке трихлорида мышьяка (штриховая линия – предел обнаружения). 1 – органические вещества; 2 – вода; 3 – кремний; 4 – сера; 5 – труднолетучие хлориды; 6 – селен; 7 – теллур.
ХТО AsCl3 рассматривается как один из способов глубокой очистки с целью удаления хлорорганических и мышьякорганических примесей [28].
Таким образом, рассмотренные способы глубокой очистки трихлорида мышьяка (ректификация, адсорбция, экстракция и ХТО) являются высокоэффективными для удаления лишь определенных классов примесей. Однако каждый из них не является универсальным и для получения AsCl3 особой чистоты (квалификация 6N) необходима комбинация нескольких методов очистки в рамках единой комплексной технологической схемы.
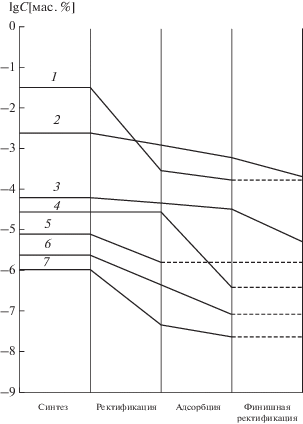
Технологические схемы получения высокочистого трихлорида мышьяка. В основу разработки комплексных схем (рис. 3) глубокой очистки AsCl3 из различного сырья [25] положен принцип постадийного удаления примесей с учетом генетических особенностей перерабатываемого сырья. Основной особенностью является лабильность химических форм халькогенидов, кремния, кислорода и органических веществ. Обобщены также альтернативные схемы получения высокочистого AsCl3 из продуктов детоксикации люизита. Анализ результатов различных вариантов синтеза AsCl3 показал, что наиболее рациональным является метод прямого хлорирования компактного продукта, полученного сублимацией технического мышьяка при пониженной температуре (150°С). Содержание примесей в синтезированном AsCl3 находится на уровне n × 10–4 мас. %. Достоинством этого способа синтеза является также обеспечение стабильности образующихся химических форм примесей в последующих процессах глубокой очистки мышьяка.
Рис. 3.
Технологическая блок-схема получения высокочистого трихлорида мышьяка и металлического мышьяка.
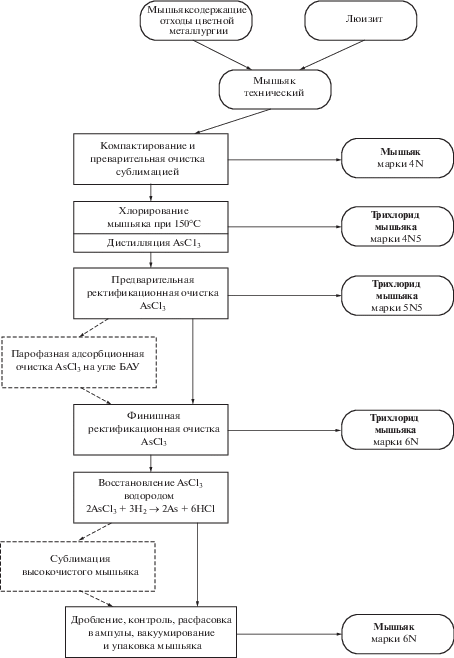
Таким образом, наиболее простой является схема переработки AsCl3, синтезированного хлорированием при пониженной температуре сублимата мышьяка. По существу, здесь используется лишь один высокоэффективный метод очистки – ректификация. Трихлорид мышьяка после финишной очистки характеризуется низким содержанием микропримесей (мас. %): Mn, Mg, Pb, Cu, Fe, Ni, Al, Cr, Zn < 2 × 10–6; Sb, Sn (сумма) < 5 × 10–6; Si ≤ 5 × 10–6; S < 5 × 10–6; Se < 1 × 10–6; Te < 1 × 10–8; органические вещества <5 × 10–5; вода <1 × 10–4. Восстановление очищенного AsCl3 “ос. ч.” водородом обеспечивает получение мышьяка квалификации 6N [28–32]. Весь процесс получения высокочистого вещества включает четыре основных стадии:
– направленный синтез;
– стабилизацию химических форм примесей;
– высокоэффективные, многоступенчатые процессы разделения;
– финишную очистку [32].
Арсин. Гидрид мышьяка AsH3 используется для получения высокочистого элементного мышьяка. Применяемая в настоящее время хлоридная технология глубокой очистки [29] обладает существенными недостатками, в числе которых сравнительно низкий выход готовой продукции и значительные потери с солянокислыми стоками.
Освоенный в промышленности способ синтеза арсина заключается во взаимодействии с растворами кислот продуктов спекания соответствующего элемента с магнием или цинком [33]. Усовершенствованием этого метода является проведение гидролиза в газовой фазе [34]. В связи с доступностью бор- или алюмогидридов щелочных металлов имеется тенденция к синтезу гидрида мышьяка химическим восстановлением его соединений [33]. Фундаментальные научные основы получения гидридов традиционными методами, их глубокой очистки и анализа представлены в [35]. В [36] приведены сведения о получении арсина гидролизом арсенида цинка. В [37] представлен способ синтеза арсина, согласно которому реакционный раствор, содержащий арсенаты щелочных металлов и неорганические кислоты в определенном соотношении, пропускают через слой цинка (магния). В [38] осуществляют двухстадийный синтез арсина: на первой стадии взаимодействием As2O3 с раствором щелочи получают NaAsO2, далее раствор подкисляют H2SO4 и вводят порошок цинка:
Содержание арсина в газовой фазе достигает 50%.
Химические методы синтеза не селективны – одновременно с целевым продуктом выделяются гидриды присутствующих в реакционной среде примесных элементов (Si, Ge, N, P, As, Sb, S, Se, Te), а также такие примеси, как углеводороды и CO2, что требует сложной многоступенчатой очистки [39]. В значительных количествах образуется побочный продукт – водород. Химический способ синтеза арсина из элементов в токе смеси аргона с водородом при пониженном давлении [40] не отличается производительностью и заметным выходом целевого продукта.
Начиная с середины XX века внимание исследователей привлекает электрохимический синтез гидридов [41, 42].
Электрохимические методы синтеза арсина. Сведения по электрохимии мышьяка систематизированы в [43, 44]. В [45] особое внимание уделено решению практических задач, в том числе синтеза арсина. Электрохимическое восстановление мышьяка в разных степенях окисления можно представить схемой
(1)
${\text{A}}{{{\text{s}}}^{{5 + }}} \to {\text{A}}{{{\text{s}}}^{{3 + }}} \to {\text{A}}{{{\text{s}}}^{0}} \to {\text{As}}{{{\text{H}}}_{3}}.$Восстановление элементного мышьяка. Согласно схеме (1) , восстановление элементного мышьяка является наиболее энергетически выгодным. При катодной поляризации мышьякового электрода одновременно происходят два электрохимических процесса: выделение водорода и восстановление мышьяка до арсина [46]. Рассматриваются два варианта образования арсина [45]. На поверхности мышьякового катода генерируются ионы арсенида, взаимодействующие с протонами (в кислых растворах) с образованием водорода или арсина:
Возможен другой механизм, согласно которому предварительно на поверхности мышьяка восстанавливаются молекулы воды. Образование арсина, по мнению авторов [46], происходит путем диспропорционирования поверхностных гидридов AsH и AsH2, которое является лимитирующей стадией. Возможно и их прямое восстановление [47]
(3)
${\text{As}}{{{\text{Н}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{О}} + {{\bar {e}}} = {\text{As}}{{{\text{H}}}_{3}} + {\text{ОН}}{\text{.}}$Такая схема скорее всего реализуется в щелочной среде, в которой выход по току арсина в области 0.01–0.1 А/см2 не зависит от плотности тока и, следовательно, стадия, лимитирующая скорость процесса в целом, не является электрохимической [45]. Избыток ионов OH– облегчает диспропорционирование поверхностных гидридов [48].
Видимо, при нанесении на электрод покрытия мышьяк образует слои не α-, а иной модификации [47, 49]. С увеличением чистоты мышьяка до 99.999% и выше выход по току арсина возрастает.
Согласно [48, 50], арсин с выходом 95–98% можно получить при использовании катода из высокочистого мышьяка в нейтральной и щелочной средах. Установлено, что выход арсина в растворе 1 М Na2SO4 увеличивается с ростом плотности тока от 0.01 до 0.9 А/см2 [50, 51], тогда как в 1 М NaOH такая зависимость не обнаружена [48]. Осуществлен синтез высокочистого арсина на установке производительностью 20–25 г/ч с катодом из чистого α-As при (20–30)°С и 0.1 А/см2 в 1 М Na2SO4 [50].
Существенным недостатком синтеза арсина восстановлением мышьяка является образование мелкодисперсного осадка (0.46 г/А ч при электролизе в 1 М К2НРО4 [51]), который содержит как твердые гидриды (AsН2)n, так и частицы элементного мышьяка, выделяющиеся вследствие диспергирования катода. Отмечается [50, 51], что этот процесс протекает тем интенсивнее, чем выше рН. Тем не менее, предложено на основе процесса восстановления α-мышьяка в щелочной среде создать генератор арсина [48].
В [52–54] представлена конструкция такого генератора. Предложено использовать его для замены баллонов со сжиженным газом в технологии MOCVD (Metal Organic Chemical Vapor Deposition) [55]. С этой целью устройство выполнено в виде емкости с единственным выходом газа. Электролитом является концентрированный раствор щелочи. Насыпной катод, представляющий собой гранулы мышьяка в полимерной сетке, снабжен токоподводом из свинца. Для подавления выделения кислорода применяется растворимый или легко окисляемый (“жертвенный”) анод из As, Mo, W, Cd, Pb или redox-пар MnO2/MnO3, Fe(OH)2/Fe3O4 и т.д. Для предотвращения отложения на катоде малоэлектропроводных продуктов их восстановления рекомендуется [53] применять катионообменную мембрану типа Nafion. Выход арсина по току составляет 45% [52], 90% [54] и до 97% при плотности тока 0,02 А/см2 [53]. Отмечается [54], что к концу срока службы генератора по мере расхода As-катода выход AsH3 снижается до 60%. Для осушки газа используются синтетические цеолиты.
Дальнейшее развитие данная концепция получила в [56], где подробно изучено влияние концентрации щелочи с целью повышения удельной производительности генератора и предотвращения кристаллизации продукта анодного окисления (K2MoO4). Рекомендовано использование ячейки без диафрагмы, 35–39%-ного KOH и монолитного катода из As чистотой не менее 99%, что способствует повышению выхода арсина.
Представлены примеры получения арсина при плотности тока от 0.05 до 0.43 А/см2 с производительностью от 2.5 до 16.0 мг/мин. Вычисленный по данным [56] выход по току арсина составляет около 90%. Полезное использование катода достигает 77.8%, остальная его часть вместе с токоподводом остается незадействованной.
Для достижения высоких выходов арсина рекомендовано проводить восстановление мышьяка из мышьяковых соединений в кислой среде на катодах из Pb, Zn, Cd, Ni, Fe или графита [57]. На основании экспериментальных данных [58] можно заключить, что наиболее подходящим материалом катода является кадмий, однако в [59] показано, что наиболее стабильный отрицательный потенциал, благоприятствующий образованию AsH3, наблюдается на свинцовом катоде. Выход арсина по току возрастает с повышением плотности тока и почти не меняется с повышением температуры.
Динамика изменения выхода AsH3 по току в ходе электролиза кислых растворов As2O3 на свинце изучена в [60]. Процесс электролиза подкисленных растворов As2O3 может быть положен в основу построения генератора арсина. Так, в [61] предложена конструкция электролизера для получения летучих гидридов, в том числе арсина. Особенностью электролизера является использование свинцовых катодов с капиллярными отверстиями, через которые продавливается свежий католит, и наличие в верхней части охлаждаемой камеры для удаления из газовой фазы летучих примесей.
Как утверждается в [62], основным условием работы генератора с высоким выходом арсина на свинцовом катоде является поддержание постоянства мольного соотношения H+ : As3+ = 1. Учитывая малую растворимость мышьяковистой кислоты и ее очень слабую диссоциацию (Kd = 7.9 × 10–9), такое соотношение может быть получено в 1%-ной H2SO4 (хотя в [62] рекомендуется ~10% H2SO4). Предлагается в процессе электролиза непрерывно насыщать раствор As3+, прокачивая его через слой оксида мышьяка (III). Выход арсина по току не указан, только его содержание в катодном газе (до 95%) [62]. Этого показателя недостаточно для характеристики процесса, т.к. часть тока может затрачиваться на образование мышьяка.
Поддержание рекомендуемого соотношения H+ : As3+ = 1 не позволяет достигнуть высокого выхода [63]. Данные, полученные с использованием 1%- и 10%-ного растворов H2SO4, вполне сопоставимы. При этом 10%-ный раствор обладает значительно лучшей электропроводностью.
В [58] изучена работа генератора арсина, основанного на восстановлении сернокислого раствора As2O3 [63]. Предложено добавлять в раствор фосфорной или серной кислоты арсенит натрия [64]. Однако в таком варианте в католите неизбежно накопление солей, ведущее к необходимости замены раствора.
Как показано в [65], электролиз щелочных растворов арсенита натрия позволяет получать наряду с основным продуктом (мышьяком) также арсин. Варьируя условия электролиза, можно синтезировать преимущественно тот или иной продукт. При этом источником арсенита для производства арсина могут служить продукты детоксикации люизита [66].
Восстановление пятивалентного мышьяка. Степень окисления 5+ мышьяк имеет в мышьяковой кислоте и ее солях, которые в водных растворах присутствуют в различных формах. Полярографическое поведение арсенатов изучалось довольно широко, однако множество попыток дало отрицательный результат, волны восстановления As5+ зафиксированы всего в двух случаях: на полярограмме в 11.5 М HCl [67, 68] и при восстановлении дигидроарсенатов [69]. Показано, что As5+ не проявляет активности в фосфатном растворе в широком интервале рН (0.9–14) [70], на фоне целого ряда солей, в присутствии поливалентных катионов, в растворах кислот [71, 72].
Методом поляризационных кривых показано [73, 74], что в сернокислых растворах скорость восстановления As5+ зависит от природы материала катода, плотности тока и состава раствора. Лучшие результаты получены на катодах из меди и свинца. Продуктами восстановления соединений мышьяка в степени окисления 5+, как полагают авторы, являются AsH3 и As, на что влияет комплексообразование. Так, на полярограмме Na2HAsO4 в 1–3 М HClO4 в присутствии 0.5 М пирогаллола наблюдаются [75 ] три волны, соответствующие восстановлению по схеме (1) . В [76] сообщается об осаждении мышьяка на катоде при электролизе кислых водно- и неводно-глицериновых растворов, содержащих As5+ и лимонную кислоту. На наш взгляд, в обоих случаях происходит восстановление молекулярной формы H3AsO4.
Гидридная схема характеризуется электрохимическим синтезом арсина, его глубокой очисткой ректификацией и термическим разложением [75 ] . При этом AsH3 “ос. ч.” является ключевым продуктом в технологии As и в процессах выращивания структур MOCVD-методом. Сравнение этих схем свидетельствует о том, что наиболее перспективным является гидридный метод, однако для его промышленного применения необходимо решить ряд аппаратурных и экологических проблем.
Для электрохимического синтеза арсина исходный арсенит натрия гидролизный (АНГ) (продукт детоксикации люизита) предварительно растворяли в Н2О и насыщали соляной кислотой, затем отгоняли воду с хлороводородом совместно с As2O3. В процессе электролиза в реакторе имеет место накопление H3AsO4, а хлор и натрий удаляются из раствора. С целью выяснения возможности использования метода восстановления мышьяковой кислоты в промышленном варианте был создан прототип электрохимического генератора. Конструкция генератора, предусматривающая дозирование жидкого реагента, представляется наиболее удобной. Основой генератора является фильтр-прессный электролизер. Циркуляция католита и анолита осуществляется по принципу газлифта за счет выделяющихся газов. Для восполнения убыли H3AsO4 в католит подается концентрированная кислота. Степень извлечения мышьяка из АНГ в форме H3AsO4 составляет до 90%. Синтезировали образцы технического арсина с выходом по мышьяку до 90%, по току – 12% [77]. По результатам физико-химических исследований системы H3AsO4–H2O, эти показатели можно повысить. Для более корректного проведения процесса электрохимического синтеза арсина были изучены плотность растворов мышьяковой кислоты и давление насыщенных паров, которые приводятся в работе [77].
Экспериментальные данные можно использовать при переработке АНГ, полученного после детоксикации люизита, для синтеза арсина электрохимическим способом.
Хотя выделение арсина при электролизе сернокислых растворов, содержащих следовые количества H3AsO4, отмечалось еще в [78], до начала современных исследований было известно только одно сообщение [79] по восстановлению As5+ для препаративного использования.
Показано [80], что в щелочной и нейтральной средах As5+ не восстанавливается, в сильнокислых растворах (рН < 2) эффективное восстановление до арсина наблюдается на целом ряде металлов. Метод синтеза арсина электролизом H3AsO4 запатентован [81]. Разработаны физико-химические основы технологии комплексной переработки мышьяксодержащих отходов промышленности цветных металлов [82]. Особенностью процесса является то, что раствор после сернокислотного выщелачивания отхода подают в анодную камеру электролизера, где As3+ окисляется, а затем в катодную камеру, где образовавшийся As5+ восстанавливается до арсина. Проведены испытания на пилотной установке, оснащенной электролизером с нагрузкой 120 А.
С целью выяснения возможности использования метода восстановления мышьяковой кислоты в промышленном варианте был создан прототип электрохимического генератора и проведены серии экспериментов по определению стабильности его работы.
Примеси Ge и Sb восстанавливаются до гидридов и загрязняют арсин, ряд металлов в процессе электросинтеза концентрируется в католите [83].
В результате однократной очистки методом низкотемпературной ректификации получен высокочистый арсин, характеризующийся относительно низким уровнем легирования (7 × 1014 см–3) синтезированных из него слоев GaAs по сравнению с неочищенным – 2 × 1017 см–3.
По итогам испытаний прототипа генератора арсина был сконструирован и изготовлен укрупненный (опытно-промышленный) вариант электрохимического генератора производительностью до 1000 кг арсина в год с электролизером, рассчитанным на нагрузку до 1.2 кА [84]. Уровень легирования синтезированных из него слоев GaAs составил 2.4 × 1014 см–3 [85].
Способ синтеза арсина восстановлением мышьяковой кислоты имеет преимущество, обусловленное использованием двухкомпонентной системы H3AsO4–H2O, что позволяет проводить длительный процесс электролиза в непрерывном режиме с подачей жидкого реагента.
Эффективным методом очистки арсина от примесей является низкотемпературная ректификация или фракционная дистилляция [86].
Вторую группу примесей в арсине составляют гидриды серы, селена, теллура в количестве 1 × × 10–2%. Эти примеси лабильны, подвергаются хемосорбции на металле и фторопласте. Для их улавливания эффективен абсорбционно-адсорбционный метод [87].
Высокоэффективная совмещенная абсорбционно-адсорбционная очистка заключается в обработке арсина в противоточном аппарате суспензией мелкодисперсного угля БАУ в особо чистой воде. Физико-химические основы этого процесса (статика, кинетика, гидродинамика) подробно описаны в [87].
Построение рациональной схемы синтеза [88–96] и глубокой очистки [97–109] арсина предусматривает постадийное удаление из него различных типов примесей, что обеспечивает проведение каждой операции в оптимальных условиях.
Таким образом, технологическая схема глубокой очистки арсина включает в себя абсорбционно-адсорбционный процесс, осушку с использованием цеолитов, низкотемпературную ректификацию и финишную ректификацию для удаления основных примесей углеводородов и фосфина. Суперфинишной стадией очистки арсина от взвешенных (гетерогенных) частиц следует считать фильтрацию с использованием ультратонких перхлорвиниловых волокон при температуре – 60°С и остаточном давлении 200–400 мм рт. ст. [86]. В этой связи чрезвычайно важным являются разработки по созданию микрогенератора арсина, в основе функционирования которого лежат два способа синтеза арсина – химический и электрохимический [88–96].
Так, в основу микрогенератора, предложенного в [108], положен непрерывный синтез арсина из малотоксичных исходных веществ и его очистка непосредственно в месте потребления.
Согласно [88], арсин “ос. ч.” рекомендуется получать электрохимическим восстановлением водных концентрированных растворов мышьяковой кислоты [97, 98] (1.0–3.5 моль/л) при высокой плотности тока (1.0–2.5 кА/м2). В качестве катода можно использовать медь, кадмий, свинец, нержавеющую сталь, никель, титан, олово. Наибольшую активность проявляют кадмий и медь.
Преимуществом этого способа перед известными является то, что электролизу подвергается только двухкомпонентная система H3AsO4–H2O, что обеспечивает максимальную чистоту арсина, который может включать только примеси, содержащиеся в исходном сырье – H3AsO4.
В [109] предложено получать арсин и мышьяк из продукта детоксикации люизита. Получение мышьяковой кислоты из раствора АНГ было проведено на укрупненном электролизере [110].
Алкоксиды мышьяка находят применение в различных областях науки и техники. По данным [13, 111], рациональная технологическая схема включает в себя следующие основные стадии: синтез As(OR)3, где R – радикалы предельных углеводородов; дистилляционную очистку синтезированных продуктов; термическое разложение As(OR)3. Для выбора и обоснования указанной схемы выполнен комплекс исследований в области синтеза алкоксидов, кинетики гетерогенной реакции As2O3 со спиртами С2–С5 в изотермических условиях, изучены температурные зависимости плотности, вязкости и давления насыщенных паров As(OR)3, механизм их терморазложения в инертной и водородной средах [112].
Алкоксиды мышьяка такого качества являются перспективными веществами для получения высокочистого элементного мышьяка и его соединений из продуктов утилизации люизита и других источников сырья.
ЗАКЛЮЧЕНИЕ
Проведен поиск, отбор и анализ патентной информации по способам и устройствам для получения мышьяка и его соединений в ведущих странах: Россия (СССР), США, Япония, Германия, Швеция – за последние 15–20 лет.
Рассмотрены актуальные проблемы выделения элементного мышьяка из различного сырья (сульфидных (As2S3, As4S4 и FeAsS)) и полиметаллических руд. Анализ патентной информации свидетельствует о том, что термический обжиг является основным методом извлечения мышьяка технической квалификации из природных руд. Обсуждены предложенные оригинальные способы, имеющие важное практическое значение в технологии мышьяка реактивной квалификации.
Проведена оценка перспектив развития разработок и производства мышьяка и его соединений: трихлорида мышьяка, триоксида мышьяка и арсина. Установлено, что наиболее распространенные способы получения мышьяка особой чистоты основаны на предварительной очистке указанных мышьяксодержащих веществ с последующим их превращением в элементный мышьяк.
Обсуждены некоторые оригинальные технические решения конструкций отдельных узлов и установок в целом, которые представляют определенный интерес для создания или усовершенствования процессов переработки мышьяксодержащих веществ в товарные продукты, перспективные в полупроводниковом материаловедении.
Список литературы
Федоров В.А., Чурбанов М.Ф. Получение высокочистого мышьяка // Высокочистые вещества / Под ред. Чурбанова М.Ф. и др. М.: Научный мир, 2018. С. 566–592.
Федоров В.А., Менщикова Т.К., Варгунин А.И., Бреховских М.Н., Мыслицкий О.Е. Процессы и аппараты для выделения и очистки элементного мышьяка и его соединений // Хим. технология. 2021. № 1. С. 44–48.
Жуков Э.Г., Николашин С.В., Бабицына А.А., Полуляк Е.С., Федоров В.А. Очистка технического мышьяка сублимацией в вакууме // Высокочистые вещества. 1995. № 5. С. 49–75.
Жуков Э.Г., Николашин С.В., Потолоков В.Н., Сметанин А.В., Федоров В.А. Сублимационная очистка технического мышьяка, полученного из отходов цветной металлургии // Неорган. материалы. 2001. Т. 37. № 10. С. 1190–1197.
Вевиорский А.П., Иванов В.Н., Кроль А.Л., Мосалев О.В. Способ рафинирования мышьяка: Патент SU 1632996. 1991.
Masato K., Satoshi N. Method for Refining Arsenic by Sublimation: Patent JP 5331569. 1993.
Lingqi Cao. Smelting Method of Special Metallic Arsenic: Patent CN 1096058. 1994.
Зорин А.Д., Каратаев Е.Н., Степанова Л.В., Сидоров Ю.В., Сиднев В.И., Косяк А.М., Капашин В.П., Холстов В.И., Анастасов А.Д. Способ компактирования и очистки аморфного мышьяка: Патент SU 2170279. 2001.
Федоров В.А., Ефремов А.А., Гринберг Е.Е., Жуков Э.Г., Баранов Ю.И., Кузнецов Б.А., Потепалов В.П., Холстов В.И. Проблемы получения мышьяка и его соединений особой чистоты на основе люизита // Журн. Рос. хим. о-ва им. Д.И. Менделеева. 1994. Т. 38. № 2. С. 25–33.
Пашков В.М. Глубокая очистка мышьяка методом направленной кристаллизации // Высокочистые вещества. 1988. № 1. С. 123–126.
Федоров В.А., Гасанова А.А., Потолоков Н.А., Менщикова Т.К., Бреховских М.Н. Глубокая очистка мышьяка методом кристаллизации // Неорган.материалы. 2018. Т. 54. № 10. С. 1085–1091.
Федоров В.А., Потолоков Н.А., Менщикова Т.К., Бреховских М.Н. Гидридный метод получения высокочистого мышьяка // Неорган. материалы. 2018. Т. 54. № 10. С. 1092–1098.
Radu I.O., Dumbac A., Dragan E.V. Inteprinderes de Gercetare si Productateriale Semiconductoare // Patent RO № 96547. 1989.
Бессарабов А.М., Николашин С.В., Жуков Э.Г., Ефремов В.А., Федоров В.А. Моделирование процесса дегазации технического мышьяка – продукта детоксикации люизита // Теор. осн. хим. технол. 2004. Т. 38. № 1. С. 71–75.
Нисельсон Л.А., Ярошевский А.Г., Гасанов А.А. и др. Глубокая очистка мышьяка // Высокочистые вещества. 1993. № 4. С. 62–74.
Wu Guoyuan. An As-Removing Process for High-As Materials: Patent CN 1155587.
Масаси Н., Наобуки К., Хироюки Т. Получение As2O3 из материалов, содержащих As2S5: Patent JP 57-160914. 1982.
Koujirou K., Reizou N., Akifumi I. Production of Arsenic Acid from Crude Arsenic Sulfideprecipitate: Patent JP 55075923. 1980.
Хисаси Д., Хидэо С., Сэйдзо А. Получение триоксида мышьяка из природного сульфида: Patent JP 58-24378. 1983.
Исабаев С.М., Полукаров А.Н., Кузгибекова Х. Способ извлечения мышьяка из медно-мышьяковистого шлама: Патент SU 937333. 1982.
Федоров В.А., Ефремов В.А., Казанский Л.Н. Ефремов А.А., Менщикова Т.К. Равновесие жидкость–пар в бинарных системах на основе трихлорида мышьяка с ацетил и хлорацетил хлоридом // Высокочистые вещества. 1994. № 2. С. 47–57.
Юити Ова, Масаси Накано, Набэсама Такэхару Набэсама. Получение треххлористого мышьяка из оксида мышьяка: Patent JP 62-100413. 1988.
Федоров В.А., Менщикова Т К., Варгунин А.И., Бреховских М.Н. Мыслицкий О.Е. Технологические основы извлечения мышьяка из различного сырья // Хим. технология. 2021. № 6. С. 283–288.
Ясуо Курода, Конти Ямагава. Получение трихлорида мышьяка: Patent JP 61-146716. 1986.
Федоров В.А., Ефремов А.А., Ефремов Е.А., Филиппов Э.П. Получение треххлористого мышьяка особой чистоты. Вып. 4. М.: Электроника, 1976. 60 с.
Юити Ова, Тадаси Накано, Такэдзи Набэсима. // Очистка трихлорида мышьяка: Patent JP 62-235216. 1987.
Юити Ова, Тадаси Накано, Такэдзи Набэсима. Очистка трихлорида мышьяка // Patent JP 62-235217. 1987.
Федоров В.А., Потолоков Н.А., Менщикова Т.К., Бреховских М.Н. Физико-химические особенности получения высокочистых мышьяксодержащих веществ из вторичного сырья // Неорган. материалы. 2017. Т. 53. № 10. С. 1048–1056.
Федоров В.А., Филиппов Э.П., Лебедева Р.Н., Кузнецова Н.П., Пашинкин А.С., Соколов Е.Б., Трушина Т.Н. О поведении примесей органических веществ в процессе термической обработки треххлористого мышьяка // Журн. прикл. химии. 1974. Т. 47. № 8. С. 1750–1760.
Федоров В.А., Потолоков Н.А., Николашин С.В., Борисов С.А., Менщикова Т.К., Шай Е.П., Хохлов Р.В., Шевченко А.В., Холстов В.И. Физико-химия и технология получения мышьяка и его соединений из продуктов детоксикации люизита // Рос. хим. журн. 2010. Т. 54. № 4. С. 56–66.
Борисов С.А., Менщикова Т.К., Потолоков Н.А., Федоров В.А., Бреховских М.Н. Физко-химические особенности получения высокочистых веществ для микроэлектроники и оптики // Неорган.материалы. 2014. Т. 50. № 11. С. 1243–1248.
Федоров В.А., Потолоков Н.А., Менщикова Т.К., Бреховских М.Н. Физико-химический и методологический подходы к разработке комплексных схем получения высокочистых веществ // Неорган. материалы. 2019. Т. 55. № 12. С. 1342–1350.
Fedorov V.A. Manufacture of High-Purity Arsenic from an Unconventional Source // Russ. J. Inorg. Chem. 2001. V. 46. Suppl. 2. P. 87–105.
Petkov L., Stoytcheva M. Anodic Reactions with As(III) Paqrticipation // Bull. Electrochem. 2005. V. 21. № 2. P. 93–96.
Девятых Г.Г., Зорин А.Д. Летучие неорганические гидриды особой чистоты. М.: Наука, 1974. 205 с.
Schon H., Heinicke J., Tzschach A. Verfahren zur Herstellang hochreinen Arsin: Patent DDR 225684. 1985.
Tesaric P., Skuta D., Nozka K. Получение чистого арсина: Patent CZ. 190113. 1981.
Piffard J.-F., Rade J.-Y. Process for the Synthesis of Arsine by Reduction of Arsenious Anhydride // Patent FR. № 2609978. 1988.
Ефремов А.А., Морозов В.И., Рябенко Е.А. Поведение примесей при синтезе моно-германа // Высокочистые вещества. 1993. № 5. С. 71–81.
Marinasce J.C. Plasma Formation of Hydride Compounds: Patent US. 4945857. 1989.
Denkhhaus E., Beck F., Buescchier P., Gerhard R., Gololoch A. Electrolytie Hydride Generation Atomic Absorption Spectrometry for the Determination of Antimony, Arsenic, Selenic and tin – Mechanistic Aspects and Figures of Merit // J. Anal. Chem. 2001. V. 370. P. 735–743.
Bolea E., Laborda F., Castillo J.R., Sturgeon R.E. Electrochemical Hydride Generation for the Simultaneous Determination of Hydride Forming Elements by Inductively Coupled Plasmas-Atomic Emission // Spectrochim. Acta. Part B. 2004. V. 59. P. 505–513.
Tomilov A.P., Chomutov N.E. Encyclopedia of Electrochemistry of the Elrments II. Arcenic / Ed. Bard A. N.-Y.: Marcel Dekker, 1974. P. 21–51.
Томилов А.П., Осадченко И.М., Хомутов Н.Е. Электрохимия мышьяка и его соединений // Итоги науки и техники. Электрохимия. М.: ВИНИТИ, 1970. Т. 14. С. 168–206.
Томилов А.П., Сметанин А.В., Черных И.Н., Смирнов М.К. Электродные реакции с участием мышьяка и его неорганических соединений // Электрохимия. 2001. Т. 37. № 10. С. 1157–1172.
Ефимов Е.А., Ерусалимчик И.Г. Электрохимические процессы на мышьяковом электроде // Электрохимия. 1965. Т. 1. № 9. С. 1133–1137.
Salzberg H.W., Goldschmidt B. Arsine Evolution and Water Reduction at an Arsenic Cathode // J. Electrochem. Soc. 1960. V. 107. P. 348–353.
Valdes J.L., Cadet G., Mitchell J.W. Ondemand Electrochemical Generation of Arsine // J. Electrochem. Soc. 1991. V. 138. P. 1654–1658.
Grube G., Kleber H. Die überspannung des Wasserstoffes an Arsenkathoden und das electromotorische Verhalten des Arsenwasserstoffes // Z. Elektrochem. 1924. B. 30. № 21/22. S. 517–523.
Воротынцев В.М., Козин Л.Ф., Жылкаманова К., Глушаченко О.А., Абдрахманов Р.Р., Балабанов В.В. Электрохимический синтез особо чистого арсина. II. Исследование реакции катодного гидрирования элементного мышьяка // Высокочистые вещества. 1995. № 5. С. 59–66.
Черных И.Н., Томилов А.П. Электрохимическое восстановление элементного мышьяка // Журн. прикл. химии. 1995. Т. 68. № 7. С. 1208–1209.
Ayers W.M. Method and Apparatus for the Electrolytic Preparation of Group IV and V Hydrides // Patent US 5158656. 1992.
Cadet G., Mitchell J.W., Valdes J.L. Process and Apparatus for Generating Precursor Gases Used in the Manufacture of Semiconductor Devices // Patent US 5474659. 1995.
Ayers W.M. Method and Apparatus for Constant Composition delivery of Hydride Gases for Semiconductor Processing: Patent US. 6080297. 2000.
Buckley D.N., Seabury C.W., Valdes J.L., Cadet G., Mitchell J.W. et al. Growth of InGaAs Structures Using in situ Electrochemically Generated Arsine // Appl. Phys. Lett. 1990. V. 57. P. 1684–1686.
Machado R.M., Hollen J.E., Ryals G.L., Hartz Ch.L., Mohr R.J. Method and Apparatus for Achieving Maximum Yield in the Electrolytic Preparation of Group IV and V Hydrides // Patent EP. 1845172. 2007.
Акбасова А.Д. Электрохимическое восстановление мышьяковистой кислоты // Тр. Минвуза КазССР. 1986. С. 97–99.
Воротынцев В.М., Балабанов В.В., Абдрахманов Р.Р., Малыгина Л.С. Электрохимический синтез особо чистого арсина. I. Выход арсина по току в реакции катодного восстановления As2O3 // Высокочистые вещества. 1993. № 5. С. 22–27.
Смирнов М.К., Сметанин А.В., Турыгин В.В., Худенко А.В., Томилов А.П. Электрохимическое восстановление As(III) в кислых средах // Электрохимия. 2001. Т. 37. № 10. С. 1214–1218.
Нилов А.П. Оптимизация процессов массопереноса и фазообразования для глубокого электрохимического восстановления соединений мышьяка(III), сурьмы(III) и германия(IV): Автореф. дис. … д-ра хим. наук. Егорьевск: ЭЛАТЕРА, 2001. 43 с.
Гладышев В.П., Зебрева А.И., Тулебаев А.Ж., Ковалева С.В., Сариева Л.С. и др. Электролизер для получения летучих гидридов: Патент SU 962335. 1982.
Bouard P., Labrune Ph., Cocolios P. Process and Device for the Electrolytic Generation of Arsine // Patent US 5425857. 1995.
Смирнов М.К., Турыгин В.В., Шалашова Н.Н., Худенко А.В., Томилов А.П. Электрохимическое восстановление As(III) в кислых средах // Неорган. материалы. 2007. Т. 43. № 1. С. 27–32.
Porter V.R. Apparatus for generation and control of dopant and reactive gases // Patent US. 4178224. 1979.
Сметанин А.В., Смирнов М.К., Черных И.Н., Турыгин В.В., Худенко А.В., Федоров В.А., Томилов А.П. Получение мышьяка и его соединений электрохимическим методом // Неорган. материалы. 2003. Т. 39. № 1. С. 27–42.
Федоров В.А., Потолоков Н.А., Менщикова Т.К., Холстов В.И. Научные основы технологии высокочистых веществ и материалов из вторичного сырья // Тр. ХХ Менделеевский съезд по общей и прикладной химии. Екатеринбург. 2016. С. 214.
Толстиков В.П. Взаимозависимость окислительно-восстановительных процессов и pH реакционной среды // Журн. общ. химии. 1969. Т. 39. № 2. С. 240.
Meites L. Polarographic characteristics of +3 and +5 Arsenic in Hydrochloric Acid Solutions // J. Am. Chem. Soc. 1954. V. 76. P. 5927–5931.
Джапаридзе Дж.И., Джохадзе Г.М., Сирадзе Р.В. Полярографическое определение аниона ${{{\text{H}}}_{2}}{\text{AsO}}_{4}^{ - }$ // Сообще. АН ГрузССР. 1975. Т. 79. С. 105–107.
Земцова А.Г., Каплан Б.Я. Полярография с переменным током в растворах фосфатов // Химия в Таджикистане. Душанбе: Дониш, 1974. С. 208–216.
Arnold J.P., Jonson R.M. Polarography of Arsenic // Talanta. 1969. V. 16. P. 1191–1207.
Жданов С.И., Крюкова Т.А., Васильева Е.Г. К вопросу о механизме восстановления мышьяка на капельном ртутном катоде // Электрохимия. 1975. Т. 11. № 5. С. 767–770.
Акбасова А.Д., Дзекунов В.П. Физико.-химические методы разделения, получения и анализа металлов. Алма-Ата: Каз. НИИНТИ, 1988. С. 28.
Акбасова А.Д., Дзекунов В.П., Павлова О.Д. Электрохимическое восстановление мышьяка(V) в присутствии ПАВ на твердых электродах // Тез. докл. 6-ой Всесоюзн. конф. по электрохимии. М.: ВИНИТИ, 1982. Т. 1. С. 172.
White M.C., Bard A.J. Polarography of Metalpyrogallol Complexes // Anal. Chem. 1966. V. 38. P. 61–63.
Попова Т.Г., Хамудханова Ш.З. Электроосаждение мышьяка // Тез. докл. 6-ой Всесоюзн. конф. по электрохимии М.: ВИНИТИ. 1982. Т. 1. С. 288.
Менщикова Т.К., Варгунин А.И., Бреховских М.Н., Федоров В.А., Мыслицкий О.Е. Физико-химические свойства мышьяксодержащих веществ–продуктов детоксикации люизита // Неорган. материалы. 2020. Т. 56. № 11. С. 1237–1242.
Ramberg L. Arseniksyras och arseniksyrlighets elektrolytiska reduktion till arsenikväte vid katoder av olika metaller // Lunds Univ. Årsskr. Avd. 2. 1978. Bd. 14. Nr. 21. 47 p.
Gopalakrishnan V., Gnanasekaran K.S., Narasimham K.C., Udupa N.V.K. Investigation of the Reduction of Arsenates // Trans. SAEST. 1976. V. 11. P. 251–258.
Черных И.Н., Томилов А.П., Сметанин А.В., Худенко А.В. Электрохимическое восстановление мышьяковой кислоты // Электрохимия. 2001. Т. 37. № 9. С. 1097–1101.
Баранов Ю.И., Сметанин А.В., Турыгин В.В., Томилов А.П., Худенко А.В., Черных И.Н. Способ получения арсина из мышьяковой кислоты: Патент RU 2203983. 2003.
Турыгин В.В., Смирнов М.К., Сметанин А.В., Жуков Э.Г., Федоров В.А., Томилов А.П. Получение мышьяка из промышленных отходов цветных металлов электрохимическим методом // Неорган. материалы. 2008. Т. 44. № 9. С. 1065–1073.
Турыгин В.В., Смирнов М.К., Березкин М.Ю., Худенко А.В., Томилов А.П., Котков А.П., Гришнова Н.Д., Полежаев Д.М., Петухов Г.Г., Громов А.В. Получение арсина электрохимическим методом и изучение его примесного состава // Матер. XVI координационного научно-технического семинара по СВЧ технике (8–10 сентября 2009). Н. Новгород. 2009. С. 187–189.
Турыгин В.В. Физико-химические основы технологии электрохимического синтеза гидридов мышьяка, фосфора и германия: Дис. … докт. хим. наук. Москва. 2012. 250 с.
Урядов А.А., Котков А.П., Гришнова Н.Д., Полежаев Д.М., Петухов Г.Г., Турыгин В.В., Березкин М.Ю., Худенко А.В. Исследование примесного состава арсина, синтезированного электрохимическим методом // Тез. докл. XIV конф. “Высокочистые вещества и материалы. Получение, анализ, применение” (30 мая–2 июня) Н. Новгород. 2011. С. 103.
Вевиорский А.П., Иванов В.Н., Фролов А.В. Способ очистки летучих неорганических гидридов: Патент SU 1004259. 1983.
Ефремов А.А., Морозов В.И., Федоров В.А. Абсорбционно-адсорбционный процесс глубокой очистки летучих неорганических гидридов // Высокочистые вещества. 1991. № 1. С. 115–123.
Кварацхели Ю.К., Шаталов В.В., Демин Ю.В., Кондратьев А.Г., Хорозова О.Д. Способ получения арсина и устройство для его осуществления: Патент RU 2369666.
Cao Huazhen, Ahan Haipeng, Ruan Huimin, Zheng Guoqu. A Study on the Evolution of Arsenic Electrodeposition. The Influence of Ammonium Citrate // Electrochem. Commun. 2012. V. 23. P. 44–47.
Uany Dunfen. Method for Preparing Arsenic Hydride by Reacting Sodium Arsenide with Ammonium Bromide: Patent CN 103896212.
Юань Дунфэн. Способ получения арсина гидролизом соли мышьяка: Patent CN 103896211.
Iny Enhua, U Fen,Gun Czynminy. Method for Synthesizing High-Purity Arsine // Patent CN 101857270.
Турыгин В.В., Томилов А.П. Использование электрохимии при создании малоотходных производств // Матер. Всерос. Конф. “Электрохимия и экология”. Новочеркасск: ЮРГУ, 2008. С. 81.
Piffard J.-F., Rade J.-Y. Patent FR 2609978. 1988.
Bouard P., Labrune Ph., Cocolios P. Процесс и устройство для электролитической генерации арсина: Patent US 5425857.
Ferguson M.A. TiO2 – Photocatalyzed As(III) Oxidation in Aqueous Suspevsiong. Reaction Kinetics and Effects of Adsorption // Environ. Sci. Technol. 2005. V. 39. № 6. P. 1880–1886.
Девятых Г.Г., Балабанов В.В., Зверева В.И. Способ очистки летучих неорганических гидридов: Патент RU 614615.
Вевиорсский А.П., Иванов В.Н., Фролов А.В. Способ очистки летучих неорганических гидридов: Патент RU 1004259.
Gas purifier: Patent CN 103816787 A.
Alvarez D. Способ и устройство для очистки потоков гидридных газов: Patent US 6241955В1.
Dingjan Wu, Golden T.C., Chun Christine Dong, Batavio P.J. Очистка гидридных газов: Patent US 20050120877А1.
Watanabe T., Fraenkel D. Материалы и способ очистки гидридных газов: Patent US 20030097929 А1.
Alvarez D. Очистка гидридного газа для полупроводниковой промышленности: Patent US 20060188420 А1.
Славутский В.П, Гурьев В.С., Куклич В.М., Ганка Г.Ф., Ольховская Л.Н. Устройство для очистки газов: Патент SU 1161159.
Катаока Масахиро, Ники Итихво, Хатаюо Мамору. Очистка арсина: Patent JP 60-215601.
Девятых Г.Г, Аглиулов Н.Х., Чурбанов М.Ф., Калмыков В.И., Балабанов В.И., Ливерко В.Н. Способ очистки летучих гидридов: Патент SU 1032708.
Катахара Коити, Симада Гакаси, Акита Нобору, Нихон Паноникусу. Метод очистки арсина: Patent JP 63-238920.
Крылов В.А., Чернова О.Ю., Созин А.Ю., Котков А.П. Хромато-масс-спектрометрический анализ арсина высокой чистоты // Завод. лаб. Диагностика материалов. 2010. Т. 76. № 3. С. 13.
Турыгин В.В., Смирнов М.К., Березкин М.Ю., Сохадзе Л.А., Степнова Н.П., Томилов А.П., Федоров В.А., Потолоков Н.А. Физико-химические основы получения высокочистых соединений мышьяка из продуктов детоксикации люизита // Неорган. материалы. 2017. Т. 53. № 4. С. 392–395.
Баранов Ю.И., Сметанин А.В., Турыгин В.В., Томилов А.П., Худенко А.В., Черных И.Н. Способ электрохимического получения мышьяковистого водорода: Патент SU2203983. 2001.
Смирнов Ю.Д., Вахер В.Ф., Князев Б.А., Томилов А.П. Электрохимическое выделение мышьяка из эфиров мышьяковистой кислоты // Неорган. материалы. 2005. Т. 41. № 8. С. 935–937.
Омиадзе А.П., Гринберг Е.Е., Ефремов А.А. Фазовые равновесия жидкость–пар в бинарных системах на основе алкоксидов мышьяка, кремния, бора, сурьмы и спиртов // Журн. физ. химии. 1986. Т. 60. № 6. С. 1575–1582.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы