Неорганические материалы, 2021, T. 57, № 11, стр. 1220-1225
Извлечение из растворов катионов Pb2+ и Cd2+ ионитами на основе фосфатов титана(IV)
Р. И. Корнейков 1, *, В. И. Иваненко 1, С. В. Аксенова 1, А. А Широкая 1, А. И. Новиков 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального исследовательского центра “Кольский научный центр Российской академии наук”
184209 Апатиты, Мурманской обл., Академгородок, 26а, Россяи
* E-mail: r.korneikov@ksc.ru
Поступила в редакцию 06.04.2021
После доработки 30.06.2021
Принята к публикации 01.07.2021
Аннотация
Показана возможность применения материалов на основе оксогидроксофосфатов титана(IV) для сорбционного извлечения из растворов катионов тяжелых металлов. Определены сорбционные характеристики ионитов по отношению к катионам Pb2+ и Cd2+. Исследована сорбционная активность фосфатотитановых материалов к катионам Pb2+ и Cd2+ во времени, установлена зависимость сродства матрицы от ионного радиуса катионов металлов. Экспериментально определены оптимальные условия эффективного применения ионообменных материалов для извлечения из растворов катионов Pb2+ и Cd2+ (отношение жидкой и твердой фаз, рН).
ВВЕДЕНИЕ
С деятельностью предприятий горнодобывающей и перерабатывающей промышленности помимо шлаковых отходов, разнообразных шламов, газовых выбросов связано образование в огромном количестве сточных вод, содержащих катионы тяжелых металлов (ТМ), количество которых может превосходить существующие нормативы (предельно допустимые концентрации) в сотни и тысячи раз [1–3]. Катионы ТМ характеризуются тем, что способны накапливаться в живых объектах экосистем и передаваться по пищевым цепям, оказывая негативное влияние на жизнедеятельность организмов [1, 4]. Поэтому такие стоки требуют незамедлительной переработки с целью их очистки от высокотоксичных катионов ТМ. Для извлечения из промышленных растворов катионов ТМ предложены такие технологические методы, как экстракция, электрокоагуляция, химическое или реагентное осаждение, адсорбция и др. [5–8]. Однако, несмотря на экономичность и простоту эксплуатации, эти методы имеют недостатки. Применение экстракционных процессов ограничено из-за растворимости экстрагентов, в результате чего может осуществляться вторичное загрязнение очищаемых растворов [9]. Использование остальных методов связано с образованием многокомпонентных плохоотстаивающихся и труднофильтруемых осадков, что осложняет их дальнейшую переработку или утилизацию [10–13]. Для извлечения катионов токсичных металлов перспективны методы ионного обмена [14]. Среди ионитов интерес могут представлять соединения на основе аморфных оксогидроксофосфатов титана(IV) с мольным соотношением Р : : Ti ≤ 1, обладающие высокими сорбционными характеристиками, обеспечивающие надежную иммобилизацию сорбированного высокотоксичного сорбата и безопасность в течение длительного хранения [15].
Поэтому цель работы заключалась в изучении сорбционной активности сорбентов на основе оксогидроксофосфатов титана(IV) различного состава в отношении некоторых катионов ТМ, в частности свинца и кадмия, при различных условиях, а также поиск оптимальных условий их применения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез сорбентов на основе гидрофосфатов оксотитана(IV) осуществляли предварительным осаждением из титансодержащего реагента прекурсора TiO(OH)2 ⋅ nH2O, его отделением от маточного раствора с последующими обработкой ортофосфорной кислотой и сушкой при комнатной температуре. В результате сформированы рентгеноаморфные оксогидроксофосфаты титана(IV) [16, 17]. Содержание фосфора в составе полученных сорбционных материалов определяли фотоколориметрически с молибдатом аммония (фотоэлектроколориметр Leki-1107), титана – атомно-абсорбционным и фотоколориметрическим (с пероксидом водорода) методами. Соотношение аквалигандов, гидроксильных и гидрофосфатных групп определяли, сопоставляя данные химического, дифференциального термического (ДТА) и термогравиметрического (ТГА) методов анализа. Для ДТА твердых фаз использовали низкочастотный термографический регистратор НТР-70 с программным нагревательным устройством ПРТ-1000М (эталоном выступал прокаленный оксид алюминия). ТГА проводили с помощью тензорных весов ВТ-1000. Температуру измеряли платина-платинородиевыми термопарами в комплекте с потенциометром ПП-63. Скорость нагрева составляла 10°С мин на воздухе. Удельную поверхность воздушно-сухого исходного сорбента (Sуд) определяли методом термической десорбции азота на электронном измерителе удельной поверхности TriStar II 3020 фирмы Micrometritics. Распределение по размерам частиц (PSD) определяли методом лазерной дифракции на анализаторе SALD-201 фирмы Shimadzu. Содержание катионов ТМ в растворах, а также в отработанных сорбционных материалах при их вскрытии определяли методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС) на приборе ELAN 9000 DRC-e фирмы Perkin Elmer. Погрешность измерений не превышала 4%. Ионообменный процесс на оксогидроксофосфатах титана осуществляли в статических условиях при эквимолярных концентрациях катионов свинца и кадмия в монокомпонентных растворах, различных отношениях жидкой и твердой фаз (Ж : Т) и равновесных значениях рН. Корректировку равновесных значений рН сорбции осуществляли раствором гидроксида лития, обладающего значительно меньшим размером ионного радиуса (r) по сравнению с катионами ТМ (r (Å): Li+ – 0.78; Pb2+ – 1.32; Cd2+ – 1.03) [18]. Такая разница в значениях r должна существенно снизить при сорбции конкуренцию со стороны катионов лития к ТМ. Значения рН контролировали рН-метром Анион 7000. Индикаторным электродом служил селективный по отношению к протонам электрод марки ЭСЛ-43-07, вспомогательным – хлорсеребряный электрод Ag/AgCl марки ЭВЛ-1М3. Значения ионообменной емкости (ИОЕ) определяли при рН 6. Для этого навеска сорбента помещалась в емкость с раствором соответствующего катиона металла в 10%-ном избытке (мг-экв) по отношению к содержанию ${\text{HPO}}_{4}^{{2 - }}$-групп в навеске образца.
Степень извлечения катионов ТМ из растворов (R) рассчитывали согласно уравнению: R = = (Vх/Vисх) × 100%, где Vх – количество извлеченного фосфатотитановой матрицей катиона металла, Vисх – исходное количество катиона металла в аликвоте. Коэффициенты распределения (Kd) рассчитывали по уравнению: Kd = Аα/(100 – А), где А – процентное содержание сорбированного катиона металла, α – отношение объема жидкой фазы к массе сорбента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе рассчитаны составы синтезированных сорбционных материалов на основе оксогидроксофосфатов титана(IV) согласно результатам химического метода анализа, ДТА и ТГА, представленные в табл. 1. Образцы содержат разное количество функциональных гидрофосфатных групп (${\text{HPO}}_{4}^{{2 - }}$), участвующих в процессах ионного обмена, что обусловлено разным соотношением катионов титана и гидрофосфатных групп на стадии фосфатирования свежеосажденного TiO(OH)2 ⋅ nH2O при получении данных сорбционных материалов. Перед исследованием ионообменных свойств в отношении катионов свинца и кадмия иониты подвергали размолу и ситованию. В табл. 2 представлены физические характеристики полученных соединений.
Таблица 1.
Составы полученных сорбентов
| Содержание, мас. % | Состав | ||
|---|---|---|---|
| TiO2 | P2O5 | H2O | |
| 42.70 | 33.70 | 23.60 | TiO(OH)0.24(HPO4)0.88 ⋅ 1.89H2O |
| 34.01 | 30.25 | 35.74 | TiOНPO4 ⋅ 4.16Н2О |
Таблица 2.
Физические свойства синтезированных сорбентов
| Состав сорбента | Sуд, м2/г | PSD, мкм |
|---|---|---|
| TiO(OH)0.24(HPO4)0.88 ⋅ 1.89H2O | 18.99 | 4–15 |
| TiOНPO4 ⋅ 4.16Н2О | 13.89 | 7–20 |
Из определенных физических характеристик следует, что образец с меньшим содержанием функциональных групп обладает несколько бóльшими удельной поверхностью и диапазоном распределения по размерам частиц. Возможно, это связано с тем, что в состав сорбента входит гидратированный диоксид титана(IV), обладающий большей дисперсностью по сравнению с гидрофосфатом оксотитана(IV). Это подтверждается физическими параметрами свежеосажденного из титансодержащего реагента прекурсора TiO(OH)2 ⋅ nН2О, отделенного от маточного раствора и просушенного при комнатной температуре (Sуд = 44.58 м2/г). Указанные в табл. 2 показатели (Sуд и PSD) могут способствовать более эффективному протеканию процесса ионного замещения на сорбентах указанного состава.
Определены ионообменные характеристики синтезированных материалов по отношению к катионам свинца и кадмия. В табл. 3 представлены экспериментально найденные значения ионообменной емкости (ИОЕэксп) для сорбентов по Pb2+ и Cd2+, а также отношение ИОЕэксп и теоретически рассчитанной емкости (ИОЕтеор) для каждого состава образца.
Таблица 3.
Значение ИОЕ фосфатотитановых сорбентов по катионам ТМ (рН 6)
| Катион | Pb2+ | Cd2+ | |
| TiO(OH)0.24(HPO4)0.88 ⋅ 1.89H2O | ИОЕ, мг-экв/г | 3.491 | 3.078 |
| ИОЕтеор/ИОЕэксп | 0.740 | 0.652 | |
| TiOНPO4 ⋅ 4.16Н2О | ИОЕ, мг-экв/г | 4.247 | 4.212 |
| ИОЕтеор/ИОЕэксп | 0.997 | 0.989 | |
Из табл. 3 видно, что образец с низким содержанием функциональных ионообменных групп обладает существенно различающимися значениями ИОЕэксп и ИОЕтеор в отличие от образца с мольным соотношением фосфора к титану, равным 1. Возможно, это связано с меньшей доступностью гидрофосфатных групп для катионов ТМ в процессе ионного замещения вследствие присутствия в составе образца титанооксидной составляющей. Достоверность экспериментально найденных значений ИОЕэксп и рассчитанных теоретически возможных для данных составов сорбентов ИОЕтеор подтверждают результаты химического анализа предварительно отмытых от маточного раствора и высушенных при комнатной температуре отработанных образцов (табл. 4). Также из табл. 4 видно, что в составах сорбентов отсутствуют катионы лития, что подтверждает предположение о слабой конкурентной активности Li+ по отношению к Pb2+ и Cd2+ вследствие существенной разницы ионных радиусов катионов щелочного и тяжелых металлов.
Таблица 4.
Составы отработанных сорбентов
| Состав, мас. % | ||||
|---|---|---|---|---|
| TiO2 | P2O5 | PbO | CdO | H2O |
| TiO(OH)0.24(HPO4)0.88 ⋅ 1.89H2O | ||||
| 31.56 | 24.71 | 28.70 | – | 15.03 |
| 36.59 | 28.61 | – | 16.82 | 17.98 |
| TiOНPO4 ⋅ 4.16Н2О | ||||
| 23.97 | 21.30 | 33.48 | – | 21.25 |
| 27.65 | 24.57 | – | 21.96 | 25.82 |
Проведены исследования по извлечению катионов Pb2+ и Cd2+ фосфатотитановыми матрицами в зависимости от соотношения жидкой и твердой фаз (табл. 5, 6). Установлено, что с уменьшением соотношения Ж : Т происходит увеличение степени извлечения для всех катионов ТМ и значений коэффициентов распределения. Наиболее оптимальное соотношение жидкой и твердой фаз для сорбции ТМ – 100.
Таблица 5.
Зависимость R и Кd по катионам Pb2+ и Cd2+ на сорбенте TiOНPO4 ⋅ 4.16Н2О от соотношения жидкой и твердой фаз
| Ж : Т | Остаточное содержание, г/л | R, % | Кd, мл/г | |||
|---|---|---|---|---|---|---|
| Pb2+ | Cd2+ | Pb2+ | Cd2+ | Pb2+ | Cd2+ | |
| 100 | 0.0012 | 0.0520 | 99.8 | 84.6 | 56 600 | 550 |
| 300 | 0.0082 | 0.143 | 98.8 | 57.7 | 24 600 | 410 |
| 500 | 0.043 | 0.194 | 93.7 | 42.6 | 7400 | 370 |
Таблица 6.
Зависимость R и Кd по катионам Pb2+ и Cd2+ на сорбенте TiO(OH)0.24(HPO4)0.88 ⋅ 1.89H2O от соотношения жидкой и твердой фаз
| Ж : Т | Остаточное содержание, г/л | R, % | Кd, мл/г | |||
|---|---|---|---|---|---|---|
| Pb2+ | Cd2+ | Pb2+ | Cd2+ | Pb2+ | Cd2+ | |
| 100 | 0.0017 | 0.075 | 99.8 | 77.8 | 39 900 | 350 |
| 300 | 0.0203 | 0.165 | 97.0 | 51.2 | 9700 | 315 |
| 500 | 0.0667 | 0.222 | 90.2 | 34.3 | 4600 | 260 |
Ионообменное извлечение катионов ТМ ограничено и конкуренционной активностью ионов водорода в отношении ТМ в этой области рН. Сорбционные матрицы обладают большей селективностью в отношении катионов свинца в сравнении с катионами кадмия, о чем свидетельствуют экспериментально полученные значения коэффициентов распределения (табл. 5 и 6). Связано это с разницей в размерах ионного радиуса. Иониты на основе гидрофосфатов оксотитана(IV) обладают повышенным сродством к более крупным катионам металла (rPb > rCd). Изучено ионообменное извлечение катионов ТМ на титанофосфатных матрицах во времени при оптимальном значении Ж : Т = 100 (при данном содержании катионов металлов) и рН 2.
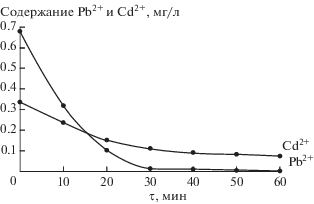
Как видно из рис. 1 и 2, характер и скорость установления равновесия при сорбции катионов ТМ одинаковы для обоих образцов. За 30 мин репульпирования суспензии в процессе ионного замещения протонов функциональных групп на катионы металлов извлекается свыше 95% Pb2+ и несколько меньше Cd2+ – около 70%.
Рис. 1.
Извлечение во времени катионов Pb2+ и Cd2+ из растворов сорбентом состава TiOНPO4 ⋅ 4.16Н2О.
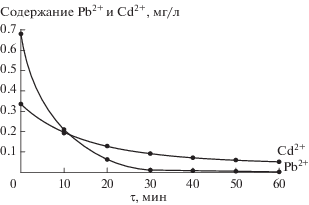
Рис. 2.
Извлечение во времени катионов Pb2+ и Cd2+ из растворов сорбентом состава TiO(OH)0.24(HPO4)0.88 ⋅ 1.89H2O.
Изучено влияние равновесных значений рН сорбции на извлечение из растворов катионов Pb2+ и Cd2+ фосфатами титана(IV) (табл. 7, 8). Из табл. 7 и 8 видно, что при увеличении равновесных значений рН сорбции происходит существенное повышение выделения катионов свинца и кадмия из раствора. Максимальное извлечение наблюдается при рН 6. Связано это с отсутствием в этой области конкуренции со стороны ионов водорода, а также с усилением подвижности протона ${\text{HPO}}_{4}^{{2 - }}$-групп сорбентов.
Таблица 7.
Зависимость R и Кd по катионам Pb2+ и Cd2+ на сорбенте TiOНPO4 ⋅ 4.16Н2О от значений рН сорбции
| рН | Остаточное содержание, г/л | R, % | Кd, мл/г | |||
|---|---|---|---|---|---|---|
| Pb2+ | Cd2+ | Pb2+ | Cd2+ | Pb2+ | Cd2+ | |
| 2 | 0.0012 | 0.052 | 99.8 | 84.6 | 56 600 | 550 |
| 4 | 0.00014 | 0.0012 | ~100 | 99.6 | 485 600 | 28 000 |
| 6 | 0.00007 | 0.0001 | ~100 | ~100 | 971 000 | 337 900 |
Таблица 8.
Зависимость R и Кd по катионам Pb2+ и Cd2+ на сорбенте TiO(OH)0.24(HPO4)0.88 ⋅ 1.89H2O от значений рН сорбции
| рН | Остаточное содержание, г/л | R, % | Кd, мл/г | |||
|---|---|---|---|---|---|---|
| Pb2+ | Cd2+ | Pb2+ | Cd2+ | Pb2+ | Cd2+ | |
| 2 | 0.0017 | 0.075 | 99.8 | 77.9 | 39900 | 350 |
| 4 | 0.00029 | 0.0035 | ~100 | 99.0 | 234000 | 9600 |
| 6 | 0.00014 | 0.0009 | ~100 | 99.7 | 485600 | 37500 |
Таким образом, показана возможность применения высокоэффективных сорбционных материалов на основе оксогидроксофосфатов титана(IV) для извлечения из сточных вод катионов ТМ, в частности свинца и кадмия.
ЗАКЛЮЧЕНИЕ
Исследована возможность применения сорбентов на основе оксогидроксофосфатов титана(IV) для извлечения из сточных вод предприятий горнодобывающей и перерабатывающей промышленности высокотоксичных катионов ТМ, в частности Pb2+ и Cd2+. Установлено, что фосфатотитановые иониты обладают высокими сорбционными характеристиками в отношении ионов свинца и кадмия. Полученный гранулометрический состав ионитов обеспечивает высокую эффективность ионнообменного процесса при замещении ионов водорода функциональных групп на катионы металла. Экспериментально показано, что с понижением соотношения жидкой и твердой фаз повышаются степень извлечения катионов металлов и значения коэффициентов распределения. Установлено, что увеличение равновесного значения рН способствует повышению сорбционного извлечения катионов Pb2+ и Cd2+ фосфатами титана(IV). Селективность сорбционной матрицы к катионам металлов определяется размерами их ионных радиусов. Сродство ионита выше к более крупному катиону металла.
Определены оптимальные условия эффективного применения фосфатотитановых сорбентов для извлечения катионов свинца и кадмия: отношение жидкой и твердой фаз – 100 (при данном содержании ТМ), равновесное значение рН сорбции – 6.
Список литературы
Mohmood I., Lopes C.B., Lopes I., Ahmad I., Duarte A.C., Pereira E. Nanoscale Materials and Their Use in Water Contaminants Removal – a Review // Environ. Sci. Pollut. Res. 2013. V. 20. № 3. P. 1239–1260.https://doi.org/10.1007/s11356-012-1415-x
Novais R.M., Carvalheiras J., Seabra M.P., Pullar R.C., Labrincha J.A. Highly Efficient Lead Extraction from Aqueous Solutions Using Inorganic Polymer Foams Derived from Biomass fly Ash and Metakaolin // J. Environ. Manage. 2020. № 272. P. 111049. https://doi.org/10.1016/j.jenvman.2020.111049
Mohammed A.A., Selman H.M., Abukhanafer G. Liquid Surfactant Membrane for Lead Separation from Aqueous Solution: Studies On Emulsion Stability and Extraction Efficiency // J. Environ. Chem. Eng. 2018. V. 6. № 6. P. 6923–6930. https://doi.org/10.1016/j.jece.2018.10.021
Chandra R., Yadav S. Phytoremediation of Cd, Cr, Cu, Mn, Fe, Ni, Pb and Zn from Aqueous Solution Using Phragmites Cummunis, Typha Angustifolia and Cyperus Esculentus // Int. J. Phytoremedi. 2011. № 13. P. 580–591. https://doi.org/10.1080/15226514.2010.495258
Mohammed A.A., Dia A.-M., Dhia M. Removal of Lead from Simulated Wastewater by Electrocoagulation Method // J. Eng. 2010. V. 16. № 4. 5811–5821. https://www.researchgate.net/publication/323429642
Kavak D. Removal of LEAD from Aqueous Solutions by Precipitation: Statistical Analysis and Modeling // Desalin. Water Treat. 2013. V. 51. № 7–9. P. 1720–1726. https://doi.org/10.1080/19443994.2012.714652
Moyo M., Chikazaza L., Nyamunda B.C., Guyo U. Adsorption Batch Studies on the Removal of Pb(II) Using Maize Tassel Based Activated Carbon // J. Chem. 2013 V. 2013. P. 508934. https://doi.org/10.1155/2013/508934
Konczyk J., Kozlowski C., Walkowiak W. Lead (II) Removal from Aqueous Solutions by Solvent Extraction with Tetracarboxylresorcin [4] Arene // Physicochem. Problems Miner. Process. 2013. V. 49. № 1. P. 213–222. https://doi.org/10.5277/ppmp130119
Ласкорин Б.Н. Сорбционные и экстракционные процессы в гидрометаллургии цветных и редких металлов // Разделение близких по свойствам редких металлов. М.: Металлургиздат, 1962. С. 11–27.
Pang F.M., Kumar P., Teng T.T., Omar A.M., Wasewar K.L. Removal of Lead, Zinc and Iron By Coagulation-flocculation // J. Taiwan Inst. Chem. Eng. 2011. V. 42. № 5. P. 809–815. https://doi.org/10.1016/j.jtice.2011.01.009
Jain M., Garg V., Kadirvelu K., Sillanpää M. Adsorption of Heavy Metals from Multimetal Aqueous Solution by Sunflower Plant Biomass-Based Carbons // Int. J. Environ. Sci. Technol. 2016. V. 13. № 2. P. 493–500. https://doi.org/10.1007/s13762-015-0875-1
Lakherwal D. Adsorption of Heavy Metals: a Review // Int. J. Environ. Res. Dev. 2014. V. 4. № 1. P. 41–48.
Pang F.M., Teng S.P., Teng T.T., Omar A. Heavy Metals Removal by Hydroxide Precipitation and Coagulation-Flocculation Methods from Aqueous Solutions // Water Qual. Res. J. 2009. V. 44. № 2. P. 174–182.https://doi.org/10.2166/WQRJ.2009.019
Qian J., Zeng Z., Xue W., Guo Q. Lead Removal from Aqueous Solutions by 732 Cation-Exchange Resin // Can. J. Chem. Eng. 2016. V. 94. № 1. P. 142–150. https://doi.org/10.1002/cjce.22363
Корнейков Р.И., Иваненко В.И. Извлечение катионов цезия и стронция из растворов ионитами на основе фосфатов титана(IV) // Неорган. материалы. 2020. Т. 56. № 5. С. 528–532. https://doi.org/10.31857/S0002337X20050085
Корнейков Р.И. Синтез и свойства сорбционных материалов на основе оксогидроксофосфатов титана(IV): Автореф. дис. … канд. техн. наук. Апатиты, 2009. 23 с.
Иваненко В.И., Корнейков Р.И., Локшин Э.П. Иммобилизация катионов металлов титанофосфатными сорбентами // Радиохимия. 2016. Т. 58. № 2 С. 140–146
Краткий справочник по химии / Под ред. Куриленко О.Д. Киев: Наукова думка, 1965. 835 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


