Неорганические материалы, 2021, T. 57, № 11, стр. 1253-1263
Электрические свойства Gd2Zr2O7, допированного бериллием
А. В. Шляхтина 1, *, Н. В. Горшков 1, И. В. Колбанев 1, К. И. Шефер 2, 3, А. В. Касьянова 4, 5, Д. А. Медведев 4, 5
1 Федеральный исследовательский центр химической физики им. Н.Н. Семенова Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
2 Федеральный исследовательский центр Институт катализа им. Г.К. Борескова СО Российской академии наук
630090 Новосибирск, пр. Академика Лаврентьева, 5, Россия
3 Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
4 Институт высокотемпературной электрохимии УрО Российской академии наук
620219 Екатеpинбуpг, ул. С. Ковалевской, 22, Россия
5 Уральский федеральный университет им. Первого президента России Б.Н. Ельцина
620002 Екатеpинбург, ул. Мира, 19, Россия
* E-mail: annashl@inbox.ru
Поступила в редакцию 27.05.2021
После доработки 21.07.2021
Принята к публикации 23.07.2021
Аннотация
Впервые с использованием метода механической активации исходных оксидов и последующего отжига сырых прессовок при 1500°С синтезирована плотная керамика на основе Gd2Zr2O7 c гетеровалентным замещением циркония бериллием состава Gd2Zr1.9Be0.1O6.9. Установлено, что использование метода механической активации позволило получить плотную керамику уже после 5-минутного отжига (гидростатическая плотность 88%) и газоплотную керамику после 4 ч отжига (гидростатическая плотность 97.3%). Gd2Zr1.9Be0.1O6.9 имеет чисто кислород-ионную проводимость 4.0 × 10–3 См/см при 800°С, а основным преимуществом введения бериллия в циркониевую подрешетку Gd2Zr2O7 явилось получение материала, в котором какая-либо значимая электронная или дырочная проводимость отсутствовала в широком интервале парциальных давлений кислорода и температур.
ВВЕДЕНИЕ
Известно, что для практических применений величина кислород-ионной проводимости электролитов твердотельных топливных элементов должна быть не ниже 8.4 × 10–3 См/см при 700°С [1]. Высокие значения кислород-ионной проводимости вплоть до 7.4 × 10–2 См/см при 700°С показывают твердые электролиты: 8YSZ (ZrO2, стабилизированный 8 мол. % Y2O3) [2, 3]; оксид церия, допированный гадолинием GDC (Ce0.9Gd0.1O1.95) [4, 5] и ZrO2, допированный скандием ScSZ [6, 7].
Среди серии цирконатов РЗЭ наиболее перспективным для получения высоких значений кислород-ионной и протонной проводимости является цирконат гадолиния Gd2Zr2O7. Собственная кислород-ионная проводимость цирконата гадолиния максимальна среди Ln2Zr2O7 со структурой пирохлора [8–11]. В связи с этим предпринимались многочисленные попытки увеличить кислород-ионную проводимость цирконата гадолиния путем легирования [12–17], и, без сомнения, интересно было бы получить протонный проводник на его основе. Однако до сих пор не удавалось получить твердые растворы с протонной проводимостью на основе Gd2Zr2O7 в связи с его низкой гидрофильностью, в отличие, например, от цирконатов самария, неодима и лантана.
На наш взгляд, интересна работа [14], где исследована проводимость Gd2Zr2 –xNbxO7 (0 ≤ x ≤ ≤ 0.4). Максимальная проводимость обнаружена у Gd2Zr2– xNbxO7.1 (x = 0.1). Авторы полагают, что эта керамика обладает протонным вкладом, поскольку ее проводимость в водородной атмосфере была несколько выше, чем на воздухе. Твердые растворы на основе Gd2Zr2O7, легированные кальцием, демонстрируют объемную кислород-ионную проводимость во всем температурном интервале измерений. Это отличает их от твердых растворов на основе пирохлора Sm2Zr2O7, у которых была установлена протонная составляющая объемной и зернограничной проводимости при температурах ниже 600°C [17, 18]. Следует отметить, однако, что небольшой вклад протонной проводимости наблюдали недавно авторы [19] во влажном воздухе при допировании магнием гадолиниевой подрешетки Gd2Zr2O7.
Среди элементов II группы бериллий имеет наименьший ионный радиус Rкч = 6 Be2+ = 0.45 Å, тогда как ионный радиус циркония Rкч = 6 Zr4+ = = 0.72 Å. Циркониевая позиция, таким образом, является наиболее предпочтительной для легирования малыми катионами. Гетеровалентное замещение в сложных оксидах нередко приводит к увеличению ионной проводимости [20–27].
Известно, что BeO имеет высокую температуру плавления – 2470°С. Летучесть ВеО незначительна, а именно: давление пара оксида бериллия при 2000°С составляет 0.003 атм [28]. Таким образом, в отсутствие паров воды это наименее летучий из всех тугоплавких оксидов II А подруппы (CaO, SrO, BaO). Оксид бериллия легко взаимодействует с MgO, CaO, Al2O3, SiO2. Прокаленный ВеО химически инертен. Очевидно, что это связано с его структурой: ВеО кристаллизуется в структурном типе вюрцита, тогда как остальные оксиды II А подруппы имеют структуру типа NaCl [28]. При хранении на воздухе ВеО не поглощает воду и CO2, в отличие от остальных оксидов II А подруппы. Закономерно, что теплота гидратации оксидов M2+O в ряду BeO, MgO, CaO, SrO, BaO растет, и для BaO ее величина в пять раз выше, чем для BeO [28]. Гидроксид бериллия является слабым и скорее даже амфотерным основанием, склонным к полимеризации с образованием гидроксильных “оловых” мостиков, в результате чего мономер n[Be(OH)2] превращается в полимер [Be(OH)2]n [28]. Образование мостиков Be2+–OH––Be2+ во влажном воздухе допированного бериллием цирконата гадолиния может способствовать появлению протонного вклада у твердого раствора Gd2Zr1.9Be0.1O6.9, исследуемого во влажной среде. Вследствие низкой летучести ВеО можно ожидать, что вводимый на стадии механоактивации оксид бериллия полностью войдет в состав сложного оксида Gd2Zr1.9Be0.1O6.9 после высокотемпературного синтеза.
В настоящей работе впервые предпринята попытка легирования циркониевой позиции пирохлора Gd2Zr2O7 бериллием с целью получения кислород- и протонпроводящего материала.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез керамики проводили с использованием механически активированной смеси оксидов Gd2O3 (99.9%, GdO-I, ТУ 48-4-200-72, Россия), ZrO2 (Aldrich Cem. Com. Inc. 99% ZrO2), BeO (для люминофоров, ТУ 6090131575), взятых в соответствующей пропорции. Отжиг предварительно спрессованных в таблетки порошков (давление 680 МПа) проводили при 1600°С в течение 4 ч для Gd2Zr2O7, при 1500°С в течение 5 мин и 4 ч для Gd2Zr1.9Be0.1O6.9. Для отжига на воздухе использовали высокотемпературную муфельную печь F46100 (Barnstead International). Тип нагревателей Super Kanthal 33 (MoSi2).
Более низкая температура для синтеза легированного бериллием образца была выбрана в связи с нежелательной возможностью внедрения бериллия в обе подрешетки – Gd и Zr, что наблюдали ранее при легировании Nd2Zr2O7 кальцием в подрешетку неодима при 1600°С [29].
Керамику растирали в порошок и анализировали методом РФА на приборе ДРОН-3М (CuKα-излучение, 2θ = 10°–75°, шаг 0.1, τ = 3 с).
Микроструктура керамики исследована методом СЭМ на микроскопе JEOL JSM-6390LA.
Образцы для импедансных измерений представляли собой таблетки диаметром 8.8–9.6 и толщиной 2.0–3.6 мм. В качестве электродов на торцы образцов было нанесено платиновое пористое покрытие. Импедансные измерения кислород-ионной проводимости в сухой воздушной атмосфере для Gd2Zr2O7 и Gd2Zr1.9Be0.1O6.9, синтезированного в течение 5 мин, были проведены с помощью импедансметра Novocontrol Alpha AN в диапазоне температур от 300 до 800°C в режиме ступенчатого нагрева с шагом 50°C и выдержкой 2 ч. Частотный диапазон импедансных измерений менялся от 0.1 Гц до 1 МГц, амплитуда переменного сигнала варьировалась от 50 до 500 мВ.
Общая проводимость цирконатов была оценена также с применением 4-зондового метода на постоянном токе. Измерения проводились с использованием микропроцессорной системы Zirconia-M при температурах 500–900°С в сухом воздухе, а также во влажных окислительной и восстановительной атмосферах. Влажные атмосферы (${{p}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ = 0.02 атм) получали пропусканием газов через водяной барботер, термостатированный при температуре 25°С. Кроме того, для оценки ионного и электронного вкладов в общую проводимость была исследована проводимость как функция парциального давления кислорода ${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ при температурах от 700 до 900°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Структура и микроструктура керамики Gd2Zr2 – xBexO7 – x/2 (x = 0, 0.1). Данные рентгеновской дифракции исследуемых образцов представлены на рис. 1. Параметр решетки изменяется следующим образом: 10.515(3), 10.533(2), 10.541(4) Å для Gd2Zr2O7, Gd2Zr1.9Be0.1O6.9 (отжиг 5 мин при 1500°C) и Gd2Zr1.9Be0.1O6.9 (отжиг 4 ч при 1500°C) соответственно. Подобный необычный эффект увеличения параметра элементарной ячейки при легировании малым катионом был обнаружен для Gd2Zr1.7Li0.3O6.55 при введении лития в циркониевую подрешетку, когда параметр кубической ячейки увеличился от 10.5346(2) Å для чистого Gd2Zr2O7 до 10.5708(2) Å для Gd2Zr1.7Li0.3O6.55 [15]. Тем не менее, увеличение параметра в этом случае оказалось закономерным, поскольку радиус 6-координированного лития (0.76 Å) чуть больше радиуса 6-координированного Zr (0.72 Å). При замещении бериллием ионный радиус допанта в любой позиции будет меньше, чем ионный радиус катионов решетки Gd2Zr2O7. Поэтому для более точной оценки параметра и распределения катионов был использован метод рентгеноструктурного анализа (РСА) с уточнением по Ритвельду. В качестве модельной структуры использовалась структура пирохлора из базы данных ICSD, № 165816. Результаты анализа представлены на рис. 1б для Gd2Zr2O7 и на рис. 1в для Gd2Zr1.9Be0.1O6.9 (отжиг 5 мин при 1500°C). В ходе уточнения структуры чистого пирохлора занятость основных позиций гадолиния и циркония уменьшалась, доля разупорядоченности структуры за счет перехода катионов в позиции соседней катионной подрешетки росла (табл. 1). При уточнении по Ритвельду состава допированного бериллием образца (ион бериллия помещался в подрешетку циркония) отношение количества гадолиния к количеству циркония в лантаноидной подрешетке увеличивалось. Рост параметра решетки в данном случае можно объяснить, прежде всего, повышением в ней доли более крупных ионов гадолиния (1.053 Å для 8-координированного иона, характерного для его основной подрешетки) по сравнению с долей ионов циркония (0.72 Å для 6-координированного иона, характерного для его основной подрешетки). В целом, занятость позиций в катионной подрешетке уменьшалась. Наличие вакансий в структуре в результате уменьшения занятости атомных позиций может также приводить к расширению решетки за счет электростатических сил отталкивания между ионами одного заряда. При помещении иона бериллия в подрешетку гадолиния занятость этой позиции стремилась к нулю. Занятость позиции бериллия в подрешетке циркония при уточнении увеличивалась. Этот результат подтверждает включение ионов бериллия именно в подрешетку циркония.
Рис. 1.
Дифрактограммы Gd2Zr2O7 (синяя кривая), Gd2Zr1.9Be0.1O6.9 (отжиг 5 мин при 1500°C) (красная кривая) и Gd2Zr1.9Be0.1O6.9 (отжиг 4 ч при 1500°C) (черная кривая) (а); cравнение экспериментальной дифрактограммы Gd2Zr2O7 (красная кривая) с теоретической, полученной в результате уточнения по Ритвельду (синяя кривая) (б); сравнение экспериментальной дифрактограммы Gd2Zr1.9Be0.1O6.9 (отжиг 5 мин при 1500°C) (красная кривая) с теоретической, полученной в результате уточнения по Ритвельду (синяя кривая) (в).
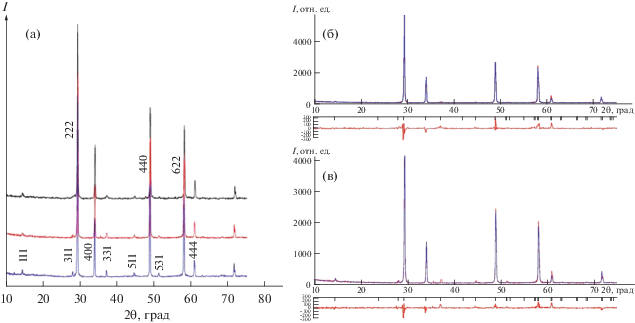
Таблица 1.
Уточнение структуры Gd2Zr2O7 и Gd2Zr1.9Be0.1O6.9 (отжиг 5 мин при 1500°C) по Ритвельду
| Образец | Формула по результатам уточнения | ПЭЯ**, нм | Занятость позиций | Rexp, Rp, GoF |
|---|---|---|---|---|
| Gd2Zr2O7 | Gd1.82Zr1.82O7 (ρ = 7.18 г/см3) |
10.5212(8) | Gd1 0.66(2) Zr1 0.36(2) Gd2 0.36(2) Zr2 0.66(2) O1 1.00(2) O2 1.00(2) O3 0.83(7) |
9.22 12.12 3.00 |
| Gd2Zr1.9Be0.1O6.9 | Gd1.62Zr1.52Be0.39O7 (ρ = 6.34 г/см3) |
10.5387(6) | Gd1 0.686(6) Zr1 0.189(1) Gd2 0.202(4) Zr2 0.655(6) Be 0.21(8) O1 1.00(2) O2 1.00(4) O3 0.685(4) |
10.05 13.07 3.16 |
Относительная плотность образцов изменялась в следующем порядке: 89.3% для Gd2Zr2O7, 85.5% для Gd2Zr1.9Be0.1O6.9 (отжиг 5 мин при 1500°C) и 95% для Gd2Zr1.9Be0.1O6.9 (отжиг 4 ч при 1500°C). Последующее гидростатическое взвешивание в толуоле показало, что плотность составляет 88 и 97.3% для Gd2Zr1.9Be0.1O6.9, синтезированного в течение 5 мин и 4 ч соответственно. Следует отметить, что механическая активация позволила получить плотную керамику после 5-минутного отжига, что свидетельствует об эффективности данного метода при синтезе сложных оксидов. Данные СЭМ подтвердили высокие значения плотности для Gd2Zr1.9Be0.1O6.9 с разным временем спекания. На рис. 2а показана микроструктура поверхности керамики Gd2Zr1.9Be0.1O6.9, синтезированной в течение 5 мин, а на рис. 2б – микроструктура той же керамики, но после 4-часового отжига. Видно, что зерна в плотной керамики подросли до 2 мкм, тогда как в менее плотной они в среднем имели величину ~0.5 мкм.
Рис. 2.
Микроструктура Gd2Zr1.9Be0.1O6.9, синтезированного при 1500°С кратковременным 5-минутным отжигом (а) и в течение 4 ч (б).

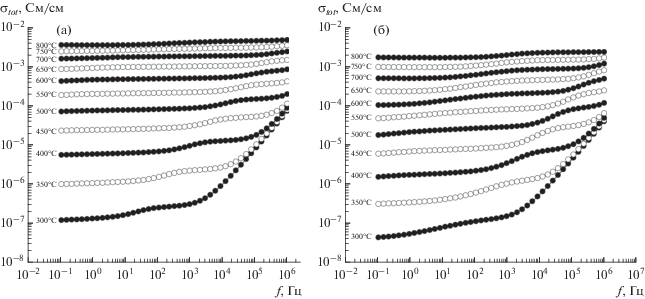
Общая проводимость Gd2Zr2O7 и Gd2Zr1.9Be0.1O6.9. Частотные зависимости проводимости Gd2Zr2O7 (рис. 3а) и Gd2Zr1.9Be0.1O6.9, полученного в результате 5-минутного отжига при 1500°C (рис. 3б) имеют плато при низких значениях частот. Зависимости σtot, полученные из низкочастотного плато, для различных температур описываются уравнением Аррениуса
(1)
${{\sigma }_{{tot}}}T = {{\sigma }_{{0tot}}}\exp ({{ - {{E}_{a}}} \mathord{\left/ {\vphantom {{ - {{E}_{a}}} {{{k}_{B}}T}}} \right. \kern-0em} {{{k}_{B}}T}}),$Рис. 3.
Частотные зависимости электропроводности Gd2Zr2O7 (а) и Gd2Zr1.9Be0.1O6.9 (б) при различных температурах.
где σ0tot – предэкспоненциальный фактор, Ea – энергия активации, kB – постоянная Больцмана, T – температура.
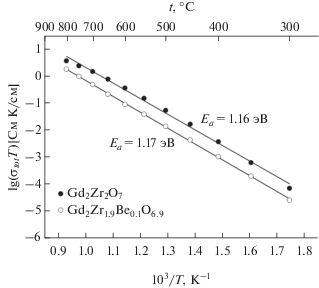
Для Gd2Zr2O7 σtot (рис. 4) выше, чем для допированного Be образца: так, при 800°C для чистого цирконата гадолиния – 6.5 × 10–3 См/см, а для легированного – 1.7 × 10–3 См/см. При этом значения энергии активации общей проводимости исследованных образцов имеют близкие значения: 1.16 эВ для чистого и 1.17 эВ для легированного.
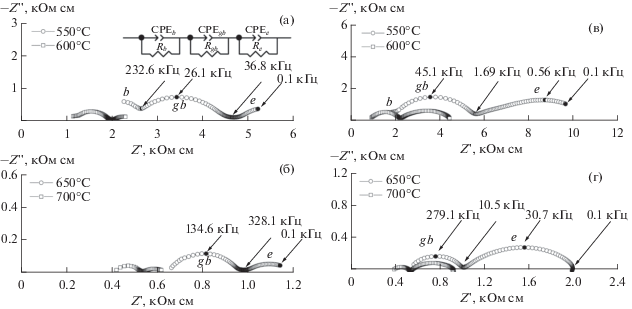
Годографы импеданса для исследованных образцов (рис. 5) имеют вид трех полуокружностей и могут быть интерпретированы эквивалентной схемой (вставка на рис. 5а) из трех последовательных участков: (RbCPEb), RgbCPEgb, ReCPEe, где Rb – сопротивление объема зерен, Rgb – сопротивление границы зерен и Re – сопротивление границы электрод/керамика, а CPEb, CPEgb и CPEe – элементы постоянной фазы. Полуокружность, обусловленная объемным вкладом зерен (RbCPEb) с емкостью в диапазоне ∼10−11 Ф, наблюдалась на высоких частотах для температур 300–550°C у Gd2Zr2O7, 300–550°C у Gd2Zr1.9Be0.1O6.9. Полуокружность RgbCPEgb соответствует вкладу границ зерен с емкостью в диапазоне ∼10−9–10−8 Ф, затем следует полуокружность ReCPEe, соответствующая электродным процессам. Процессы на границе электрод/электролит можно отнести к переносу заряда (e–) между цирконатом и электродом, а также к переносу заряда (O2−) между образцом и газовой фазой.
Рис. 5.
Годографы импеданса для различных температур Gd2Zr2O7 (а, б) и Gd2Zr1.9Be0.1O6.9 (в, г) (вставка на рис. 5а – эквивалентная схема импеданса).
Проводимость объема и границ зерен σb и σgb была рассчитана из значений соответствующих сопротивлений (Rb и Rgb) по уравнению
(2)
${{\sigma }_{{b,gb}}} = {l \mathord{\left/ {\vphantom {l {{{R}_{{b,gb}}}S}}} \right. \kern-0em} {{{R}_{{b,gb}}}S}},$Значения σb,gb, полученные из соответствующих сопротивлений, для различных температур описываются уравнением Аррениуса в следующем виде:
(3)
${{\sigma }_{{b,gb}}}T = {{\sigma }_{{0b,gb}}}\exp ({{ - {{E}_{a}}} \mathord{\left/ {\vphantom {{ - {{E}_{a}}} {{{k}_{B}}T}}} \right. \kern-0em} {{{k}_{B}}T}}).$Зависимости проводимости объема зерен σb в координатах Аррениуса (рис. 6а) имеют два участка: 300–550 и 550–800°C, что соответствует различным значениям энергий активации. Так, энергии активации проводимости объема зерен Gd2Zr2O7 и Gd2Zr1.9Be0.1O6.9 для температур ниже 550°C одинаковы (1.24 эВ), при этом для температур выше 550°C у Gd2Zr1.9Be0.1O6.9 энергия активации Ea = 0.91 эВ, а у Gd2Zr2O7Ea = 0.94 эВ (табл. 2). Значения проводимости объема зерен во всем температурном диапазоне для Gd2Zr2O7 незначительно выше, чем для Gd2Zr1.9Be0.1O6.9.
Рис. 6.
Электропроводность объема (а) и границ (б) зерен в координатах Аррениуса для Gd2Zr2O7 и Gd2Zr1.9Be0.1O6.9.
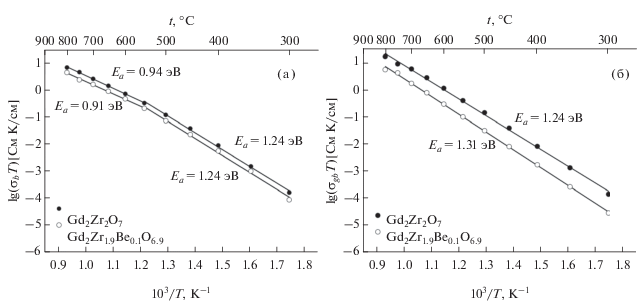
Таблица 2.
Энергия активации проводимости объема зерен, межзеренной границы и общей проводимости
| Образец | t, °C | Ea, эВ | ||
|---|---|---|---|---|
| σb | σgb | σtot | ||
| Gd2Zr2O7 | 300–550 | 1.24 | 1.24 | 1.16 |
| 550–800 | 0.94 | |||
| Gd2Zr1.9Be0.1O6.9 | 300–550 | 1.24 | 1.31 | 1.17 |
| 550–800 | 0.91 | |||
Проводимость границ зерен σgb в координатах Аррениуса (рис. 6б) у Gd2Zr2O7 значительно выше, чем у Gd2Zr1.9Be0.1O6.9. При этом значение энергии активации проводимости границ зерен Gd2Zr2O7 меньше, чем у Gd2Zr1.9Be0.1O6.9 (1.24 и 1.31 эВ соответственно).
Уменьшение значений межзеренной проводимости, сопровождающееся увеличением энергии активации, для легированного цирконата может свидетельствовать о затруднении миграции кислородных вакансий в границах зерен по механизму
(4)
${\text{O}}_{{\text{O}}}^{ \times }(48f) \leftrightarrow V_{{\text{O}}}^{{''}}(48f) + {\text{O}}_{i}^{{''}}(8b).$В результате легирования Gd2Zr2O7, наряду с образованием дополнительных кислородных вакансий, происходит формирование акцепторных дефектов по механизму: ${\text{Be}}_{{{\text{Zr}}}}^{{'''}} + V_{{\text{O}}}^{'} \leftrightarrow \left\{ {{\text{Be}}_{{{\text{Zr}}}}^{{'''}} \cdot V_{{\text{O}}}^{'}} \right\}$. Взаимодействие этих дефектов структуры наиболее сильно влияет на электропроводность и энергию активации межзеренной границы.
Диэлектрическую проницаемость и тангенс угла диэлектрических потерь Gd2Zr2O7 и Gd2Zr1.9Be0.1O6.9 можно рассчитать из известных зависимостей [30]:
(5)
$\varepsilon * = \varepsilon '(\omega ) - j\varepsilon ''(\omega ) = \frac{1}{{j{{\varepsilon }_{0}}\omega }}\frac{l}{S}{{Z}^{{* - 1}}},$(7)
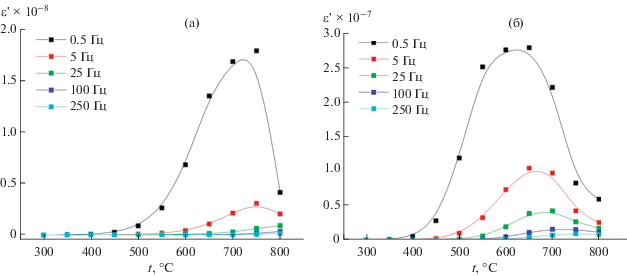
${\text{tg}}\delta {\text{(}}\omega {\text{) = }}\frac{{\varepsilon {\kern 1pt} ''(\omega )}}{{\varepsilon {\kern 1pt} '(\omega )}},$Рис. 7.
Температурные зависимости диэлектрической проницаемости для Gd2Zr2O7 (а) и Gd2Zr1.9Be0.1O6.9 (б) на низких частотах 0.5– 250 Гц.
Электрофизические свойства Gd2Zr1.9Be0.1O6.9 при высоких температурах. Исследование электрофизических свойств проводили для двух образцов Gd2Zr1.9Be0.1O6.9 – низкоплотного и высокоплотного. На рис. 8 представлены Аррениусовские зависимости общей проводимости газоплотной керамики Gd2Zr1.9Be0.1O6.9 в различных атмосферах, которые отличаются по парциальному давлению как кислорода, так и паров воды, оказывающих влияние на протонную проводимость. Согласно представленным данным, керамика Gd2Zr1.9Be0.1O6.9 обладает полупроводниковым типом проводимости, энергия активации попадает в диапазон 0.99 ± 0.05 эВ для всех рассмотренных атмосфер. Эти данные согласуются со значением энергии активации объемной проводимости, измеренной двухзондовым методом (табл. 2).
Рис. 8.
Аррениусовские зависимости общей проводимости Gd2Zr1.9Be0.1O6.9 в различных атмосферах; на вставках показаны примеры сопоставления проводимостей, измеренных в различных атмосферах.
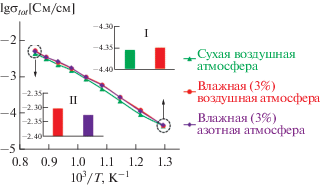
Протонный транспорт в оксидах возникает при их контакте с водородсодержащими компонентами газовой атмосферы. При этом концентрация протонов снижается с увеличением температуры вследствие экзотермической природы реакции гидратации. Поскольку для исследуемых материалов даже в условиях низких температур (500–600°С) не наблюдается существенных различий между значениями проводимости, измеренными в сухом (0.1 об. % Н2О) и влажном (3 об. % Н2О) воздухе (вставка I на рис. 8), можно утверждать, что в материалах отсутствует значимый протонного транспорт.
Электронная проводимость p-типа проявляется в материалах при высоких температурах в окислительных атмосферах, а n-типа – в восстановительных (т.е. при низких парциальных давлениях кислорода). При анализе данных на вставке II к рис. 8 не установлено сильных различий проводимости, измеренной во влажной воздушной и влажной азотной атмосферах, отличающихся парциальным давлением кислорода, даже при очень высоких температурах. Это указывает на отсутствие значимой электронной проводимости исследуемых образцов.
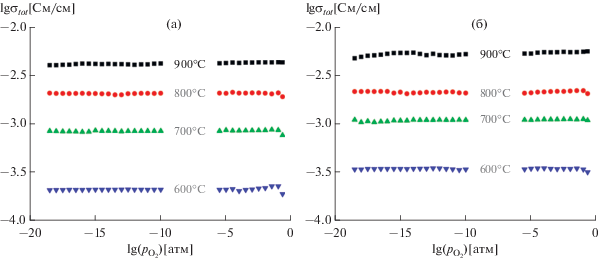
С целью оценки электролитических свойств была также измерена электропроводность керамики с разной продолжительностью отжига в зависимости от парциального давления кислорода (рис. 9). Сравнение общей проводимости образцов с разной продолжительностью отжига показывает чуть более высокую проводимость образца, полученного 4-часовым отжигом при 1500°С (рис. 9б), что, очевидно, связано с его более высокой плотностью. Полученные данные указывают на формирование широкой электролитической области, соответствующей ионной проводимости материалов. Величина ионной проводимости была определена на горизонтальном плато представленных зависимостей и составила 0.4 × 10–3, 0.95 × 10–3, 4.0 × 10–3 и 6.5 × 10–3 См/см при 600, 700, 800 и 900°С соответственно. Значения проводимости, измеренные при различных ${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$, находятся в полном соответствии с данными, представленными на вставке II к рис. 8.
Рис. 9.
Общая проводимость Gd2Zr1.9Be0.1O6.9 как функция парциального давления кислорода при различных температурах и различной продолжительности отжига: 5 мин (а), 4 ч (б).
Кислород-ионная проводимость плотного образца Gd2Zr1.9Be0.1O6.9 оказалась выше, чем у Gd1.55Li0.45Zr2O6.55 [33], Gd2(Zr0.9Mo0.1)2O7.2 [34], но ниже, чем у твердого раствора Gd1.7Li0.3Zr2O6.7 (~3.0 × 10–2 См/см при 800°С), полученного при легировании литием гадолиниевой подрешетки [15]. Однако, в отличие от Li-допированных материалов на основе Gd2Zr2O7, в Gd2Zr1.9Be0.1O6.9 отсутствуют значимые электронная и дырочная проводимости в широком интервале парциальных давлений кислорода. Это достаточно редкий случай реализации чисто кислород-ионной проводимости, которая сохраняется в широком интервале температур (600–900°С) и парциальных давлений кислорода, что является благоприятным фактором для применения полученных цирконатов в качестве электролитов электрохимических устройств, в которых потенциально возможно достижение высокой эффективности из-за отсутствия паразитного электронного тока [35].
ЗАКЛЮЧЕНИЕ
С использованием механической активации оксидов и последующего высокотемпературного отжига при температуре 1500°С в течение 5 мин и 4 ч синтезированы образцы Gd2Zr2– xBexO6.9 (x = = 0.1) со структурой пирохлора. Хотя проводимость Gd2Zr1.9Be0.1O6.9 оказалась ниже (4 × 10–3 См/см при 800°С), чем у Gd2Zr2O7, следует подчеркнуть, что у твердого раствора Gd2Zr1.9Be0.1O6.9 отсутствовала какая-либо значимая электронная или дырочная проводимость в широком интервале парциальных давлений кислорода и температур (600–900°С). Эта особенность, т.е. широкая область чисто ионной проводимости, выделяет его из ряда других материалов на основе Gd2Zr2O7, допированных малыми катионами [15, 33, 34]. Протонная проводимость у Gd2Zr1.9Be0.1O6.9 не найдена.
Температурная зависимость диэлектрической проницаемости на низких частотах позволяет предположить устойчивость этого материала в окислительных условиях при высоких температурах (до 800°С). Несомненным преимуществом метода механоактивации является получение достаточно плотного материала (гидростатическая плотность 88%) после кратковременного 5-минутного отжига при 1500°С.
Список литературы
Zhang J., Lenser C., Menzler N.H., Guillon O. Comparison of Solid Oxide Fuel Cell (SOFC) Electrolyte Materials for Operation at 500°C // Solid State Ionics. 2020. V. 344. P. 115138. https://doi.org/10.1016/j.ssi.2019.115138
Yeh T.-H., Hsu W.-C., Chou C.-C. Mechanical and Electrical Properties of ZrO2 (3Y) Doped with RENbO4 (RE = Yb, Er, Y, Dy, YNd, Sm, Nd) // J. Phys. IV. 2005. V. 128. P. 213–219.
Yoon S., Noh T., Kim W., Choi J., Lee H. Structural Parameters and Oxygen-Ion Conductivity of Y2O3–ZrO2 and MgO–ZrO2 at High Temperature // Ceram. Int. 2013. V. 39. P. 9247–9251. https://doi.org/10.1016/j.ceramint.2013.05.032
Xia C., Liu M. Microstructures, Conductivities, and Electrochemical Properties of Ce0.9Gd0.1O2 and GDC–Ni Anodes for Low-Temperature SOFCs // Solid State Ionics. 2002. V. 152. P. 423–430.
Li B., Wei X., Pan W. Improved Electrical Conductivity of Ce0.9Gd0.1O1.95 and Ce0.9Sm0.1O1.95 by Co-Doping // Int. J. Hydrogen Energy. 2020. V. 35. P. 3018–302. https://doi.org/10.1016/j.ijhydene.2009.07.002
Gao Z., Mogni L.V., Miller E.C., Railsback J.G., Barnett S.A. A Perspective on Low-Temperature Solid Oxide Fuel Cells // Energy Environ. Sci. 2016. V. 9. № 5. P. 1602–1644. https://doi.org/10.1039/C5EE03858H
Lee D.S., Kim W.S., Choi S.H., Kim J., Lee H.W., Lee J.H. Characterization of ZrO2 Co-Doped with Sc2O3 and CeO2 Electrolyte for the Application of Intermediate Temperature SOFCs // Solid State Ionics. 2005. V. 176. № 1–2. P. 33–39.
Yamamura H., Nishino H., Kakinuma K., Nomura K. Electrical Conductivity Anomaly around Fluorite-Pyrochlore Phase Boundary // Solid State Ionics. 2003. V. 158. № 3–4. P. 359–365.
Nishino H., Yamamura H., Arai K., Kakinuma K., Nomura K. Effect of Cation Radius Ratio and Unit Cell Free Volume on Oxide-Ion Conductivity in Oxide Systems with Pyrochlore-Type Composition // Ceram. Soc. Japan. 2004. V. 112. P. 541–546.
Shlyakhtina A.V., Pigalskiy K.S. Tolerance Factor as the Basic Criterion in Searching for Promising Oxygen-Ion and Proton Conductors among Ln2 –xDxM2O7 – δ (Ln = La–Lu; M= Sn, Ti, Zr, Hf; D = Sr, Ca, Mg; x = 0, 0.1) 3+/4+ Pyrochlores // Mater. Res. Bull. 2019. V. 116. P. 72–78. https://doi.org/10.1016/j.materresbull.2019.04.021
Shlyakhtina A.V., Shcherbakova L.G. New Solid Electrolytes of the Pyrochlore Family // Russ. J. Electrochem. 2012. № 1. P. 1–25. https://doi.org/10.1134/S1023193512010144
Liu Z.G., Ouyang J.H., Zhou Y., Xia X.L. Effect of Sm Substitution for Gd on the Electrical Conductivity of Fluorite-Type Gd2Zr2O7 // J. Power Sources. 2008. V. 185. № 2. P. 876–880.
Moreno K.J., Fuentes A.F., Garcia-Barriocanal J., Leon C., Santamaria J. Mechanochemical Synthesis and Ionic Conductivity in the Gd2(Sn1 –yZry)2O7 (0 ≤ y ≤ 1) Solid Solution // J. Solid State Chem. 2006. V. 179. № 1. P. 323–330.
Xia X.L., Gao S., Liu Z.G., Ouyang J.H. The Influence of Pentavalent Nb Substitution for Zr on Electrical Property of Oxide-Ion Conductor Gd2Zr2O7 // Electrochim. Acta. 2010. V. 55. № 19. P. 5301–5306. https://doi.org/10.1016/j.electacta.2010.04.086
Anokhina I.A., Animitsa I.E., Voronin V.I., Vykhodets V.B., Kurennykh T.E., Molchanova N.G., Vylkov A.I., Dedyukhin A.E., Zaikov Y.P. The Structure and Electrical Properties of Lithium Doped Pyrochlore Gd2Zr2O7 // Ceram. Int. 2021. V. 47. P. 1949–1961. https://doi.org/10.1016/j.ceramint.2020.09.025
Moreno K.J., Guevara-Liceaga M.A., Fuentes A.F., García-Barriocanal J., León C., Santamaría J. Room-Temperature Synthesis and Conductivity of the Pyrochlore Type Dy2(Ti1−yZry)2O7 (0 ≤ y ≤ 1) Solid Solution // J. Solid State Chem. 2006. V. 179. № 3. P. 928–934.
Shlyakhtina A.V., Abrantes J.C.C., Gomes E., Lyskov N.V., Konysheva E.Yu., Kharitonova E. P., Karyagina O.K., Kolbanev I.V., Shcherbakova L.G. Evolution of Oxygen-Ion and Proton Conductivity in Ca Doped Ln2Zr2O7 (Ln = Sm, Gd) Zirconates, Located Near Pyrochlore–Fluorite Phase Boundary // Materials. 2019. V. 12. № 15. P. 2452. https://doi.org/10.3390/ma12152452
Eurenius K.E.J., Ahlberg E., Knee C.S. Role of B-Site Ion on Proton Conduction in Acceptor-Doped Sm2B2O7-δ (B = Ti, Sn, Zr and Ce) Pyrochlores and C‑Type Compounds // J. Chem. Soc., Dalton Trans. 2011. V. 40. P. 3946–3954.
Sadykov V., Shlyakhtina A., Lyskov N., Sadovskaya E., Cherepanova S., Eremeev N., Kharitonova E. Oxygen Diffusion in Mg-Doped Sm and Gd Zirconates with Pyrochlore Structure // Ionics. 2020. V. 26. P. 4621–4633. https://doi.org/10.1007/s11581-020-03614-5
Горелов В.П., Балакирева В.Б., Воротников В.А. Протонная проводимость акцепторно допированного Sr2CeO4 // Неорган. материалы. 2019. Т. 55. № 11. С. 1235–1240. https://doi.org/10.1134/S0002337X19110058
Тарасова Н.А., Галишева А.О., Анимица И.Е. Проводимость новых сложных оксидов BaLaIn0.9M0.1O3.9 (M = Mg, Zn) со структурой Раддлесдена–Поппера // Неорган. материалы. 2021. Т. 57. С. 63–70.
Агаркова Е.А., Борик М.А., Кулебякин А.В., Курицина И.Е., Ломонова Е.Е., Милович Ф.О., Музина В.А., Осико В.В., Табачкова Н.Ю. Структурные, механические и транспортные свойства кристаллов оксида циркония, частично стабилизированного скандием и иттрием // Неорган. материалы. 2019. Т. 55. № 7. С. 793–798. https://doi.org/10.1134/S0020168519070021
Калинина Е.Г., Пикалова Е.Ю. Приготовление и свойства стабильных суспензий порошков ZRO2–Y2O3 с различным размером частиц для электрофоретического осаждения // Неорган. материалы. 2020. Т. 56. № 9. С. 993–1000. https://doi.org/10.1134/S0020168520090095
Морозова Л.В., Калинина М.В., Дроздова И.А., Шилова О.А. Приготовление и характеристика нанокерамики для твердооксидных топливных ячеек // Неорган. материалы. 2018. Т. 54. № 1. С. 85–93. https://doi.org/10.1134/S0020168518010107
Калева Г.М., Мосунов А.В., Садовская Н.В., Политова Е.Д. Фазообразование, микроструктура и ионная проводимость керамики (La,Sr)(Ga,Ge,Mg)O3 – δ// Неорган. материалы. 2017. Т. 53. № 7. С. 775–780. https://doi.org/10.1134/S002016851707010X
Стенина И.А., Ярославцев А.Б. Высокотемпературные и композиционные протонпроводящие электролиты // Неорган. материалы. 2017. Т. 53. № 4. С. 335–346. https://doi.org/10.1134/S002016851707010X
Тарасова Н.А., Анимица И.Е., Галишева А.О., Анохина И.А. Структура и электрические свойства нового Zn-замещенного кислородного проводника на основе BaLaInO4 // Журн. неорган. химии. 2021. Т. 66. С. 108–112.
Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н., Цивадзе А.Ю. Неорганическая химия элементов. Книга I. М.: Издательство Химия, 2001. 472 с.
Shlyakhtina A.V., Lyskov N.V., Konysheva E.Yu., Cher-nyak S.A., Kolbanev I.V., Vorobieva G.A., Shcherbakova L.G. Gas-Tight Proton-Conducting Nd2 −xCaxZr2O7 − δ (x = 0, 0.05) Ceramics // J. Solid State Electrochem. 2020. V. 24. № 7. P. 1475–1486.
Barsoukov E., Macdonald J.R. Impedance Spectroscopy Theory, Experiment, and Applications. Canada: Wiley, 2005. P. 129–204.
Shlyakhtina A.V., Pygalskiy K.S., Belov D. A., Lyskov N.V., Kharitonova E.P., Kolbanev I.V., Borunova A.B., Karyagina O.K., Sadovskaya E.M., Sadykov V.A., Eremeev N.F. Proton and Oxygen Ion Conductivity in the Pyrochlore/Fluorite Family of Ln2 – xCaxScMO7 – δ (Ln = = La, Sm, Ho, Yb; M = Nb, Ta; x = 0, 0.05, 0.1) Niobates and Tantalates // J. Chem. Soc., Dalton Trans. 2018. V. 47. № 7. P. 2376–2392. https://doi.org/10.1039/C7DT03912C
Shlyakhtina A.V., Lyskov N.V., Shchegolikhin A.N., Kolbanev I.V., Chernyak S.A., Konysheva E. Yu. Valence State of Europium and Samarium in Ln2Hf2O7 (Ln = Eu, Sm) Based in Oxygen – Ion Conductors // Ceram. Int. 2021https://doi.org/10.1016/j.ceramint.2021.06.099
Liu Z.-G., Gao S., Ouyang J.-H., Xia X.-L. Influence of MoO3 Doping on Structure and Electrical Conductivity of Defect Fluorite-Type Gd2Zr2O7 // J. Alloys Compd. 2010. V. 506. № 2. P. 868–871. https://doi.org/10.1016/j.jallcom.2010.07.101
Anokhina I.A., Animitsa I.E., Buzina A.F., Voronin V.I., Vykhodets V.B., Kurennykh T.E., Zaikov Y.P. Synthesis, Structure and Electrical Properties of Li+-Doped Pyrochlore Gd2Zr2O7 // Chim. Techno Acta. 2020. V. 7. № 2. P. 51–60. https://doi.org/10.15826/chimtech.2020.7.2.02
Pikalova E.Yu., Kalinina E.A. Solid Oxide Fuel Cells Based on Ceramic Membranes with Mixed Conductivity: Improving Efficiency // Russ. Chem. Rev. 2021. V. 90. № 6. P. 703–749.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы