Неорганические материалы, 2021, T. 57, № 2, стр. 197-202
Физико-химические превращения кристаллогидрата хлорида железа(III) в СВЧ-полях и образование гетита
О. Н. Каныгина 1, А. Г. Четверикова 1, М. М. Филяк 1, *, А. А. Юдин 1
1 Оренбургский государственный университет
460018 Оренбург, пр. Победы, 13, Россия
* E-mail: filyak@mail.ru
Поступила в редакцию 02.03.2020
После доработки 14.09.2020
Принята к публикации 15.09.2020
Аннотация
Изучены физико-химические превращения частиц моноклинного кристаллогидрата хлорида железа(III) в СВЧ-полях. СВЧ-активацию проводили на воздухе в два этапа: сначала в течение 5 мин при мощности 300 Вт, затем 2 мин при 400 Вт. Оптико-физическими методами обнаружено, что изменились цвет, форма частиц и качество их поверхности. Рентгенофазовым методом установлено, что прошли интенсивные фазовые превращения. В результате протекания серии химических реакций кристаллогидрат [Fe(H2O)6]Cl3 превратился в новую фазу – гетит α-FeO(OH); более 15% объема частиц аморфизировалось.
ВВЕДЕНИЕ
Известно, что минералы железа являются активными сорбентами микроэлементов в почвах. Обладая переменным зарядом поверхности, зависящим от рН, они способны поглощать микроэлементы как в катионной, так и в анионной формах. В частности, гетит является эффективным сорбентом мышьяка As(V) и его соединений, прочно удерживая их на своей поверхности. Процессы структурных превращений в соединениях переходного 3d-металла (железа), которые могут быть инициированы высокочастотными электромагнитными полями, изучены слабо, несмотря на то что железо является одним из самых важных металлов в природных структурах.
Микроволновое облучение является перспективной альтернативой традиционному нагреву при осуществлении процессов спекания, дегидратации, разложения солей и гидроксидов, синтеза многокомпонентных соединений. СВЧ-излучение в десятки и сотни раз ускоряет многие химические реакции и фазовые превращения, снижая в большинстве случаев температуры этих процессов и, что особенно важно, исключая загрязнение “рабочих” компонентов примесями.
Авторы исследования [1] утверждают, что молекулы воды, содержащиеся в элементарных ячейках кристаллогидратов солей металлов, обладающие значительным дипольным моментом, способны к переориентации и вращению при интенсивном поглощении микроволнового излучения. В частности, разложение кристаллогидратов d-элементов в микроволновом поле с образованием оксидов начинается до удаления из системы всей содержащейся в ней воды.
Общая теория взаимодействия высокочастотного электромагнитного поля с веществом в основном разработана [1–3]. Тем не менее, физико-химические процессы, сопровождающие микроволновую обработку конкретных химических соединений, сложно прогнозировать из-за изменения их диэлектрической проницаемости, теплопроводности, а также химических реакций и фазовых превращений, протекающих в процессе СВЧ-обработки. В настоящее время СВЧ-излучение широко применяют как способ повышения реакционной способности конденсированных сред и скорости твердофазных превращений [4].
С этой точки зрения представляет несомненный теоретический и практический интерес поведение кристаллогидрата хлорида железа при СВЧ-активации, которое практически не изучено.
Новизна и оригинальность работы заключаются в изучении возможности получения гетита путем СВЧ-активации частиц кристаллогидрата хлорида железа(III).
Известно [5], что в определенных условиях в результате протекания химических реакций с участием молекул воды во внутренней координационной сфере возможно образование оксигидроксида железа(III) α-FeO(OH) (гетита). При рассмотрении топохимических реакций, протекающих в кристалле хлорного железа под воздействием микроволнового излучения, выявлено несколько промежуточных состояний, приводящих к образованию гетита [6].
1. Димеризация хлорного железа с последующим разложением димеров:
при этом вероятны процессы полимеризации с образованием димеров, содержащих оксомостик:
На третьей стадии возможно образование димеров, соединенных двумя μ-OH-группами
или димеризация с помощью оксомостика
Полученный димер способен разлагаться с образованием метагидроксида железа FeO(OH); разложение сопровождается выделением хлороводорода
Разлагаться также способен и димер, содержащий оксомостик, возможное образование которого описано на второй стадии
2. Мономерный гидролиз с возникновением равновесий между Fe3+, FeOH2+, Fe(OH)2+, FeO+, протекание которого более вероятно в исследуемых условиях ввиду температуры системы более 100°C и сильнокислой среды [7]:
При дальнейшем микроволновом воздействии полученный гетит в процессе дегидратации способен к превращению в лепидокрокит и магнетит [8].
Процессы структурообразования, протекающие в порошках кристаллогидрата хлорида железа под действием СВЧ-излучения, происходят на трех масштабных уровнях: миллиметровом, микронном и наноразмерном. Изучение влияния воздействия микроволнового излучения на степень и динамику структурных изменений в порошках кристаллогидрата хлорида железа на каждом из уровней требует системного подхода, включающего методы рентгенофазового анализа, фрактальной параметризации и колориметрической градации.
Цель работы – выявление закономерностей химических и фазовых превращений в частицах хлоргидрата железа(III) при микроволновом воздействии и исследование полученных структур.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования выбран сертифицированный порошок кристаллогидрата хлорида железа(III) FeCl3 · 6H2O квалификации “х. ч.” с размерами частиц менее 20 мкм. Порошковые пробы подвергали СВЧ-активации с частотой 2.45 ГГц в два этапа: в течение 5 мин при мощности излучения 300 Вт и далее 2 мин при 400 Вт. Источником поля служила микроволновая система с магнетроном [9]. Образцы размещали слоем толщиной 5 мм на плоской подложке, установленной на вращающейся пластине для усреднения условий нагрева. Пробы до и после двух этапов СВЧ-облучения обозначены соответственно А0, А1 и А2. Температуру образцов проб А1 и А2 измеряли с помощью инфракрасного пирометра Pyro-1 (рабочий диапазон 20–900°С, погрешность измерения ±2°С). В процессе микроволновой обработки она составляла соответственно 130 ± 10 и 140 ± 10°С. Средние значения эффективных диаметров частиц оценивали с помощью анализатора размеров объектов типа Photocolor Compact.
Первичная информация о структурных превращениях в кристаллогидрате хлорида железа(III) получена путем рентгенофазового анализа проб А0, А1 и А2. Рентгенографические исследования образцов проводили на минидифрактометре МД10 в режиме фокусировки Брегга–Брентано в монохроматизированном излучении CuKα. Дифракционный спектр снимали в интервале углов от 16° до 120° с шагом 0.05° по шкале 2θ с записью результатов в цифровом формате. Среднеквадратичное отклонение угловой координаты одного и того же дифракционного пика составило не более 0.02° по шкале 2θ. Для обработки данных использовали программу LookPDF, с помощью которой проводили расшифровку дифрактограмм на основе данных картотеки ICDD.
Размеры областей когерентного рассеяния (ОКР) в химически чистых веществах, которые служат маркерами тонкоструктурных изменений, происходящих в кристаллитах, оценивали по уширению рентгеновских максимумов в соответствии с современными методиками, предложенными в работе [10], по формуле
(1)
${{D}_{{hkl}}} = {{0.94\lambda } \mathord{\left/ {\vphantom {{0.94\lambda } {(\sigma \cos {{\theta }_{{hkl}}})}}} \right. \kern-0em} {(\sigma \cos {{\theta }_{{hkl}}})}},$Для математической обработки дифрактограмм, разрешения перекрывающихся рефлексов и точного определения их положения в работе использовали графическую интерпретацию вейвлет-преобразования – линии локальных экстремумов (скелетоны) [11]. На них расположены центры тяжести истинных рефлексов. Идентификация дифракционных пиков с помощью вейвлет-коэффициентов, согласно [12], продемонстрировала высокую чувствительность алгоритма.
Анализ микроструктуры частиц порошка осуществляли оптико-математическими методами, включая мультифракционную параметризацию, подробно описанную в работах [13, 14]. Привлечение таких методов исследования конденсированных сред дало значительный объем дополнительной информации о процессах структурообразования, позволило выявить и количественно сравнить визуально неразличимые структурные изменения.
Мультифрактальные параметры – фрактальную размерность D, показатель меры заполнения пространства фрактальной структурой; лакунарность Λ как меру несплошности (пористости) и параметр однородности fq – рассчитывали по стандартным методикам [15, 16].
Изменения, происходящие на миллиметровом уровне, анализировали путем оценки вариации цветовых параметров [17, 18] системы CIE – L*a*b*, отражающих вклад четырех основных цветов для оксидов железа: красноту, зеленость, синеву и желтизну. Система зарекомендовала себя в качестве информативной при анализе цвета почв, содержащих (гидр)оксиды железа [19].
Разработанная и апробированная авторами [20] методика позволила выразить цвет исследуемого вещества одним числом – “параметром красноцветности” R(a*b*), определяемым по эмпирическому уравнению
(2)
$R(a * ,b * ) = a{\text{*}}\frac{{\sqrt {\left( {{{a}^{{*2}}} + {{b}^{{*2}}}} \right)} }}{{7b{\text{*}}}}.$Параметры +а* и –а* характеризуют красноту и зеленость объекта, +b* и –b* – соответственно желтизну и синеву [20].
Изображения поверхностей проб получали с помощью типового микроскопа с цифровым окуляром высокого разрешения в диапазоне увеличений от 10 до 1000 крат. Значения, необходимые для оценки параметров а* и b*, определяли с помощью программы ImageJ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В процессе исследования обнаружено, что при СВЧ-активации частиц кристаллогидрата хлорида железа(III) произошли значительные изменения в их фазовом и химическом составах, морфологии. Потеря массы составила более 45%. Рядом с облучаемой пробой поместили вату, пропитанную аммиаком; “дымок” хлорида аммония подтвердил выделение HCl как одного из продуктов реакции на первых двух стадиях.
В результате воздействия высокочастотного электромагнитного поля в веществе произошли фазовые превращения. Дифрактограммы порошков FeCl3 · 6H2O до и после СВЧ-обработок приведены на рис. 1. Визуальный сравнительный анализ дифрактограмм показал наличие фазовых изменений, произошедших во время воздействия микроволнового излучения. Анализ рентгенограмм с помощью традиционных методик позволил однозначно идентифицировать около 60% пиков при удовлетворительном согласии с данными картотеки ICDD. В результате воздействия СВЧ-поля доля аморфных фаз, определенная по соотношению интенсивностей гало и ближайшей характеристической линии, увеличилась с 35% (проба А0) до 50–52% в пробах А1 и А2, возможно, за счет образования “желтого стекла” при кристаллизации расплавленного хлорного железа.
Рис. 1.
Совмещенные фрагменты дифрактограмм порошков хлоргидрата железа до и после воздействия СВЧ-поля в диапазоне углов 16° ≤ 2θ ≤ 70°.
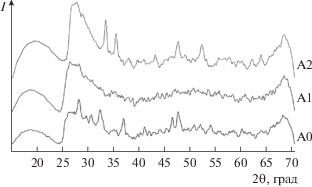
Выявить все дифракционные максимумы из общего спектра, уточнить их положение и разрешить мультиплетные пики удалось в процессе вейвлет-анализа дифрактограмм. Результат вейвлет-преобразования рентгенограмм (рис. 1) в скелетоны с идентификацией пиков, принадлежащих конкретным фазам, проиллюстрирован рис. 2.
Рис. 2.
Скелетоны, полученные в результате вейвлет-преобразования дифрактограмм проб А0 (а), А1 (б), А2 (в).
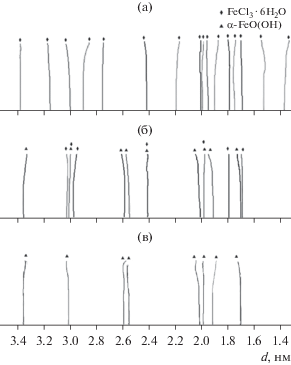
На рис. 3а видно, что в пробе А0 все 16 линий принадлежали одной кристаллической фазе – кристаллогидрату хлорида железа FeCl3 · 6H2O с молекулярной массой 270.3 а. е. м. Температуры плавления и кипения этой фазы соответственно равны 306 и 315°С. Элементарная моноклинная ячейка имела следующие параметры, нм: а = = 1.1183, b = 0.7029 и с = 0.5952, угол β = 100.47°.
Рис. 3.
Изображение частиц порошка FeCl3 · 6H2O с размерами частиц менее 20 мкм: а – в исходном состоянии (А0); б, в – после СВЧ-активации (А1, А2).

В пробе А1 (рис. 2б) наблюдали две кристаллических фазы. Некоторые дифракционные максимумы, например с d = 0.3013, 0.2426 и 0.1998 нм, можно отнести одновременно к обеим фазам: α-FeO(OH) и FeCl3 · 6H2O. Объемная доля кристаллогидрата хлорида железа составила менее 40%. Больше 60% объема кристаллических частиц отнесено к метагидроксиду железа – гетиту α-FeO(OH), имеющему ромбическую элементарную ячейку с параметрами, нм: а = 0.4643, b = = 0.9941 и с = 0.3032 [21]. Средние размеры ОКР в частицах всех проб составили около 7 нм, что коррелирует с результатами, представленными в работе [22].
На первом этапе объемное поглощение энергии при СВЧ-активации способствовало разрушению димера, в результате чего происходили частичная дегидратация вещества и выделение газообразного хлороводорода по всему реакционному объему. Образовалось большое число зародышей, состав которых можно выразить формулой FeOx(OH)3 – 2x, где x < 1. При x = 1 указанная фаза перешла в α‑FeO(OH) (гетит), вкрапления которого были видны после окончания выделения HCl.
Частичное фазовое превращение FeCl3 · 6H2O в метагидроксид α-FeO(OH) могло быть обусловлено способностью хлорного железа к поглощению уходящей кристаллизационной воды (сродство к “расплытию”), а также тем, что при данном режиме СВЧ-обработки молекулы кристаллизационной воды были активированы не полностью.
Второй этап СВЧ-воздействия обеспечил подвод необходимого количества энергии для завершения физико-химических процессов в порошковом слое. В итоге кристаллическая часть пробы А2 оказалась однофазной (рис. 1). Стерические проблемы были преодолены благодаря тонкому слою мелкодисперсных частиц.
Результаты рентгенофазового анализа указали на высокую вероятность изменений морфологических параметров частиц, обусловленных фазовыми превращениями.
Морфологические изменения в частицах FeCl3 ⋅ ⋅ 6H2O, прошедшие под воздействием СВЧ-излучения, подтверждены методами фрактального анализа их оптических изображений.
Расчет фрактальных параметров – фрактальной размерности D, параметров лакунарности Λ и однородности fq – проводили, используя функции мультифрактального спектра и спектра обобщенных размерностей Реньи [13, 14]. Значения фрактальных параметров приведены в табл. 1.
Таблица 1.
Фрактальные параметры порошковых проб
| Образец | D | Λ | fq |
|---|---|---|---|
| А0 | 2.9295 | 0.0201 | 0.3387 |
| А1 | 2.9116 | 0.0926 | 1.3428 |
| А2 | 2.9838 | 0.2134 | 1.1530 |
После СВЧ-воздействия излучения мощностью 300 Вт в течение 5 мин фрактальная размерность изображения пробы А1 практически не изменилась, а А2 – значительно выросла, т.е. поверхность частиц стала более развитой, извилистой. Лакунарность выросла после 1-го этапа примерно в 5 раз, а после 2-го – в 10 раз. Это говорит об образовании рыхлой структуры. Извилистая поверхность (параметр D) и пористая структура (параметр Λ) указывают на потенциально высокие адсорбционные свойства гетита, полученного путем микроволнового нагрева.
Параметр однородности fq достиг максимальных значений для пробы А1, незначительно снизившись для А2. Следовательно, после СВЧ-воздействия частицы стали морфологически более однородными.
Исходный порошок был представлен полупрозрачными полиэдрическими (равноосными) частицами со средним размером менее 20 мкм, часть из которых коалесцировала (рис. 3а). После первого этапа воздействия СВЧ-излучения наблюдали около 10% этих же частиц. Дополнительно появились коричневые ограненные частицы размерами менее 10 мкм, расположенные, как правило, в центрах полупрозрачных глобул размерами более 100 мкм, образовавших практически непрерывную матрицу на фоне прозрачной стеклофазы (рис. 3б). На рис. 3в показаны землистые кристаллы бурого цвета со средними эффективными диаметрами около 5 мкм, образовавшиеся на втором этапе микроволнового нагрева.
На миллиметровом уровне фазовые превращения проявились количественными изменениями цветовых параметров частиц порошка FeCl3 · 6H2O. Результаты сравнительного колориметрического анализа приведены в табл. 2. Установлено соотношение между краснотой и желтизной (гидр)оксидов железа. Светлота L* после СВЧ-активации практически не меняется, поскольку кристаллы гидрохлорида железа и гетита имеют близкие значения коэффициентов отражения. Параметр красноцветности R(a*b*) снижается почти в 2 раза: красно-охристый цвет гидрохлорида железа поменялся на бурый гетита. Определяющим цветовым параметром являлась желтизна: чем больше ее значение, тем выше содержание гетита в смеси [20].
ЗАКЛЮЧЕНИЕ
На первом этапе воздействия СВЧ-поля мощностью 300 Вт на воздухе в частицах порошка кристаллогидрата хлорида железа(III) произошли существенные фазовые и морфологические превращения:
во-первых, более 60% исходной фазы превратилось в новую фазу – гетит α-FeO(OH), доля аморфных фаз увеличилась на 15%;
во-вторых, изменились цвет, форма частиц и качество их поверхности.
На втором этапе СВЧ-активации (мощность 400 Вт, 2 мин) фазовые превращения кристаллогидрата хлорида железа в гетит завершились.
В процессе СВЧ-активации частиц кристаллогидрата хлорида железа(III), по-видимому, ключевую роль сыграли диполи воды, входящие в решетку; при этом способность молекул воды к переориентации проявилась при умеренной температуре, когда вещество активно поглощало энергию микроволнового излучения.
Авторы считают полученные результаты полезными для поиска оптимальных режимов СВЧ-воздействия на тонкодисперсные порошки кристаллогидрата хлорида железа(III) с целью повышения выхода гетита, не содержащего посторонних примесей.
Список литературы
Ванецев А.С., Третьяков Ю.Д. Микроволновой синтез индивидуальных и многокомпонентных оксидов // Успехи химии. 2007. Т. 76. № 5. С. 435–453.
Николаенко И.В., Штин А.П., Швейкин Г.П. Получение оксидов титана и циркония путем взаимодействия СВЧ излучения с их гидроксидами // Тез. докл. XXII Междунар. конф. “Воздействие интенсивных потоков энергии на вещество” Эльбрус (1–6 марта). 2007. С. 64–65.
Швейкин Г.П., Николаенко И.В. Способ получения ультра-нанодисперсного порошка оксида переходного металла или смеси оксидов переходных металлов: Патент № 2337791, 10 ноября 2008.
Жужгов А.В., Криворучко О.П., Ларина Т.В., Ищенко А.В., Исупова Л.А. Синтез 2D-высокодисперсных алюмокобальтовых оксигидроксидных соединений на основе продуктов СВЧ-активации кристаллического гиббсита // Неорган. материалы. 2019. Т. 55. № 4. С. 411–420. https://doi.org/10.1134/S0002337X1904016X
Сорокина И.Д., Дресвянников А.Ф., Юсупов Р.А. Математическое моделирование равновесий в системах Fe(II), ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$−H2O−OH– (I); Fe(II), ${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$−H2O−OH−, NH3 (II); Fe(II)−Al(III)−H2O−OH− (III) для оптимизации синтеза гетероядерных соединений // Вестн. Казанского технол. ун-та. 2008. № 6. С. 1–24.
Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. М.: Химия, 2000. 480 с.
Arden T.V. The Hydrolysis of Ferric Iron in Sulphate Solution // J. Chem. Soc. 1951. P. 350–363. https://doi.org/10.1039/JR9510000350
Rigneau R., Bellon K., Zahreddine I., Stuerga D. Microwave Flash-Synthesis of Iron Oxides Nanoparticles // Eur. Phys. J.: Appl Phys. 1999. V. 7. № 1. P. 41–43. https://doi.org/10.1051/epjap:1999197
Четверикова А.Г., Каныгина О.Н., Филяк М.М., Огерчук С.А. Структурно-морфологические особенности монтмориллонита, обработанного высокочастотным микроволновым полем // Физика и химия обработки материалов. 2019. № 3. С. 5–12. https://doi.org/10.30791/0015-3214-2019-3-5-12
Бузимов А.Ю., Кульков С.Н., Gömze L.A., Géber R., Kocserha I. Влияние механической обработки на структуру и свойства природного цеолита // Перспективные материалы. 2018. № 4. С. 31–39. https://doi.org/10.30791/1028-978X-2018-4-31-39
Каныгина О.Н., Филяк М.М., Четверикова А.Г. Фазовые превращения в природной глине, обусловленные воздействием микроволнового излучения в воздушной и влажной средах // Неорган. материалы. 2018. Т. 54. № 9. С. 955–960.
Gregoire J.M., Dale D.B., Van Dover R.B. A Wavelet Transform Algorithm for Peak Detection and Application to Powder X-ray Diffraction Data // Rev. Sci. Instrum. 2011. V. 82. № 1. P. 015105–0151013. https://doi.org/10.1063/1.3505103
Chetverikova A.G., Filyak M.M., Kanygina O.N. Evolution of Phase Morphology in Dispersed Clay Systems under the Microwave Irradiation // Cerâmica. 2018. V. 64. № 371. P. 367–372. https://doi.org/10.1590/0366-69132018643712354
Каныгина О.Н., Четверикова А.Г., Филяк М.М., Огерчук А.А. Фрактальный подход к анализу поверхностей керамических материалов // Стекло и керамика. 2015. № 12. С. 11–16.
Мандельброт Б. Фрактальная геометрия природы: пер. с англ. М.: Ин-т компьютерных исслед., 2002. 656 с.
Встовский Г.В. Элементы информационной физики. М.: МГИУ, 2002. 260 с.
Четверикова А.Г., Каныгина О.Н. Метод колориметрической градации в RGB-пространстве как способ регистрации структурных изменений в керамическом материале // Измерительная техника. 2016. № 6. С. 44–47.
Khoiroh L.M., Al-Chabib M.N., Prasetyo A. Synthesis and Characterization of Hematite (α-Fe2O3) from Lathe Waste Using Co-precipitation -calcination Method // IOP Conf. Ser.: Mater. Sci. Eng. 2019. V. 578. Article 012004.2019 IOP https://doi.org/10.1088/1757-899X/578/1/012004
Водяницкий Ю.Н., Васильев А.А., Кожева А.В., Сатаев Э.Ф., Власов М.Н. Влияние железосодержащих пигментов на цвет почв на аллювиальных отложениях Средне-Камской равнины // Почвоведение. 2007. № 3. С. 318–330.
Водяницкий Ю.Н., Кириллова Н.П. Использование системы CIE-L*a*b* для характеристики цвета почв // Почвоведение. 2016. № 11. С. 1337–1346.
Cornell R.M., Schwertmann U. The Iron Oxides: Structure, Properties, Reactions, Occurrence and Uses. Weinheim: Wiley, 2003. 703 p.
Manceau A., Drits V.A. Local Structure of Ferrihydrite and Feroxyhite by Exafs Spectroscopy // Clay Miner. 1993. V. 28. P. 165–184. https://doi.org/10.1180/claymin.1993.028.2.01
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


