Неорганические материалы, 2021, T. 57, № 2, стр. 173-180
Малостадийный синтез ксерогелей PdO/TiO2 и Pd/TiO2
А. Б. Шишмаков 1, Ю. В. Микушина 1, *, О. В. Корякова 1
1 Институт органического синтеза им. И.Я. Постовского УрО Российской академии наук
620137 Екатеринбург, ул. С. Ковалевской, 22/20, Россия
* E-mail: Mikushina@ios.uran.ru
Поступила в редакцию 17.03.2020
После доработки 16.09.2020
Принята к публикации 17.09.2020
Аннотация
Разработана малостадийная методика синтеза ксерогелей PdO/TiO2 и Pd/TiO2 (0.1–2.0 мас. % Pd), включающая гидролиз раствора азотнокислого палладия в тетрабутоксититане в атмосфере паров водного раствора уксусной кислоты, сушку и прокаливание материала при 800–870°С. Методами РФА и электронной микроскопии установлено, что в прокаленных при 800°С ксерогелях палладий содержится в виде частиц PdO с размером ≤3–5 нм. Дисперсный оксид палладия(II) покрывает поверхность кристаллитов рутила и заполняет поры между ними. Установлено, что размер частиц PdO во всем исследованном диапазоне концентраций Pd(NO3)2 одинаков. В материале, прокаленном при 870°С, палладий представлен частицами металла диаметром 55–420 нм. Установлено, что рост концентрации нитрата палладия в тетрабутоксититане приводит к увеличению среднего размера частиц Pd.
ВВЕДЕНИЕ
Палладиевые катализаторы на оксидных носителях давно и успешно применяются в процессах органического синтеза [1–4] и в экологическом катализе [5–10].
Активность катализаторов в конкретной реакции зачастую зависит от того, в каком химическом состоянии находится палладий – металлическом или оксидном [11]. Так, в катализаторах нейтрализации выхлопных газов автомобилей скорость реакций окисления NO в NO2 и дальнейшего превращения последнего в нитраты и нитриты в условиях окислительной среды [12]; восстановления NO2 метаном в присутствии кислорода [13]; разложения оксидов азота на N2 и O2 [14, 15] значительно выше на металлическом палладии. Оксид палладия(II), согласно литературным данным, проявляет повышенную относительно металла активность в реакциях окисления углеводородов с более сложным, чем у метана, строением [15, 16]. В [10] отмечена высокая каталитическая активность PdO/TiO2–SiO2 в реакции фотокаталитического окисления СО. Следует отметить, что присутствие атомов палладия на поверхности носителей в двух валентных состояниях не оказывает влияния на каталитическую активность материала в реакциях гидрирования углеводородов, так как оксид палладия(II) быстро восстанавливается до металла благодаря взаимодействию с газообразным водородом из реакционной смеси [17].
Традиционный синтез Pd/MxOy-катализаторов осуществляется по следующей схеме: синтез носителя (MxOy), его пропитка прекурсором металла, восстановление металла и прокаливание (при необходимости) [6, 18, 19].
Пропитка является важной стадией процесса, во многом определяющей потребительские свойства палладийсодержащего материала. Известно несколько традиционных методов пропитки. Метод окунания, когда носитель погружают в пропиточный раствор и выдерживают некоторое время при перемешивании [19]. Недостаток метода – существенные потери дорогостоящего активного компонента. Метод орошения (опрыскивания) – носитель опрыскивают раствором соединения металла. В этом случае отсутствуют потери пропиточного раствора. Метод достаточно экономичен, безотходен, но имеются трудности с получением однородного катализатора. Метод пропитки носителя на “полное впитывание” (“по влагоемкости”) или с упариванием раствора [1, 3, 7]. Для пропитки используется небольшой избыток раствора, который затем упаривается. Метод практически безотходен. Однако возможно неравномерное распределение активного компонента в носителе при возрастании концентрации раствора по мере упаривания [20]. В целом, “пропиточные” методы достаточно трудоемки и продолжительны.
Альтернативой может выступать предложенная в [21] технически простая методика нанесения палладия на оксидные носители, позволяющая в одну стадию при невысокой температуре за короткий промежуток времени получать материалы с мелкодисперсным металлом. Основная идея разработанного подхода заключалась в одновременном соосаждении оксида палладия(II) и оксида-носителя из соответствующих растворов. Сходным образом в [22] осуществлен одностадийный синтез Pd/ZrO2(TiO2) с использованием воды в суб- и сверхкритическом состояниях.
Ранее в [23] авторами была показана возможность синтеза ксерогеля Pd/TiO2 по “беспропиточной” методике, включающей следующие стадии: гидролиз раствора азотнокислого палладия в тетрабутоксититане (ТБТ) в атмосфере паров водного раствора уксусной кислоты, сушку и прокаливание. В настоящем исследовании авторы продолжили изучение влияния условий синтеза на характеристики получаемого палладийсодержащего материала.
Цель работы заключалась в гидролизе ТБТ (в атмосфере паров CH3COOH + H2O) с предварительно растворенным в нем нитратом палладия, формировании ксерогеля Pd/TiO2 и исследовании влияния концентрации Pd(NO3)2 в ТБТ и температуры прокаливания материала на состояние палладия в титан-оксидной матрице.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гидролиз ТБТ осуществляли в эксикаторе объемом 3000 см3 при температуре 20°С. Уксуснокислая атмосфера в эксикаторе обеспечивалась 10 мл 50%-ного водного раствора уксусной кислоты. ТБТ или его смесь с Pd(NO3)2 ⋅ 2H2O равномерно наливали в чашки Петри слоем в 2 мм и помещали в эксикатор.
Для синтеза палладийсодержащих образцов 1–4 проводили растворение в 5 мл ТБТ (Sigma-Aldrich, titanium(IV)butoxide, reagent grade, 97%) навески Pd(NO3)2 ⋅ 2H2O (Fluka Analytical, palladium(II) nitrate dihydrate) массой 0.003, 0.01, 0.03 и 0.06 г соответственно.
Образцы выдерживали в эксикаторе 1 сут, сушили на воздухе 1 сут и в сушильном шкафу 3 сут при 90°С. Далее образцы загружали в кварцевый реактор, нагревали (скорость нагрева 10°С/мин) до: 400°С (образец 3(400)), 600°С (образец 3(600)), 800°С (образцы 1(800)–4(800)) и прокаливали в токе воздуха (скорость подачи 0.075 м3/ч) в течение 1 ч при заданной температуре. Образцы 1(870)–4(870) прокаливали аналогичным образом в течение 2 ч при 870°С.
Содержание PdO в образцах 1(800)–4(800) составило: 0.1 (0.0014), 0.4 (0.0046), 1.2 (0.0138) и 2.3 мас. % (0.0276 г) соответственно. Содержание металлического палладия в образцах 1(870)–4(870) составило: 0.1 (0.0012), 0.34 (0.004), 1.0 (0.012) и 2.0 мас. % (0.024 г) соответственно. Содержание палладия в ксерогелях диоксида титана соответствует его количеству, введенному при синтезе.
Индивидуальный TiO2 синтезировали аналогично (без добавления соли палладия). Прокаливание осуществляли при 400°С (образец TiO2(400)), 600°С (образец TiO2(600)) и 800°С (образец TiO2(800)).
ИК-спектры регистрировали на ИК-Фурье-спектрометре Spectrum One фирмы Perkin Elmer в диапазоне частот 4000–400 см–1 в виде твердых порошков с использованием приставки диффузного отражения (DRA). Обработку и расчет интенсивностей спектров проводили с использованием специальных программ прикладного программного обеспечения спектрометра.
Рентгенофазовый анализ (РФА) образцов выполняли на дифрактометре Rigaku D-MAX-2200V (Япония) с вертикальным гониометром в интервале 2θ = 10°–75°, скорость сканирования 1 град/мин. Использовали CuKα-излучение (40 кВ, 30 мА, λ = 1.54184 Å). Для автоматического поиска применяли базу данных PDF-2.
Электронные фотографии ксерогелей были сняты на электронном микроскопе GSM-5900LV (Jeol, Япония).
Модельную реакцию распада пероксида водорода на ксерогелях осуществляли в термостатируемом реакторе, снабженном обратным холодильником, при перемешивании реакционной смеси посредством барботажа воздухом (скорость подачи 6.2 л/ч) при 50°С с точностью термостатирования ±0.2°C. Реакцию проводили в течение 60 мин при начальной концентрации Н2О2 0.33 моль/л и навеске образца 0.1 г.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После выдержки в эксикаторе в чашках (1–4) обнаружены прозрачные коричневые пленки, отслаивающиеся от дна и покрывающиеся сетью трещин на воздухе. Прокаленные пленки 3(600) и 1(800)–4(800) теряли прозрачность и приобретали серую окраску с коричневым оттенком разной интенсивности. У образцов 1(870)–4(870) окраска была серебристой. Индивидуальные ксерогели TiO2(600) и TiO2(800) – бесцветные стекловидные. Окраска образцов 3(400) и TiO2(400) – черная, что, очевидно, указывает на неполное выгорание карбонизированного органического вещества.
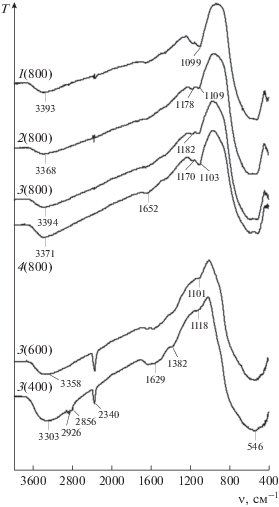
ИК-спектры (рис. 1) всех ксерогелей содержали интенсивную полосу поглощения 546 см–1 – валентные колебания Ti–O-связей, широкое поглощение в области 3000–4000 см–1 – валентные колебания гидроксильных групп и воды, полосу поглощения 1629–1652 см–1 – деформационные колебания H2O, полосу сложной формы с максимумом 1099–1118 см–1 – колебания связи поверхностный катион–кислород в диоксиде титана [24]. Кроме перечисленных, в спектрах образцов 3(400) и 3(600) присутствовала полоса поглощения с максимумом 2340 см–1 – сорбированный углекислый газ. Его присутствие, очевидно, вызвано сгоранием карбонизированного органического вещества.
Прокаливание при 400°С не приводило к полному выжиганию органики, о чем свидетельствуют полосы поглощения 2926, 2856 см–1 (валентные) и 1382 см–1 (деформационные колебания групп CH2– и –СН3) в спектре образца 3(400).
Наибольшее содержание воды наблюдается в образце 3(400) (рис. 1). Наличие в спектрах образцов 1(800)–4(800) полос поглощения воды является, очевидно, результатом сорбции атмосферной влаги вследствие гигроскопичности образцов.
Полосу с максимумом 1099–1118 см–1 связывают с возникновением колебаний связи поверхностный катион–кислород различной прочности, ее положение и интенсивность зависят от дисперсности частиц диоксида титана [25]. Ее большая интенсивность в спектрах 1(800)–4(800), по-видимому, свидетельствует об образовании прочносвязанных агрегатов частиц TiO2.
РФА (рис. 2) фиксирует присутствие оксида палладия(II) в образцах 2(800)–4(800). Интенсивность рефлекса PdO растет с ростом содержания соли палладия на стадии смешения с ТБТ. Диоксид титана представлен в образцах 1(800) и 2(800) в виде чистой фазы рутила; в образцах 3(800) и 4(800) – рутила с незначительной примесью анатаза (~3%). Отсутствие рефлекса PdO на дифрактограмме образца 1(800), очевидно, вызвано его малой концентрацией в исходной смеси.
Рис. 2.
Фрагменты дифрактограмм прокаленных при 400, 600 и 800°С палладийсодержащих ксерогелей и TiO2(800).
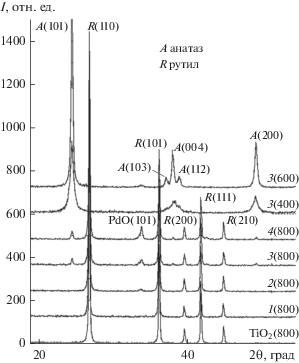
В том случае, когда прокаливание ксерогеля происходит в интервале 400–600°С (образцы 3(400) и 3(600)), TiO2 представлен только анатазом.
Температура разложения нитрата палладия до PdO составляет 350°С. На дифрактограмме образца 3(400) пик оксида палладия(II) отсутствует, т.е. весь оксид палладия(II) рентгеноаморфен. Интенсивность рефлекса PdO на дифрактограмме образца 3(600) близка к таковой для образца 2(800), что соответствует содержанию PdO в ксерогеле 0.4 мас. %. Таким образом, при температуре 600°С ~2/3 оксида палладия(II) остается в рентгеноаморфном состоянии.
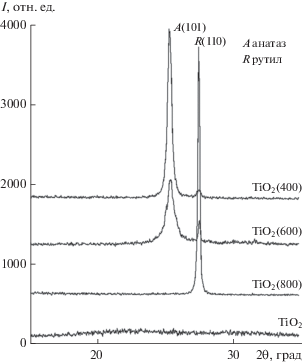
С целью определения влияния, оказываемого палладиевым компонентом на фазовый состав диоксида титана, был проведен РФА индивидуального TiO2 (рис. 3). С ростом температуры обработки TiO2 наблюдается обычная последовательность смены фаз: аморфная фаза–анатаз–рутил.
Результаты РФА прокаленных ксерогелей TiO2 (рис. 3) и образца 3 (рис. 2) сопоставлены в табл. 1. Из приведенных данных можно заключить, что присутствие палладиевого компонента в ксерогелях, прокаленных при 400–600°С, способствует стабилизации фазы анатаза, препятствуя его переходу в рутил.
Таблица 1.
Содержание фазы анатаза в прокаленных при 400, 600 и 800°С ксерогелях 3 и TiO2
| Температура прокаливания, °С | Анатаз, % | |
|---|---|---|
| 3 | TiO2 | |
| 400 | 100 | 96 |
| 600 | 100 | 89 |
| 800 | 3 | 0 |
Поверхность образцов 1(800)–4(800) имеет вид “булыжной мостовой” (рис. 4). Кристаллиты диоксида титана покрыты тонкодисперсным порошком PdO. На основании данных электронной микроскопии установлено, что максимальный размер частиц PdO составляет ~3–5 нм. При этом визуально, различие между ксерогелями с разным содержанием PdO не обнаружено. По-видимому, наблюдаемая в интервале 400-600°С стабилизация фазы анатаза обусловлена отложением рентгеноаморфной высокодисперсной фазы PdO в порах между кристаллитами, что создает препятствие для их роста.
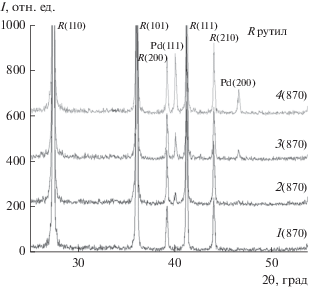
После двухчасового прокаливания при 870°С на дифрактограммах ксерогелей исчезает пик PdO, вместо него появляются рефлексы, соответствующие отражениям 111 и 200 металлического палладия (рис. 5). Интенсивность указанных рефлексов увеличивается с ростом содержания металла в материале.
Оценка среднего размера частиц палладия проведена с использованием уравнения Дебая–Шеррера:
Электронно-микроскопическое исследование образцов 1(870)–4(870) выявило, что все ксерогели имеют идентичную морфологию поверхности. Отличие заключается только в количестве частиц палладия (растет в ряду 1(870)–4(870)) в титан-оксидной матрице. В качестве примера на рис. 6 приведены микрофотографии образца 3(870) с разной степенью увеличения. Частицы металла расположены в матрице достаточно равномерно (рис. 6а). Они локализуются на поверхности кристаллитов TiO2 и в порах между ними (рис. 6б). Частицы палладия обладают хорошо различимыми кристаллическими гранями. Значительная доля частиц представлена сростками кристаллов (рис. 6в).
На основании данных электронной микроскопии был проведен расчет распределения частиц палладия по размерам (рис. 7). В образцах 1(870)–4(870) ~80% частиц палладия (основная фракция) имеют размеры: 163 ± 33, 163 ± 33, 193 ± 33 и 210 ± ± 50 нм соответственно. При этом в образцах 1(870) и 2(870) не наблюдается присутствия частиц металла >420 нм, а в образцах 3(870) и 4(870) – <55 нм. Таким образом, рост концентрации соли палладия в ТБТ приводит к увеличению доли частиц палладия крупной фракции в синтезированном материале.
Рис. 7.
Распределение по размерам частиц палладия в образцах 1(870) (1), 2(870) (2), 3(870) (3), 4(870) (4).
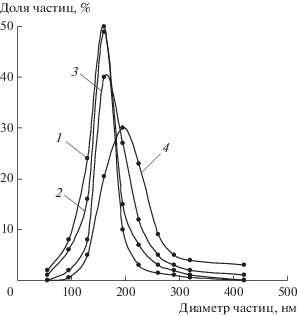
Следует отметить, что в случае, когда в качестве матрицы выступает бинарный оксид TiO2–SiO2, в порах которого карбонизат полностью не выгорает, формируются значительно более мелкие частицы палладия (основная фракция 36–99 нм) [25].
Размер частиц палладия, рассчитанный по формуле Дебая–Шеррера, оказался значительно меньше размера, определенного с помощью электронной микроскопии. Это возможно в следующих случаях: если отдельная частица, наблюдаемая в электронном микроскопе, состоит из нескольких областей когерентного рассеяния (ОКР), т.е. является сростком монокристаллов, имеющих размер ОКР; если границы частиц сильно искажены, поскольку ОКР соответствует внутренней (упорядоченной) области частицы; при двойниковании частиц. Кроме того, формула Дебая–Шеррера неприменима для кристаллов, размеры которых больше 100 нм, а в ксерогелях 1(870)–4(870) такие кристаллы доминируют.
Палладийсодержащие ксерогели были протестированы в модельной реакции распада пероксида водорода. Полученные результаты для образцов 1(800)–4(800) приведены на рис. 8. Зависимость конверсии Н2О2 от содержания PdO в титан-оксидной матрице прямо пропорциональная. Это указывает на то, что размеры наначастиц PdO (их фракционный состав) во всех ксерогелях близки.
Рис. 8.
Зависимость конверсии пероксида водорода от содержания оксида палладия(II) в ксерогелях 1(800) (1), 2(800) (2), 3(800) (3), 4(800) (4).
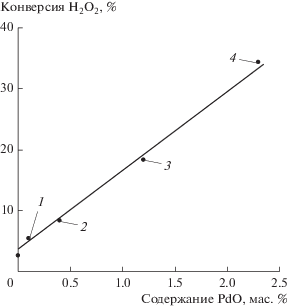
Металлический палладий (образцы 1(870)–4(870)) активности в модельном процессе не проявляет.
ЗАКЛЮЧЕНИЕ
Разработана малостадийная методика синтеза ксерогелей PdO/TiO2 и Pd/TiO2. Установлено, что прокаливание материала при температуре 800°С приводит к формированию в титан-оксидной матрице частиц PdO. Во всем исследованном интервале (0.1–2.3 мас. % PdO) диаметр частиц оксида палладия(II) ≤3–5 нм. Температура прокаливания 870°С позволяет получать материал, содержащий частицы металлического палладия диаметром 55–420 нм. Варьируя концентрацию нитрата палладия в ТБТ, можно регулировать размер частиц металла.
Список литературы
Smirnova N.S., Shlyapin D.A., Protasova O.V., Trenikhin M.V., Gulyaeva T.I., Gerasimov E.Y., Kibis L.S., Shitova N.B., Kochubey D.I., Tsyrul’nikov P.G. Investigation of the State of Active Component in Pd/Ga2O3 and Pd/In2O3 Catalysts of Liquid-Phase Hydrogenation of Acetylene into Ethylene // Chem. Sustainable Dev. 2013. V. 21. № 1. P. 91–100.
Okhlopkova L.B., Kerzhentsev M.A., Ismagilov Z.R. Capillary Microreactor with a Catalytic Coating Based on Mesoporous Titanium Dioxide for the Selective Hydrogenation of 2-methyl-3-butyn-2-ol // Kinet. Catal. 2016. V. 57. № 4. P. 497–503.
Simonov M.N., Gulaeva Yu.A., Prosvirin I.P., Chetyrin I.A., Simakova I.L. One-Pot Pentanoic Acid into n‑Nonane Conversion over Palladium Supported on Zirconia // J. Siberian Federal Univ. Chem. 2013. V. 6. № 4. P. 331–343.
Lavorato C., Argurio P., Molinari R. TiO2 and Pd/TiO2 as Photocatalysts for Hydrogenation of Ketones and Perspective of Membrane Application // Int. J. Adv. Res. Chem. Sci. (IJARCS). 2019. V. 6. № 1. P. 33–41. https://doi.org/10.20431/2349-0403.0601005
Zhong J.B., Lu Y., Jiang W.D., Meng Q.M., He X.Y., Li J.Z., Chen Y.Q. Characterization and Photocatalytic Property of Pd/TiO2 with the Oxidation of Gaseous Benzene // J. Hazardous Mater. 2009. V. 168. № 2–3. P. 1632–1635. https://doi.org/10.1016/j.jhazmat.2009.02.158
Слептерев А.А., Цырульников П.Г. Палладиевые катализаторы на оксиде алюминия, модифицированном оксидами РЗЭ // Омский науч. вестн. Хим. науки. 2013. № 1(117). С. 51.
Kenzhin R.M., Vedyagin A.A., Volodin A.M., Stoyanovskii V.O., Slavinskaya E.M., Plyusnin P.E., Shubin Y.V., Mishakov I.V. Effect of Carrier Phase Conversions on the Thermal Stability of Alumina Catalysts with Low Palladium Content // Chem. Sustainable Dev. 2017. V. 25. № 1. P. 25–33.
Selishcheva D.S., Kolobov N.S., Bukhtiyarov A.V., Gerasimov E.Y., Gubanov A.I., Kozlov D.V. Deposition of Pd Nanoparticles on TiO2 Using a Pd(acac)2 Precursor for Photocatalytic Oxidation of CO under UV-LED Irradiation // Appl. Catal. B: Environmental. 2018. V. 235. P. 214–224. https://doi.org/10.1016/j.apcatb.2018.04.074
García-Zaleta D.S., Montes De Oca-Valero J.A., Torres-Huerta A.M., Domínguez-Crespo M.A., Dorantes-Rosales H.J., López-González R., García-Murillo A. Effect of Pd Addition on the Nanostructure and Properties of Pd/TiO2 Catalysts for the Photocatalytic Degradation of 4-Chlorophenol // J. Nano Res. 2014. V. 28. P. 9–20. https://doi.org/10.4028/www.scientific.net/JNanoR.28.9
Karakas G., Yetisemiyen P. Room Temperature Photocatalytic Oxidation of Carbon Monoxide over Pd/TiO2–SiO2 Catalysts // Top. Catal. 2013. V. 56. P. 1883–1891. https://doi.org/10.1007/s11244-013-0124-0
Smirnov M.Yu., Klembovskii I.O., Kalinkin A.V., Bukhtiyarov V.I. An XPS Study of the Interaction of a Palladium Foil with NO2 // Kinet. Catal. 2018. V. 59. № 6. P. 786–791. https://doi.org/10.1134/S0023158418060150
Mirkelamoglu B., Liu M., Ozkan U.S. Dual-Catalyst Aftertreatment of Lean-Burn Engine Exhaust // Catal. Today. 2010. V. 151. № 3. P. 386–394. https://doi.org/10.1016/j.cattod.2009.12.014
Oktar N., Mitome J., Holmgreen E.M., Ozkan U.S. Catalytic Reduction of N2O and NO2 With Methane over Sol–Gel Palladium-based Catalysts // J. Mol. Catal. A: Chem. 2006. V. 259. № 1–2. P. 171–182. https://doi.org/10.1016/j.molcata.2006.06.024
Lin S., Yang L., Yang X., Zhou R. Redox Properties and Metal-Support Interaction of Pd/Ce0.67Zr0.33O2–Al2O3 Catalyst for CO, HC and NOx Elimination // Appl. Surf. Sci. 2014. V. 305. P. 642–649. https://doi.org/10.1016/j.apsusc.2014.03.153
Lin S., Yang X., Yang L., Zhou R. Three-Way Catalytic Performance of a Pd/Ce0.67Zr0.33O2–Al2O3 Catalyst for Automotive Emission Control: the Role of Pretreatment Gas // RSC Adv. 2015. V. 5. № 47. P. 37353–37359. https://doi.org/10.1039/C5RA02797G
Mirkelamoglu B., Liu M., Ozkan U.S. Dual-Catalyst Aftertreatment of Lean-Burn Engine Exhaust // Catal. Today. 2010. V. 151. № 3–4. P. 386–394. https://doi.org/10.1016/j.cattod.2009.12.014
Аксенов И.А. Наноструктурированные катализаторы селективного гидрирования ацетиленовых и диеновых углеводородов: Автореф. дис. … к. х. н. М. 2014. 22 с.
Paul S., Islam Md.M., Islam Sk.M. Suzuki-Miyaura Reaction by Heterogeneously Supported Pd in Water: Recent Studies // RSC Adv. 2015. V. 5. № 53. P. 42193–42221. https://doi.org/10.1039/C4RA17308B
Еременко Н.К., Образцова И.И., Сименюк Г.Ю., Еременко А.Н. Палладиевые катализаторы на оксидных матрицах для гидрирования нитробензола // Ползуновский вестн. 2014. № 3. С. 91–95.
Билалов Т.Р., Гумеров Ф.М., Габитов Ф.Р., Харлампиди Х.Э., Федоров Г.И., Сагдеев А.А., Яруллин Р.С., Якушев И.А. Синтез и регенерация палладиевых катализаторов с использованием сверхкритического диоксида углерода // Сверхкритические флюиды: теория и практика. 2009. Т. 4. № 2. С. 34–52.
Бумагин Н.А., Ливанцов М.В., Алексеев Р.С., Белов Д.С., Веселов И.С. PdO–CeO2, PdO–TiO2 и PdO–Fe3O4 – многоразовые гетерогенные катализаторы реакций кросс-сочетания в водных средах // Научный альманах. Хим. науки. 2015. № 12-2(14). С. 362–367. https://doi.org/10.17117/na.2015.12.02.362
Галкин А.А., Туракулова А.О., Кузнецова Н.Н., Лунин В.В. Физико-химические и каталитические свойства нанокристаллических гетерогенных катализаторов состава Pd(RH)/ZrO2(TiO2), приготовленных в суб- и сверхкритической воде // Вестн. МГУ. Сер. 2. Химия. 2001. Т. 42. № 5. С. 305–308.
Shishmakov A.B., Mikushina Yu.V., Petrov L.A. Three-Step Synthesis of Pd0/TiO2 // Russ. Chem. Bull. 2019. V. 68. № 7. P. 1451–1453.
Shishmakov A.B., Koryakova O.V., Mikushina Yu.V., Petrov L.A. Synthesis of Porous Zirconium and Titanium Dioxides by Hydrolysis of Tetrabutoxyzirconium (Tetrabutoxytitanium) with Atmospheric Moisture in the Absence of Acid-Base Catalysts with the Use of Cellulose and Activated Charcoal as Matrices // Russ. J. Inorg. Chem. 2014. T. 59. № 9. C. 979–985. https://doi.org/10.1134/S0036023614090198
Shishmakov A.B., Mikushina Yu.V., Koryakova O.V., Petrov L.A. Synthesis of Pd(0) Nanoparticles in TiO2–SiO2 Xerogel // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 864–869. https://doi.org/10.1134/S0036023619070155
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы