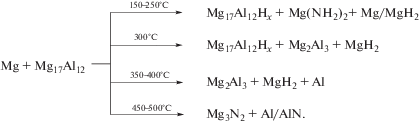Неорганические материалы, 2021, T. 57, № 3, стр. 250-256
Гидрирование эвтектического сплава системы Mg–Al
В. Н. Фокин 1, *, П. В. Фурсиков 1, Э. Э. Фокина 1, Б. П. Тарасов 1
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. Академика Семенова, 1, Россия
* E-mail: fvn@icp.ac.ru
Поступила в редакцию 10.07.2020
После доработки 21.10.2020
Принята к публикации 22.10.2020
Аннотация
Для определения оптимальных условий гидрирования микрокристаллического эвтектического сплава состава Mg69Al31 (смесь магния с интерметаллическим соединением γ-Mg17Al12) исследовано взаимодействие 200-микронного порошка сплава с водородом и аммиаком в интервале температур 100–500°C. Установлен состав продуктов реакций и показано, что использование водорода позволяет получить дигидрид магния при температуре 420°C, а гидрирование эвтектического сплава аммиаком в качестве гидрирующего агента происходит с образованием MgH2 и твердого раствора водорода в интерметаллиде Mg17Al12 при 250°C. Водородоемкость продуктов гидрирования водородом составляет 4.4 мас. %.
ВВЕДЕНИЕ
Неослабевающий интерес к соединениям и сплавам системы Mg–Al, подтвержденный рядом новых публикаций [1, 2], обусловлен необходимостью и возможностью решения реальных проблем, мешающих практическому использованию магния и его сплавов как рабочих веществ в металлогидридных аккумуляторах [3–7].
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Установленное в ряде работ [8–10] эффективное влияние алюминия в сплавах Mg–Al на скорость гидрирования магния при взаимодействии сплавов с водородом или при дегидрировании MgH2 объясняют наличием интерметаллического соединения Mg17Al12 (т. н. γ-фазы) на поверхности магния [8] или его образованием в процессе сплавления компонентов. Таким же эффектом обладает и гидридная фаза интерметаллида, получающаяся при гидрировании композитов системы Mg–Al. Повышение скорости гидрирования Mg объясняют синергетическим эффектом каталитической активности интерметаллида и наличия дефектов на поверхности магния, образующихся при приготовлении композита в шаровой мельнице [10].
На основании данных по исследованию методов и способов улучшения водородсорбционных характеристик магния и его сплавов, приведенных в различных обзорных публикациях [1–3, 11–13], можно сделать вывод о наибольшей перспективности метода, связанного с уменьшением размера зерна магния до субмикронного и наноразмерного диапазонов [3, 6, 13]. Такое состояние достигается, например, в эвтектических сплавах, которые обладают преимущественно высокодисперсной микроструктурой.
В системе Mg–Al эвтектический сплав имеет состав Mg70Al30 (Mg69.8Al30.2 по данным [14]) и представляет собой, согласно РФА, смесь двух фаз: α-Mg с гексагональной структурой (a = 3.2091 Å, c = 5.2102 Å) и γ-Mg17Al12 с кубической структурой (a = 10.5711 Å) [15].
Эвтектический сплав Mg69Al31, полученный методом быстрого затвердевания, упорядочивающим микроструктуру и, тем самым, улучшающим условия абсорбции–десорбции водорода, состоял из кубической фазы γ-Mg17Al12 и гексагональной фазы твердого раствора Mg〈Al〉 [16]. Такой сплав в атмосфере водорода под давлением 3 МПа и при 400°C поглощает (по данным десорбции) 3 мас. % водорода, а в продуктах этой реакции установлено присутствие, наряду с исходной фазой γ-Mg17Al12, MgH2 и β-Mg2Al3. Отмечают бóльшую водородоемкость сплава (3 мас. %), приготовленного методом быстрого затвердевания, по сравнению со сплавом, полученным методом плавки (1.2 мас. %) [16].
В работе [17] по исследованию условий гидрирования 200-микронного порошка интерметаллида γ-Mg17Al12 показано, что прямое гидрирование происходит при 390°C, но сопровождается его гидрогенолизом с образованием смеси гидрида магния с алюминием, содержащей 4 мас. % водорода. Было сделано предположение о влиянии кристалличности порошка на результаты гидрирования, что в свою очередь давало основание для продолжения оптимизации условий гидрирования сплавов в системе Mg–Al в направлении уменьшения размера зерен интерметаллида. Это возможно при использовании в качестве объектов исследования сплавов эвтектического состава и модифицированных методами пластической деформации.
Ранее [18, 19] показано, что использование аммиака вместо водорода для гидрирования металлов, сплавов и интерметаллидов в ряде случаев позволяет провести процесс образования гидридных фаз в более мягких условиях с сохранением исходной металлической решетки.
Цель данной работы – разработка оптимальных условий гидрирования микрокристаллической эвтектической смеси магния с интерметаллическим соединением γ-Mg17Al12 как водородом, так и аммиаком.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные соединения. Образцы эвтектического сплава Mg70Al30 готовили сплавлением шихты из металлов чистотой 99.95 (Mg) и 99.99% (Al) в электродуговой печи с нерасходуемым вольфрамовым электродом под давлением очищенного аргона 0.2 МПа.
Для обработки водородом и аммиаком готовили порошок сплава измельчением королька в металлической ступке с последующим отсевом фракции с размером частиц 200 мкм. Удельная поверхность (Sуд) такого порошка составляла 0.08 м2/г.
Гидрирование интерметаллида проводили высокочистым водородом (99.999%), выделяемым при нагревании металлогидридного аккумулятора на основе интерметаллического соединения LaNi5.
Хлорид аммония квалификации “х. ч.” сушили вакуумированием в течение 9 ч при 150°C. Осушенный металлическим натрием NH3 имел чистоту 99.99%.
Методика эксперимента. Гидрирование порошка сплава водородом и аммиаком осуществляли в контейнере из нержавеющей стали, помещенном в реактор-автоклав лабораторной установки высокого давления емкостью 60 мл.
Перед гидрированием водородом сплав (масса 2–3 г) подвергали предварительной дегазации в вакууме ~1 Па при ≥390°C в течение 1 ч и при этой же температуре автоклав заполняли водородом под давлением 3.0–4.5 МПа. После окончания гидрирования автоклав с образцом для установления равновесия выдерживали в течение нескольких часов при комнатной температуре.
Взаимодействие порошка сплава с аммиаком исследовали при начальном давлении аммиака 0.6–0.8 МПа при использовании NH4Cl (10 мас. % от количества интерметаллида) в качестве активатора процесса в контейнере из нержавеющей стали, помещенном в реактор-автоклав установки высокого давления емкостью 60 мл. Навеску приготовленной смеси порошков (0.8–1.0 г) вакуумировали до давления ~0.13 Па в течение 30 мин при комнатной температуре, в реактор подавали аммиак и оставляли на 30 мин. Далее реактор нагревали до заданной температуры, выдерживали в течение 3 ч, охлаждали до ~20°C и снова нагревали. Так как в ходе взаимодействия происходит увеличение давления в системе (до 1.5 МПа), окончание процесса фиксировали по прекращению изменения давления. После проведения нескольких циклов нагревание–охлаждение аммиак сбрасывали в буферную емкость, продукты реакции выгружали в инертной атмосфере и анализировали.
Удаление NH4Cl из продуктов взаимодействия осуществляли обработкой абсолютным этиловым спиртом при перемешивании смеси в течение 1 ч при комнатной температуре (процедуру повторяли дважды).
Методы анализа. Аттестация микроструктуры сплавов проводилась с использованием сканирующей электронной микроскопии (СЭМ) и рентгеноспектрального микроанализа (РСМА) на микроскопе Tescan Vega TS 5130MM (CanScan MV2300), оснащенном энергодисперсионным спектрометром INCA Energy 450 с полупроводниковым Si(Li)-детектором INCA Penra FETx3 фирмы Oxford Instruments. Рентгенофазовый анализ образцов проводили методом порошка на дифрактометре АДП-1 (CuKα-излучение). Полнопрофильная аппроксимация рентгенограмм осуществлялась методом ЛеБейла (Le Bail). Погрешность определения параметров кристаллических решеток не превышала 0.005 Å.
Термическую устойчивость продуктов реакций исследовали на установке синхронного ТГ–ДТА/ДСК-анализа STA 409 Luxx фирмы Netzsch.
Удельную поверхность образцов определяли по величине низкотемпературной адсорбции криптона после удаления из твердой фазы летучих продуктов в вакууме 1.3 × 10–3 Па при 300°C в течение 5 ч и рассчитывали методом Брунауэра–Эммета–Теллера. Погрешность определения ±10%.
Состав образующихся фаз устанавливали методами волюмометрического и химического анализов. Количество водорода и азота определяли на CHNS/O-элементном анализаторе Vario Micro cube Elementar GmbH. Анализ на содержание хлора выполняли турбидиметрическим методом.
Давление водорода измеряли образцовым манометром МО класса точности 0.4.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
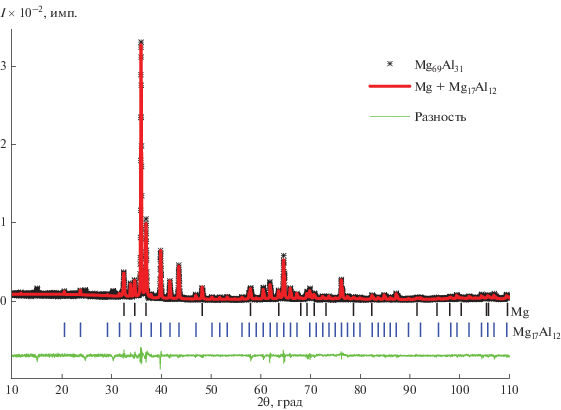
По данным химического анализа, выплавленный сплав по составу (Mg69Al31) близок к эвтектическому (Mg70Al30) и, согласно РФА, является двухфазным. На рентгенограмме порошка сплава (рис. 1) присутствуют отражения интерметаллида Mg17Al12 (γ-фаза на фазовой диаграмме системы Mg–Al [14]) с периодом кристаллической решетки a = 10.5876 Å и гексагональной фазы магния (a = 3.1926 Å, c = 5.1879 Å). Значение периода решетки интерметаллида Mg17Al12 входит в установленный из-за наличия у интерметаллида области гомогенности (55–62.5 ат. % Mg) интервал значений параметра а (a = 10.4691–10.5916 Å) [14, 20].
Рис. 1.
Рентгенограмма (черные крестики) порошка сплава Mg69Al31 и теоретическая рентгенограмма (красная кривая) смеси кристаллических фаз: ОЦК, отвечающей фазе Mg17Al12 со структурным типом α-Mn, с пр. гр. $I{\bar {4}3}m$ (№ 217) и ГЦК с пр. гр. P63/mmc (№ 194), отвечающей фазе Mg (синими и черными вертикальными штрихами показаны положения брэгговских рефлексов фаз Mg17Al12 и Mg соответственно с относительной интенсивностью не менее 0.5%, внизу приведен разностный спектр).
Согласно данным СЭМ и РСМА, проведенного по точкам и площадям, а также элементному картированию, сплав Mg69Al31 имеет преимущественно однородные микроструктуру и элементный состав.
Сплав дегазировали при 390°C в течение 1 ч, а затем гидрировали при этой же температуре в течение 10 ч (5 циклов по 2 ч). В отличие от полученных ранее данных по прямому гидрированию интерметаллида [17], в указанных условиях эвтектический сплав с водородом не взаимодействует.
Повышение температуры дегазации и синтеза до 420°C (2 цикла по 2 ч) приводит к поглощению сплавом водорода без индукционного периода с образованием смеси гидрида магния (a = 4.517 Å, c = 3.021 Å) и интерметаллида Mg2Al3 (а = 28.230 Å), содержащей 4.4 мас. % водорода. Можно считать, что в указанных условиях реакция гидрирования проходит полностью, так как дальнейшее увеличение числа циклов гидрирования до 5 (по 2 ч) не изменило не только состав продуктов, но и количество содержащегося в них водорода.
В ряде работ, например [21, 22], указывалось, что использование аммиака вместо водорода для гидрирования металлов, сплавов и интерметаллических соединений позволяет провести процесс образования гидридных фаз, как правило, в более мягких условиях.
В табл. 1 приведены условия и результаты обработки сплава Mg69Al31 аммиаком. Продолжительность всех синтезов составляла 30 ч. Из приведенных в табл. 1 данных видно сильное влияние температуры на направление реакции и, соответственно, на состав образующихся продуктов.
Таблица 1.
Условия и результаты взаимодействия сплава Mg69Al31 с аммиаком
| Образец | Условия синтеза | Продукты взаимодействия | ||||
|---|---|---|---|---|---|---|
| t, °C | ${{p}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}},$ МПа | фазовый состав | a, Å | c, Å | Sуд, м2/г | |
| 1 | 100 | 0.82 | Mg17Al12Hx | 10.5262 | – | 27.0 |
| Mg | 3.2190 | 5.1879 | ||||
| 2 | 150 | 0.89 | Mg17Al12Hx | 10.5214 | – | 29.0 |
| Mg(NH2)2 | 10.37 | 20.10 | ||||
| Mg | 3.2066 | 5.1780 | ||||
| 3 | 200 | 0.86 | Mg17Al12Hx | 10.5256 | – | 30.8 |
| Mg(NH2)2 | 10.37 | 20.15 | ||||
| α-MgH2 | 4.510 | 2.9911 | ||||
| 4 | 250 | 0.84 | Mg17Al12Hx | 10.5571 | – | 40.0 |
| α-MgH2 | 4.499 | 3.0101 | ||||
| Mg(NH2)2* | ||||||
| 5 | 300 | 0.86 | Mg17Al12Hx | 10.5755 | – | 11.2 |
| α-MgH2 | 4.5133 | 2.9944 | ||||
| Mg2Al3 | 28.2235 | – | ||||
| 6 | 350 | 0.84 | α-MgH2 | 4.5230 | 3.0210 | 10.4 |
| Mg2Al3 | 28.220 | – | ||||
| Al | 4.0515 | – | ||||
| 7 | 400 | 0.82 | α-MgH2 | 4.5200 | 3.0190 | 9.3 |
| Mg2Al3 | 28.230 | – | ||||
| Al | 4.0513 | – | ||||
| 8 | 450 | 0.86 | Al | 4.0505 | – | 4.5 |
| Mg3N2 | 9.9660 | – | ||||
| 9 | 500 | 0.79 | Al | 4.0528 | – | 1.6 |
| Mg3N2 | 9.9635 | – | ||||
| AlN | 3.130 | 4.945 | ||||
Обработка сплава аммиаком при 100°C (образец 1) сопровождается образованием твердого раствора водорода в интерметаллиде Mg17Al12H0.1. Металлический магний при этой температуре в реакцию не вступает.
Как и следовало ожидать, реакция сопровождается значительным (до 27 м2/г) повышением удельной поверхности смеси порошков, что свидетельствует о мелкодисперсном состоянии продукта. Вероятно, повышение удельной поверхности связано с присутствием в реакционной среде хлорида аммония, для которого характерна обратимая реакция разложения на NH3 и HCl. Выделяющийся хлористый водород, взаимодействуя с поверхностными атомами металлов или их оксидов, разрушает оксидную пленку, обнажая свежие слои металлической фазы, содержащие микропоры и трещины. Последние и дают прирост величины поверхности. К тому же под действием водорода начинают разрушаться частицы интерметаллида, происходит процесс гидрирования с образованием новой фазы с расширенной решеткой – твердого раствора водорода, обладающего большей поверхностью по сравнению с металлической фазой.
Следует отметить, что при температуре взаимодействия в интервале 100–300°C (образцы 1–5) в продуктах реакции сохраняется присутствие твердого раствора водорода в интерметаллиде с незначительным возрастанием параметра кристаллической решетки.
В продуктах реакции, проведенной при 150°C (образец 2), появляется амид магния Mg(NH2)2 вследствие реакции магния с аммиаком. Образование амида, по данным РФА, происходит и при температуре реакции 200°C (образец 3), но при дальнейшем повышении температуры до 250°C (образец 4) на дифрактограмме продуктов отмечаются только самые сильные рефлексы амида, что свидетельствует о следовых количествах амида вследствие его разложения при этой температуре.
Повышение температуры взаимодействия от 100 до 200°C (образец 3) оказывается достаточным для образования гидрида α-MgH2, который сохраняется в качестве продукта реакции вплоть до 400°C (образец 7). Согласно данным дифференциального термического анализа, температура разложения синтезированного дигидрида магния составляет 440°C.
Для взаимодействия сплава с аммиаком при 300°C (образец 5) характерны не только образование твердого раствора водорода в Mg17Al12, но и его разложение по схеме (1) с появлением в уже значительных количествах, согласно данным РФА, не взаимодействующего с аммиаком в данных условиях интерметаллида Mg2Al3
(1)
$\begin{gathered} {\text{M}}{{{\text{g}}}_{{{\text{17}}}}}{\text{A}}{{{\text{l}}}_{{{\text{12}}}}} + {\text{N}}{{{\text{H}}}_{3}} \to {\text{M}}{{{\text{g}}}_{{{\text{17}}}}}{\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{x}} + \\ + \,\,{\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{A}}{{{\text{l}}}_{{\text{3}}}} + {\text{Mg}}{{{\text{H}}}_{2}}. \\ \end{gathered} $Образование этого соединения характерно для реакции прямого гидрирования интерметаллида Mg17Al12 водородом при 300°C [20]. Существование интерметаллида Mg2Al3 отмечено также в продуктах реакций, проведенных при 350 и 400°C (образцы 6 и 7). Но в таких температурных условиях происходит разложение Mg2Al3 по схеме (2) , как и отмечалось в работе [20], на гидрид магния и металлический алюминий, что и подтверждено данными РФА
(2)
${\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{A}}{{{\text{l}}}_{{\text{3}}}} + {\text{N}}{{{\text{H}}}_{3}} \to {\text{Mg}}{{{\text{H}}}_{{\text{2}}}} + {\text{Al}}.$Таким образом, взаимодействие сплава с аммиаком при 350–400°C (образцы 6, 7) приводит к образованию смеси из трех продуктов: дигидрида магния, интерметаллида Mg2Al3 и алюминия. Повышение температуры до 450–500°C (образцы 8, 9) изменяет направление реакции и, соответственно, состав ее продуктов – гидрид магния преобразуется при разложении в нитрид. К тому же при 500°C (образец 9) образуется нитрид алюминия.
На основании полученных данных о зависимости направления реакций взаимодействия сплава Mg69Al31 с аммиаком от температуры и о составе полученных продуктов составлена общая схема гидрирования, дающая более наглядное представление о результатах исследования
Указанная смена состава продуктов реакции при повышении температуры согласуется с изменением удельной поверхности: если при температурах взаимодействия 100–200°C (образцы 1–3) эта величина была практически постоянной и составляла ~30 м2/г, то для продуктов, полученных при температурах 300–400°C (образцы 5–7), Sуд сильно уменьшается (практически до ~10 м2/г), а при образовании нитрида магния (образцы 8, 9) – падает до 2–4 м2/г. Вероятно, определенный вклад в уменьшение удельной поверхности могут вносить происходящие при повышенных температурах процессы спекания.
Обращает на себя внимание факт значительного снижения температуры образования гидрида магния в реакции эвтектического сплава с аммиаком по сравнению с реакцией с водородом: 250 и 420°C соответственно. Вероятно, это связано с активационным эффектом хлорида аммония, для которого характерна обратимая реакция разложения на NH3 и HCl. Выделяющийся хлористый водород, взаимодействуя с поверхностными атомами металлов или их оксидов, облегчает дальнейшее гидрирование металлической фазы. К тому же, как указывалось выше, в реакцию при 100°C (образец 1) вступает в первую очередь интерметаллид, являясь в дальнейшем катализатором гидрирования металла.
Все синтезированные фазы в условиях проведения эксперимента устойчивы и, по данным РФА, присутствуют в продуктах реакции после снятия давления.
Рассчитанные и представленные в табл. 1 (для продуктов реакций сплава с аммиаком) значения периодов кристаллических решеток всех веществ, полученных в процессах гидрирования как водородом, так и аммиаком, соответствуют известным из литературных источников [14, 15, 20, 23].
ЗАКЛЮЧЕНИЕ
Исследованы фазовые превращения при гидрировании эвтектического сплава Mg69Al31 водородом и аммиаком. Показано, что образование MgH2 при использовании аммиака происходит при значительно более низкой температуре, чем в реакции с водородом – 250 и 420°C соответственно. Взаимодействие второго компонента эвтектического сплава – интерметаллического соединения Mg17Al12 – с аммиаком при нагревании до температуры 300°C сопровождается образованием твердого раствора водорода, а свыше 300°C – его распадом до интерметаллического соединения Mg2Al3 и алюминия. В продуктах реакции, полученных при 500°C, содержатся нитриды магния и алюминия.
Список литературы
Sun Y., Shen C., Lai Q., Liu W., Wang D.-W., Aguey-Zinsou K.-F. Tailoring Magnesium Based Materials for Hydrogen Storage through Synthesis: Current State of the Art // Energy Storage Mater. 2018. V. 10. P. 168–198. https://doi.org/10.1016/j.ensm.2017.01.010
Yartys V.A., Lototskyy M.V., Akiba E., Albert R., Antonov V.E., Ares J.R., Baricco M., Bourgeois N., Buckley C.E., Bellosta von Colbe J.M., Crivello J.-C., Cuevas F., Denys R.V., Dornheim M., Felderhoff M., Grant D.M., Hauback B.C., Humphries T.D., Jacob I., Jensen T.R., de Jongh P.E., Joubert J.-M., Kuzovnikov M.A., Latroche M., Paskevicius M., Pasquini L., Popilevsky L., Skripnyuk V.M., Rabkin E., Sofianos M.V., Stuart A., Walker G., Wang Hui, Webb C.J., Zhu Min. Magnesium Based Materials for Hydrogen Based Energy Storage: Past, Present and Future // Int. J. Hydrogen Energy. 2019. V. 44. P. 7809–7859. https://doi.org/10.1016/j.ijhydene.2018.12.212
Фурсиков П.В., Тарасов Б.П. Водородсорбирующие магниевые сплавы и композиты // Изв. АН. Сер. хим. 2018. № 2. С. 193–199.
Sadhasivam T., Kim H.-T., Jung S., Roh S.-H., Park J.-H., Jung H.-Y. Dimensional Effects of Nanostructured Mg/MgH2 for Hydrogen Storage Applications: A Review // Renewable Sustainable Energy Rev. 2017. V. 72. P. 523–534. https://doi.org/10.1016/j.rser.2017.01.107
El-Eskandarany M.S., Al-Ajmi F., Banyan M., Al-Duweesh A. Synergetic Effect of Reactive Ball Milling and Cold Pressing on Enhancing the Hydrogen Storage Behavior of Nanocomposite MgH2/10 wt. % TiMn2 Binary System // Int. J. Hydrogen Energy. 2019. V. 44. P. 26428–26443. https://doi.org/10.1016/j.ijhydene.2019.08.093
Tarasov B.P., Arbuzov A.A., Mozhzhuhin S.A., Volodin A.A., Fursikov P.V., Lototskyy M.V., Yartys V.A. Hydrogen Storage Behavior of Magnesium Catalyzed by Nickel-Graphene Nanocomposites // Int. J. Hydrogen Energy. 2019. V. 44. № 55. P. 29212–29223. https://doi.org/10.1016/j.ijhydene.2019.02.033
Арбузов А.А., Можжухин С.А., Володин А.А., Фурсиков П.В., Тарасов Б.П. Водород-аккумулирующие материалы и способ их получения: Патент RU № 2675882 по заявке № 2016150246 от 21.12.2016 г. с приоритетем от 21.12.2016 г. Дата регистрации 25.12.2018 г. Б.И. № 36.
Zhu Y., Luo S., Lin H., Liu Y., Zhu Y., Zhang Y., Li L. Enhanced Hydriding Kinetics of Mg–10 At. % Al Composite by Forming Al12Mg17 during Hydriding Combustion Synthesis // J. Alloys Compd. 2017. V. 712. P. 44–49. https://doi.org/10.1016/j.jallcom.2017.04.049
Ismail M. The Hydrogen Storage Properties of Destabilized MgH2–AlH3 (2 : 1) System // Mater. Today: Proc. 2016. V. 3S. P. S80–S87. https://doi.org/10.1016/j.matpr.2016.01.011
Wang X.L., Tu J.P., Zhang P.L., Zhang X.B., Chen C.P., Zhao X.B. Hydrogenation Properties of Ball-Milled MgH2–10 wt. % Mg17Al12 Composite // Int. J. Hydrogen Energy. 2007. V. 32. P. 3406–3410. https://doi.org/10.1016/j.ijhydene.2007.03.003
Abd.Khalim Khafidz N.Z., Yaakob Z., Lim K.L., Timmiati S.N. The Kinetics of Lightweight Solid-State Hydrogen Storage Materials: A Review // Int. J. Hydrogen Energy. 2016. V. 41. P. 13131–13151. https://doi.org/10.1016/j.ijhydene.2016.05.169
Pang Y., Li Q. A Review on Kinetic Models and Corresponding Analysis Methods for Hydrogen Storage Materials // Int. J. Hydrogen Energy. 2016. V. 41. P. 18072–18087. https://doi.org/10.1016/j.ijhydene.2016.08.018
Ren J., Musyoka N.M., Langmi H.W., Mathe M., Liao S. Current Research Trends and Perspectives on Materials-Based Hydrogen Storage Solutions: A Critical Review // Int. J. Hydrogen Energy. 2017. V. 42. P. 289–311. https://doi.org/10.1016/j.ijhydene.2016.11.195
Диаграммы состояния двойных металлических систем: Справочник / Под общ. ред. акад. Лякишева Н.П. Т. 1. М.: Машиностроение, 1996. 992 с.
El-Amoush A.S. An X-Ray Investigation of Hydrogenated Mg-30Al Magnesium Alloy // J. Alloys Compd. 2007. V. 441. P. 278–283. https://doi.org/10.1016/j.jallcom.2006.09.109
Urgnani J., Di Chio M., Palumbo M., Feuerbacher M., Fernandez J.F., Leardini F., Baricco M. Hydrogen Absorption and Desorption in Rapidly Solidified Mg-Al Alloys // J. Phys.: Conf. Ser. 2009. V. 144. 012016 (4 pages). https://doi.org/10.1088/1742-6596/144/1/012016
Фокин В.Н., Фурсиков П.В., Фокина Э.Э., Коробов И.И., Фаттахова А.М., Тарасов Б.П. Гидрирование интерметаллического соединения Mg17Al12 // Журн. неорган. химии. 2019. Т. 64. № 9. С. 909–915. https://doi.org/10.1134/S0044457X19090125
Фокин В.Н., Фокина Э.Э., Коробов И.И., Тарасов Б.П. Гидрирование интерметаллического соединения Ti2Ni // Журн. неорган. химии. 2014. Т. 59. № 10. С. 1308–1311. https://doi.org/10.7868/S0044457X14100079
Тарасов Б.П., Фокина Э.Э., Фокин В.Н. Диспергирование и фазовые превращения интерметаллических соединений и сплавов Ti, Zr и Y с железом и никелем при взаимодействии с аммиаком // Изв. АН. Сер. хим. 2016. № 8. С. 1887–1892.
Crivello J.-C., Nobuki T., Kuji T. Limits of the Mg–Al γ-Phase Range by Ball-Milling // Intermetallics. 2007. V. 15. P. 1432–1437. https://doi.org/10.1016/j.intermet.2007.05.001
Тарасов Б.П., Фокина Э.Э., Фокин В.Н. Химические методы диспергирования металлических фаз // Изв. АН. Сер. хим. 2011. № 7. С. 1228–1236.
Тарасов Б.П., Фокина Э.Э., Фокин В.Н. Синтез гидридов интерметаллических соединений // Журн. общ. химии. 2014. Т. 84. № 2. С. 199–203.
Клямкин С.Н. Металлогидридные композиции на основе магния как материалы для аккумулирования водорода // Рос. хим. журн. 2006. Т. L. № 6. С. 49–55.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы