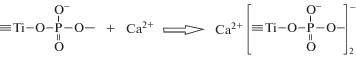Неорганические материалы, 2021, T. 57, № 5, стр. 536-542
Влияние содержания TiO2 на синтез и физико-химические свойства тонкопленочных кальций-фосфатных материалов
Л. П. Борило 1, Е. С. Лютова 1, *
1 Национальный исследовательский томский государственный университет
634050 Томск, пр. Ленина, 36, Россия
* E-mail: lyutova.tsu@mail.ru
Поступила в редакцию 13.04.2020
После доработки 07.12.2020
Принята к публикации 09.12.2020
Аннотация
Для получения материалов на основе системы P2O5–CaO–TiO2 были приготовлены пленкообразующие растворы четырех составов с содержанием оксида титана(IV) 70, 75, 85, 95 мас. %. Установлено, что пригодность пленкообразующих растворов для получения из них пленок ограничена значениями вязкости в пределах от 3.4 до 3.7 мм2/с. При содержании оксида титана(IV) 70 и 75 мас. % в системе P2O5–CaO–TiO2 идентифицируется фаза перовскита CaTiO3. Наиболее равномерное осаждение частиц с большим количеством открытых пор после погружения в раствор SBF (Simulated Body Fluid) наблюдается при содержаниях оксида титана(IV) 70 и 75 мас. %, поэтому эти составы являются наиболее подходящими для дальнейшего практического применения.
ВВЕДЕНИЕ
Важнейшей задачей материаловедения в области травматологии является создание материалов для лечения заболеваний опорно-двигательной системы [1–4]. В последние годы широкое применение находят различные биоматериалы. На данный момент известно, что главную роль играют кальций-фосфатные материалы, т. к. их структура и состав аналогичны составляющей костной ткани живого организма [5–7]. Установлено, что нарушение обмена кальция сопровождается различными заболеваниями, в т. ч. атеросклеротическими процессами. Одной из главных задач считается разработка и изучение поведения кальций-фосфатных и титановых имплантатов в системах in vivo и in vitro [8]. Имплантат должен быть биологически совместимым, биологически активным. Доказано, что биологически активными являются материалы с соотношением Ca : P от 1.5 до 2, соответствующим костной ткани человека [9, 10]. Использование такого материала вызовет запуск механизмов высвобождения ионов кальция и фосфата для связывания и формирования связи между имплантатом и костью, что приведет к накоплению тканей на поверхности имплантата без отслаивания.
Одной из тенденций является включение различных элементов в состав кальций-фосфатных систем для повышения механической и химической устойчивости, а также биологической активности в целом [11]. К таким элементам относят титан и его сплавы. Они подходят для применения в качестве заменителей твердых тканей из-за высокой биосовместимости и механических свойств. Кроме того, титан является биоинертным материалом. Испытания in vitro показали, что TiO2 может улучшить биосовместимость и повысить вероятность осаждения кальция и фосфора на поверхность [10]. Известно, что металлические имплантаты, изготовленные из стали или титана, не способны обеспечивать прочную связь с тканями. Большинство исследований посвящено получению биологически активных систем, но мало внимания уделено титану в качестве добавки в кальций-фосфатную систему. Поэтому создание материалов на основе оксидов кальция и фосфора с добавлением оксида титана является актуальным.
Цель настоящей работы – золь–гель-синтез тонкопленочных материалов на основе системы P2O5–CaO–TiO2, изучение влияния содержания TiO2 на физико-химические и биоактивные свойства полученных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения материалов на основе системы P2O5–CaO–TiO2 были приготовлены пленкообразующие растворы (ПОР) четырех составов: Ti_70, Ti_75, Ti_85, Ti_95. Состав Ti_70 содержал (мас. %): P2O5 – 12, СаО – 18, TiO2 – 70; состав Ti_75: P2O5 – 10, СаО – 15, TiO2 – 75; состав Ti_85: P2O5 – 6, СаО – 9, TiO2 – 85; состав Ti_95: P2O5 – 2, СаО – 3, TiO2 – 95.
Исходные реагенты: бутиловый спирт (Россия), ортофосфорная кислота (“ос. ч.”, “Химмед”, Россия), нитрат кальция (“ч. д. а.”, “Химмед”, Россия), тетрабутоксититан (“ос. ч.”, Германия). Общая концентрация ПОР составляла 0.1 моль/л.
ПОР выдерживали в термостате при температуре 25°С. Пленки получали на подложках из монокристаллического кремния (модельная подложка) методом центрифугирования со скоростью вращения центрифуги 3000 об./мин с последующей термообработкой при 60°С в течение 20 мин и при 600°С в течение 1 ч. Для изучения пленкообразующей способности растворов измеряли их вязкость с помощью стеклянного вискозиметра с диаметром капилляра 0.99 мм при температуре 25°С.
Термическая устойчивость на воздухе высушенных при 60°С растворов исследована на синхронном термическом анализаторе SТA 449 C Jupiter в атмосфере кислорода по ходу ДСК-кривой в температурном интервале 60–1000°С. Энергия активации каждого этапа термической деструкции ПОР определена с помощью аппроксимационных методов по термографическим и термогравиметрическим измерениям с помощью уравнения Метцгера–Горовица [12].
ИК-спектры высушенных ПОР получены на ИК-Фурье-спектрометре NICOLET 6700 в диапазоне частот 400–4000 см–1. Рентгенофазовый анализ проведен на дифрактометрах Rigaku MiniFlex 600 и Shimadzu XRD – 6000 (CuKα-излучение) с использованием баз данных PCPDFWIN и JSPDS.
Исследована также склонность поверхности материала к минерализации в модельном растворе SBF (Simulated Body Fluid) по методике, предложенной в работе [13]. Образцы погружались в раствор SBF на 14 суток при непрерывном термостатировании при рН 7.4 и температуре 37°С, после чего морфологию поверхности полученных материалов исследовали на сканирующем электронном микроскопе HITACHI TM-3000. Определение ионов Ca2+ и Mg2+ проводили методом трилонометрического титрования.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
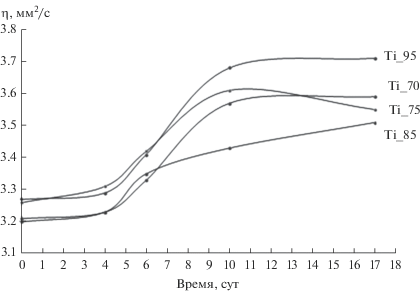
Согласно золь–гель-технологии, приготовленные растворы, которые впоследствии будут пригодны для получения тонких пленок, должны пройти стадию созревания. Этот процесс можно контролировать вискозиметрическим методом. По характеру изменения вязкости четырех образцов от времени можно установить временной промежуток для получения пленок и отследить процессы, происходящие в растворах.
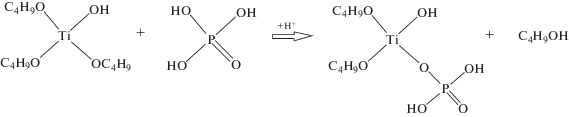
Первые 4 суток наблюдается незначительное увеличение вязкости всех образцов – от 3.2 до 3.3 мм2/с (рис. 1). Затем вязкость растворов повышается за счет реакций гидролиза и поликонденсации тетрабутоксититана [6, 7]. Реакции гидролиза и поликонденсации ускоряются с присутствием в системе фосфорной кислоты. Анион замещает бутоксигруппу по SN2-механизму (реакция (1)), катион кальция встраивается в структуру по реакции (2) [14, 15]:
Последующее выравнивание вязкости ПОР связано с переходом золя в гель, при этом рост частиц замедляется, образуются трехмерные пространственные структуры. В среднем временной промежуток для получения пленок ограничивается 10 сутками. Экспериментально установлено, что после 10 суток пленки получаются неравномерными.
В дальнейшем исследовали высушенные ПОР, из которых в ходе термической обработки формируются пленки. Молекулы растворителя (бутилового спирта) удаляются из растворов при температуре 60°С, поэтому состав высушенных ПОР соответствует составу исследуемых растворов до термической обработки (высушивания).
Высушенные при 60°С ПОР исследованы методом ИК-спектроскопии (табл. 1). В сформированных образцах (60°C) присутствуют адсорбированная вода и органический растворитель. В образцах, полученных при 60°С, присутствуют органические остатки, адсорбированная вода, нитрогруппы. В ИК-спектрах зафиксированы валентные колебания P=O, $--{\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ и Ti–O. Колебания связи Тi–O указывают на формирование в растворе молекулярного каркаса, который, согласно данным [7, 12], образуется в результате гидролиза и поликонденсации тетрабутоксититана.
Таблица 1.
Результаты ИК-спектроскопии пленок, полученных из ПОР при 60°С
| ν, см–1 | Тип колебаний | |||
|---|---|---|---|---|
| Ti_70 | Ti_75 | Ti_85 | Ti_95 | |
| 3468.1 | – | 3466.2 | 3411.4 | Валентные OH (H2Oадс) |
| 1559.1 1636.4 |
1551.4 1636.7 |
1551.1 1636.3 |
1550.0 1627.9 |
Деформационные вода |
| 1336.9 | 1341.7 | 1339.6 | 1337.7 1374.8 |
Деформационные CH2, CH3 |
| 2868.5 2957.3 |
2871.1 2957.1 |
2869.9 2956.5 |
2867.9 2955.9 |
Валентные CH |
| 1023.8 | 979.8 1024.3 |
977.7 1025.4 |
975.8 1018.3 |
Валентные P=O, $ - {\kern 1pt} {\text{PO}}_{4}^{{3 - }}$ |
| 1419.8 | 1410.6 | 1430.1 | 1457.7 | Валентные NO3 |
| 743.6 814.4 |
743.3 814.5 |
742.8 | 797.6 740.0 |
Ti–O |
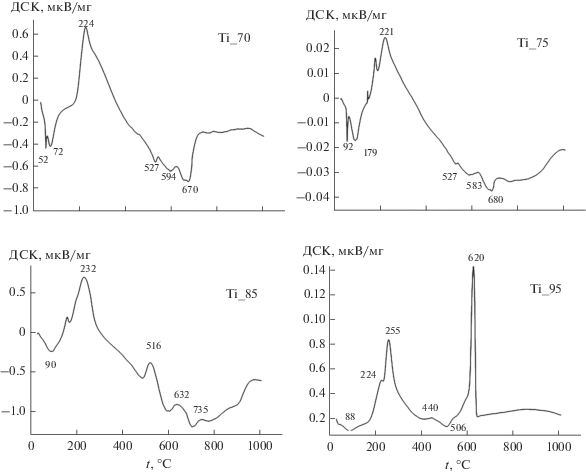
Независимо от содержания оксидов в системе процесс формирования материалов происходит в три стадии (рис. 2). В интервале температур до 300°С происходит удаление физически и химически связанной воды, при 300–550°С – окисление органической составляющей. При 600–800°С отмечается переход аморфных соединений в кристаллическое состояние.
Как видно из рис. 2, ДСК-кривые для образцов Ti_70, Ti_75, Ti_85 имеют схожий характер. ДСК-кривая образца Ti_95 имеет вид, типичный для титановых систем без добавок [16]. Установлено, что для получения кристаллических образцов Ti_70, Ti_75 необходима температурная обработка при 600°С, а для образцов Ti_85, Ti_95 – выше 700°С. В образце Ti_95 пик при температуре 620°С характеризует переход оксида титана из анатаза в рутил [16].
Энергию активации (табл. 2) каждого этапа формирования материала рассчитывали по уравнению Метцгера–Горовица [12]. Относительно низкие значения энергии активации – от 23 до 51 кДж/моль – указывают на удаление физически адсорбированной воды и растворителя. Такое низкое значение Еа подтверждает разрушение межмолекулярных связей (ван-дер-ваальсовых (Еа ~ 10–20 кДж/моль [15]) и/или водородных (Еа < 40 кДж/моль [15])) с молекулами гидратной воды. Энергия активации второй стадии характерна для химических процессов, обусловленных удалением химически связанной воды, органических остатков и нитрогрупп. На третьей стадии высокие значения энергии активации характеризуют разрушение химических связей в соединениях.
Таблица 2.
Значения энергии активации по данным термического анализа
| Стадия | Δt, °С | Еа, кДж/моль | Δt, °С | Еа, кДж/моль | Δt, °С | Еа, кДж/моль | Δt, °С | Еа, кДж/моль |
|---|---|---|---|---|---|---|---|---|
| Ti_70 | Ti_75 | Ti_85 | Ti_95 | |||||
| I | 25–100 | 23 | 25–100 | 37 | 25–100 | 51 | 25–100 | 32 |
| 100–300 | 47 | 100–300 | 71 | 100–300 | 36 | 224–255 | 42 | |
| II | 300–550 | 78 | 300–550 | 73 | 300–500 | 59 | 300–550 | 56 |
| III | 550–650 | 125 | 550–650 | 94 | 550–650 | 132 | 550–650 | 87 |
| 650–1000 | 158 | 650–1000 | 162 | 650–1000 | 178 | – | – | |
Идентификацию фаз, присутствующих в образцах при 600°С, осуществляли с помощью рентгенофазового анализа. В образцах Ti_70, Ti_75 идентифицируется фаза перовскита CaTiO3, в образцах Ti_85 и Ti_95 – только фаза анатаза TiO2. Полученные результаты указывают на то, что после отжига на поверхности материала образуется буферный слой перовскита и фосфата кальция, который обнаруживается в форме пентаоксида на поверхности, что и является способом улучшения биосовместимости титанового имплантата.
При температуре 600°С и выше структура всех образцов состоит из фосфоркислородных атомных групп, о чем свидетельствует присутствие в ИК-спектрах полос 979–1029 см–1. Для образцов Ti_70, Ti_ 75 регистрируются деформационные колебания CH2, CH3 (1412–1419 см–1) и связи Ca–O–Ti (540–542 см–1). С увеличением содержания оксида титана на ИК-спектрах наблюдается размытие полос, характерных для колебания связи Ca–O–Ti, что объясняется низким содержанием оксида кальция в системе.
Методом центрифугирования были получены тонкие пленки на кремниевых подложках [14]. Микрофотографии до погружения в раствор SBF показывают, что поверхность пленок однородна (рис. 3). С уменьшением содержания титана в системе толщина пленок увеличивается от 21.43 до 31.61 нм (погрешность прибора составляет 0.03).
Исследовали биологическую активность в растворе SBF, имитирующем межклеточную жидкость организма человека, по методике [13]. Изменения, происходящие на поверхности образцов, наблюдали с помощью растровой электронной микроскопии. На рис. 3 представлены микрофотографии поверхности образцов до и после погружения в SBF-раствор.
После 14 суток нахождения в растворе SBF количество осажденных частиц значительно увеличивается, образуются крупные агломераты (рис. 3). На поверхности наблюдаются большие рыхлые частицы, наличие которых благоприятно для дальнейшего врастания в них костной ткани и формирования более прочного соединения имплантата с костью. Наиболее равномерное осаждение частиц с большим количеством открытых пор наблюдается для пленок Ti_70 и Ti_75. Такой рельеф определяет лучшие биоактивные свойства за счет того, что поры создают условия для прочного сцепления с костной тканью [17, 18]. Скорость формирования аморфного слоя на поверхности материала можно оценить по уменьшению суммарной концентрации ионов кальция и магния в SBF-растворе методом трилонометрического титрования (рис. 4).
Рис. 4.
Зависимость суммарной концентрации ионов Ca2+ и Mg2+ в образцах от времени нахождения в SBF-растворе.

В первые 7 суток скорость осаждения составляет 0.2 моль/(л сут), затем – 0.01 моль/(л сут). Это связано с тем, что в первые сутки происходит быстрый обмен ионами щелочных и щелочноземельных металлов за счет образования гидроксильных групп на поверхности материала [16]. Затем ионы Ca2+, ${\text{PO}}_{{\text{4}}}^{{{\text{3}} - }}$ мигрируют, образуя кальций-фосфатный слой на поверхности материала, вследствие накопления ионов с течением времени уменьшается скорость процесса [19].
ЗАКЛЮЧЕНИЕ
Показано, что пригодность ПОР для получения из них пленок ограничена значениями вязкости, которые находятся в пределах от 3.4 до 3.7 мм2/с. При температуре 600°С в образцах Ti_70, Ti_75 идентифицируется фаза перовскита CaTiO3, в Ti_85 и Ti_95 – фаза анатаза TiO2. Наиболее равномерное осаждение частиц с большим количеством открытых пор после погружения в раствор SBF наблюдается для пленок Ti_70 и Ti_75. Поэтому для дальнейшего практического применения они являются наиболее подходящими.
Список литературы
Sadat-Shojai M., Khorasani M., Dinpanah-Khoshdargi E., Jamshidi A. Synthesis Methods for Nanosized Hydroxyapatite Indiverse Structures // Acta Biomater. 2013. V. 9. P. 7591–7621.
Li X., Wang M., Deng Y., Xiao Y., Zhang X. Fabrication and Properties of Ca-P Bioceramic Spherical Granules with Interconnected Porous Structure // ACS Biomater. Sci. Eng. 2017. V. 3. № 8. P. 1557–1566.
Jmal N., Bouaziz J. Fluorapatite-Glass-Ceramics Obtained by Heat Treatment of a Gel Synthesized by the Sol-Gel Processing Method // Mater. Sci. Eng. 2017. № 71. P. 279–288.
Борило Л.П., Козик В.В., Лютова Е.С., Жаркова В.В., Бричков А.С. Получение и свойства сферических биоматериалов для системы TiO2–SiO2/СаO с использованием золь-гель метода // Стекло и керамика. 2019. Т. 76. № 7–8. С. 42–49.
Zhang J., Liu W., Schnitzler V., Tancret F. Calcium Phosphate Cements for Bone Substitution: Chemistry, Handling and Mechanical Properties // Acta Biomater. 2014. V. 10. P. 1035–1039.
Zaroog O.S., Satgunam M.A., Wei L.C. Biomaterials for Bone Tissue Engineering: Properties and Applications // Materials Science and Materials Engineering. Ansterdam: Elsevzer, 2019. P. 14.
Баринов С.М. Биокерамика на основе фосфатов кальция. М.: Наука, 2005. 204 с.
Путляев В.И. Современные биокерамические материалы // Соросовский образ. журн. 2004. Т. 8. С. 44–50.
Третьяков Ю.Д. Введение в химию твердофазных материалов. М.: Изд-во МГУ. 2006. 399 с.
Borilo L.P., Lyutova E.S., Spivakova L.N. Study of Biological Properties of Thin-Film Materials on the Basis of the SiO2–P2O5–CaO System // Key Eng. Mater. 2016. V. 683. P. 427–432.
Lei B., Chen X., Wang Y., Zhao N., Du C., Fang L. Synthesis and Bioactive Properties of Macroporous Nanoscale SiO2–CaO–P2O5 Bioactive Glass // J. Non-Cryst. Solids. 2009. V. 355. P. 2678–2681.
Фиалко М.Б. Неизотермическая кинетика в термическом ана лизе. Томск: Изд-во Томск. ун-та, 1981. 110 с.
Kokubo T., Kushitani H., Sakka S. Solutions Able to Reproduce in Vivo Surface – Structure Changes in Bioactive Glass – Ceramic // Biomaterials. 1990. V. 24. P. 721–734.
Суйковская Н.В. Химические методы получения тонких пленок. Л.: Химия, 1971. 230 с.
Борило Л.П., Петровская Т.С., Лютова Е.С. Синтез и свойства тонких пленок на основе фаз системы SiO2–P2O5–СаO // Неорган. материалы. 2014. Т. 50. № 8. С. 874–877.
Kaur M., Singh K. Review on Titanium and Titanium Based Alloys as Biomaterials for Orthopaedic Applications // Mater. Sci. Eng., C. 2019. V. 102. P. 844–862.
Greenspan D.C., Zhong J.P., Wheeler D.L. Bioactivity and Biodegradability: Melt Sol-Gel Derived Bioglass in Vitro and in Vivo // Bioceramics. 1998. V. 11. P. 345–348.
Park K.H., Kim S.J., Jeong Y.H., Moon H.J., Song H.J., Park Y.J. Fabrication and Biological Properties of Calcium Phosphate/Chitosan Composite Coating on Titanium in Modified SBF // Mater. Sci. Eng. 2018. P. 113–118.
Bellucci D., Salvatori R., Anesi A., Chiarini L., Cannillo V. SBF Assays, Direct and Indirect Cell Culture Tests to Evaluate the Biological Performance of Bioglasses and Bioglass-Based Composite // Mater. Sci. Eng., C. 2019. V. 96. P. 757–764.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы