Неорганические материалы, 2021, T. 57, № 5, стр. 549-553
Извлечение из растворов ионов сурьмы(III) сорбентами на основе соединений титана(IV)
Р. И. Корнейков 1, *, В. И. Иваненко 1, А. М. Петров 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение ФИЦ “Кольский научный центр Российской академии наук”
184209 Мурманская обл., Апатиты, Академгородок, 26А, Россия
* E-mail: r.korneikov@ksc.ru
Поступила в редакцию 28.09.2020
После доработки 08.12.2020
Принята к публикации 09.12.2020
Аннотация
Показана перспективность применения сорбентов на основе соединений титана(IV) для глубокой очистки жидких радиоактивных отходов сложного химического состава от ионов сурьмы(III). Установлено, что оксогидроксофосфаты титана(IV) обладают повышенным сродством к катионам сурьмы(III). Селективность сорбционной матрицы усиливается с повышением кислотности раствора и увеличением содержания в составе образца гидрофосфатных групп. Для извлечения анионных форм перспективны гидроксиды оксотитана(IV), проявляющие повышенное сродство к отрицательно заряженным ионам сурьмы(III).
ВВЕДЕНИЕ
С деятельностью объектов атомной энергетики, а также гражданского и военного флотов связано образование больших объемов жидких радиоактивных отходов (ЖРО) [1, 2], переработка которых затруднена из-за сложности химического состава, что в результате приводит к их накоплению [3]. Основная активность ЖРО обусловлена присутствием долгоживущих радионуклидов 134, 137Cs, 90Sr, 60Co [1–5]. Для “основных” радиоизотопов предложены преимущественно сорбционные методы извлечения из растворов [6, 7]. Однако в ЖРО присутствуют и менее долгоживущие, но привносящие вклад в удельную активность радионуклиды, в частности, радиоизотопы сурьмы 125Sb, являющиеся продуктами деления [8], а также образующиеся в результате активации ионов сурьмы, высвобожденных из конструкционных материалов, графитовых уплотнений, пропитанных сурьмой (обычно используются в насосах теплоносителя ядерных реакторов) и т.д., период полураспада которых составляет более 2.76 года [9–13].
Для извлечения ионов сурьмы(III) из растворов перспективны ионообменные методы. Предложено использовать органические (смолы) и неорганические материалы. Использование ионообменных смол ограничено вследствие их деструкции в радиационном поле [13], с одной стороны, и слабой активностью ионогенных групп в присутствии конкурирующих ионов [9] – с другой. Извлечение сурьмы может быть осложнено и формой ее нахождения в растворе (катионная/анионная) в зависимости от значений рН.
Наибольший интерес представляют неорганические иониты на основе соединений титана(IV) [13], а именно: аморфные гидратированные оксогидроксофосфаты титана(IV) с соотношением фосфора к титану ≤1, обладающие высокими сорбционными характеристиками, устойчивостью к агрессивным средам и обеспечивающие надежную иммобилизацию радиоактивного сорбата [7, 15, 16], а также гидроксиды титана(IV) [17]. Однако литературные данные по сорбционному извлечению из растворов радионуклидов сурьмы сорбентами на основе соединений титана немногочисленны.
Цель настоящей работы – извлечение из многокомпонентных высокосолевых растворов ионов сурьмы(III) сорбентами на основе соединений титана: гидроксофосфатами и гидроксидами оксотитана(IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез сорбционных материалов на основе оксогидроксофосфатов титана(IV) осуществляли фосфатированием свежеосажденного высокогидратированного оксогидроксидного прекурсора с последующей сушкой согласно [18]. Гидроксиды оксотитана(IV) формировали непосредственно в модельных растворах, содержащих ионы сурьмы(III).
Состав ионитов анализировали химическими методами: содержание Р(V) – фотоколориметрически с молибдатом аммония (фотоэлектроколориметр Leki-1107); Ti(IV) – атомно-абсорбционным и фотоколориметрическим (с пероксидом водорода) методами; координационную воду (H2O), конституционную воду (OH–- и ${\text{HPO}}_{{\text{4}}}^{{{\text{2}} - }}$-группы) – сопоставлением результатов химического, дифференциального термического (ДТА) и термогравиметрического (ТГА) методов анализа. Для ДТА использовали низкочастотный термографический регистратор НТР-70 с программным нагревательным устройством ПРТ-1000М (эталоном выступал прокаленный оксид алюминия). ТГА проводили с помощью тензорных весов ВТ-1000. Температуру измеряли платина–платинородиевыми термопарами в комплекте с потенциометром ПП-63. Скорость нагрева составляла 10°С/мин.
Удельную поверхность (Sуд) воздушно-сухого исходного сорбента, средний диаметр (d) и объем (V) пор определяли методом термической десорбции азота на электронном измерителе удельной поверхности TriStar II 3020 фирмы Micrometritics. При определении содержания в растворах ионов сурьмы(III) использовали масс-спектрометрическую систему с индуктивно-связанной плазмой (ИСП-МС) с динамической реакционной системой ELAN 9000 DRC-e фирмы Perkin Elmer.
Ионообменный процесс проводили в статических условиях при различных равновесных значениях рН. Корректировку значений рН осуществляли концентрированными растворами соляной кислоты и гидроксида натрия. Равновесные значения рН контролировали рН-метром “Анион 7000”. Индикаторный электрод – селективный по отношению к протонам электрод марки ЭСЛ-43-07, вспомогательный – хлорсеребряный электрод Ag/AgCl марки ЭВЛ-1М3. Коэффициенты распределения (Kd) рассчитывали по уравнению Kd = Аα/(100 – А), где А – процентное содержание сорбированного катиона металла, α – отношение объема жидкой фазы к массе сорбента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В работе рассчитаны составы синтезированных соединений на основе оксогидроксофосфатов титана(IV) сопоставлением используемых методов анализа (химического, ДТА и ТГА): 1 – TiOНPO4 ⋅ 4.16Н2О, 2 – TiO1.59(ОН)0.1(НPO4)0.36 · · 1.38Н2О. В составе образца 1 существенно больше гидрофосфатных ионообменных групп, чем у образца 2. Однако у образца 2 присутствуют и гидроксидные группы, координированные у атома Ti(IV) и способные принимать участие в ионном обмене.
Полученные образцы размалывали и просеивали через сито с размером ячеи 0.05 мм. В табл. 1 представлены физические параметры сорбентов. Видно, что образец 2 обладает более развитой удельной поверхностью, меньшим размером частиц и большим объемом пор. По-видимому, это связано с присутствием в составе образца более дисперсного TiO2 в сравнении с TiOНPO4. В работе на модельных растворах, содержащих ионы сурьмы, апробированы оба состава сорбентов.
Таблица 1.
Физические параметры сорбентов на основе оксогидроксофосфатов титана(IV)
| Сорбент | Sуд, м2/г | d, нм | V, см3/г |
|---|---|---|---|
| TiOНPO4 · 4.16Н2О | 13.89 | 19.41 | 0.06 |
| TiO1.59(ОН)0.1(НPO4)0.36 · 1.38Н2О | 46.34 | 9.66 | 0.12 |
Поскольку для охлаждения ядерных энергетических установок атомных электростанций, военного и гражданского судов могут использовать морскую воду [1–3] с общим солесодержанием около 30 г/л, в работе проведены исследования по извлечению ионов сурьмы(III) из растворов, моделирующих состав морской воды, при разном значении рН (исходное значение рН модельного раствора 8, что соответствует значению рН морской воды (7.6–8.6 [19])). В аликвоты модельных растворов, содержащих ионы сурьмы(III), помещали сорбент. При введении сорбентов в раствор происходит понижение значений рН до ~2 вследствие ионного обмена. Равновесное значение рН сорбции получали введением гидроксида натрия с концентрацией 2.5 моль/л при интенсивном перемешивании. На рис. 1 и в табл. 2 приведены результаты исследований. Поскольку сорбенты на основе гидрофосфатов оксотитана(IV) являются катионитами, снижение содержания ионов сурьмы в растворе после сорбции свидетельствует о катионной форме (Sb3+) ее нахождения при данных значениях рН.
Рис. 1.
Извлечения при различном значении рН катионов сурьмы(III) из раствора, моделирующего состав морской воды, оксогидроксофосфатами титана(IV): 1 – TiOНPO4 · 4.16H2O, 2 – TiO1.59(ОН)0.1(НPO4)0.36 · · 1.38Н2О.
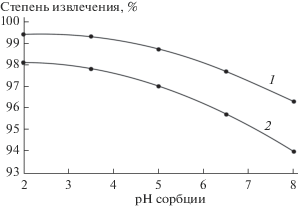
Таблица 2.
Извлечение катионов Sb(III) сорбентами различного состава (Ж : Т = 100) из раствора, моделирующего состав морской воды [19], при различном значении рН (состав раствора: Na+ – 10.7, K+ – 0.39, Са2+ – 0.41, Мg2+ – 1.30, Sr2+ – 0.01, Сl– – 21.45 г/л)
| рН сорбции | Остаточное содержание, мг/л | Kd, мг/г | Остаточное содержание, мг/л | Kd, мг/г |
|---|---|---|---|---|
| TiOНPO4 · 4.16H2O | TiO1.59(ОН)0.1(НPO4)0.36 · 1.38Н2О | |||
| 2 | 0.0064 ± 0.0004 | 16 931 ± 1863 | 0.0207 ± 0.0015 | 5166 ± 517 |
| 3.5 | 0.0075 ± 0.0005 | 14 433 ± 1588 | 0.0240 ± 00018 | 4442 ± 445 |
| 5 | 0.0146 ± 0.0011 | 7366 ± 811 | 0.0327 ± 0.0024 | 3233 ± 324 |
| 6.5 | 0.0251 ± 0.0015 | 4242 ± 467 | 0.0469 ± 0.0033 | 2224 ± 245 |
| 8 | 0.0403 ± 0.0023 | 2605 ± 261 | 0.0654 ± 0.0050 | 1567 ± 157 |
Из экспериментально полученных данных видно, что с понижением равновесного значения рН сорбции извлечение катионов сурьмы из раствора повышается для обоих составов сорбентов (рис. 1). Но образец состава TiOНPO4 ⋅ 4.16Н2О обладает существенно бóльшими значениями коэффициентов распределения по сравнению с образцом TiO1.59(ОН)0.1(НPO4)0.36 ⋅ 1.38Н2О (табл. 2), несмотря на более развитую удельную поверхность последнего. Обусловлено это, по-видимому, большим содержанием функциональных групп $\left( {{\text{НPO}}_{{\text{4}}}^{{{\text{2}} - }}} \right)$ в составе образца. Повышение извлечения катионов сурьмы с понижением значения рН сорбции, возможно, связано с уменьшением подвижности протонов функциональных групп [7] и, как следствие, увеличением сродства сорбционной матрицы к катионам сурьмы в присутствии существенно превосходящих по содержанию фоновых компонентов. Повышение же значения рН сорбции приводит к усилению подвижности протонов ${\text{НPO}}_{{\text{4}}}^{{{\text{2}} - }}$-групп, в результате существенно возрастает конкуренция при сорбции присутствующих катионов натрия, калия и т.д. по отношению к Sb3+.
При эксплуатации атомных энергетических установок могут образовываться более концентрированные высокощелочные многокомпонентные ЖРО (кубовые остатки), преимущественно нитратные, общее солесодержание которых может достигать десятков и сотен граммов на литр [1]. В работе проведены исследования по извлечению ионов сурьмы из растворов, моделирующих состав таких ЖРО (табл. 3). Состав рабочих растворов моделировали исходя из состава ЖРО, образующихся при эксплуатации водо-водяного энергетического реактора. В отличие от предыдущего эксперимента значение рН раствора сначала доводили до 12 (исходное значение рН 7) 5 М раствором NaOH. Так как в щелочной среде сурьма(III) может присутствовать в анионной форме [9], а сведения о кинетике перехода катионной формы сурьмы в анионную $\left( {{\text{SbO}}_{{\text{3}}}^{{{\text{3}} - }}} \right)$ в подобных сложных по химическому составу средах отсутствуют, подщелоченные растворы выдерживали в течение 10 суток. Далее осуществляли ионообменный процесс на оксогидроксофосфатах титана(IV) при различном отношении жидкой и твердой фаз (табл. 3). Из табл. 3 видно, что образец с мольным соотношением P(V) : Ti(IV) = 1 не сорбирует ионы сурьмы, что связано с полным переходом последней в анионную форму. Образец с соотношением P(V) : Ti(IV) < 1 с координированными у атома титана(IV) гидроксильными группами, которые участвуют в ионном обмене, извлекает анионы сурьмы. Извлечение увеличивается с уменьшением отношения жидкой и твердой фаз, однако это увеличение несущественно. Связано это с малым содержанием OН–-групп в составе образца, которое определяется протеканием во время синтеза сорбента процессов оляции и оксоляции с образованием связей –Ti–О–Ti–, и с экранированием сорбированными анионами, несмотря на хорошо развитую удельную поверхность (табл. 1), непрореагировавших в ионообменном процессе функциональных центров.
Таблица 3.
Результаты сорбции Sb(III) из раствора сорбентами различного состава при различном значении Ж : Т (состав раствора: Na+ – 7.4, K+ – 3.6, ${\text{NO}}_{{\text{3}}}^{ - }$ – 20; ${\text{BO}}_{{\text{3}}}^{{{\text{3}} - }}$ – 9.5 г/л)
| Ж : Т | Остаточное содержание, мг/л | Извлечение, % |
|---|---|---|
| TiOНPO4 · 4.16Н2О | ||
| 100 | 0.9653 ± 0.0396 | – |
| TiO1.59(ОН)0.1(НPO4)0.36 · 1.38Н2О | ||
| 100 | 0.5648 ± 0.0288 | 43 ± 8 |
| 50 | 0.3762 ± 0.0177 | 62 ± 8 |
| 25 | 0.2475 ± 0.0124 | 71 ± 8 |
| TiO(OН)2 · nН2О | ||
| 0.19 г* | 0.0792 ± 0.0054 | 92 ± 9 |
| 0.38 г * | 0.0198 ± 0.0018 | 98 ± 8 |
Так как была найдена возможность сорбционного извлечения анионов сурьмы гидроксильными группами сорбентов, для исключения процессов оляции и оксоляции, синтез оксогидроксида титана(IV) осуществляли непосредственно в рабочем растворе введением титансодержащего прекурсора (использовали раствор оксосульфата титана(IV) с концентрацией по Ti(IV) 93.4 г/л), после чего осуществляли ионообменный процесс (табл. 3). Для количественной оценки образованного в растворе оксогидроксида титана(IV) расчет проводили на безводный продукт (TiO(OН)2).
Из табл. 3 видно, что свежеосажденный в растворе оксогидроксид Ti(IV) обладает повышенным сродством к анионным формам сурьмы(III), о чем свидетельствуют показатели степеней извлечения. Для глубокой очистки раствора от анионов сурьмы(III) достаточно провести две стадии сорбции или увеличить количество TiO(OН)2 · nН2О.
Таким образом, проведена апробация и показана перспективность применения сорбционных материалов на основе соединений титана(IV) для извлечения катионов и анионов сурьмы(III) из сложных по химическому составу растворов, моделирующих составы ЖРО, образующихся при эксплуатации ядерных энергетических установок.
ЗАКЛЮЧЕНИЕ
Проведена апробация сорбционных материалов при извлечении ионов сурьмы(III) из растворов, моделирующих ЖРО и близких по составу к морской воде и кубовым остаткам.
Показано, что сорбционные материалы на основе соединений титана(IV) представляют интерес для извлечения микроколичеств катионных и анионных форм сурьмы(III) из многокомпонентных высокосолевых ЖРО. Экспериментально установлено, что применение образцов на основе оксогидроксофосфатов титана(IV) эффективно для сорбционного извлечения из растворов катионов сурьмы. Сродство ионообменной матрицы усиливается с повышением кислотности раствора и с увеличением содержания функциональных ${\text{НРО}}_{{\text{4}}}^{{{\text{2}} - }}$-групп в составе сорбционного материала, принимающих участие в ионообменном процессе. Для извлечения анионных форм сурьмы(III), существующих в щелочной области, перспективны гидроксидные соединения титана(IV), особенно свежеосажденный оксогидроксид титана(IV), обладающий повышенной селективностью к отрицательно заряженным ионным формам сурьмы. Применение последнего упрощено его синтезом непосредственно в растворе.
Список литературы
Рябчиков Б.Е. Очистка жидких радиоактивных отходов. М.: ДеЛи принт, 2008. 516 с.
Вишняков Ю.М., Малышев С.П., Пчелинцев В.М., Хорошев В.Г. Малогабаритная станция комплексной переработки жидких радиоактивных отходов // Судостроение. 1999. № 3. С. 44–48.
Takahatakea Y., Watanabea S., Shibataa A., Nomuraa K., Komaa Y. Decontamination of Radioactive Liquid Waste with Hexacyanoferrate(II) // Procedia Chem. 2012. № 7. P. 610–615.
Mansy M.S., Hassana R.S., Selim Y.T., Kenawy S.H. Evaluation of Synthetic Aluminum Silicate Modified by Magnesia for the Removal of 137Cs, 60Co and 152 + 154Eu from Low-Level Radioactive Waste // Appl. Radiat. Isot. 2017. № 130. P. 198–205. https://doi.org/10.1016/j.apradiso.2017.09.042
Abdel-Karima A.M., Zaki A.A., Elwana W., El-Naggar M.R., Gouda M.M. Experimental and Modeling Investigations of Cesium and Strontium Adsorption onto Clay of Radioactive Waste Disposal // Appl. Clay Sci. 2016. № 132–133. P. 391–401. https://doi.org/10.1016/j.clay.2016.07.005
Милютин В.В., Некрасова Н.А., Козлитин Е.А. Селективные неорганические сорбенты в современной прикладной радиохимии // Материалы II Всерос. науч. конф. с международным участием “Исследования и разработки в области химии и технологии функциональных материалов” Спецвыпуск отделения “Химия и материаловедение”. Апатиты: Изд-во КНЦ РАН, 2015. С. 418–421.
Корнейков Р.И., Иваненко В.И. Извлечение катионов цезия и стронция из растворов ионитами на основе фосфатов титана(IV) // Неорган. материалы. 2020. Т 56. № 5. С. 528–532. https://doi.org/10.31857/S0002337X20050085
Roberts C.J. Management and Disposal of Waste from Sites Contaminated by Radioactivity // Radiat. Phys. Chem. 1998. V. 51. № 4–6. P. 579–587.
Nishad P.A., Bhaskarapillai A., Velmurugan S. Nano-Titania-Crosslinked Chitosan Composite as a Superior Sorbent for Antimony (III) and (V) // Carbohydr. Polym. 2014. № 108. P. 169–175. https://doi.org/10.1016/j.carbpol.2014.02.091
Kong T.Y., Kim S., Lee Y., Son J.K., Maeng S.J. Radioactive Effluents Released from Korean Nuclear Power Plants and the Resulting Radiation Doses to Members of the Public // Nucl. Eng. Technol. 2017. № 49. P. 1772–1777. https://doi.org/10.1016/j.net.2017.07.021
Gil-Díaz T., Schäfer J., Pougnet F., Abdou M., Dutruch L., Eyrolle-Boyer F., Coynel A., Blanc G. Distribution and Geochemical Behaviour of Antimony in the Gironde Estuary: A First Qualitative Approach to Regional Nuclear Accident Scenarios // Mar. Chem. 2016. № 185. P. 65–73. https://doi.org/10.1016/j.marchem.2016.02.002
Herrmann J., Kershaw P.J., Bois P.B., Guegueniat P. The Distribution of Artificial Radionuclides in the English Channel, Southern North Sea, Skagerrak and Kattegat, 1990–1993 // J. Mar. Syst. 1995. № 6. P. 427–456.
Remya Devi P.S., Joshi S., Verma R., Lali A.M., Gantayet L.M. Effect of Gamma Radiation on Organic Ion Exchangers // Radiat. Phys. Chem. 2010. № 79. P. 41–45. https://doi.org/10.1016/j.radphyschem.2009.08.002
Chauvenet B., Be´ M.-M., Amiot M.-N., Bobin C., Le’py M.-C., Branger T., Laniece I., Luca A. et al. International Exerciseon 124Sb Activity Measurements // Appl. Radiat. Isot. 2010. № 68. P. 1207–1210. https://doi.org/10.1016/j.apradiso.2010.01.037
Корнейков Р.И., Аксенова С.В., Иваненко В.И., Локшин Э.П. Устойчивость оксогидрофосфатов титана(IV) в водных средах // Неорган. материалы. 2018. Т. 54. № 7. С. 727–732. https://doi.org/10.7868/S0002337X18070126
Иваненко В.И., Корнейков Р.И., Локшин Э.П. Иммобилизация катионов металлов титанофосфатными сорбентами // Радиохимия. 2016. Т. 58. № 2 С. 140–146.
Malinen L.K., Koivula R., Harjula R. Sorption of Kadiocobalt and Its EDTA Complex on Titanium Antimonates // J. Hazard. Mater. 2009. № 172. P. 875–879. https://doi.org/10.1016/j.jhazmat.2009.07.099
Иваненко В.И., Локшин Э.П., Аксенова С.В., Корнейков Р.И., Калинников В.Т. Термодинамика гетерогенного катионного замещения на гидрофосфате титанила // Журн. неорган. химии. 2008. Т. 53. № 4. С. 557–563.
Давыдов Л.К., Дмитриева А.А., Конкина Н.Г. Общая гидрология. Л.: Гидрометеоизда, 1973. 454 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


