Неорганические материалы, 2021, T. 57, № 5, стр. 543-548
Изобарно-изотермические полиэдры твердых растворов системы Li–Ni–Mn–Co–O
Г. Д. Нипан *
Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
* E-mail: nipan@igic.ras.ru
Поступила в редакцию 18.11.2020
После доработки 02.12.2020
Принята к публикации 07.12.2020
Аннотация
На основе фрагментарных экспериментальных данных в рамках тетраэдра Li–Ni–Mn–Co построены изобарно-изотермические концентрационные полиэдры твердых растворов, существующих в системе Li–Ni–Mn–Co–O при температуре 800°C и парциальных давлениях кислорода 20–100 кПа. Проанализированы фазовые равновесия с участием твердых растворов LNMCO1, LNMCO2, LNMCO3 и LNMCO4, обладающих структурами галита – Li(Ni,Mn,Co)O, феррита α-NaFeO2 – Li(Ni,Mn,Co)O2, манганита – Li2MnO3 и шпинели – Li(Ni,Mn,Co)2O4.
ВВЕДЕНИЕ
Система Li–Ni–Mn–Co–O привлекла внимание исследователей при поиске дешевых и нетоксичных катодных материалов для литий-ионных аккумуляторов (ЛИА) [1, 2]. В громадном числе экспериментальных работ неоднократно воспроизведены структурные, термические и электрохимические характеристики однофазных смешанных оксидов для широкого спектра соотношений Li : Ni : Mn : Co, однако многофазовые равновесия с участием твердых растворов LNMCO1, LNMCO2, LNMCO3 и LNMCO4, обладающих структурами галита – Li(Ni,Mn,Co)O, феррита α-NaFeO2 – Li(Ni,Mn,Co)O2, манганита – Li2MnO3 и шпинели – Li(Ni,Mn,Co)2O4, исследованы фрагментарно [3–5], а в теоретических работах анализируются равновесия для идеализированных стехиометрических соединений [6].
Между тем, на электрохимические параметры ЛИА влияют не только температура, давление и концентрация компонентов в отдельном твердом растворе [7], но и фазовый состав системы Li–Ni–Mn–Co–O [4].
Ранее были оценены интервалы парциальных давлений кислорода, температур и катионных соотношений, в которых существуют LNMCO1, LNMCO2, LNMCO3 и LNMCO4 [8], однако в зависимости от изобарно-изотермических условий синтеза области гомогенности твердых растворов трансформируются.
При анализе фазовых равновесий в пятикомпонентной системе Li–Ni–Mn–Co–O в изобарно-изотермических условиях используется концентрационный тетраэдр Li–Ni–Mn–Co. На трех изоконцентрационных разрезах тетраэдра (10, 20 и 30 мол. % Co) определены соотношения катионов для областей гомогенности LNMCO1, LNMCO2 и LNMCO4 в изобарно-изотермических условиях (p(O2) = 100 кПа, t = 800°C) [3], а для образцов LiδNi0.25 –zMn0.75 –zCo2zOy (0 ≤ δ ≤ 1.75, 0 ≤ z ≤ 0.25) с катионными составами, принадлежащими сечению Li–Ni0.25Mn0.75–Mn0.50Co0.50 (p(O2) ~ 20 кПа, t = 900°C), исследованы фазовые превращения при изменении содержания лития [5].
В настоящем исследовании с помощью тетраэдра Li–Ni–Mn–Co представлены полиэдры гомогенности твердых растворов LNMCO1, LNMCO2, LNMCO3 и LNMCO4, совместно существующих в равновесных изобарно-изотермических условиях.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Область гомогенности LNMCO1 (Fm3m). Фазовый объем LNMCO1 в зависимости от температуры и парциального давления кислорода трансформируется внутри усеченного до 30 мол. % Li тетраэдра Li–Ni–Mn–Co, что соответствует насыщению литием твердого раствора NiO, MnO и CoO со структурой галита (NaCl) до граничных составов Li0.3(Ni,Mn,Co)0.7O [8]. Однофазный LNMCO1 при температуре 800°C и парциальных давлениях кислорода 20–100 кПа представляет собой ограниченный твердый раствор на основе NiO, которому в тетраэдре Li–Ni–Mn–Co соответствует объем, локализованный возле Ni (рис. 1). Монооксиды CoO, MnO и пероксид Li2O2 при t = = 800°C и p(O2) ~ 20 кПа не образуются, в квазибинарных системах NiO–(CoO) и (Li2O2)–NiO твердые растворы распространяются до составов Ni0.5Co0.5O [9] и Li0.3Ni0.7O [10], а для Ni1 – xMnxO предельная величина x не превышает 0.02 [11]. Содержание марганца в твердом растворе со структурой Fm3m в системе (Li2O2)–NiO–(MnO) увеличивается до Li0.3Ni0.5Mn0.2O (t = 800°C, p(O2) = = 100 кПа) [12] и снижается вместе с содержанием лития в системе (Li2O2)–NiO–(MnO)–(CoO) [3]. Область гомогенности LNMCO1 в изобарно-изотермическом тетраэдре Li–Ni–Mn–Co представлена полиэдром Ni–1–2–3–4–5 (жирные линии на рис. 1), в котором вершины 1, 2, 3 и 5 соответствуют составам Ni0.5Co0.5O, Li0.3Ni0.7O, Li0.3Ni0.35C0.35O и Li0.3Ni0.5Mn0.2O, а линия 4–5 практически вырождена в точку. Грани полиэдра Ni–1–2–3, Ni–2–5 и 2–3–4–5 принадлежат граням тетраэдра Li–Ni–Co, Li–Ni–Mn и сечению при 30 мол. % Li, грани 2–3–4–5 и 1–3–4 обращены к полиэдрам LNMCO2 и LNMCO4, а грань Ni–1–4–5 – в сторону мало исследованной концентрационной области тетраэдра Li–Ni–Mn–Co (рис. 1), в которой, например, образуется перовскит NiMnO3 [13]. Увеличение концентрации лития в LNMCO1 приводит к появлению твердого раствора LNMCO2 со слоистой структурой (R$\bar {3}$m), а снижение концентрации лития – к образованию шпинели LNMCO4 (Fd3m).
Рис. 1.
Полиэдры твердых растворов системы Li–Ni–Mn–Co–O в рамках изобарно-изотермической фазовой диаграммы Li–Ni–Mn–Co.
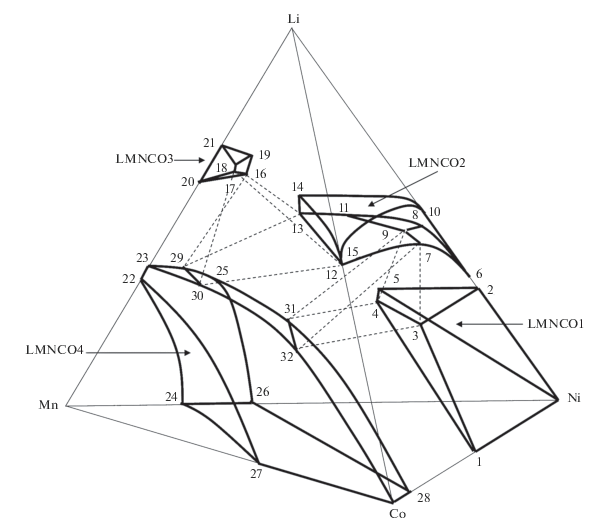
Область гомогенности LNMCO2 (R${\mathbf{\bar {3}}}$m). В условном тетраэдре составов Li–Ni–Mn–Co концентрационный полиэдр LNMCO2 трансформируется между плоскостями, отвечающими составам Li0.35(Ni,Mn,Co)O2 – δ и Li1.2(Ni,Mn,Co)O2 + δ [8]. Соответственно, изобарно-изотермический (p(O2) ~ 20 кПа, t = 900°C) катионный полиэдр LNMCO2 (рис. 1, 6–7 –8–9–10–11–12–13–14–15) располагается в тетраэдре Li–Ni–Mn–Co между сечениями 33–55 мол. % Li. При стабильно существующих ромбоэдрических (тип α-NaFeO2) модификациях LiCoO2, LiNiO2, LiNi1 –xCoxO2 (0 ≤ x ≤ ≤ 1), LiNi1 –xMnxO2 (0 ≤ x ≤ 0.5) [14] и не изоморфной им орторомбической модификация LiMnO2 [15] сечение изобарно-изотермического полиэдра гомогенности LNMCO2 в тетраэдре Li–Ni–Mn–Co при 50 мол. % Li принадлежит концентрационному треугольнику LiCoO2–LiNiO2–LiNi0.5Mn0.5O2 (10–12–13, рис. 1), для которого многократно исследованы составы LiNixMnyCozO2 (x + y + z = 1) со стехиометрическими отношениями Ni : Mn : : Co [16–20]. Идея стабильного существования непрерывного твердого раствора от Li(Ni,Co)O2 (R$\bar {3}$m) до Li2MnO3 (C2/m) [3] опровергается рядом экспериментальных данных, указывающих на существование упорядоченного двухфазного композита LNMCO2 + LNMCO3 [21–26]. Общий вид полиэдра LNMCO2 внутри тетраэдра Li–Ni–Mn–Co можно представить благодаря работам [3, 12, 27–30] (рис. 1). Наборы линий 6–10 [27], 6–7–12, 12–15, 10–15 [3] и 6–10, 6–8–11–13, 10–14, 13–14 [28] очерчивают грани LNMCO2 на гранях Li–Ni–Co и Li–Ni–Mn тетраэдра, а линии 12–15, 12–13, 14–15 и 13–14 [29, 30] обозначают грань LNMCO2 на сечении Li–Ni0.5Mn0.5–Co тетраэдра, обращенную к полиэдру LNMCO3. Поверхности 6–7–8–9–11–12–13 и 10–14–15 располагаются между сечениями тетраэдра 33–50 мол. % Li и 50–55 мол. % Li (рис. 1). На нижней поверхности участки 6–7–8–9 и 7–9–11–12–13 обращены к полиэдрам LNMCO1 и LNMCO4.
Область гомогенности LNMCO3 (C2/m). Твердый раствор на основе Li2MnO3 (LNMCO3) появляeтся при увеличении концентрации лития. На рис. 1 LNMCO3 представлен полиэдром 16–17–18–19–20–21. Избыточное содержание лития в Li2 +xMnO3 достигает x = 0.2 (69 мол. % Li) при p(O2) ~ 20 кПа и t = 850°C [15] (рис. 1, точка 21), составы Li1.7Mn1.3O3 (340°C, азот) [31] и Li1.75Mn1.25O3 (58 мол. % Li, 900°C, воздух) как результат образования твердого раствора Li(Li(1 –x)/3Mn(x+ 2)/3)O2 (0 ≤ x ≤ 0.5) характеризуют дефицит лития [32] (рис. 1, 20). После отжига на воздухе (t = 800–900°C) при введении оксида никеля структуру Li2MnO3 (C2/m) сохраняют гомогенные фазы Li2(Ni0.25Mn0.75)O3 (67 мол. % Li) [33] и Li[Li0.2Ni0.2Mn0.6]O2 (60 мол. % Li) [34] (рис. 1, 16 и 19 ). При введении оксидов кобальта области гомогенности принадлежат составы Li1.95Mn0.9Co0.15O3 (65 мол. % Li) [35], Li[Li0.29Mn0.59Co0.12] (64.5 мол. % Li) [36], Li[Li0.27Mn0.53Co0.2]O2 (64 мол. % Li) [37] и Li[Li0.2Mn0.4Co0.4]O2 (60 мол. % Li) [38] (рис. 1, 17 и 18 ). В последнем случае при увеличении температуры отжига с 750 до 950°C наблюдается обратимый переход от моноклинной структуры C2/m к гексагональной R$\bar {3}$m [38], что объясняется образованием высокотемпературной моноклинной модификации LiMnO2 (C2/m) и последующим ее объединением с LiCoO2 (C2/m) в непрерывный твердый раствор. Образцы 0.35Li2MnO3 ⋅ 0.65LiNi0.33Mn0.33Co0.33O2 (900°C, 57 мол. % Li) [39] и 0.5Li2MnO3 ⋅ 0.5LiNi0.42Mn0.42Co0.16O2 (500–1000°C, 60 мол. % Li) [40], отожженные на воздухе, неоднофазны, и указанные составы не принадлежат области гомогенности LNMCO3. Грани полиэдра 17–18–20–21 и 16–19–20–21 принадлежат граням Li–Mn–Co и Li–Ni–Mn тетраэдра, а грани 16–17–18–19 и 16–17–20 обращены к LNMCO2 и LNMCO4 (рис. 1).
Область гомогенности LNMCO4 (Fd3m). Твердый раствор со структурой шпинели Li1 + xMn2 – xO4 (0 ≤ x ≤ 0.11, 800°C) [41, 42] (рис. 1, точки 22 и 23) способен при снижении температуры обогащаться литием до Li4Mn5O12 [15, 41]. Шпинели на основе LiCo2O4 и LiNi2O4 существуют стабильно только при низких температурах [43], и для них характерны нестехиометрические соотношения Li : Co и Li : Ni [44–46]. В системе Li–Mn–Co–O область шпинели (Fd3m) объединяет Li1 +xMn2 –xO4 и Mn3 –xCoxO4 (1.8 ≤ x ≤ 3, 800°C) [42, 47, 48] (рис. 1, 27 и Co). Cостав LiMnCoO4 является граничным для разрезов LiMn2 –xCoxO4 [48, 49] и Li4 –xMn5 –2xCo3xO12 [48, 50], но начиная с 600°C из шпинели LiMnCoO4 при выделении кислорода образуются Li2MnO3 и литийдефицитная шпинель Li1 – 2xMn1 –xCoO4 – 3x– δ, состав которой при 780°C приближается к LiMn2Co3O8 [48]. В отличие от Co3O4 оксид Ni3O4 может существовать только как метастабильная фаза [43], и в системе Li–Mn–Ni–O область шпинели (Fd3m) связывает Mn3 –xNixO4 (0.7 ≤ x ≤ 1.2, 800°C) [51] (рис. 1, 24 и 26 ) с LiMn2 –xNixO4 (0 ≤ x ≤ ≤ 0.5) [12] (рис. 1, 22 и 25 ). В отсутствие Mn получена шпинель (NixCo1 –x)3O4 (0 ≤ x ≤ 0.3) [52] (рис. 1, 28 и Co), состав которой при снижении температуры отжига (350°С) распространяется до NiCo2O4 [53].
В рамках квазитрехкомпонентной системы LiMn2O4–LiNi2O4–LiCo2O4 область шпинели занимает треугольник LiMn2O4–LiMn1.5Ni0.5O4–LiMnCoO4 [5, 14, 54–56] и увеличение концентрации Co в LiMn1.5 –xNi0.5 –xCo2xO4 (0 ≤ x ≤ 0.5) способствует сохранению высокотемпературной модификации шпинели Fd3m при охлаждении [54–56]. В системе Li–Mn–Ni–Co–O шпинель может иметь дефицит по литию [3] и распространяться к (Mn,Ni,Co)3O4 [57, 58].
На полиэдре шпинели LNMCO4, представленном на рис. 1, точки 29–32 отмечены гипотетически для разделения поверхности на участки, обращенные к LNMCO1 (Co–28–31–32), LNMCO2 (25–29–30–31–32) и LNMCO3 (23–29–30). В тетраэдре Li–Ni–Mn–Co штриховыми линиями, соединяющими по три линии составов в моновариантных равновесиях, выделены два шестигранника, соответствующих равно-весиям LNMCO1(3–4) + LNMCO2(7–9) + + LNMCO4 (31–32) и LNMCO2(12–13) + + LNMCO3(16–17) + LNMCO4 (29–30).
Ретроградный характер растворимости оксидов в LNMCO2 (рис. 1) свидетельствует о том, что для сохранения однофазного твердого раствора Li(Ni,Mn,Co)O2, наиболее интересного для ЛИА, после отжига лучше использовать закаливание, а не медленное охлаждение, что подтверждается экспериментально [3].
ЗАКЛЮЧЕНИЕ
С помощью топологического моделирования на основе фрагментарных экспериментальных данных в рамках тетраэдра Li–Ni–Mn–Co построены изобарно-изотермические концентрационные полиэдры твердых растворов, существующих в системе Li–Ni–Mn–Co–O при температуре 800°C и парциальных давлениях кислорода 20–100 кПа. Проанализированы фазовые равновесия с участием твердых растворов LNMCO1, LNMCO2, LNMCO3 и LNMCO4, обладающих структурами галита – Li(Ni,Mn,Co)O, феррита α‑NaFeO2 – Li(Ni,Mn,Co)O2, манганита – Li2MnO3 и шпинели – Li(Ni,Mn,Co)2O4.
Список литературы
Ohzuku T., Makimura Y. Layered Lithium Insertion Material of LiCo1/3Ni1/3Mn1/3O2 for Lithium-Ion Batteries // Chem. Lett. 2001. V. 30. № 7. P. 642–643. https://doi.org/10.1246/cl.2001.642
Lu Z., MacNeil D.D., Dahn J.R. Layered Li[NixCo1 – 2xMnx]O2 Cathode Materials for Lithium-Ion Batteries // Electrochem. Solid-State Lett. 2001. V. 4. № 12. P. A200–A203. https://doi.org/10.1149/1.1413182
Brown C.R., McCalla E., Watson C., Dahn J.R. Combinatorial Study of the Li–Ni–Mn–Co Oxide Pseudoquaternary System for Use on Li–Ion Battery Materials Research // ACS Comb. Sci. 2015. V. 17. P. 381–391. https://doi.org/10.1021/acscombsci.5b00048
Thackeray M.M., Kang S.-H., Johnson C.S., Vaughey J.T., Benedek R., Hackney S.A. Li2MnO3-stabilized LiMO2 (M = Mn, Ni, Co) electrodes for lithium batteries // J. Mater. Chem. 2007. V. 17. № 30. P. 3112–3125. https://doi.org/10.1039/B702425H
Yang T., Wang D., Shi X., Han Y., Zhang H., Song D., Zhang L. Design and Property Investigations of Manganese-Based Cathode Material LiδNi0.25 –zMn0.75 –zCo2zOy (0 ≤ δ ≤ 1.75) for Lithium-Ion Batteries // Electrochim. Acta. 2019. V. 298. P. 595–517. https://doi.org/10.1016/j.electacta.2018.12.111
Kim Y. Effect of Metal Composition on the Structure of Layer‑Structured Cathode Materials for Li-Ion Batteries // Appl. Phys. A. 2020. V. 126. P. 556. https://doi.org/10.1007/s00339-020-03744-7
Houchins G., Viswanathan V. Towards Ultra Low Cobalt Cathodes: A High Fidelity Computational Phase Search of Layered Li–Ni–Mn–Co Oxides // J. Electrochem. Soc. 2020. V. 167. P. 070506. https://doi.org/10.1149/2.0062007JES
Нипан Г.Д., Клындюк А.И. Твердые растворы в системе Li–Ni–Mn–Co–O // Неорган. материалы. 2019. Т. 55. № 2. P. 154–160. https://doi.org/10.1134/S0002337X19020088
Abe Y., Meguro T., Oyamatsu S., Yokoyama T., Komeya K. Formation Region of Monophase with Cubic Spinel-Type Oxides in Mn–Co–Ni Ternary System // J. Mater. Sci. 1999. V. 34. P. 4639–4644. https://doi.org/10.1023/A:1004633610231
Antolini E. LixNi1 – xO (0 < x ≤ 0.3) Solid Solutions: Formation, Structure and Transport Properties // Mater. Chem. Phys. 2003. V. 82. № 3. P. 937–948. https://doi.org/10.1016/j.matchemphys.2003.08.006
Балакирев В.Ф., Бархатов В.П., Голиков Ю.В., Майзель С.Г. Манганиты: равновесные и нестабильные состояния. Екатеринбург: УрО РАН, 2000. С. 397.
McCalla E., Rowe A.W., Shunmugasundaram R., Dahn J.R. Structural Study of the Li–Mn–Ni Oxide Pseudoternary System of Interest for Positive Electrodes of Li-Ion Batteries // Chem. Mater. 2013. V. 25. P. 989–999. https://doi.org/10.1021/cm4001619
Kim H.-Y., Shin J., Jang I.-C., Ju Y.-W. Hydrothermal Synthesis of Three-Dimensional Perovskite NiMnO3 Oxide and Application in Supercapacitor Electrode // Energies. 2020. V. 13. P. 36. https://doi.org/10.3390/en13010036
Kan W.H., Huq A., Manthiram A. Exploration of a Metastable Normal Spinel Phase Diagram for the Quaternary Li–Ni–Mn–Co–O System // Chem. Mater. 2016. V. 28. № 6. P. 1832–1837. https://doi.org/10.1021/acs.chemmater.5b04994
Бузанов Г.А., Нипан Г.Д., Жижин К.Ю., Кузнецов Н.Т. Фазовые равновесия с участием твердых растворов в системе Li–Mn–O // ЖНХ. 2017. Т. 62. № 5. С. 551–558. https://doi.org/10.7868/S0044457X17050051
Wang L., Li J., He X., Pu W., Wan C., Jiang C. Recent Advances in Layered LiNixCoyMn1 –x–yO2 Cathode Materiales for Lithium Ion Batteries // J. Solid State Electrochem. 2009. V. 13. № 8. P. 1157–1164. https://doi.org/10.1007/s10008-008-0671-7
Noh H.J., Youn S., Yoon C.S., Sun Y.K. Comparison of the Structural and Electrochemical Properties of Layered Li[NixCoyMnz]O2 (x = 1/3, 0.5, 0.6, 0.7, 0.8 and 0.85) Cathode Material for Lithium-Ion Batteries // J. Power Sources. 2013. V. 233. P. 121–130. https://doi.org/10.1016/j.jpowsour.2013.01.063
Zheng J., Liu T., Hu Z., Wie Y., Song X., Ren Y., Wang W., Rao M., Lin Y., Chen Z., Lu J., Wang C., Amine K., Pan F. Tuning of Thermal Stability in Layered Li(NixMnyCoz)O2 // J. Am. Chem. Soc. 2016. V. 138. № 40. P. 13326–13334. https://doi.org/10.1021/jacs.6b07771
Julien C.M., Mauger A., Zaghib K., Groult H. Optimization of Layered Cathode Materials for Lithium-Ion Batteries // Materials. 2016. V. 9. P. 595. https://doi.org/10.3390/ma9070595
Xiao Y., Liu T., Liu J., He L., Chen J., Zhang J., Luo P., Lu H., Wang R., Zhu W., Hu Z., Teng G., Xin C., Zheng J., Liang T., Wang F., Chen Y., Huang Q., Pan F., Chen H. Insight into the Origin of Lithium/Nickel Ions Exchange in Layered Li(NixMnyCoz)O2 Cathode Materials // Nano Energy. 2018. V. 49. P. 77–85. https://doi.org/10.1016/j.nanoen.2018.04.020
Li J., Shunmugasundaram R., Doig R., Dahn J.R. In-situ X-ray Diffraction Study of Layered Li–Ni–Mn–Co Oxides: Effect of Particle Size and Structural Stability of Core-Shell Materials // Chem. Mater. 2016. V. 28. № 1. P. 162–171. https://doi.org/10.1021/acs.chemmater.5b03500
McCalla E., Lowartz C.M., Brown C.R., Dahn J.R. Formation of Layered–Layered Composites in the Li–Co–Mn Pseudoternary System during Slow Cooling // Chem. Mater. 2013. V. 25. P. 912–918. https://doi.org/10.1021/cm304002b
Geder J., Song J.H., Kang S.H., Yu D.Y.W. Thermal Stability of Lithium-Rich Manganese-Based Cathode // Solid State Ionics. 2014. V. 268. Part B. P. 242–246. https://doi.org/10.1016/j.ssi.2014.05.020
Kang S.H., Thackeray M.M. Enhancing the Rate Capability of High Capacity xLi2MnO3 ⋅ (1 – x)LiMO2 (M = = Mn, Ni, Co) Electrodes by Li–Ni–PO4 Treatment // Electrochem. Commun. 2009. V. 11. P. 748–751. https://doi.org/10.1016/j.elecom.2009.01.025
Lobo L.S., Kumar A.R. Synthesis, Structural and Electrical Properties of Li1.2Mn0.54Ni0.13Co0.13O2 Synthesised by Sol–Gel Method // Mater. Res. Innovations. 2017. V. 21. № 4. P. 249–256. https://doi.org/10.1080/14328917.2016.1210876
Ma X., He H., Sun Y., Zhang Y. Synthesis of Li1.2Mn0.54Ni0.13Co0.13O2 by Sol–Gel Method and Its Electrochemical Properties as Cathode Materials for Lithium-Ion Batteries // J. Mater Sci: Mater Electron. 2017. V. 28. № 2. P. 16665–16671. https://doi.org/10.1007/s10854-017-7578-y
Barton P.T., Premchand Y.D., Chater P.A., Seshadri R., Rosseinsky M.J. Chemical Inhomogeneity, Short-Range Order, and Magnetism in the LiNiO2–NiO Solid Solution // Chem. Eur. J. 2013. V. 19. № 43. P. 14521–14531. https://doi.org/10.1002/chem.201301451
McCalla E., Li J., Rowe A.W., Dahn J.R. The Negative Impact of Layered-Layered Composites on the Electrochemistry of Li–Mn–Ni–O Electrodes for Lithium-Ion Batteries // J. Electrochem. Soc. 2014. V. 161. № 4. P. A606–A613. https://doi.org/10.1149/2.083404jes
Shizuka K., Kobayashi T., Okahara K., Okamoto K., Kanzaki S., Kanno R. Characterization of Li1 +yNixCo1 – 2xMnxO2 Positive Active Materials for Lithium Ion Batteries // J. Power Sources. 2005. V. 146. № 1–2. P. 589–593. https://doi.org/10.1016/j.jpowsour.2005.03.046
Kim J.-M., Kumagai N., Kadoma Y., Yashiro H. Synthesis and Electrochemical Properties of Lithium Non-Stoichiometric Li1 +x(Ni1/3Co1/3Mn1/3)O2 + δ Prepared by a Spray Drying Method // J. Power Sources. 2007. V. 174. № 2. P. 473–479. https://doi.org/10.1016/j.jpowsour.2007.06.183
Zhang Q., Peng T., Zhan D., Hu X. Synthesis and Electrochemical Property of xLi2MnO3 ⋅ (1 – x)LiMnO2 Composite Cathode Materials Derived from Partially Reduced Li2MnO3 // J. Power Sources. 2014. V. 250. P. 40–49. https://doi.org/10.1016/j.jpowsour.2013.10.139
Saroha R., Gupta A., Panwar A.K. Electrochemical Performances of Li-rich Layered-Layered Li2MnO3–LiMnO2 Solid Solutions as Cathode Material for Lithium-Ion Batteries // J. Alloys. Compd. 2017. V. 696. P. 580–589. https://doi.org/10.1016/j.jallcom.2016.11.199
Matsunaga T., Komatsu H., Shimoda K., Minato T., Yonemura M., Kamiyama T., Kobayashi S., Kato T., Hirayama T., Ikuhara Y., Arai H., Ukyo Y., Uchimoto Y., Ogumi Z. Structural Understanding of Superior Battery Properties of Partially Ni-Doped Li2MnO3 as Cathode Material // J. Phys. Chem. Lett. 2016. V. 7. P. 2063–2067. https://doi.org/10.1021/acs.jpclett.6b00587
Jarvis K.A., Deng Z., Allard L.F., Manthiram A., Ferreira P.J. Atomic Structure of a Lithium-Rich Layered Oxide Material or Lithium-Ion Batteries: Evidence of a Solid Solution // Chem. Mater. 2011. V. 23. № 16. P. 3614–3621. https://doi.org/10.1021/cm200831c
Ozawa K., Nakao Y., Mochiku T., Cheng Z., Wang L., Iwai H., Tsuchiya Y., Fujii H., Igawa N. Electrochemical Characteristics of Layered Li1.95Mn0.9Co0.15O3 (C2/m) as a Lithium-Battery Cathode // J. Electrochem. Soc. 2012. V. 159. № 3. P. A300–A304. https://doi.org/10.1149/2.079203jes
Ye D., Wang B., Chen Y., Han G., Zhang Z., Hulcova-Jurcakova D., Zou J., Wang L. Understanding the Stepwise Capacity Increase of High Energy Low-Co Li-Rich Cathode Materials for Lithium Ion Batteries // J. Mater. Chem. A. 2014. V. 2. P. 18767–18774. https://doi.org/10.1039/c4ta03692a
Kumagai N., Kim J.-M., Tsuruta S., Kadoma Y., Ui K. Structural Modification of Li[Li0.27Co0.20Mn0.53]O2 by Lithium Extraction and its Electrochemical Property as the Positive Electrode for Li-Ion Batteries // Electrochim. Acta. 2008. V. 53. P. 5287–5293. https://doi.org/10.1016/j.electacta.2008.01.044
Sun Y., Shiosaki Y., Xia Y., Noguchi H. The Preparation and Electrochemical Performance of Solid Solutions LiCoO2–Li2MnO3 as Cathode Materials for Lithium Ion Batteries // J. Power Sources. 2006. V. 159. № 2. P. 1353–1359. https://doi.org/10.1016/j.jpowsour.2005.12.037
Song L., Tang Z., Chen Y., Xiao X., Li L., Zheng H., Li B., Liu Z. Structural Analysis of Layered Li2MnO3–LiMO2 (M = Ni1/3Mn1/3Co1/3, Ni1/2Mn1/2) Cathode Materials by Rietveld Refinement and First-Principles Calculations // Ceram. Int. 2016. V. 42. P. 8537–8544. https://doi.org/10.1016/j.ceramint.2016.02.080
Yu H., Kim H., Wang Y., He P., Asakura D., Nakamura Y., Zhou H. High-Energy ‘Composite’ Layered Manganese-Rich Cathode Materials via Controlling Li2MnO3 Phase Activation for Lithium-Ion Batteries // Phys. Chem. Chem. Phys. 2012. V. 14. № 18. P. 6584–6595. https://doi.org/10.1039/c2cp40745k
Paulsen J.M., Dahn J.R. Phase Diagram of Li–Mn–O Spinel in Air // Chem. Mater. 1999. V. 11. P. 3065–3079. https://doi.org/10.1021/cm9900960
Brown C.R., McCalla E., Dahn J.R. Analysis of the Cubic Spinel Region of the Li–Co–Mn Oxide Pseudo-Ternary System // Solid State Ionics. 2013. V. 253. P. 234–238. https://doi.org/10.1016/j.ssi.2013.09.051
Wang L., Maxisch T., Ceder G. A First-Principles Approach to Studying the Thermal Stability of Oxide Cathode Materials // Chem. Mater. 2007. V. 19. P. 543–552. https://doi.org/10.1021/cm0620943
Maiyalagan T., Jarvis K.A., Therese S., Ferreira P.J., Manthiram A. Spinel-Type Lithium Cobalt Oxide as a Bifunctional Electrocatalyst for the Oxygen Evolution and Oxygen Reduction Reactions // Nat. Commun. 2014. V. 5. P. 3949. https://doi.org/10.1038/ncomms4949
Choi S., Manthiram A. Chemical Synthesis and Properties of Spinel Li1 – xCo2O4 – δ // J. Solid State Chem. 2002. V. 164. P. 332–338. https://doi.org/10.1006/jssc.2001.9480
Cho Y., Lee Y.-S., Park S.-A., Lee Y., Cho J. LiNi0.8Co0.15Al0.05O2 Cathode Materials Prepared by TiO2 Nanoparticle Coatings on Ni0.8Co0.15Al0.05(OH)2 Precursors // Electrochim. Acta. 2010. V. 56. P. 333–339. https://doi.org/10.1016/j.electacta.2010.08.074
Bordeneuve H., Guillemet-Fritsch S., Rousset A., Schuurman S., Pouain V. Structure and Electrical Properties of Single-Phase Cobalt Manganese Oxide Spinels Mn3 –xCoxO4 Sintered Classically and by Spark Plasma Sintering (SPS) // J. Solid State Chem. 2009. V. 182. P. 396–401. https://doi.org/10.1016/j.jssc.2008.11.004
Reeves-McLaren N., Sharp J., Beltran-Mir N., Rainforth W.M., West A.R. Spinel-Rock Salt Thansformation in LiCoMnO4 – δ // Proc. R. Soc. A. 2016. V. 472. P. 20140991. https://doi.org/10.1098/rspa.2014.0991
Amarilla J.M., Rojzs R.M., Pico F., Pascual L., Petrov K., Kovacheva D., Lazarraga M.G., Rojo J.M. Nanosized LiMyMn2 – y O4 (M = Cr, Co and Ni) Spinels Synthesized by a Sucrose-Aided Combustion Method. Structural Characterization and Electrochemical Properties // J. Power Sources. 2007. V. 174. P. 1212–1217. https://doi.org/10.1016/j.jpowsour.2007.06.056
Robertson A.D., Amstrong A.R., Bruce R.G. Low Temperature Lithium Manganese Cobalt Oxide Spinels, Li4 –xMn5 – 2xCo3xO12 (0 ≤ x ≤ 1), for Use as Cathode Materials in Rechargeable Lithium Batteries // J. Power Sources. 2001. V. 97–98. P. 332–335.
Kjellqvist L., Selleby M. Thermodynamic Assessment of the Mn–Ni–O System // Int. J. Mater. Res. 2010. V. 101. P. 1222–1231. https://doi.org/10.3139/146.110412
Kaboon S., Hu Y.H. Study of NiO–CoO and Co3O4–Ni3O4 Solid Solutions in Multiphase Ni–Co–O Systems // Ind. Eng. Chem. Res. 2011. V. 50. P. 2015–2020.https://doi.org/10.1021/ie101249r
Huang T., Liu B., Yang P., Qiu Z., Hu Z. Facilely Synthesized NiCo2O4 Nanoparticles as Electrode Material for Supercapacitors // Int. J. Electrochem. Sci. 2018. V. 13. P. 6144–6154. https://doi.org/10.20964/2018.06.60
Alca’ntara R., Jaraba M., Lavela P., Tirado J.L. New LiNiyCo1 – 2yMn1 +yO4 Spinel Oxide Solid Solutions as 5 V Electrode Material for Li-Ion Batteries // J. Electrochem. Soc. 2004. V. 151. P. A53–A58. https://doi.org/10.1149/1.1625945
Li D., Ito A., Kobayakawa K., Noguchi H., Sato Y. Structural and Electrochemical Characteristics of LiNi0.5 – xCo2xMn1.5 – xO4 Prepared by Spray Drying Process and Post-Annealing in O2 // J. Power Sources. 2006. V. 161. P. 1241–1246. https://doi.org/10.1016/j.jpowsour.2006.04.120
Ito A., Li D., Lee Y., Kobayakawa K., Sato Y. Influence of Co Substitution for Ni and Mn on the Structural and Electrochemical Characteristics of LiNi0.5Mn1.5O4 // J. Power Sources. 2008. V. 185. P. 1423–1433. https://doi.org/10.1016/j.jpowsour.2008.08.087
Oh S.W., Park S.-H., Amine K., Sun Y.-K. Synthesis and Characterization of Spherical Morphology [Ni0.4Co0.2Mn0.4]3O4 Materials for Lithium Secondary Batteries // J. Power Sources. 2006. V. 160. P. 558–562. https://doi.org/10.1016/j.jpowsour.2006.01.023
Yokoyama T., Meguro T., Shimada Y., Tatami J., Komeya K., Abe Y. Preparation and Electrical Properties of Sintered Oxides Composed of Mn1.5Co(0.25 +x)Ni(1.25 –x)O4 (0 ≤ ≤ x ≤ 0.75) with a Cubic Spinel Structure // J. Mater. Sci. 2007. V. 42. P. 5860–5966. https://doi.org/10.1007/s10853-006-1141-1
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


