Неорганические материалы, 2021, T. 57, № 5, стр. 467-499
Неорганические материалы для регенеративной медицины
Т. В. Сафронова *
Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: t3470641@yandex.ru
Поступила в редакцию 24.08.2020
После доработки 22.12.2020
Принята к публикации 23.12.2020
Аннотация
В основе методов, используемых в регенеративной медицине, лежит присущая живым организмам способность к регенерации собственных тканей. В том случае, если дефект превышает некоторый критический размер (объем), регенерация может быть инициирована и поддержана с помощью резорбируемых пористых матриц из природных, искусственных или синтетических материалов, временно компенсирующих дефект. Модифицированные лекарственными препаратами, специфическими белками или клетками такие пористые матрицы называют конструкциями тканевой инженерии. Чаще всего неорганические резорбируемые материалы используют при лечении дефектов костной ткани. Естественная кость представляет собой композит с полимерной (коллагеновой) матрицей, наполненной нанокристаллами фосфатов кальция в виде устойчивого к растворению гидроксиапатита кальция. По этой причине материалы на основе фосфатов кальция являются лидерами медицинского неорганического материаловедения. Разработаны резорбируемые биосовместимые материалы на основе трикальцийфосфата, пирофосфата кальция, брушита, монетита, октакальциевого фосфата. Гидроксиапатит кальция известен как неорганический ионообменник. Поэтому в составе костной ткани кроме фосфат-ионов и ионов кальция присутствуют карбонат-ионы, силикат-ионы, сульфат-ионы, а также ионы натрия, калия, магния, железа, стронция, цинка и ряда других металлов. Присутствие в костной ткани анионов, замещающих ортофосфат-ион или гидроксид-ион в гидроксиапатите кальция костной ткани, вдохновило исследователей на создание резорбируемых материалов на основе сульфатов кальция, карбоната кальция и фосфатов кальция с замещением ортофосфат-иона названными анионами. Катионные замещения в гидроксиапатите кальция костной ткани и химический состав среды организма стали основанием для создания и использования в качестве резорбируемых материалов для костных имплантатов катионзамещенных фосфатов кальция и двойных фосфатов кальция-биосовместимого катиона, таких как натрийзамещенный трикальцийфосфат, калийзамещенный трикальцийфосфат, натриевый ренанит, калиевый ренанит, двойной пирофосфат кальция-магния. Управление резорбцией неорганического материала, предназначенного для использования в качестве лекарственного средства, может быть осуществлено проектированием заданного фазового состава. Перечисленные выше биосовместимые резорбируемые фазы могут быть использованы в различных сочетаниях в уже созданных и создаваемых новых композиционных материалах. Формирование микроструктуры биосовместимого резорбируемого неорганического материала может быть осуществлено в результате различных физико-химических процессов. Фазовый состав и микроструктура керамического материала формируются в процессе твердофазного, жидкофазного спекания, а также в результате гетерогенных химических реакций, протекающих при обжиге. Фазовый состав и микроструктура цементного камня формируются в результате реакций химического связывания, инициированных добавлением воды или водных растворов. Аморфные материалы могут быть получены сплавлением исходных компонентов или с использованием золь–гель-технологии. Остеокондуктивность биосовместимого неорганического резорбируемого материала – важное свойство, необходимое для проникновения в материал имплантата питающих жидкостей организма и костных клеток. Макропористость, определяющая остеокондуктивность неорганического резорбируемого материала, создается с использованием различных технологических приемов. Методы 3D-печати позволяют получать материалы необходимого фазового состава и микроструктуры с проницаемой макропористостью заданной архитектуры. Развитая поверхность пористого неорганического материала рассматривается как фактор управления скоростью резорбирования. В настоящем обзоре обобщена информация о существующих биосовместимых резорбируемых неорганических материалах для регенеративной медицины, рассмотрены физико-химические основы создания и способы их получения с использованием синтетических исходных порошков и природных материалов.
ВВЕДЕНИЕ
Неорганические резорбируемые материалы чаще всего используют при лечении дефектов костной ткани. В научной литературе отражены различные стратегии создания и использования биосовместимых материалов для компенсации и лечения дефектов костной ткани, размер которых превышает критический. Критическим размером дефекта костной ткани принято считать наименьший костный дефект в конкретной кости определенного вида живого организма, который не заживает самопроизвольно или показывает менее 10% костной регенерации в течение его жизни [1]. Компенсация дефекта костной ткани с размером более критического может быть осуществлена с применением аутотрансплантатов, аллоимплантатов, ксеноимплантатов или биосовместимых синтетических материалов [2–5]. Применение аутотрансплантатов связано с высокой травматичностью пациента, применение аллоимплантатов или ксеноимплантатов несет в себе опасность отторжения вследствие иммунного ответа организма реципиента на чужеродную ткань донора. Применение синтетических биосовместимых материалов позволяет обойтись без излишней травматизации пациента и нежелательного иммунного ответа его организма.
Состав и структура костной ткани как подсказка. Естественная кость представляет собой композит с полимерной (коллагеновой) матрицей [6], наполненной нанокристаллами фосфатов кальция преимущественно в виде устойчивого к растворению гидроксиапатита кальция. Были предприняты неоднократные попытки воспроизвести структуру естественной костной ткани сочетанием полимерной или гидрогелевой матрицы и неорганического, предпочтительно кальцийфосфатного, наполнителя [7, 8]. Хотя природные, искусственные (полусинтетические) и синтетические полимеры имеют свои преимущества [9], взаимодействие костной ткани живого организма и имплантата, содержащего полимеры и гидрогели, может сопровождаться нежелательными процессами. Воспаление в области имплантации при лечении дефектов костной ткани с использованием полимеров и гидрогелей может быть обусловлено недостаточной очисткой полимеров природного происхождения и присутствием следов токсичных продуктов в искусственных и синтетических полимерах, привнесенных при их синтезе или переработке. Роль фосфатов и других солей кальция как наполнителя в композите с полимерной матрицей или компонента материала неорганической природы прежде всего заключается в сообщении сигнала костным/стволовым клеткам о дружелюбной среде для их распространения, роста, деления и дифференциации [10–12].
В настоящее время регенеративные методы лечения дефектов костной ткани приобретают все большую популярность. Для реализации регенеративных методов лечения дефектов костной ткани необходимо создание имплантатов из биосовместимых резорбируемых материалов, которые, выполнив свое предназначение временного заполнения дефекта, затем перерабатываются организмом при восстановлении костной ткани. Используемые для изготовления костных имплантатов резорбируемые фосфаты и другие соли кальция являются источником ионов для построения новой костной ткани. Регенерация костной ткани может быть инициирована и поддержана с помощью резорбируемых пористых матриц из природных, искусственных или синтетических материалов, временно компенсирующих дефект. Модифицированные белками, клетками, антибиотиками пористые резорбируемые матрицы – конструкции тканевой инженерии – относят к последнему поколению синтетических материалов для лечения дефектов костной ткани [13–16]. Поверхность костного имплантата из неорганического оксидного материала гидрофильна. При внесении в костный дефект неорганический пористый имплантат пропитывается кровью пациента и его поверхность в этот же момент подвергается модификации. Предварительная модификация поверхности неорганического пористого имплантата антибиотиками и факторами роста до применения в качестве лекарственного средства является предметом интенсивных исследований [17]. Управление свойствами костных имплантатов или конструкций тканевой инженерии на основе неорганических кальцийфосфатных материалов может быть осуществлено с использованием модификации поверхности органическими и неорганическими веществами [18, 19]. Изменение рельефа также может рассматриваться как вариант модификации поверхности костного имплантата [20], в том числе обработкой поверхности материала выдерживанием в модельных средах [21].
Биосовместимые минералы в организме человека. По данным научной литературы в химическом и минералогическом составе неорганического компонента костной ткани преобладает гидроксиапатит [22]. Структура гидроксиапатита костной ткани отличается от структуры стехиометрического гидроксиапатита из-за многочисленных катионных и анионных замещений [23]. Гидроксиапатит кальция известен как неорганический ионообменник [24–26]. Данное свойство гидроксиапатита проявляется замещениями в структуре природного гидроксиапатита ${\text{РО}}_{4}^{{3 - }}$ на ${\text{HPO}}_{{\text{4}}}^{{{\text{2}} - }},$ ${\text{CO}}_{{\text{3}}}^{{{\text{2}} - }},$ ${\text{SiO}}_{{\text{4}}}^{{{\text{4}} - }}$ [27], гидроксильной группы ОН– на Cl–, F–, ${\text{CO}}_{{\text{3}}}^{{{\text{2}} - }},$ а также Са2+ на K+, Na+, Mg2+, Sr2+ [28]. Соблюдение электронейтральности соединения приводит не только к сочетанию анионных и катионных замещений, но и к образованию вакансий в структуре апатита. Исследования элементного состава костной ткани показали, что список элементов в структуре гораздо богаче и включает следующие элементы: Na, K, Mg, Zn, Si, Fe, Sr, Ni, Al, Cr, Ba, Ti, Cu, Co, Mn, Sn, V, Pb, Sr [29, 30].
Следует отметить, что химический и фазовый состав биосовместимых минералов, сформированных в организме млекопитающего в результате патологических процессов при нарушении обмена веществ [31–34], также может быть принят во внимание как мотивирующий при создании неорганических материалов для костных имплантатов. В списке среди минералов, сформированных в результате нарушения обмена веществ, находятся: гидроксиапатит Са10(РО4)6(ОН)2, трикальцийфосфат – витлокит Ca3(PO4)2, струвит MgNH4PO4 ⋅ · 6H2O, гидратированный пирофосфат Ca2P2O7 ⋅ · 2H2O/Ca2P2O7 ⋅ 4H2O, брушит CaHPO4 ⋅ 2H2O, октакальциевый фосфат Ca8(HPO4)2(PO4) ⋅ 5H2O, карбонаты кальция CaCO3 (ватерит, арагонит и кальцит), силикат кальция – хатрурит Ca3SiO5, уевеллит CаC2O4 ⋅ H2O, уедделлит CаC2O4 ⋅ 2H2O, урикит C5H4N4O3, дигидрат мочевой кислоты C5H4N4O3 ⋅ 2H2O, урат аммония C5H2O3N4(NH4)2 [35–37]. Об использовании оксалатов кальция, уратов или дигидрата мочевой кислоты для создания биоматериалов как лекарственных средств в научной литературе не сообщается. Остальные минералы, в основном соли кальция и магния, которые могут формироваться в результате патологических процессов в организме млекопитающих, в том или ином виде применяются для создания костных имплантатов.
Биосовместимые и биорезорбируемые фазы материалов для костных имплантатов. Для развития передовых методов лечения дефектов костной ткани методами регенеративной медицины [38] особый интерес представляют пористые неорганические матрицы, состоящие из биосовместимых биорезорбируемых фаз. Список таких фаз достаточно объемный. Следует упомянуть следующие биорезорбируемые фазы неорганической природы: Са-дефицитный гидроксиапатит, карбонатзамещенный гидроксиапатит, трикальцийфосфат, пирофосфат кальция, тромелит, полифосфат кальция, Na- и/или K-замещенный трикальцийфосфат, калиевый и натриевый ренаниты, двойные пирофосфаты кальция-натрия и кальция-калия, силикат кальция, аморфные фазы (в системах, содержащих оксиды-стеклообразователи Р2О5 и SiО2), брушит, монетит, гидратированные пирофосфаты кальция, карбонаты кальция, сульфаты кальция. Материалы неорганической природы, включающие эти фазы, могут быть переработаны (резорбированы) организмом при имплантации, поскольку хотя бы и в незначительной степени растворимы в воде либо физиологическом растворе в модельных экспериментах или при имплантации в среде организма [39].
В табл. 1 [40] представлены данные по растворимости и резорбции некоторых материалов, применяемых в настоящее время для лечения и компенсации дефектов костной ткани.
Таблица 1.
Характеристика растворимости и резорбции некоторых солей кальция, применяемых для лечения или компенсации дефектов костной ткани
| Материалы | Са10(РО4)6(ОН)2 | β-Сa3(PO4)2 | СаСО3 | СаНРО4 ⋅ 2Н2О | СаSO4 ⋅ 2Н2О |
|---|---|---|---|---|---|
| рKs (= –lg Ks) | 118 | 28.9 | 8.4 (кальцит) 8.2 (арагонит) |
6.6 | 4.2 |
| Растворимость s, моль/л | 0.4 × 10–7 | 0.6 × 10–6 | 0.6 × 10–4 | 0.5 × 10–3 | 0.8 × 10–2 |
| рСа (= –lgs) | 7.4 | 6.2 | 4.2 – 4.1 | 3.3 | 2.1 |
| Оценка резорбции по литературным данным | – – | – | + | ++ | ++ |
Следует отметить, что существуют два подхода к управлению растворимостью/резорбируемостью синтетических неорганических материалов, предназначенных для изготовления костных имплантатов. Один из них предполагает создание ионных замещений в кристаллической структуре ионного соединения. И этот подход широко применяется для повышения раствормости/резобируемости гидроксиапатита кальция. Другой подход предполагает создание композиционных материалов, которые сочетают в своем составе фазы, способные растворяться с различной скоростью. Оба подхода нашли свое развитие в рамках неорганического медицинского материаловедения как по отдельности, так и в сочетании.
Проектирование фазового и химического состава резорбируемых неорганических материалов для лечения дефектов костной ткани. Проектирование фазового и химического составов резорбируемых неорганических материалов для лечения дефектов костной ткани проводится с учетом химического и минералогического составов ее неорганической составляющей. Поскольку гидроксиапатит является преобладающим минералом костной ткани, то чаще всего при разработке неорганических (керамических или аморфных) материалов для костных имплантатов рассматривают оксидные системы, в которых присутствуют оксиды фосфора и/или кальция: CaO–P2O5, CaO–P2O5–H2О [41, 42], Na2О–CaO–P2O5, K2О–CaO–P2O5, СаО–Р2О5–K2O–Na2O [43, 44], MgO–CaO–P2O5 [45, 46], СаО–Р2О5–SiO2, CaO–P2O5–SiO2–H2О, Na2O–СаО–Р2О5–SiO2 [47–50], K2O–СаО–Р2О5–SiO2, MgО–Р2О5–SiO2, CaO–MgО–Р2О5–SiO2 [51, 52], CaO–MgO–P2O5–CaF [53], CaO–SO3 [54], СаО–Р2О5–SO3 [55], СаО–Р2О5–SO3–Н2О [56], CaO–SO3–SiO2 [57, 58], CaO–SO3–SiO2–Na2O–P2O5 [59], СаО–CO2 [60, 61], СаО–Р2О5–CO2 и CaO–P2O5–CO2–H2О [62–65]. Следует упомянуть также и системы, в которых материалы получают в результате протекания реакций химического связывания: CaO–P2O5–H2О, CaO–SiO2–Н2О [66], СаО–SО3–Н2О [67–69], NH3–MgО–Р2О5, H2O–MgО–Р2О5 и H2O–NH3–MgО–Р2О5 [70], CaO–Р2О5–SiO2–Н2О [71], CaO–MgО–Р2О5–SiO2–Н2О [72], CaO–P2O5–SiO2–CO2–H2О [73], СаО–Р2О5–SО3–Н2О [74–76] и СаО–MgO–Р2О5–SО3–Н2О [77].
Перечисленные системы содержат множество фаз и подходят для проектирования и создания неорганических композитов, в которых резорбируемость (растворимость) может регулироваться сочетанием фаз, обладающих различной растворимостью. Примером наиболее изученного и широко используемого в медицинской практике материала является композит, который содержит одновременно гидроксиапатит кальция Са10(РО4)6(ОН)2 и трикальцийфосфат Ca3(PO4)2 [78–82].
В качестве модификаторов микроструктуры керамики на основе ортофосфатов кальция использовали и используют вещества, содержащие ионы K+, Na+ [83], ${\text{CO}}_{3}^{{2 - }}$ [84] и Mg2+ [85], Zn2+ [86], хлориды, фториды [87] и силикаты Si4+ [88]. Упомянутые добавки, если их содержание в порошковой системе невелико, вызывают формирование твердых растворов, иногда соединений, влияют на процессы объемной и поверхностной диффузии при спекании.
При синтезе порошков фосфатов кальция [89], создании керамических или цементных материалов для костных имплантатов в их состав могут вводиться допирующие ионы [90, 91], придающие материалу особые свойства, например антибактериальные [92]. Использование многокомпонентных оксидных систем, в состав которых входят оксиды натрия или калия, при создании материалов для костных имплантатов привлекательно еще и тем, что в них присутствуют соединения и эвтектики с низкой температурой плавления. Использование добавок, формирующих расплавы и затем биосовместимые фазы, а при растворении дающих биосовместимые ионы, делает получение керамических материалов более удобным за счет снижения температуры обжига.
Совокупность в одном материале различных фаз, обладающих различной прочностью, скоростью биодеградации или способностью вызывать различный уровень рН при погружении в среду организма, позволяет управлять свойствами создаваемых костных имплантатов. Так, например, композиты, содержащие натриевый NaCaPO4 или калиевый KCaPO4 ренаниты, при взаимодействии с водой подвергаются гидролизу, в результате чего рН среды становится щелочным [21, 43]. А вот при взаимодействии трикальцийфосфата Са3(РО4)2 с водой происходит закисление среды [93]. При сочетании фаз, генерирующих сильнощелочной или сильнокислый уровень рН, при их сопоставимой растворимости можно ожидать приемлемого, т.е. близкого к нейтральному, уровеня рН среды вокруг материала костного имплантата.
Упомянутые оксидные системы и их сочетания являются основой для создания неорганических композиционных материалов с заданными свойствами. Рассмотрим некоторые оксидные системы, которые чаще всего используются для получения неорганических резорбируемых материалов.
СИСТЕМА СаО–Р2О5–Н2О
Рассмотрение данной системы важно по нескольким причинам. Гидроксиапатит кальция Са10(РО4)6(ОН)2 (основной неорганический компонент костной ткани), формула которого может быть записана как 10СаО ⋅ 3Р2О5 ⋅ Н2О, принадлежит этой системе. Данной системе принадлежат синтетические порошковые прекурсоры, используемые в дальнейшем при получении гранул, композитов с полимерными/гидрогелевыми матрицами, керамических и цементных материалов. В данной системе происходит формирование различных кальцийфосфатных цементов. Система СаО–Р2О5–Н2О и сосуществование в ней различных фосфатов кальция неоднократно рассмотрены в литературе при различных температурах [94, 95], давлениях и рН [96, 97], а также с оценкой термодинамических параметров образования существующих там соединений [98–102]. Как часть системы СаО–Р2О5–Н2О важна и система СаО–Р2О5 [103]. На рис. 1 представлен треугольник мольных соотношений оксидов в соединениях, принадлежащих системе СаО–Р2О5–Н2О. На рис. 1 отмечены различные существующие в нем соединения, использование которых возможно при получении материалов для костных имплантатов. В табл. 1 приведены координаты точек для соединений данного треугольника мольных соотношений.
Рис. 1.
Треугольник мольных соотношения оксидов в соединениях, принадлежащих системе СаО–Р2О5–Н2О (формула соединения указана слева от точки, кроме Са3(РО4)2, Са10(РО4)6О, Са4(РО4)2О, Са10(РО4)6(ОН)2.
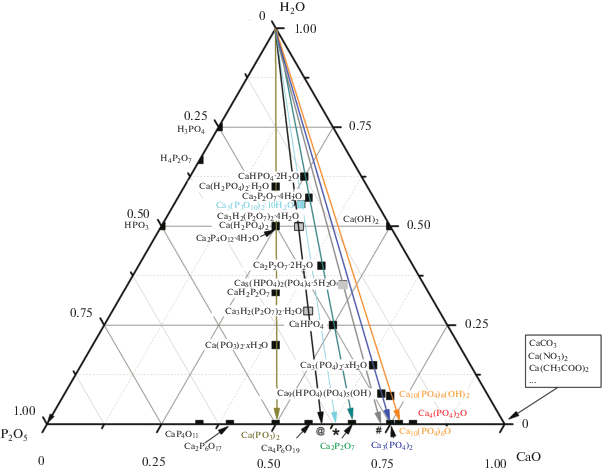
Для синтеза фосфатов кальция, расположенных в поле треугольника, рационально использовать соединения, расположенные в вершинах и на сторонах треугольника. При синтезе определенного фосфата кальция важно не только рассчитанное по уравнению реакции количество реагентов, но и рН, а также температура в зоне реакции, которые, по сути, и определяют результат синтеза [41]. Представленный треугольник мольных соотношений может быть использован для определения пары реагентов для получения целевого фосфата кальция. Образование кислых и основных фосфатов кальция в системе СаО–Р2О5–Н2О протекает в результате кислотно-основного взаимодействия, к которому обобщенно относят реакции ионного обмена, нейтрализации, гидролиза, дегидратации и т.д. [104]. Примером кислотно-основного взаимодействия может служить взаимодействие фосфорных кислот и гидроксида кальция. Фосфорные кислоты и гидроксид кальция/оксид кальция используют как исходные вещества при синтезе различных фосфатов кальция. Взаимодействие данных веществ в виде растворов или суспензий (паст) при поддержании заданного рН и соотношения реагентов позволяет получить фосфаты кальция, не содержащие кроме воды других сопутствующих продуктов реакции синтеза. Реакции (1)–(4) описывают взаимодействие водного раствора ортофосфорной кислоты Н3РО4 и гидроксида кальция Са(ОН)2:
(1)
$2{{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{4}} + {\text{Са(ОН}}{{{\text{)}}}_{2}} = {\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {{{\text{Н}}}_{{\text{2}}}}{\text{О}},$(2)
${{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{4}} + {\text{Са(ОН}}{{{\text{)}}}_{2}} = {\text{СаНР}}{{{\text{О}}}_{4}} \cdot 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}},$(3)
$\begin{gathered} {\text{6}}{{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{4}} + 9{\text{Са(ОН}}{{{\text{)}}}_{2}} = \\ = \,\,{\text{С}}{{{\text{а}}}_{{\text{9}}}}({\text{НР}}{{{\text{О}}}_{{\text{4}}}}){{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{{\text{5}}}}{\text{ОН}} + 17{{{\text{Н}}}_{{\text{2}}}}{\text{О}}, \\ \end{gathered} $(4)
$\begin{gathered} {\text{6}}{{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{4}} + 10{\text{Са(ОН}}{{{\text{)}}}_{2}} = \\ = \,\,{\text{С}}{{{\text{а}}}_{{{\text{10}}}}}{{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{{\text{6}}}}{{({\text{ОН}})}_{2}} + 18{{{\text{Н}}}_{{\text{2}}}}{\text{О}}. \\ \end{gathered} $Моногидрат монокальцийфосфата Са(Н2РО4)2 ⋅ · Н2О (реакция (1)) из-за достаточно высокой растворимости и низкого рН при растворении не используют напрямую в качестве материала для костных имплантатов, однако в качестве прекурсора его применяют для синтеза порошков других фосфатов кальция, при создании кальцийфосфатных цементов и в качестве прекурсора полифосфата кальция Са(РО3)2 в керамических материалах. Моногидрат монокальцийфосфата Са(Н2РО4)2 ⋅ · Н2О может быть синтезирован и при взаимодействии других реагентов, принадлежащих системе СаО–Р2О5–Н2О. Разработан синтез гидроксиапатита кальция Са10(РО4)6(ОН)2 по реакции (4) [105]. В форме порошкового прекурсора Са(Н2РО4)2 ⋅ Н2О был синтезирован по реакции (5) из гидроксиапатита Са10(РО4)6(ОН)2 и водного раствора ортофосфорной кислоты Н3РО4 [106]. Взаимодействие гидроксиапатита кальция Са10(РО4)6(ОН)2 и водного раствора ортофосфорной кислоты Н3РО4 позволяет синтезировать и другие кислые фосфаты кальция (реакции (6), (7)). При взаимодействии водного раствора фосфорной кислоты Н3РО4 и гидроксиапатита Ca10(PO4)6(OH)2 возможно образование брушита CaHPO4 ⋅ 2Н2О (реакция (6)) и монетита CaHPO4 (реакция (7)). Моногидрат монокальцийфосфатa Са(Н2РО4)2 ⋅ Н2О может быть синтезирован также и из карбоната кальция СаСО3 и водного раствора фосфорной кислоты по реакции (9) [107]:
(5)
$\begin{gathered} 14{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{6}}}}{{({\text{OH}})}_{2}} + \\ + \,\,8{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 10{\text{Ca(}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}}, \\ \end{gathered} $(6)
$\begin{gathered} 4{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{6}}}}{{({\text{OH}})}_{2}} + \\ + \,\,18{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 10{\text{CaHP}}{{{\text{O}}}_{4}} \cdot 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}}, \\ \end{gathered} $(7)
$\begin{gathered} 4{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{6}}}}{{({\text{OH}})}_{{\text{2}}}} = \\ = \,\,10{\text{CaHP}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(8)
${{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{2}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 3{\text{CaHP}}{{{\text{O}}}_{4}} \cdot 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}},$(9)
$2{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} + {\text{CaC}}{{{\text{O}}}_{3}} = {\text{Ca(}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{C}}{{{\text{O}}}_{2}}.$Использование СаСО3 как источника оксида кальция СаО при получении фосфатов кальция в системах СаО–Р2О5–Н2О или СаО–Р2О5 оказывается весьма удобным. Оксид кальция СаО при хранении может претерпевать превращения под действием влаги воздуха и углекислого газа. Изменение состава оксида кальция при хранении может быть причиной неточного дозирования исходных компонентов для синтеза фосфата кальция с заданным мольным соотношением Са/Р. Углекислый газ как сопутствующий продукт реакции карбоната кальция с водными растворами фосфорных кислот при получении кислых фосфатов кальция не загрязняет и не модифицирует поверхность получаемого продукта.
Реакции (2)–(5), (7), (8) могут быть применены для получения кальцийфосфатного цементного камня и для синтеза порошков (реакция (2)) [108]. Взаимодействием порошка Ca3(PO4)2 и фосфорной кислоты H3PO4 получены трехмерные пористые образцы брушита (реакция (9)) [109, 110]. Синтез октакальциевого фосфата Са8(НРО4)2(РО4)4 ⋅ 5Н2О, по литературным данным, может быть осуществлен в ограниченной области значений температуры и рН, для поддержания которых необходимо использование буферных растворов [111]. Реакции (11)–(16) используют для получения кальцийфосфатного цементного камня [112–116] и для синтеза порошков (реакции (11), (12), (15)) [117, 118]. Взаимодействие моногидрата монокальцийфосфата Ca(H2PO4)2 ⋅ Н2О и пирофосфата кальция Ca2P2O7 (реакция (17)) использовано при формовании прекерамических полуфабрикатов [119]:
(10)
$\begin{gathered} 3{\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 7{\text{Са(ОН}}{{{\text{)}}}_{2}} = \\ = \,\,{\text{С}}{{{\text{а}}}_{{{\text{10}}}}}{{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{{\text{6}}}}{{({\text{ОН}})}_{2}} + 15{{{\text{Н}}}_{{\text{2}}}}{\text{О}}, \\ \end{gathered} $(11)
$\begin{gathered} {\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{Са(ОН}}{{{\text{)}}}_{2}} = \\ = \,\,2{\text{CaHP}}{{{\text{O}}}_{4}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(12)
$\begin{gathered} {\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 2{\text{C}}{{{\text{a}}}_{{\text{4}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,{\text{C}}{{{\text{a}}}_{{\text{9}}}}{\text{HP}}{{{\text{O}}}_{{\text{4}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{5}}}}{\text{OH}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(13)
$2{\text{CaHP}}{{{\text{O}}}_{4}} + 2{\text{C}}{{{\text{a}}}_{{\text{4}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{2}}}}{\text{O}} = {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{6}}}}({\text{OH}}),$(14)
$\begin{gathered} 2{\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{C}}{{{\text{a}}}_{{\text{4}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,6{\text{CaHP}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(15)
$\begin{gathered} 4{\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{2}}}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{С}}{{{\text{а}}}_{{{\text{10}}}}}{{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{{\text{6}}}}{{({\text{ОН}})}_{2}} = \\ = \,\,14{\text{CaHP}}{{{\text{O}}}_{4}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(16)
$\begin{gathered} {\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}} = \\ = \,\,4{\text{CaHP}}{{{\text{O}}}_{4}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(17)
$\begin{gathered} {\text{Са(}}{{{\text{Н}}}_{{\text{2}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{С}}{{{\text{а}}}_{{\text{2}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{7}} + 3{{{\text{Н}}}_{{\text{2}}}}{\text{О}} = \\ = \,\,2{\text{СаНР}}{{{\text{О}}}_{4}} \cdot 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{Са}}{{{\text{Н}}}_{{\text{2}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{7}}}}. \\ \end{gathered} $Взаимодействие водного раствора пирофосфорной кислоты Н4Р2О7 и гидроксида кальция Са(ОН)2 может быть отражено реакциями (18)–(20). Взаимодействие водного раствора пирофосфорной кислоты Н4Р2О7 и трикальцийфосфата Ca3(PO4)2 (реакция (21)) использовано для получения кальцийфосфатного цементного камня [120, 121]:
(18)
${{{\text{Н}}}_{{\text{4}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{7}} + {\text{Са(ОН}}{{{\text{)}}}_{2}} = {\text{Са}}{{{\text{Н}}}_{{\text{2}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{7}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(19)
${{{\text{Н}}}_{{\text{4}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{7}} + 2{\text{Са(ОН}}{{{\text{)}}}_{2}} = {\text{С}}{{{\text{а}}}_{{\text{2}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{7}}}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$(20)
${{{\text{Н}}}_{{\text{4}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{7}} + 2{\text{Са(ОН}}{{{\text{)}}}_{{\text{2}}}} = {\text{С}}{{{\text{а}}}_{{\text{2}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{7}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(21)
$\begin{gathered} {{{\text{H}}}_{{\text{4}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + 2{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,4{\text{CaHP}}{{{\text{O}}}_{4}} + {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Использование конденсированных фосфорных кислот для синтеза фосфатов кальция несколько осложнено, так как доступность этих реактивов на рынке ограничена. Коммерческая пирофосфорная кислота Н4Р2О7, получаемая методом термической конверсии Н3РО4, содержит также ортофосфорную и различные полифосфорные кислоты [122]. В качестве удобного способа получения водных растворов пирофосфорной Н4Р2О7 [123, 124] или полифосфорной НРО3 [125] кислот может быть рассмотрен ионный обмен из соответствующих растворимых фосфатов натрия. В научной литературе синтез гидратированных пирофосфатов кальция чаще рассматривается из-за необходимости лучшего понимания процессов, протекающих при развитии артрита и артроза, и для исследования свойств данных минералов [126]. Отмечается влияние рН и температуры синтеза на возможность образования различных модификаций дигидрата пирофосфата кальция Ca2P2O7 ⋅ 2H2O, тетрагидрата пирофосфата кальция Ca2P2O7 ⋅ 4H2O и аморфного продукта [127]. Синтез порошков гидратированного пирофосфата кальция проводят также и с целью дальнейшего использования для получения керамики на основе пирофосфата кальция Ca2P2O7 [124, 128].
Следует отметить, что в работах [124, 126–128] для синтеза гидратированного пирофосфата кальция использованы обменные реакции и такие пары прекурсоров (растворимые пирофосфаты и растворимые соли кальция), которые помимо целевого фосфата кальция образуют хорошо растворимые сопутствующие продукты реакции, биосовместимые [129] или удаляемые при обжиге [124, 128]. Из-за требования биосовместимости получаемых с использованием обменных реакций фосфатов кальция, которые используют без термообработки, предпочтение отдается таким синтезам, в которых сопутствующими продуктами реакции являются хлориды или ацетаты калия (KCl, КСН3СОО) или натрия (NaCl, NaCH3COO). После удаления основной массы сопутствующего продукта реакции промыванием адсорбированные на поверхности частиц фосфатов кальция ионы этих солей не проявляют агрессивности к живым тканям, как это характерно, например, для нитрата аммония. Введение в зону реакции некоторых ионов при синтезе рассматривается как фактор, управляющий процессом кристаллизации, который способствует образованию аморфного пирофосфата кальция [130]. Разработка способов синтеза гидратированного пирофосфата кальция привлекает интерес и по той причине, что он может быть использован как прекурсор для получения биосовместимых аморфных материалов [131] или керамики [124, 128].
Список реакций и вариантов синтеза может быть существенным образом расширен при рассмотрении ряда соединений, которые могут быть использованы в качестве источников оксидов, образующих данный треугольник. Так, например, в качестве источника СаО может быть рассмотрен СаСО3. При взаимодействии карбоната кальция с фосфорными кислотами и моногидратом монокальцийфосфата могут образовываться различные фосфаты кальция. Ниже приведены реакции, которые могут протекать при взаимодействии порошка/суспензии карбоната кальция СаСО3 и водного раствора ортофосфорной кислоты Н3РО4:
(22)
${{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{4}} + {\text{СаС}}{{{\text{О}}}_{3}} = {\text{СаНР}}{{{\text{О}}}_{4}} \cdot 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + {\text{С}}{{{\text{О}}}_{2}},$(23)
$\begin{gathered} 6{{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{4}} + 8{\text{СаС}}{{{\text{О}}}_{3}} = \\ = \,\,{\text{С}}{{{\text{а}}}_{{\text{8}}}}{{({\text{НР}}{{{\text{О}}}_{{\text{4}}}})}_{2}}{{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{4}} \cdot 5{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 11{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 8{\text{С}}{{{\text{О}}}_{2}}, \\ \end{gathered} $(24)
$\begin{gathered} 6{{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{4}} + 9{\text{СаС}}{{{\text{О}}}_{3}} = \\ = \,\,{\text{С}}{{{\text{а}}}_{{\text{9}}}}({\text{НР}}{{{\text{О}}}_{{\text{4}}}}){{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{{\text{5}}}}{\text{ОН}} + 17{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 9{\text{С}}{{{\text{О}}}_{2}}, \\ \end{gathered} $(25)
$\begin{gathered} 6{{{\text{Н}}}_{{\text{3}}}}{\text{Р}}{{{\text{О}}}_{{\text{4}}}} + 10{\text{СаС}}{{{\text{О}}}_{3}} = \\ = \,\,{\text{С}}{{{\text{а}}}_{{{\text{10}}}}}{{({\text{Р}}{{{\text{О}}}_{{\text{4}}}})}_{6}}{{({\text{ОН}})}_{2}} + 18{{{\text{Н}}}_{{\text{2}}}}{\text{О}} + 10{\text{С}}{{{\text{О}}}_{2}}. \\ \end{gathered} $Использование в синтезе суспензии СаСО3 может приводить к образованию карбонатзамещенного гидроксиапатита А-, В- или АВ-типа при соответствующих значениях рН [132].
Треугольник мольных соотношений (рис. 1) может быть использован и для более широкого планирования синтезов представленных там фосфатов кальция. Так, например, для синтезов в качестве источника оксида кальция в целевых соединениях могут быть использованы кроме карбоната кальция следующие соли кальция: нитрат [124, 133], хлорид [134], ацетат [124, 128, 135], формиат [136], лактат [137], малат [138], цитрат [139, 140] и сахарат [141, 142]. В свою очередь в качестве источника оксида фосфора для соединений данного треугольника мольных соотношений могут быть рассмотрены кроме фосфорных кислот фосфаты аммония, калия и натрия.
Следует учитывать влияние сопутствующего продукта реакции синтеза (солей аммония, натрия, калия различных кислот) [143]. Так, например, такой сопутствующий продукт реакции, как ацетат аммония CH3COONH4, при синтезе из растворов с высокой концентрацией может выступать в качестве стабилизатора рН в зоне реакции [144]. Если сопутствующий продукт реакции удален промыванием или для солей аммония термообработкой, то возможный вклад этих соединений в формирование микроструктуры керамики незначителен или исключен. Образующийся из солей карбоновых кислот при нагревании аморфный углерод может выступать в качестве физического препятствия роста зерен [145]. Если соли натрия и/или калия как сопутствующие продукты реакции сохранены в синтезированном порошке, тогда формирование фазового состава и микроструктуры керамики будет проходить уже не в системе СаО–Р2О5, а в СаО–Р2О5–Na2O [146], СаО–Р2О5–K2O [147] или СаО–Р2О5–Na2O–K2O [44].
При получении материала в форме цементного камня выбор порошкового прекурсора, жидкости затворения и концентрации в ней солей и добавок ограничен в большей степени, поскольку реакция химического связывания завершает формирование материала. И удаление сопутствующих продуктов реакции в этом случае промыванием или термообработкой невозможно. Присутствие удаляемых или частично удаляемых сопутствующих продуктов реакции в цементном камне допустимо, если этот цементный камень является промежуточным полуфабрикатом и подлежит затем обжигу для получения керамического материала [112, 116, 119, 139, 140, 148].
Стрелки из вершины “Н2О” треугольника мольных соотношений оксидов в соединениях системы СаО–Р2О5–Н2О, направленные вниз, схематично отображают превращения в фосфатах кальция при нагревании. Кислые орто- и пирофосфаты с мольным соотношением Са/Р = 0.5 при нагревании (реакции (26)–(28)) превращаются в полифосфат кальция Ca(PO3)2 [149]. Гидратированные фосфаты кальция с мольным соотношением Са/Р = 0.5 при нагревании также превращаются в полифосфат кальция (реакции (29)–(33)):
(26)
${\text{Ca(}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Ca(}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(27)
${\text{Ca(}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{2}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(28)
${\text{Ca}}{{{\text{H}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(29)
${\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} \cdot x{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + x{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(30)
${\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({{{\text{P}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{9}}}})}_{2}} \cdot 10{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 3{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 10{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(31)
${\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{4}}}}{{{\text{O}}}_{{12}}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} = 2{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(32)
${\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{4}}}}{{{\text{O}}}_{{12}}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 2{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(33)
${\text{C}}{{{\text{a}}}_{{\text{4}}}}{{{\text{P}}}_{{\text{8}}}}{{{\text{O}}}_{{24}}} \cdot 16{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 4{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 16{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Термическое разложение тетраметафосфата кальция Ca2P4O12 ⋅ 4H2O (Ca/P = 0.5) может быть представлено в виде последовательности трансформаций [150–152]:
Ca2P4O12 ⋅ 4H2O → 120°С → Ca2P4O12 ⋅ H2O → → 220°С → Ca2P4O12 → 460°С → аморфная фаза → → 520°С → xCa(PO3)2 → 589°С → β-Ca(PO3)2 → → 850°С → β-Ca2P2O7.
Тромелит Са4Р6О19 с мольным соотношением Са/Р = 0.67, расположенный на стороне СаО–Р2О5 треугольника мольных соотношений оксидов в системе СаО–Р2О5–Н2О между полифосфатом кальция Ca(PO3)2 и пирофосфатом кальция Ca2P2O7, при нагревании может образовывать композит, включающий эти две фазы:
(34)
${\text{С}}{{{\text{а}}}_{{\text{4}}}}{{{\text{Р}}}_{{\text{6}}}}{{{\text{О}}}_{{{\text{19}}}}} = {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + 2{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}}.$Гидратированные пирофосфаты или гидроортофосфаты с мольным соотношением Са/Р = 1 при нагревании превращаются в пирофосфат кальция Ca2P2O7:
(35)
${\text{CaHP}}{{{\text{O}}}_{4}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{CaHP}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(36)
$2{\text{CaHP}}{{{\text{O}}}_{4}} = {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(37)
${\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(38)
${\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Гидратированный трикальцийфосфат Ca3(PO4)2 ⋅ · xH2O или Са-дефицитный гидроксиапатит Ca9(HPO4)(PO4)5(OH) с мольным соотношением Са/Р = 1.5 при нагревании превращаeтся в трикальцийфосфат Ca3(PO4)2:
(39)
${\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{2}} \cdot x{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{2}} + x{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(40)
${\text{C}}{{{\text{a}}}_{{\text{9}}}}({\text{HP}}{{{\text{O}}}_{{\text{4}}}}){{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{5}}}}({\text{OH}}) = 3{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Гидроксиапатит Ca10(PO4)6(OH)2 с мольным соотношением Са/Р = 1.67 может превращаться в оксиапатит Ca10(PO4)6O:
(41)
${\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{6}}}}{{({\text{OH}})}_{2}} = {\text{C}}{{{\text{a}}}_{{{\text{10}}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{{\text{6}}}}{\text{O}} + {{{\text{Н}}}_{{\text{2}}}}{\text{О}}{\text{.}}$В табл. 2 и на рис. 1 есть соединения (гидратированные фосфаты кальция) с мольными соотношениями Са/Р = 0.75, 0.83 и 1.33. В списке высокотемпературных фосфатов кальция, которые расположены на стороне СаО–Р2О5 треугольника (рис. 1), соединения с такими мольными соотношениями отсутствуют. Для стрелок, направленных из вершины “Н2О”, символизирующих дегидратацию и проходящих через точки соединений Ca3H2(P2O7)2 ⋅ 4H2O, Ca3H2(P2O7)2 ⋅ H2O и Ca5(P3O10)2 ⋅ 10H2O, пересечения со стороной Р2О5–СаО обозначены как @ (Са/Р = 0.75) и * (Са/Р = 0.83). Пересечения @ (Са/Р = 0.75) и * (Са/Р = 0.83) попадают соответственно между точками полифосфата кальция Ca(PO3)2 и пирофосфата кальция Ca2P2O7 или даже в более узкий интервал между точками тромелита Са4Р6О19, который считается метастабильной фазой, и пирофосфата кальция Ca2P2O7. Следовательно, эти соединения могли бы быть рассмотрены как однофазные прекурсоры керамических композитов, включающих фазы Ca(PO3)2 и Ca2P2O7. Превращения, которые возможны для этих соединений при нагревании, отражены следующими реакциями:
(42)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{2}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{2}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{2}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{2}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(43)
$\begin{gathered} 2{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\text{H}}}_{2}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{2}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}}~\,\, = \\ = \,\,{\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}}~ + \,{\text{С}}{{{\text{а}}}_{{\text{4}}}}{{{\text{Р}}}_{{\text{6}}}}{{{\text{О}}}_{{19}}} + 4{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $Таблица 2.
Расчет координат точек для соединений, отмеченных на рис. 1
| Соединение | Са/Р | СаО/Р2О5 | Количество оксидов в формуле соединения | Мольная доля оксида в соединении | |||||
|---|---|---|---|---|---|---|---|---|---|
| CaO | P2O5 | H2O | сумма | CaO | P2O5 | H2O | |||
| 2H3PO4 | 0 | 0 | 0 | 1 | 3 | 4 | 0 | 0.25 | 0.75 |
| H4P2O7 | 0 | 0 | 0 | 1 | 2 | 3 | 0 | 0.33 | 0.67 |
| 2HPO3 | 0 | 0 | 0 | 1 | 1 | 2 | 0 | 0.5 | 0.5 |
| Са2Р6О17 | 0.33 | 0.67 | 2 | 3 | 0 | 5 | 0.33 | 0.67 | 0 |
| Ca(H2PO4)2 ⋅ H2O | 0.5 | 1 | 1 | 1 | 3 | 5 | 0.2 | 0.2 | 0.6 |
| Ca(H2PO4)2 | 0.5 | 1 | 1 | 1 | 2 | 4 | 0.25 | 0.25 | 0.5 |
| Ca2P4O12 ⋅ 4H2O | 0.5 | 1 | 2 | 2 | 4 | 8 | 0.25 | 0.25 | 0.5 |
| CaH2P2O7 | 0.5 | 1 | 1 | 1 | 1 | 3 | 0.33 | 0.33 | 0.33 |
| Ca(PO3)2 | 0.5 | 1 | 1 | 1 | 0 | 2 | 0.5 | 0.5 | 0 |
| Ca(PO3)2 ⋅ xH2O | 0.5 | 1 | 1 | 1 | 0.5* | 2.5 | 0.4 | 0.4 | 0.2 |
| Са4Р6О19 | 0.67 | 1.33 | 4 | 3 | 0 | 7 | 0.57 | 0.43 | 0 |
| Ca3H2(P2O7)2 ⋅ 4H2O | 0.75 | 1.5 | 3 | 2 | 5 | 10 | 0.3 | 0.2 | 0.5 |
| Ca3H2(P2O7)2 ⋅ H2O | 0.75 | 1.5 | 3 | 2 | 2 | 7 | 0.43 | 0.29 | 0.29 |
| Ca5(P3O10)2 ⋅ 10H2O | 0.83 | 1.67 | 5 | 3 | 10 | 18 | 0.28 | 0.17 | 0.56 |
| 2CaHPO4 ⋅ 2H2O | 1 | 2 | 2 | 1 | 5 | 8 | 0.25 | 0.13 | 0.63 |
| 2CaHPO4 | 1 | 2 | 2 | 1 | 1 | 4 | 0.5 | 0.25 | 0.25 |
| Ca2P2O7 ⋅ 4H2O | 1 | 2 | 2 | 1 | 4 | 7 | 0.29 | 0.14 | 0.57 |
| Ca2P2O7 ⋅ 2H2O | 1 | 2 | 2 | 1 | 2 | 5 | 0.4 | 0.2 | 0.4 |
| Ca2P2O7 | 1 | 2 | 2 | 1 | 0 | 3 | 0.67 | 0.33 | 0 |
| Ca8(HPO4)2(PO4)4 ⋅ 5H2O | 1.33 | 2.7 | 8 | 3 | 6 | 17 | 0.47 | 0.18 | 0.35 |
| Ca3(PO4)2 ⋅ xH2O | 1.5 | 3 | 3 | 1 | 0.7* | 4.7 | 0.64 | 0.21 | 0.15 |
| Ca3(PO4)2 | 1.5 | 3 | 3 | 1 | 0 | 4 | 0.75 | 0.25 | 0 |
| Ca9(HPO4)(PO4)5(OH) | 1.5 | 3 | 9 | 3 | 1 | 13 | 0.69 | 0.23 | 0.08 |
| Ca10(PO4)6(OH)2 | 1.67 | 3.3 | 10 | 3 | 1 | 14 | 0.71 | 0.21 | 0.07 |
| Ca10(PO4)6O | 1.67 | 3.33 | 10 | 3 | 0 | 13 | 0.77 | 0.23 | 0 |
| Ca4(PO4)2O | 2 | 4 | 4 | 1 | 0 | 5 | 0.8 | 0.2 | 0 |
| Ca(OH)2 | ∞ | ∞ | 1 | 0 | 1 | 2 | 0.5 | 0 | 0.5 |
или
(44)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{2}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{2}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,{\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(45)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{5}}}}{{({{{\text{P}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{10}}}}})}_{2}} \cdot 10{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,2{\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 10{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Пересечение стрелки, идущей от вершины “Н2О” (рис. 1) и проходящей через точку октакальциевого фосфата Ca8(HPO4)2(PO4)4 ⋅ 5H2O, и стороны Р2О5–СаО, обозначенное # (Са/Р = 1.33), попадает в интервал между пирофосфатом кальция Ca2P2O7 и трикальцийфосфатом Ca3(PO4)2. Термическое разложение этого соединения может быть отражено реакцией.
(46)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{8}}}}{{({\text{HP}}{{{\text{O}}}_{{\text{4}}}})}_{2}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{4}} \cdot 5{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,2{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{P}}{{{\text{O}}}_{{\text{4}}}})}_{2}} + {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Однофазный синтетический порошок октакальциевого фосфата Ca8(HPO4)2(PO4)4 ⋅ 5H2O использован как высокогомогенный прекурсор для получения керамического композита пирофосфат кальция Ca2P2O7/трикальцийфосфат Ca3(PO4)2 [153]. Гидратированные полифосфаты (Ca5(P3O10)2 ⋅ 10H2O) или кислые пирофосфаты кальция (Ca3H2(P2O7)2 · 4H2O, Ca3H2(P2O7)2 ⋅ H2O) также могут представлять интерес не только как минеральные удобрения [154], но и как прекурсоры высокотемпературных фаз керамического материала, таких как пирофосфат кальция Ca2P2O7, тромелит Са4Р6О19 или полифосфат кальция Ca(PO3)2. Однако до настоящего времени о создании композитов тромелит/прирофосфат кальция или полифосфат кальция/пирофосфат кальция из порошков фосфатов кальция с соотношением Са/Р = 0.75 или 0.83 в научной и патентной литературе не сообщалось. Керамический композит может быть получен из порошка, синтезированного при заданном мольном соотношении Са/Р, находящемся между значениями Са/Р для существующих высокотемпературных фосфатов кальция. Так, например, керамический композит, включающий фазы трикальцийфосфата Ca3(PO4)2 (Са/Р = 1.5) и пирофосфата кальция Ca2P2O7 (Са/Р = 1), был получен из порошка, синтезированного в условиях механической активации при заданном соотношении Са/Р = 1.25 [155].
Примерами синтезов фосфатов кальция из порошковой смеси, включающей компоненты с мольными соотношениями, отличающимися от заданного в большую и меньшую сторону, является синтез трикальцийфосфата Са3(РО4)2 (Са/Р = 1.5) из порошковой смеси брушита СаНРО4 ⋅ 2Н2О (Са/Р = 1) и карбоната кальция СаСО3 (Са/Р = ∞) [156], а также серия синтезов фосфатов кальция с различными мольными соотношениями из порошковой смеси Ca(H2PO4)2 ⋅ H2O (Са/Р = 0.5) и СаСО3 [157].
Таким образом, взаимосвязь синтетических прекурсоров и высокотемпературных фосфатов кальция, отраженная схематично с использованием треугольника мольных соотношений оксидов в соединениях, принадлежащих системе СаО–Р2О5–Н2О, позволяет сделать вывод о том, что использование гидратированных кислых орто-, пиро- и поли- и ультрафосфатов кальция в сочетании с веществами – источниками оксида кальция: тетракальциевым фосфатом и гидроксиапатитом кальция – позволяет получать высокотемпературные фазы и керамические материалы с заданным мольным соотношением Са/Р в интервале 0.5 ≤ Са/Р ≤ 1.5. А использование кальцийфосфатных вяжущих материалов в качестве матрицы и любых других биосовместимых гидратов фосфатов кальция и/или высокотемпературных фосфатов кальция в качестве наполнителей открывает широкую возможность творчества в создании новых композиционных материалов в системе СаО–Р2О5–Н2О.
Принято считать, что с уменьшением мольного соотношения Са/Р от 1.67 для гидроксиапатита Ca10(PO4)6(OH)2 до 0.5 для полифосфата кальция Са(РО3)2 растворимость фосфатов кальция и их способность к резорбции увеличиваются. Однако опыт некоторых исследователей указывает на нелинейную зависимость способности керамического композита к растворению от соотношения Са3(РО4)2 и Ca2P2O7 [158]. При рассмотрении гетерофазных взаимодействий в системах СаО–Р2О5 и СаО–Р2О5–Н2О следует также учитывать полиморфизм, присущий многим фосфатам кальция. Фазовые превращения при нагревании/охлаждении могут протекать с изменением плотности минерала. Так, например, керамику на основе пирофосфата кальция обжигают при температуре ниже фазового перехода (β → α). Спекание таких фосфатов кальция не может быть интенсифицировано повышением температуры. Введение добавок, инициирующих жидкофазное спекание, может стать решением для достижения более высокой плотности кальцийфосфатных керамических материалов [159]. Для достижения более высокой плотности керамики на основе фосфатов кальция применяют также горячее прессование, электроимпульсное спекание [160], спекание при воздействии микроволнового излучения [161], а также обжиг в атмосфере СО2 [162] или в парах воды [163].
СИСТЕМА СаО–Р2О5–(NH4)2O
Системы, содержащие фосфаты аммония, представляют значительный интерес для синтеза фосфатов кальция [164]. Пара исходных солей, наиболее часто используемая в растворных синтезах фосфатов кальция, – это нитрат кальция Са(NO3)2 и гидрофосфат аммония (NH4)2HPO4. В данном разделе рассмотрен треугольник мольных соотношений оксидов в соединениях для системы СаО–Р2О5–(NH4)2O (рис. 2). Данный треугольник мольных соотношений оксидов представляет интерес для выбора и планирования синтезов возможных прекурсоров высокотемпературных фаз кальцийфосфатной керамики. Оксид аммония (NH4)2O – соединение, существующее при низких температурах [165, 166] – использован для построения треугольника СаО–Р2О5–(NH4)2O формальных мольных соотношений в соединениях, которые могут быть использованы для получения резорбируемых материалов для костных имплантатов в системе СаО–Р2О5.
Рис. 2.
Треугольник мольных соотношений оксидов в соединениях, принадлежащих системе СаО–Р2О5–(NH4)2O (формула соединения указана справа от точки).
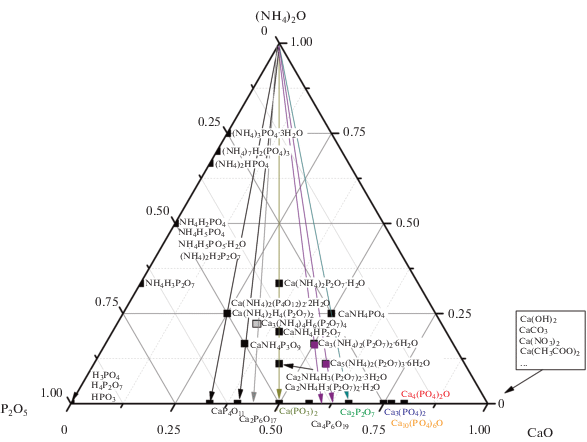
Список двойных фосфатов кальция-аммония взят из статей, посвященных разработке минеральных удобрений [167–169]. В табл. 3 представлен расчет координат точек для треугольника мольных соотношений оксидов в соединениях, принадлежащих системе СаО–Р2О5–(NH4)2O. В действительности многие из рассматриваемых соединений являются гидратами и могли бы быть представлены точками в объеме тетраэдра. Для удобства восприятия в поле треугольника мольных соотношений точки для гидратов представлены как проекции. В качестве источников оксида аммония (NН4)2О и оксида фосфора Р2О5 в одном соединении могут быть рассмотрены, например, кислый пирофосфат аммония NH4H3P2O7, применяемый при создании огнезащитных материалов [170], фосфат моноаммония NН4Н2РО4 и фосфат диаммония (NН4)2НРО4 [171]. На рис. 2, так же как и на рис. 1, на стороне Р2О5–СаО отмечены точки для высокотемпературных фосфатов кальция. Стрелки из вершины “(NН4)2О”, направленные вниз к стороне Р2О5–СаО, символизируют процессы разложения двойных фосфатов кальция-аммония, приводящие к формированию высокотемпературных фаз в системе СаО–Р2О5.
Таблица 3.
Расчет координат точек для соединений, отмеченных на рис. 2
| Соединение | Са/Р | СаО/Р2О5 | Оксиды в формуле соединения | Мольная доля оксида в соединении | Мольная доля оксида в соединении без H2O | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CaO | (NH4)2O | H2O | P2O5 | сумма | сумма без H2O | CaO | (NH4)2O | H2O | P2O5 | CaO | (NH4)2O | P2O5 | |||
| 2(NH4)3PO4 ⋅ 3H2O | 0 | 0 | 0 | 3 | 6 | 1 | 10 | 4 | 0 | 0.3 | 0.6 | 0.1 | 0 | 0.75 | 0.25 |
| 2(NH4)7H2(PO4)3 | 0 | 0 | 0 | 7 | 2 | 3 | 12 | 10 | 0 | 0.58 | 0.17 | 0.25 | 0 | 0.7 | 0.3 |
| 2(NH4)2HPO4 | 0 | 0 | 0 | 2 | 1 | 1 | 4 | 3 | 0 | 0.5 | 0.25 | 0.25 | 0 | 0.67 | 0.33 |
| 2NH4H5PO4 | 0 | 0 | 0 | 1 | 5 | 1 | 7 | 2 | 0 | 0.14 | 0.71 | 0,14 | 0 | 0.5 | 0.5 |
| 2NH4H5PO5 ⋅ H2O | 0 | 0 | 0 | 1 | 7 | 1 | 9 | 2 | 0 | 0.11 | 0.78 | 0.11 | 0 | 0.5 | 0.5 |
| 2NH4H2PO4 | 0 | 0 | 0 | 1 | 2 | 1 | 4 | 2 | 0 | 0.25 | 0.5 | 0.25 | 0 | 0.5 | 0.5 |
| (NH4)2H2P2O7 | 0 | 0 | 0 | 1 | 1 | 1 | 3 | 2 | 0 | 0.33 | 0.33 | 0.33 | 0 | 0.5 | 0.5 |
| 2NH4H3P2O7 | 0 | 0 | 0 | 1 | 3 | 2 | 6 | 3 | 0 | 0.17 | 0.5 | 0.33 | 0 | 0.33 | 0.67 |
| 2H3PO4 | 0 | 0 | 0 | 0 | 3 | 1 | 4 | 1 | 0 | 0 | 0.75 | 0.25 | 0 | 0 | 1 |
| H4P2O7 | 0 | 0 | 0 | 0 | 2 | 1 | 3 | 1 | 0 | 0 | 0.67 | 0.33 | 0 | 0 | 1 |
| 2HPO3 | 0 | 0 | 0 | 0 | 1 | 1 | 2 | 1 | 0 | 0 | 0.5 | 0.5 | 0 | 0 | 1 |
| Ca(NH4)2H4(P2O7)2 | 0.25 | 0.5 | 1 | 1 | 2 | 2 | 6 | 4 | 0.17 | 0.17 | 0.33 | 0.33 | 0.25 | 0.25 | 0.5 |
| Ca(NH4)2P4O12 ⋅ 2H2O | 0.25 | 0.5 | 1 | 1 | 2 | 2 | 6 | 4 | 0.17 | 0.17 | 0.33 | 0.33 | 0.25 | 0.25 | 0.5 |
| CaP4O11 | 0.25 | 0.5 | 1 | 0 | 0 | 2 | 3 | 3 | 0.33 | 0 | 0 | 0.67 | 0.33 | 0.00 | 0.67 |
| 2CaNH4P3O9 | 0.33 | 0.67 | 2 | 1 | 0 | 3 | 6 | 6 | 0.33 | 0.17 | 0 | 0.50 | 0.33 | 0.17 | 0.5 |
| Ca2(NH4)2P6O18 ⋅ 6H2O | 0.33 | 0.67 | 2 | 1 | 6 | 3 | 12 | 6 | 0.17 | 0.08 | 0.5 | 0.25 | 0.33 | 0.17 | 0.5 |
| Ca2(NH4)2P6O18 ⋅ 7H2O | 0.33 | 0.67 | 2 | 1 | 7 | 3 | 13 | 6 | 0.15 | 0.08 | 0.54 | 0.23 | 0.33 | 0.17 | 0.5 |
| Ca2P6O17 | 0.33 | 0.67 | 2 | 0 | 0 | 3 | 5 | 5 | 0.4 | 0 | 0 | 0.6 | 0.4 | 0 | 0.6 |
| Ca3(NH4)4H6(P2O7)4 | 0.38 | 0.75 | 3 | 2 | 3 | 4 | 12 | 9 | 0.25 | 0.17 | 0.25 | 0.33 | 0.33 | 0.22 | 0.44 |
| Ca3(NH4)4H6(P2O7)4 ⋅ 3H2O | 0.38 | 0.75 | 3 | 2 | 6 | 4 | 15 | 9 | 0.2 | 0.13 | 0.4 | 0.27 | 0.33 | 0.22 | 0.44 |
| Ca(NH4)2P2O7 ⋅ H2O | 0.5 | 1 | 1 | 1 | 1 | 1 | 4 | 3 | 0.25 | 0.25 | 0.25 | 0.25 | 0.33 | 0.33 | 0.33 |
| 2CaNH4HP2O7 | 0.5 | 1 | 2 | 1 | 1 | 2 | 6 | 5 | 0.33 | 0.17 | 0.17 | 0.33 | 0.4 | 0.20 | 0.40 |
| 2Ca2NH4H3(P2O7)2 ⋅ 3H2O | 0.5 | 1 | 4 | 1 | 6 | 4 | 15 | 9 | 0.27 | 0.07 | 0.40 | 0.27 | 0.44 | 0.11 | 0.44 |
| 2Ca2NH4H3(P2O7)2 ⋅ H2O | 0.5 | 1 | 4 | 1 | 4 | 4 | 13 | 9 | 0.31 | 0.08 | 0.31 | 0.31 | 0.44 | 0.11 | 0.44 |
| Ca(PO3)2 | 0.5 | 1 | 1 | 0 | 0 | 1 | 2 | 2 | 0.5 | 0 | 0 | 0.5 | 0.5 | 0 | 0.5 |
| Ca4P6O19 | 0.67 | 1.33 | 4 | 0 | 0 | 3 | 7 | 7 | 0.57 | 0 | 0 | 0.43 | 0.57 | 0 | 0.43 |
| Ca3(NH4)2(P2O7)2 ⋅ 6H2O | 0.75 | 1.5 | 3 | 1 | 6 | 2 | 12 | 6 | 0.25 | 0.08 | 0.5 | 0.17 | 0.5 | 0.17 | 0.33 |
| Ca5(NH4)2(P2O7)3 ⋅ 6H2O | 0.83 | 1.67 | 5 | 1 | 6 | 3 | 15 | 9 | 0.33 | 0.07 | 0.4 | 0.2 | 0.56 | 0.11 | 0.33 |
| Ca2P2O7 | 1 | 2 | 2 | 0 | 0 | 1 | 3 | 3 | 0.67 | 0 | 0 | 0.33 | 0.67 | 0 | 0.33 |
| 2CaNH4PO4 | 1 | 2 | 2 | 1 | 0 | 1 | 4 | 4 | 0.5 | 0.25 | 0 | 0.25 | 0.5 | 0.25 | 0.25 |
| 2Ca(NH4)PO4 ⋅ 7H2O | 1 | 2 | 2 | 1 | 7 | 1 | 11 | 4 | 0.18 | 0 | 0.64 | 0.09 | 0.5 | 0.25 | 0.25 |
| Ca3(PO4)2 | 1.5 | 3 | 3 | 0 | 0 | 1 | 4 | 4 | 0.75 | 0 | 0 | 0.25 | 0.75 | 0 | 0.25 |
| Ca10(PO4)6O | 1.67 | 3.33 | 10 | 0 | 0 | 3 | 13 | 13 | 0.77 | 0 | 0 | 0.23 | 0.77 | 0 | 0.23 |
| Ca4(PO4)2O | 2 | 4 | 4 | 0 | 0 | 1 | 5 | 5 | 0.8 | 0 | 0 | 0.2 | 0.8 | 0 | 0.2 |
Рассмотрение соединений-прекурсоров высокотемпературных фаз в треугольнике мольных соотношений системы СаО–Р2О5–(NН4)2О позволяет увидеть, что использование двойных фосфатов кальция-аммония дает возможность получить высокотемпературные фосфаты кальция с мольными соотношениями Са/Р ≤ 1. Пирофосфат кальция Са2Р2О7 (Са/Р = 1) может быть получен из двойных ортофосфатов кальция-аммония CaNH4PO4, Ca(NH4)PO4 ⋅ 7H2O. Ниже представлены формальные реакции, отражающие термическое разложение этих соединений:
(47)
${\text{Ca(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)P}}{{{\text{O}}}_{4}} \cdot 7{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Ca(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)P}}{{{\text{O}}}_{4}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}},$(48)
$2{\text{CaN}}{{{\text{H}}}_{{\text{4}}}}{\text{P}}{{{\text{O}}}_{4}} = {\text{С}}{{{\text{а}}}_{{\text{2}}}}{{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{7}} + 2{\text{N}}{{{\text{H}}}_{3}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Несколько двойных пирофосфатов кальция-аммония с мольным соотношением Са/Р = 0.5 могли бы быть прекурсорами полифосфата кальция Са(РО3)2. Ниже представлены возможные реакции образования полифосфата кальция Са(РО3)2 из этих двойных и/или кислых пирофосфатов кальция аммония:
(49)
${\text{CaN}}{{{\text{H}}}_{{\text{4}}}}{\text{H}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{N}}{{{\text{H}}}_{3}}{{,}_{{}}}$(50)
$\begin{gathered} {\text{Ca(N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{N}}{{{\text{H}}}_{3}}, \\ \end{gathered} $(51)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{2}}}}{\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{3}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{2}} \cdot 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,2{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + 5{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{N}}{{{\text{H}}}_{3}}. \\ \end{gathered} $Порошок Ca(NH4)2P2O7 ⋅ H2O, полученный взаимодействием пирофосфорной кислоты и лактата кальция в присутствии аммиака [123], использован в качестве прекурсора полифосфата кальция Са(РО3)2. Повышение температуры обжига керамики, полученной из этого порошка, как и в работе [125], приводит к изменению фазового состава керамики и образованию фосфатов кальция с более высоким соотношением Са/Р, а именно: тромелита Ca4P6O19 и пирофосфата кальция Са2Р2О7. Протекание термогидролиза и высокое давление паров над фосфатными расплавами рассматриваются в качестве причин повышения соотношения Са/Р и изменения фазового состава керамических материалов, содержащих Ca(PO3)2.
Стрелки от вершины “(NH4)2O”, символизирующие термическое разложение двойных фосфатов кальция-аммония и проходящие через точки соединений Ca3(NH4)2(P2O7)2 ⋅ 6H2O (+, Са/Р = 0.75) и Ca5(NH4)2(P2O7)3 ⋅ 6H2O (x, Са/Р = 0.83), пересекают сторону СаО–Р2О5 между пирофосфатом кальция Ca2P2O7 и тромелитом Ca4P6O19/полифосфатом кальция Ca(PO3)2. Следовательно, при нагревании двойные фосфаты кальция-аммония, имеющие соотношение Са/Р = 0.75 или 0.83 (табл. 3, рис. 2) могут образовывать композиты, включающие фазы Ca2P2O7, Ca4P6O19 и Ca(PO3)2:
(52)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{5}}}}{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{\text{2}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{{\text{3}}}} \cdot 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,2{\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{N}}{{{\text{H}}}_{3}}, \\ \end{gathered} $(53)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{\text{2}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{{\text{2}}}} \cdot 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \,\,{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{7}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{N}}{{{\text{H}}}_{3}}. \\ \end{gathered} $В табл. 3 и на рис. 2 присутствуют также высокотемпературные фосфаты кальция, обладающие низкой температурой плавления, и их прекурсоры с мольными соотношениями Са/Р = 0.25 (CaP4O11, Ca(NH4)2H4(P2O7)2, Ca(NH4)2P4O12 ⋅ 2H2O) и 0.33 (Ca2P6O17, CaNH4P3O9, Ca2(NH4)2P6O18 ⋅ · 6H2O, Ca2(NH4)2P6O18 ⋅ 7H2O). Отмечены также соединения (двойные пирофосфаты кальция-аммония Ca3(NH4)4H6(P2O7)4, Ca3(NH4)4H6(P2O7)4 ⋅ · 3H2O) с мольным соотношением Са/Р = 0.38. Пересечение стрелки из вершины “(NH4)2O”, проходящей через точку соединения Ca3(NH4)4H6(P2O7)4, и стороны СаО–Р2О5 обозначено как v. До настоящего времени не отмечено сообщений в научной литературе об использовании этих соединений для получения кальцийфосфатных материалов.
Двойные фосфаты кальция-аммония с меньшим, чем у полифосфата кальция, соотношением Са/Р могут образовывать полифосфат кальция и ряд кислых фосфатов аммония (реакции (54)–(60)) [172–174]
(54)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{3}}}}{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{\text{4}}}}{{{\text{H}}}_{{\text{6}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{4}} \cdot 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 3{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,2{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{1 - x}}}{{{\text{H}}}_{x}}{\text{P}}{{{\text{O}}}_{3}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{ }}2x{\text{N}}{{{\text{H}}}_{3}}, \\ \end{gathered} $(55)
$\begin{gathered} {\text{Ca(N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{{({{{\text{P}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{7}}}})}_{2}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,2{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{1 - x}}}{{{\text{H}}}_{x}}{\text{P}}{{{\text{O}}}_{3}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2x{\text{N}}{{{\text{H}}}_{3}}, \\ \end{gathered} $(56)
$\begin{gathered} {\text{Ca(N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{3}}}}{{{\text{P}}}_{{\text{3}}}}{{{\text{O}}}_{{10}}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,{{({\text{N}}{{{\text{H}}}_{4}})}_{{1 - x}}}{{{\text{H}}}_{x}}{\text{P}}{{{\text{O}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \left( {2{\text{ }} + x} \right){\text{N}}{{{\text{H}}}_{3}}, \\ \end{gathered} $(57)
$\begin{gathered} {\text{CaN}}{{{\text{H}}}_{{\text{4}}}}{{{\text{P}}}_{{\text{3}}}}{{{\text{O}}}_{9}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,{{({\text{N}}{{{\text{H}}}_{4}})}_{{1 - x}}}{{{\text{H}}}_{x}}{\text{P}}{{{\text{O}}}_{3}} + x{\text{N}}{{{\text{H}}}_{3}}, \\ \end{gathered} $(58)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{\text{2}}}}{{{\text{P}}}_{{\text{6}}}}{{{\text{O}}}_{{18}}} \cdot 6{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 2{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,2{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{1 - x}}}{{{\text{H}}}_{x}}{\text{P}}{{{\text{O}}}_{3}} + 2x{\text{N}}{{{\text{H}}}_{3}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(59)
$\begin{gathered} {\text{C}}{{{\text{a}}}_{{\text{2}}}}{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{\text{2}}}}{{{\text{P}}}_{{\text{6}}}}{{{\text{O}}}_{{18}}} \cdot 7{{{\text{H}}}_{{\text{2}}}}{\text{O}} = 2{\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,2{{({\text{N}}{{{\text{H}}}_{4}})}_{{1--x}}}{{{\text{H}}}_{x}}{\text{P}}{{{\text{O}}}_{3}} + 2x{\text{N}}{{{\text{H}}}_{3}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(60)
$\begin{gathered} {\text{Ca(N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{2}}}}{{{\text{P}}}_{{\text{4}}}}{{{\text{O}}}_{{12}}} \cdot 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{Ca(P}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{2}} + \\ + \,\,2{{({\text{N}}{{{\text{H}}}_{{\text{4}}}})}_{{1--x}}}{{{\text{H}}}_{x}}{\text{P}}{{{\text{O}}}_{3}} + 2x{\text{N}}{{{\text{H}}}_{3}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Образовавшись по реакциям (54)–(60), кислые фосфаты аммония могли бы вступать в реакцию с другими фосфатами кальция, расположенными на стороне треугольника СаО–Р2О5 и имеющими более высокое мольное соотношение Са/Р, чем у полифосфата кальция. Условия для такого взаимодействия могут быть созданы или в гомогенизированной порошковой смеси компонентов с различным мольным соотношением Са/Р, или в суспензии.
Опыт работы, с порошками, содержащими соли аммония в качестве сопутствующих продуктов реакции синтеза фосфатов кальция, свидетельствует о том, что разложение солей аммония на воздухе протекает сложнее. И кроме аммиака могут также образовываться оксиды азота [123].
В табл. 4 представлены возможные прекурсоры высокотемпературных фосфатов кальция, существующие в системах СаО–Р2О5–Н2О и СаО–Р2О5–(NH4)2O. Некоторые из них уже используются при получении керамических материалов. Другие не доступны как реактивы и предварительно должны быть синтезированы.
Таблица 4.
Возможные прекурсоры высокотемпературных фосфатов кальция, существующие в системах СаО–Р2О5–Н2О и СаО–Р2О5–(NH4)2O
| Са/Р | Соединениe | Формула |
|---|---|---|
| 5 : 3 | Ортофосфаты кальция | Ca10(PO4)6(OH)2 |
| 3 : 2 | Ca9(HPO4)(PO4)5(OH) | |
| Ca3(PO4)2 ⋅ xH2O | ||
| 4 : 3 | Ca8(HPO4)2(PO4)4 ⋅ 5H2O | |
| 1 : 1 | Гидратированные пирофосфаты кальция | Ca2P2O7 ⋅ 2H2O |
| Ca2P2O7 ⋅ 4H2O | ||
| Кислые ортофосфаты | CaHPO4 ⋅ 2H2O | |
| CaHPO4 | ||
| Двойные ортофосфаты кальция-аммония | CaNH4PO4 | |
| Ca(NH4)PO4 ⋅ 7H2O | ||
| 5 : 6 | Двойные пирофосфаты кальция-аммония | Ca5(NH4)2(P2O7)3 ⋅ 6H2O |
| Полифосфаты | Ca5(P3O10)2 ⋅ 10H2O | |
| 3 : 4 | Кислые пирофосфаты | Ca3H2(P2O7)2 ⋅ H2O Ca3H2(P2O7)2 ⋅ 4H2O |
| Двойные пирофосфаты кальция-аммония | Ca3(NH4)2(P2O7)2 ⋅ 6H2O | |
| 1 : 2 | Кислые ортофосфаты | Ca(H2PO4)2 Ca(H2PO4)2 ⋅ H2O |
| Кислые пирофосфаты | CaH2P2O7 | |
| Двойные пирофосфаты кальция-аммония | CaNH4HP2O7 Ca(NH4)2P2O7 ⋅ H2O Ca2NH4H3(P2O7)2 ⋅ 3H2O |
|
| Метафосфаты | Ca3(P3O9)2 ⋅ 10H2O Ca2P4O12 ⋅ H2O Ca2P4O12 ⋅ 4H2O Ca4P8O24 ⋅ 16H2O |
|
| Прочие двойные фосфаты | Ca(C10H7HPO4)2 ⋅ 3H2O | |
| 3 : 8 | Двойные пирофосфаты кальция-аммония | Ca3(NH4)4H6(P2O7)4 ⋅ 3H2O |
| 1 : 3 | Двойные метафосфаты кальция-аммония | Ca(NH4)3P3O10 · 2H2O CaNH4P3O9 Ca2(NH4)2P6O18 ⋅ 6H2O Ca2(NH4)2P6O18 ⋅ 7H2O |
| 1 : 4 | Двойные пирофосфаты кальция-аммония | Ca(NH4)2H4(P2O7)2 |
| Двойные метафосфаты кальция-аммония | Ca(NH4)2P4O12 ⋅ 2H2O |
Керамические композиты, фазы которых принадлежат стороне СаО–Р2О5, могут быть получены из порошковых смесей, компоненты которых (высокотемпературные фазы или их прекурсоры в системах СаО–Р2О5–Н2О и СаО–Р2О5–(NH4)2O) взяты в определенных соотношениях (рис. 1, рис. 2). Фазы керамического материала могут быть получены при обжиге компактных образцов из порошковых смесей веществ, которые являются источниками СаО и Р2О5. Например, порошковая смесь гидрофосфата аммония (NН4)2НРО4 и карбоната кальция СаСО3 была использована для получения пористого керамического материала на основе пирофосфата кальция [175]. При получении керамики компоненты порошковых смесей, взятые в заданных соотношениях, могут подвергаться термическому разложению, фазовым превращениям, а также вступать в гетерофазные химические реакции. Полифосфаты и ультрафосфаты кальция, обладающие относительно низкими температурами плавления, представляют интерес в качестве добавок, делающих возможным жидкофазное спекание кальцийфосфатной керамики и интенсифицирующих протекание гетерофазных химических реакций.
СИСТЕМА СаО–Р2О5–Na2O
Керамические материалы в системе СаО–Р2О5–Na2O также являются предметом интенсивных исследований на протяжении долгого времени [176–179]. Биосовместимые биорезорбируемые материалы в системе СаО–Р2О5–Na2О могут содержать следующие фазы [180–182]: трикальцийфосфат Са3(РО4)2 (Са/Р = 1.5), пирофосфат кальция Са2Р2О7 (Са/Р = 1.0), тромелит Ca4P6O19 (Са/Р = 0.66), полифосфат кальция Са(РО3)2 (Са/Р = 0.5), натрийзамещенный трикальций фосфат, натриевый ренанит NaCaPO4, двойной пирофосфат натрия-кальция Na2CaP2O7, а также фосфатные стекла [183, 184].
На рис. 3 представлен треугольник мольных соотношений оксидов в соединениях системы СаО–Р2О5–Na2O. На рис. 3 указаны также и некоторые прекурсоры (вещества и смеси), которые могут быть использованы для получения керамических материалов, фазовый состав которых принадлежит системе СаО–Р2О5–Na2O. Формулы некоторых соединений и их прекурсоров (кислых фосфатов натрия) для стороны Na2O–P2O5 взяты из статей [185, 186]. Расчет координат точек для построения треугольника мольных соотношений оксидов в соединениях представлен в табл. 5.
Рис. 3.
Треугольник мольных соотношений оксидов в соединениях, принадлежащих системе СаО–Р2О5–Na2О (формула соединения указана справа от точки).
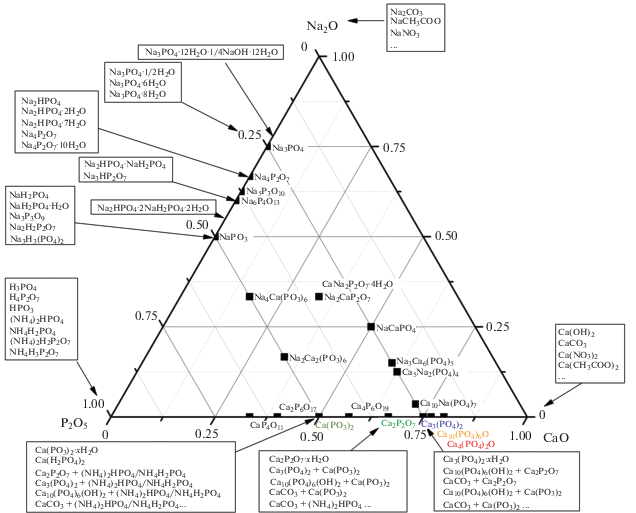
Таблица 5.
Расчет координат точек для соединений, отмеченных на рис. 3
| Соединения | Са/Р | СаО/Р2О5 | Оксиды в формуле соединения | Мольная доля оксида в соединении | Мольная доля оксида в соединении без H2O | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CaO | Na2O | H2O | P2O5 | сумма | сумма без H2O | CaO | Na2O | H2O | P2O5 | CaO | Na2O | P2O5 | |||
| 8Na3PO4 ⋅ 12H2O ⋅ 1/4NaOH ⋅ 12H2O | 0 | 0 | 0 | 13 | 193 | 4 | 210 | 17 | 0 | 0.06 | 0.92 | 0.02 | 0 | 0.76 | 0.24 |
| 2Na3PO4 | 0 | 0 | 0 | 3 | 0 | 1 | 4 | 4 | 0 | 0.75 | 0 | 0.25 | 0 | 0.75 | 0.25 |
| 2Na3PO4 ⋅ 1/2H2O | 0 | 0 | 0 | 3 | 1 | 1 | 5 | 4 | 0 | 0.6 | 0.2 | 0.2 | 0 | 0.75 | 0.25 |
| 2Na3PO4 ⋅ 6H2O | 0 | 0 | 0 | 3 | 12 | 1 | 16 | 4 | 0 | 0.19 | 0.75 | 0.06 | 0 | 0.75 | 0.25 |
| 2Na3PO4 ⋅ 8H2O | 0 | 0 | 0 | 3 | 16 | 1 | 20 | 4 | 0 | 0.15 | 0.8 | 0.05 | 0 | 0.75 | 0.25 |
| Na4P2O7 | 0 | 0 | 0 | 2 | 0 | 1 | 3 | 3 | 0 | 0.67 | 0 | 0.33 | 0 | 0.67 | 0.33 |
| 2Na5P3O10 | 0 | 0 | 0 | 5 | 0 | 3 | 8 | 8 | 0 | 0.63 | 0 | 0.38 | 0 | 0.63 | 0.38 |
| Na6P4O13 | 0 | 0 | 0 | 3 | 0 | 2 | 5 | 5 | 0 | 0.6 | 0 | 0.4 | 0 | 0.6 | 0.4 |
| 2Na2HPO4 ⋅ NaH2PO4 | 0 | 0 | 0 | 3 | 3 | 2 | 8 | 5 | 0 | 0.38 | 0.38 | 0.25 | 0 | 0.6 | 0.4 |
| 2Na3HP2O7 | 0 | 0 | 0 | 3 | 1 | 2 | 6 | 5 | 0 | 0.5 | 0.17 | 0.33 | 0 | 0.6 | 0.4 |
| 2Na2HPO4 ⋅ 2NaH2PO4 ⋅ 2H2O | 0 | 0 | 0 | 4 | 5 | 3 | 12 | 7 | 0 | 0.33 | 0.42 | 0.25 | 0 | 0.57 | 0.43 |
| 2NaPO3 | 0 | 0 | 0 | 1 | 0 | 1 | 2 | 2 | 0 | 0.5 | 0 | 0.5 | 0 | 0.5 | 0.5 |
| 2NaH5(PO4)2 | 0 | 0 | 0 | 1 | 5 | 2 | 8 | 3 | 0 | 0.13 | 0.63 | 0.25 | 0 | 0.33 | 0.67 |
| Na4Ca(PO3)6 | 0.17 | 0.33 | 1 | 2 | 0 | 3 | 6 | 6 | 0.17 | 0.33 | 0 | 0.5 | 0.17 | 0.33 | 0.5 |
| CaP4O11 | 0.25 | 0.5 | 1 | 0 | 0 | 2 | 3 | 3 | 0.33 | 0 | 0 | 0.67 | 0.33 | 0 | 0.67 |
| Ca2P6O17 | 0.33 | 0.67 | 2 | 0 | 0 | 3 | 5 | 5 | 0.40 | 0 | 0 | 0.6 | 0,4 | 0 | 0.6 |
| Na2Ca2(PO3)6 | 0.33 | 0.67 | 2 | 1 | 0 | 3 | 6 | 6 | 0.33 | 0.17 | 0 | 0.5 | 0.33 | 0.17 | 0.5 |
| Na2CaP2O7 ⋅ 4H2O | 0.5 | 1 | 1 | 1 | 4 | 1 | 7 | 3 | 0.14 | 0.14 | 0.57 | 0.14 | 0.33 | 0.33 | 0.33 |
| Na2CaP2O7 | 05 | 1 | 1 | 1 | 0 | 1 | 3 | 3 | 0.33 | 0.33 | 0 | 0.33 | 0.33 | 0.33 | 0.33 |
| Ca(PO3)2 | 0.5 | 1 | 1 | 0 | 0 | 1 | 2 | 2 | 0.50 | 0 | 0 | 0.5 | 0.5 | 0 | 0.5 |
| Ca4P6O19 | 0.67 | 1.33 | 4 | 0 | 0 | 3 | 7 | 7 | 0.57 | 0 | 0 | 0.43 | 0.57 | 0 | 0.43 |
| 2NaCaPO4 | 1 | 2 | 2 | 1 | 0 | 1 | 4 | 4 | 0.5 | 0.25 | 0 | 0.25 | 0.5 | 0.25 | 0.25 |
| Ca2P2O7 | 1 | 2 | 2 | 0 | 0 | 1 | 3 | 3 | 0.67 | 0 | 0 | 0.33 | 0.67 | 0 | 0.33 |
| 2Na3Ca6(PO4)5 | 1.2 | 2.4 | 12 | 3 | 0 | 5 | 20 | 20 | 0.6 | 0.15 | 0 | 0.25 | 0.6 | 0.15 | 0.25 |
| Ca5Na2(PO4)4 | 1.25 | 1.5 | 5 | 1 | 0 | 2 | 8 | 8 | 0.63 | 0.13 | 0 | 0.25 | 0.625 | 0.125 | 0.25 |
| 2Ca10Na(PO4)7 | 1.43 | 2.86 | 20 | 1 | 0 | 7 | 28 | 28 | 0.71 | 0.04 | 0 | 0,25 | 0.71 | 0.04 | 0.25 |
| Ca3(PO4)2 | 1.5 | 3 | 3 | 0 | 0 | 1 | 4 | 4 | 0.75 | 0 | 0 | 0.25 | 0.75 | 0 | 0.25 |
| Ca10(PO4)6O | 1.67 | 3.33 | 10 | 0 | 0 | 3 | 13 | 13 | 0.77 | 0 | 0 | 0.23 | 0.77 | 0 | 0.23 |
| Ca4(PO4)2O | 2 | 4 | 4 | 0 | 0 | 1 | 5 | 5 | 0.8 | 0 | 0 | 0.2 | 0.8 | 0 | 0.2 |
Следует отметить, что фосфаты натрия системы Na2O–P2O5–Н2O исследуются также и потому, что являются основными компонентами различных моющих и умягчающих средств, детергентов для очистки металлов, антипиренов, гидратантов и пептизаторов, регуляторов реологических свойств бетонов, клеев и кормовых средств [187, 188]. Различные фосфаты натрия в виде порошков или водных растворов представляют интерес как исходные вещества для растворных и гетерофазных проводимых при нагревании синтезов высокодисперсных порошков фосфатов кальция, которые затем используют для получения резорбируемых неорганических материалов для медицинских применений [146, 189, 190]. Порошки фосфатов натрия в качестве компонентов порошковых смесей могут быть использованы для получения керамических материалов [191–193]. Кроме того, кислые соли натрия могут быть использованы при получении биосовместимого и биорезорбируемого цементного камня как компоненты жидкости затворения или в составе порошковой смеси [194, 195]. Двойные фосфаты натрия-кальция, такие как ренанит NaCaPO4 или Na3Ca6(PO4)5, могут быть использованы как компоненты щелочного характера при получении с использованием кислотно-основного взаимодействия цементов, предназначенных для лечения дефектов костной ткани [196].
Двойные орто- и пирофосфаты натрия-кальция были синтезированы из солей натрия (NaNO3, NaCH3COO), которые являются источниками оксида натрия в соответствующих двойных фосфатах при рассмотрении треугольника мольных соотношений оксидов СаО–Р2О5–Na2О [146, 197, 198]. Натриевый ренанит NaCaPO4 и Na-замещенный трикальцийфосфат [199–203] наиболее часто используются для создания резорбируемых неорганических композитов для регенеративных методов лечения дефектов костной ткани. Разработаны керамические композиты и композиты со стеклянной матрицей, содержащие фазы трикальцийфосфата Са3(РО4)2, ренанита NaCaPO4, пирофосфата Са2Р2О7, двойного пирофосфата натрия-кальция CaNa2P2O7 [204–206]. Разработаны материалы, в которых варьируется степень замещения Са на Na [204, 207].
Рассмотрение известных для системы Na2O–СаО–P2O5 тройных и квазибинарных фазовых диаграмм указывает на возможность существенного снижения температуры обжига создаваемых керамических материалов вследствие наличия множества эвтектических составов (табл. 6).
Таблица 6.
Сведения о значениях эвтектических температур в системе Na2O–СаО–P2O5
| Система | tэвт, °С |
|---|---|
| NaPO3–Ca(PO3)2 | 627 |
| Na2O–Ca(PO3)2 | 648 |
| Na2CaP2O7–Ca2P2O7–Ca(PO3)2 | 638 |
| NaCaPO4–Ca2P2O7–Na2CaP2O7 | 780 |
| Na2CaP2O7–Ca2P2O7 | 800 |
| Na4P2O7–Ca2P2O7 | 800 |
Использование добавок эвтектического состава в системе СаО–Р2О5–Na2O может сделать получение керамических материалов более удобным за счет снижения температуры обжига.
СИСТЕМЫ СаО–Р2О5–K2O и СаО–Р2О5–Na2O–K2O
Отмечено [204], что фазовые диаграммы Са3(РО4)2–NaCaPO4 и Са3(РО4)2–KCaPO4 имеют много общего. Учитывая данный факт и близость многих свойств катионов K+ и Na+, принципы планирования фазового состава керамических материалов и синтезов натрийзамещенных фосфатов кальция с использованием треугольника мольных соотношений оксидов в соединениях системы СаО–Р2О5–Na2O, представленного на рис. 3, могут быть распространены и на планирование фазового состава и синтезов калийзамещенных фосфатов кальция.
Следует отметить, что при разработке материалов достаточно часто вещества, содержащие ионы Na+ в качестве модификатора микроструктуры керамики на основе ортофосфатов кальция, используют в сочетании с веществами, содержащими ионы K+ [208].
Компонентами, способными снижать температуру обжига керамики медицинского назначения на основе фосфатов кальция, являются различные соли. Как правило, это соли щелочных металлов (Na или K) [209, 210]. Есть работы, в которых такими солями являются карбонаты щелочных металлов [211]. Есть работы, в которых такими солями являются полифосфаты кальция или щелочных (K или Na) металлов [193].
Следует отметить, что присутствие солей калия или натрия в порошковых системах на основе фосфатов кальция при нагревании всегда приводит к образованию двойных фосфатов кальция и щелочного металла (K или Na) [146, 147]. Материалы на основе двойных фосфатов кальция-натрия/калия, таких как натрий- или калийзамещенный трикальцийфосфат, натриевый или калиевый ренаниты, являются биосовместимыми и биодеградируемыми. По этой причине они достаточно часто являются объектами исследования при разработке материалов для потенциального использования в регенеративной медицине.
СИСТЕМА СаО–MgO–Р2О5
Магний занимает десятое место среди элементов, присутствующих в организме, и второе место после натрия по влиянию катионов на внутриклеточные процессы в организме позвоночных. Было установлено, что ион магния является важнейшим кофактором в сотнях ферментативных реакций, включающих как реакции, обеспечивающие организм энергией, так и реакции синтеза белков и нуклеиновых кислот. Очевидно, что магний чрезвычайно важен для физиологически корректного функционирования тканей и органов. Магний необходим для поддержания нормальной работы околощитовидной железы и для метаболизма витамина D. Часть магния, присутствующего в организме, интегрирована в решетку гидроксиапатита костной ткани, а часть принимает участие в процессах клеточного метаболизма [212]. Первым деградируемым из изученных в прошлом веке ортопедических имплантатов был имплантат из металлического магния [213, 214]. Однако металлический магний реагирует в водных растворах с выделением водорода, что осложняет его применение. В статье [215] впервые исследована биосовместимость ряда гидратированных синтетических ортофосфатов магния (ньюбериита MgHPO4 ⋅ 3H2O, каттиита Mg3(PO4)2 ⋅ 22H2O) и брусита (Mg(OH)2). Созданы магнийфосфатные цементы для ортопедических применений на основе ньюбериита MgHPO4 ⋅ H2O и струвита MgNH4PO4 ⋅ 6H2O [216–218]. Получены и исследованы керамические материалы из ортофосфатов кальция и магния [219]. Керамические материалы состава β-Mg2P2O7 получены из порошков струвита и ньюбериита, синтезированных из хлорида магния и гидрофосфатов натрия, калия и аммония [220]. Керамика в квазибинарной системе Са3(РО4)2–Mg2P2O7 получена из порошков, синтезированных из нитратов кальция и магния и гидрофосфата аммония при различных мольных соотношениях Ca/Mg [221].
Получение аморфных осадков характерно для фосфатов кальция в присутствии ионов Mg, а также при синтезе фосфатов магния в присутствии ионов Са [222]. Присутствие пирофосфат-ионов, благодаря склонности к образованию в растворе комплексов, также может способствовать образованию аморфных осадков [223]. Замечено также формирование аморфного смешанного фосфата кальция-магния при получении биоцемента при взаимодействии фосфата кальция, карбоната магния и фосфорной кислоты [224]. Аморфный слоистый гидратированный фосфат магния был получен из диэтоксида магния Mg(OEt)2 и ортофосфорной кислоты в качестве реагентов и безводного спирта и этиленгликоля в качестве растворителей [225]. Присутствие магния на поверхности образовавшихся при синтезе частиц фосфатов кальция стабилизирует аморфный фосфат кальция и препятствует росту кристаллов [226].
На рис. 4 представлен треугольник мольных соотношений оксидов для соединений, присутствующих в системе СаО–MgO–Р2О5, а также некоторые прекурсоры для получения этих соединений. Расчет координат точек для соединений, присутствующих в системе СаО–MgO–Р2О5, а также для некоторых соединений-прекурсоров представлен в табл. 7.
Рис. 4.
Треугольник мольных соотношений оксидов в соединениях, принадлежащих системе СаО–Р2О5–MgО (формула соединения указана справа от точки).
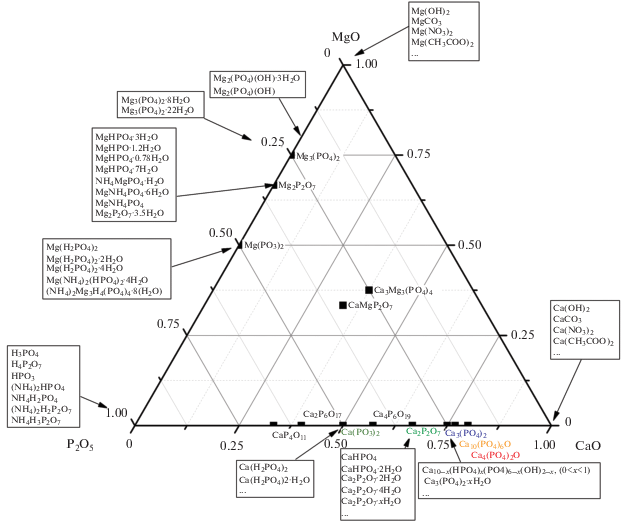
Таблица 7.
Расчет координат соединений, отмеченных на рис. 4
| Соединения | Са/Р | СаО/Р2О5 | Mg/Р | MgО/Р2О5 | Количество оксидов в формуле соединения | Мольная доля оксида в соединении | Мольная доля оксида в соединении без H2O и (NH4)2O | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CaO | MgO | H2O | (NH4)2O | P2O5 | сумма | сумма без Н2О и (NH4)2O | CaO | MgO | H2O | (NH4)2O | P2O5 | CaO | MgO | P2O5 | |||||
| Mg(PO3)2 | 0 | 0 | 0.5 | 1 | 0 | 1 | 0 | 0 | 1 | 2 | 2 | 0 | 0.5 | 0 | 0 | 0.50 | 0 | 0.5 | 0.5 |
| Mg(H2PO4)2 | 0 | 0 | 0.5 | 1 | 0 | 1 | 2 | 0 | 1 | 4 | 2 | 0 | 0.25 | 0.5 | 0 | 0.25 | 0 | 0.5 | 0.5 |
| Mg(H2PO4)2 ⋅ 2H2O | 0 | 0 | 0.5 | 1 | 0 | 1 | 4 | 0 | 1 | 6 | 2 | 0 | 0.167 | 0.667 | 0 | 0.167 | 0 | 0.5 | 0.5 |
| Mg(H2PO4)2 ⋅ 4H2O | 0 | 0 | 0.5 | 1 | 0 | 1 | 6 | 0 | 1 | 8 | 2 | 0 | 0.125 | 0.75 | 0 | 0.125 | 0 | 0.5 | 0.5 |
| Mg(NH4)2(HPO4)2 · 4H2O | 0 | 0 | 0.5 | 1 | 0 | 1 | 5 | 1 | 1 | 8 | 2 | 0 | 0.125 | 0.63 | 0.125 | 0.125 | 0 | 0.5 | 0.5 |
| (NH4)2Mg3H4(PO4)4 ⋅ 8H2O | 0 | 0 | 0.75 | 1.5 | 0 | 3 | 10 | 1 | 2 | 16 | 5 | 0 | 0.188 | 0.63 | 0 | 0.13 | 0 | 0.6 | 0.4 |
| Mg2P2O7 | 0 | 0 | 1 | 2 | 0 | 2 | 0 | 0 | 1 | 3 | 3 | 0 | 0.67 | 0 | 0 | 0.33 | 0 | 0.67 | 0.33 |
| 2MgHPO4 ⋅ 3H2O | 0 | 0 | 1 | 2 | 0 | 2 | 7 | 0 | 1 | 10 | 3 | 0 | 0.2 | 0.7 | 0 | 0.1 | 0 | 0.67 | 0.33 |
| 2MgHPO ⋅ 1.2H2O | 0 | 0 | 1 | 2 | 0 | 2 | 3.4 | 0 | 1 | 6.4 | 3 | 0 | 0.31 | 0.53 | 0 | 0.16 | 0 | 0.67 | 0.33 |
| 2MgHPO4 ⋅ 0.78H2O | 0 | 0 | 1 | 2 | 0 | 2 | 2.6 | 0 | 1 | 5.6 | 3 | 0 | 0.36 | 0.46 | 0 | 0.18 | 0 | 0.67 | 0.33 |
| 2MgHPO4 ⋅ 7H2O | 0 | 0 | 1 | 2 | 0 | 2 | 15 | 0 | 1 | 18 | 3 | 0 | 0.11 | 0.83 | 0 | 0.06 | 0 | 0.67 | 0.33 |
| 2NH4MgPO4 ⋅ H2O | 0 | 0 | 1 | 2 | 0 | 2 | 2 | 1 | 1 | 6 | 3 | 0 | 0.33 | 0.33 | 0.17 | 0.17 | 0 | 0.67 | 0.33 |
| 2MgNH4PO4 ⋅ 6H2O | 0 | 0 | 1 | 2 | 0 | 2 | 12 | 1 | 1 | 16 | 3 | 0 | 0.13 | 0.75 | 0.06 | 0.06 | 0 | 0.67 | 0.33 |
| 2MgNH4PO4 | 0 | 0 | 1 | 2 | 0 | 2 | 0 | 1 | 1 | 4 | 3 | 0 | 0.50 | 0 | 0.25 | 0.25 | 0 | 0.67 | 0.33 |
| Mg2P2O ⋅ 3.5H2O | 0 | 0 | 1 | 2 | 0 | 2 | 3.5 | 0 | 1 | 6.5 | 3 | 0 | 0.31 | 0.54 | 0 | 0.15 | 0 | 0.67 | 0.33 |
| Mg3(PO4)2 | 0 | 0 | 1.5 | 3 | 0 | 3 | 0 | 0 | 1 | 4 | 4 | 0.00 | 0.75 | 0 | 0 | 0.25 | 0 | 0.75 | 0.25 |
| Mg3(P04)2 ⋅ 8H2O | 0 | 0 | 1.5 | 3 | 0 | 3 | 8 | 0 | 1 | 12 | 4 | 0 | 0.25 | 0.67 | 0 | 0.08 | 0 | 0.75 | 0.25 |
| Mg3(PO4)2 ⋅ 22H2O | 0 | 0 | 1.5 | 3 | 0 | 3 | 22 | 0 | 1 | 26 | 4 | 0 | 0.12 | 0.85 | 0 | 0.04 | 0 | 0.75 | 0.25 |
| 2Mg2(PO4)(OH) ⋅ 3H2O | 0 | 0 | 2 | 4 | 0 | 4 | 7 | 0 | 1 | 12 | 5 | 0 | 0.33 | 0.58 | 0 | 0.08 | 0 | 0.8 | 0.2 |
| 2Mg2(PO4)(OH) | 0 | 0 | 2 | 4 | 0 | 4 | 1 | 0 | 1 | 6 | 5 | 0 | 0.67 | 0.17 | 0 | 0.17 | 0 | 0.8 | 0.2 |
| CaMgP2O7 | 0.5 | 1 | 0.5 | 1 | 1 | 1 | 0 | 0 | 1 | 3 | 3 | 0.33 | 0.33 | 0 | 0 | 0.33 | 0.33 | 0.33 | 0.33 |
| Ca3Mg3(PO4)4 | 0.75 | 1.5 | 0.75 | 1.5 | 3 | 3 | 0 | 0 | 2 | 8 | 8 | 0.38 | 0.38 | 0 | 0 | 0.25 | 0.38 | 0.38 | 0.25 |
| CaP4O11 | 0.25 | 0.5 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | 3 | 3 | 0.33 | 0 | 0 | 0 | 0.67 | 0.33 | 0 | 0.67 |
| Ca2P6O17 | 0.33 | 0.67 | 0 | 0 | 2 | 0 | 0 | 0 | 3 | 5 | 5 | 0.40 | 0 | 0 | 0 | 0.60 | 0.40 | 0 | 0.60 |
| Ca(PO3)2 | 0.5 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 2 | 2 | 0.50 | 0 | 0 | 0 | 0.50 | 0.50 | 0 | 0.50 |
| Ca4P6O19 | 0.67 | 1.33 | 0 | 0 | 4 | 0 | 0 | 0 | 3 | 7 | 7 | 0.57 | 0 | 0 | 0 | 0.43 | 0.6 | 0 | 0.43 |
| Ca2P2O7 | 1 | 2 | 0 | 0 | 2 | 0 | 0 | 0 | 1 | 3 | 3 | 0.67 | 0 | 0 | 0 | 0.33 | 0.67 | 0 | 0.33 |
| Ca3(PO4)2 | 1.5 | 3 | 0 | 0 | 3 | 0 | 0 | 0 | 1 | 4 | 4 | 0.75 | 0 | 0 | 0 | 0.25 | 0.75 | 0 | 0.25 |
| Ca10(PO4)6O | 1.67 | 3.33 | 0 | 0 | 10 | 0 | 0 | 0 | 3 | 13 | 13 | 0.77 | 0 | 0 | 0 | 0.23 | 0.77 | 0 | 0.23 |
| Ca4(PO4)2O | 2 | 4 | 0 | 0 | 4 | 0 | 0 | 0 | 1 | 5 | 5 | 0.80 | 0 | 0 | 0 | 0.20 | 0.8 | 0 | 0.2 |
Фосфаты магния и кальция в системе MgO–CaO–P2O5 являются продуктами термолиза соответствующих соединений или могут быть получены в результате твердофазных либо гетерофазных реакций. Создание керамических материалов в системе MgO–CaO–P2O5 допускает возможность получения керамических материалов следующих двухкомпонентных систем: Са3(РО4)2–Mg3(PO4)2, Са2Р2О7–Mg2P2O7, Ca(PO3)2–Mg(PO3)2, Са2Р2О7–Mg3(PO4)2, Mg2P2O7–Са3(РО4)2, Са2Р2О7–Mg(PO3)2, Mg2P2O7–Ca(PO3)2.
Создание керамических материалов в этой системе предполагает разработку порошков соединений, которые показаны на рис. 4 как прекурсоры соответствующих фаз. Превращения прекурсоров (гидратированных фосфатов магния или гидратированных солей аммония) для получения высокотемпературных фаз в керамическом материале системы MgO–CaO–P2O5 могут быть рассмотрены аналогично превращениям, представленным для фосфатов кальция на рис. 1 и 2.
Доступны результаты исследований фазовых диаграмм систем, имеющих совпадения с системой MgO–CaO–P2O5 по двум компонентам, например, систем MgO–Na2O–Р2О5 [227] или Na2O–CaO–SiO2, содержащей дополнительно оксид магния [228].
ПОРИСТОСТЬ И ОСТЕОКОНДУКТИВНОСТЬ РЕЗОРБИРУЕМЫХ МАТЕРИАЛОВ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ КОСТНЫХ ИМПЛАНТАТОВ
Помимо способности к биодеградации, синтетический материал для замены утраченной костной ткани должен обладать достаточной прочностью; характерной пористой архитектурой, по возможности подобной естественной кости; гидрофильностью, благодаря которой происходит смачивание имплантата межклеточной жидкостью и кровью; должен обеспечивать миграцию клеток (быть остеокондуктивным), адгезию (прикрепление клеток), способствовать пролиферации и дифференцировке в остеогенном направлении нанесенных клеток (быть остеоиндуктивным) [229, 230].
Опыт применения пористых матриц для лечения дефектов костной ткани указывает на то, что пористость должна иметь бимодальный характер. Крупные открытые макропоры размером 100–1000 мкм обеспечивают проникновение костных клеток в матрицу, а поры размером 1–10 мкм на поверхности стенок крупных пор обеспечивают условия для закрепления костных клеток [231]. При этом мелкие поры необходимы также для адсорбции белков, факторов роста, и других молекул, создающих микроокружение костных клеток [232].
Увеличение площади поверхности при взаимодействии с различными модельными средами или при имплантации также способствует уменьшению периода растворения/резорбции как многофазных неорганических композитов, так и материалов, изготовленных из гидроксиапатита, в структуру которого привнесены катионные и/или анионные изо- или гетеровалентные замещения и их сочетания [233].
Увеличение площади поверхности взаимодействия среды организма и условия для проникновения костных клеток обеспечиваются приданием материалу пористой проницаемой структуры [234–236]. Для создания неорганической (чаще всего керамической) матрицы, обладающей нерегулярной пористостью, заданного фазового состава могут быть использованы самые различные способы [237, 238]. По-прежнему для формирования пористости в неорганическом материале актуальным остается метод реплики [239]. Известен метод приготовления пористых гранул с заданной геометрией пор обжигом нарезанного порошкового стержня, предварительно экструдированного через фильеру [240, 241]. Повышение прочности керамической пористой матрицы связывают с созданием порового пространства заданной геометрии [242]. Для получения керамических материалов с заданной геометрией порового пространства [243] используют аддитивные технологии, включая печать из порошков (селективное лазерное спекание, добавление связывающего раствора [244]), печать порошковых прекерамических полуфабрикатов из высококонцентрированных суспензий (стереолитография, робокастинг) [245, 246].
Как правило, в качестве порошкового прекурсора и целевой фазы при формовании из суспензий используют гидроксиапатит или трикальцийфосфат в α- или β-модификации [146, 147]. Биоматериалы с фазовым составом, отличным от гидроксиапатита или трикальцийфосфата, получены с применением стереолитографии, лазерного спекания или порошковой печати с использованием жидкости затворения. Имеются сведения о печати из водных суспензий СаSiO3, содержащих поливиниловый спирт [247]. Селективное лазерное спекание применяют для получения керамики на основе сульфата кальция CaSO4 (ангидрита) [248]. Материалы на основе гипса также получены с использованием 3D-печати при взаимодействии слоя порошка и капель жидкости затворения [249]. Предложен метод, сочетающий экструзионную 3D-печать из сульфата кальция с последующим взаимодействием материала пористой конструкции с раствором гидрофосфата натрия для превращения сульфата в фосфат кальция [250].
ЗАКЛЮЧЕНИЕ
Обобщена информация о существующих в настоящее время неорганических резорбируемых материалах, предназначенных для компенсации и лечения дефектов костной ткани методами регенеративной медицины. Особое внимание уделено рассмотрению ряда оксидных систем, наиболее часто используемых для синтеза порошков, получения цементов и керамики. Представленные в статье треугольники мольных соотношений оксидов в соединениях, принадлежащих системам СаО–Р2О5–Н2O и СаО–Р2О5–(NН4)2O, могут стать инструментом планирования синтезов порошков гидратированных фосфатов кальция, гидрофосфатов кальция, двойных солей кальция-аммония, которые затем могут быть использованы для получения неорганических резорбируемых материалов, таких как керамика или цементный камень. Треугольники мольных соотношений оксидов в соединениях, принадлежащих системам СаО–Р2О5–Н2O, СаО–Р2О5–(NН4)2O, СаО–Р2О5–Na2O и CaO–P2O5–MgO, могут быть также использованы для выбора состава исходных порошковых смесей для получения керамических материалов заданного фазового состава.
Получение керамических материалов в системах СаО–Р2О5, СаО–Р2О5–Na2O и CaO–P2O5–MgO рассмотрено в аспекте взаимосвязи состава синтетического высокодисперсного порошкового прекурсора и целевого фазового состава, который формируется в результате превращений, протекающих в порошковой системе при нагревании.
Особенностью рассмотренных неорганических резорбируемых материалов, предназначенных для использования в регенеративной медицине, является формирование их фазового состава в результате различных химических реакций: реакций химического связывания для цементного камня и совокупности гетерофазных реакций и реакций термического разложения при получении керамических материалов.
Также рассмотрены различные методы придания неорганическому биосовместимому резорбируемому материалу пористой структуры, определяющей остеокондуктивность. Это возможно с использованием как известных методов для создания пористой керамики технического назначения (метод выгорающих добавок, метод реплики и т.д.), так и аддитивных методов (стереолитографическая 3D-печать, экструзионная 3D-печать, порошковая послойная печать и т.д.).
Считается, что идеальный материал для лечения дефектов костной ткани до настоящего времени не создан, поэтому его поиск будет продолжен.
Список литературы
Wang W., Yeung K.W.K. Bone Grafts and Biomaterials Substitutes for Bone Defect Repair: A review // Bioact. Mater. 2017. V. 2. № 4. P. 224–247. https://doi.org/10.1016/j.bioactmat.2017.05.007
Кирилова И.А., Садовой М.А., Подорожная В.Т. Сравнительная характеристика материалов для костной пластики: состав и свойства // Хирургия позвоночника. 2012. № 3. С. 72–83. https://doi.org/10.14531/ss2012.3.72-83 (https://www.elibrary.ru/item.asp?id=17918266)
Мудрая В.Н., Степаненко И.Г., Шаповалов А.С. Применение костнопластических материалов в современной стоматологии // Укр. журн. клінічної та лабораторної медицини. 2010. Т. 5. № 1. С. 52–57. http://www.irbis-nbuv.gov.ua/cgi-bin/irbis_nbuv/cgiirbis_64.exe?C21COM=2&I21DBN=UJRN&P21DBN=UJRN&IMAGE_FILE_DOWNLOAD=1&Image_file_name=PDF/Ujkl_2010_5_1_15.pdf
Titsinides S., Agrogiannis G., Karatzas T. Bone Grafting Materials in Dentoalveolar Reconstruction: a Comprehensive Review // Jpn. Dent. Sci. Rev. 2019. V. 55 P. 26–32. https://doi.org/10.1016/j.jdsr.2018.09.003
Balaji V.R., Manikandan D., Ramsundar A. Bone Grafts in Periodontics // Matrix Sci. Med. 2020. V. 4. № 3. P. 57. https://doi.org/10.4103/MTSM.MTSM_2_19
Матвейчук И.В., Розанов В.В., Литвинов Ю.Ю. Изучение биофизических свойств костной ткани для медико-биологических приложений // Альманах клинической медицины. 2016. Т. 44. № 2. С. 193–202. https://doi.org/10.18786/2072-0505-2016-44-2-193-202
Ramesh N., Moratti S.C., Dias G.J. Hydroxyapatite–Polymer Biocomposites for Bone Regeneration: A Review of Current Trends // J. Biomed. Mater. Res., Part B. 2018. V. 106. № 5. P. 2046–2057. https://doi.org/10.1002/jbm.b.33950
Nonoyama T. Robust Hydrogel–Bioceramics Composite and its Osteoconductive Properties // Polym. J. 2020. V. 52. P. 709–716. https://doi.org/10.1038/s41428-020-0332-y
Filippi M., Born G., Chaaban M., Scherberich A. Natural Polymeric Scaffolds in Bone Regeneration // Front. Bioeng. Biotechnol. 2020. V. 8. P. 474. https://doi.org/10.3389/fbioe.2020.00474
Aquino-Martínez R., Angelo A.P., Pujol F.V. Calcium-Containing Scaffolds Induce Bone Regeneration by Regulating Mesenchymal Stem Cell Differentiation and Migration // Stem Cell Res. Ther. 2017. V. 8. № 1. P. 1–10. https://doi.org/10.1186/s13287-017-0713-0
Roden J.R.D. Principles of Bone Grafting // Oral Maxillofac. Surg. Clin. 2010. V. 22. № 3. P. 295–300. https://doi.org/10.1016/j.coms.2010.06.001
Хлусов И.А., Карлов А.В., Поженько К.С., Суходоло И.В., Хлусова М.Ю. Зависимость остеогенных свойств клеток костного мозга от рельефа и растворимости кальцийфосфатных поверхностей // Бюлл. экспериментальной биологии и медицины. 2006. Т. 141. № 1. С. 107–112. https://www.elibrary.ru/item.asp?id=9181774&
Navarro M., Michiardi A., Castan O., Planell J.A. Biomaterials in Orthopaedics // J. R. Soc., Interface. 2008. V. 5. № 27. P. 1137–1158. https://doi.org/10.1098/rsif.2008.0151
Ginebra M.P., Canal C., Espanol M., Pastorino D., Montufar E.B. Calcium Phosphate Cements as Drug Delivery Materials // Adv. Drug Delivery Rev. 2012. V. 64. № 12. P. 1090–1110. https://doi.org/10.1016/j.addr.2012.01.008
Qu H., Fu H., Han Z., Sun Y. Biomaterials for Bone Tissue Engineering Scaffolds: a Review // RSC Adv. 2019. V. 9. № 45. P. 26252–26262. https://doi.org/10.1039/C9RA05214C
Janicki P., Schmidmaier G. What Should Be the Characteristics of the Ideal Bone Graft Substitute? Combining Scaffolds with Growth Factors and/or Stem Cells // Injury. 2011. V. 42. P. S77–S81. https://doi.org/10.1016/j.injury.2011.06.014
Verron E., Khairoun I., Guicheux J., Bouler J.M. Calcium Phosphate Biomaterials as Bone Drug Delivery Systems: a Review // Drug Discov. Today. 2010. V. 15. № 13–14. P. 547–552. https://doi.org/10.1016/j.drudis.2010.05.003
Dorozhkin S.V. Functionalized Calcium Orthophosphates (CaPO4) and Their Biomedical Applications // J. Mater. Chem. B. 2019. V. 7. № 47. P. 7471–7489. https://doi.org/10.1039/C9TB01976F
Голованова О.А., Головченко К.К. Адсорбция аминокислот на поверхности брушита и гидроксилапатита // Журн. физ. химии. 2019. Т. 93. № 11. С. 1714–1723. https://elibrary.ru/item.asp?id=39524389
Gui N., Xu W., Myers D.E., Shukla R., Tang H.P., Qian M. The Effect of Ordered and Partially Ordered Surface Topography on Bone Cell Responses: a Review // Biomater. Sci. 2018. V. 6. № 2. P. 250–264. https://doi.org/10.1039/C7BM01016H
Орлов Н.К., Путляев В.И., Евдокимов П.В., Сафронова Т.В., Климашина Е.С., Милькин П.А. Резорбция кальцийфосфатной биокерамики Ca3 – xM2x (PO4)2 (M = Na, K) в модельных растворах // Неорган. материалы. 2018. Т. 54. № 5. С. 523–531. https://doi.org/10.7868/S0002337X18050147
Eliaz N., Metoki N. Calcium Phosphate Bioceramics: a Review of Their History, Structure, Properties, Coating Technologies and Biomedical Applications // Materials. 2017. V. 10. № 4. P. 334. https://doi.org/10.3390/ma10040334
Von Euw S., Wang Y., Laurent G., Drouet C., Babonneau F., Nassif N., Azais T. Bone Mineral: New Insights into Its Chemical Composition // Sci. Rep. 2019. V. 9. № 1. P. 1–11. https://doi.org/10.1038/s41598-019-44620-6
Амфлетт Ч. Неорганические иониты. М.: Мир, 1966. 188 с.
Берлянд А.С., Снякин А.П., Прокопов А.А. Исследование сорбционной способности гидроксиапатита по отношению к некоторым аминокислотам и ионам тяжелых металлов // Химико-фармацевтический журн. 2012. Т. 46. № 5. С. 32–34. https://elibrary.ru/item.asp?id=23152962
Иванец А.И., Шашкова И.Л., Китикова Н.В., Радкевич А.В., Давыдов Ю.П. Извлечение ионов стронция фосфатами кальция и магния из водных растворов на фоне CaCl2 // Радиохимия. 2015. Т. 57. № 6. С. 521–525. https://elibrary.ru/item.asp?id=24870324
Bang L.T., Ramesh S., Purbolaksono J., Ching Y.C., Long B.D., Chandran H., Othman R. Effects of Silicate and Carbonate Substitution on the Properties of Hydroxyapatite Prepared by Aqueous Co-precipitation Method // Mater. Des. 2015. V. 87. P. 788–796. https://doi.org/10.1016/j.matdes.2015.08.069
Данильченко С.Н. Структура и свойства апатитов кальция с точки зрения биоминералогии и биоматериаловедения (обзор) // Вісник СумДУ. Серія Фізика, математика, механіка. 2007. № 2. С. 33–59. https://essuir.sumdu.edu.ua/handle/123456789/1152
Герк С.А., Голованова О.А. Элементный состав костной ткани человека в норме и при патологии // Вестник Омского ун-та. 2015. № 4(78). С. 39–44. https://elibrary.ru/item.asp?id=25068755
Лемешева С.А., Голованова О.А., Туренков С.В. Исследование особенностей состава костных тканей человека // Химия в интересах устойчивого развития. 2009. Т. 17. № 3. С. 327–332. https://www.elibrary.ru/item.asp?id=12790115
Lonsdale K. Human Stones: Limited Studies Give Some Details of Composition, Rates of Growth, Distribution, and Possible Causes // Science. 1968. V. 159. № 3820. P. 1199–1207. https://doi.org/10.1126/science.159.3820.1199
Abhishek A., Doherty M. Update on Calcium Pyrophosphate Deposition // Clin. Exp. Rheumatol. 2016. V. 34. № 4. Suppl. 98. P. 32–38. https://www.clinexprheumatol.org/article.asp?a=10848
Севостьянова О.А., Бощенко В.С., Осадчий В.К., Парначёв В.П., Полиенко А.К. Изучение минерального состава и структуры уролитов жителей Томского района (г. Томск) // Урология. 2017. № 2. С. 76–81. https://doi.org/10.18565/urol.2017.2.71-75
Лемешева С.А., Голованова О.А., Муромцев И.В., Туренков С.В. Состав и структура костных тканей человека как отражение процессов патогенной минерализации при коксартрозе // Вестн. Омского ун-та. 2010. № 2(56). С. 106–112. https://elibrary.ru/item.asp?id=15511050
Голованова О.А. Биоминералогия мочевых, желчных, зубных и слюнных камней из организма человека: Автореф. дис. … д. г.-м. н. Томск: ТПУ, 2009. 39 с. https://www.elibrary.ru/item.asp?id=15932831
Голованова О.А., Франк-Каменецкая О.В., Пунин Ю.О. Особенности патогенного минералообразования в организме человека // Рос. хим. журн. 2010. Т. 54. № 2. С. 124–136. https://elibrary.ru/item.asp?id=15014828
Антонова М.О., Кузьмичева Г.М., Руденко В.И., Натыкан А.А., Садовская Н.В. Состав и микроструктура коралловидных мочевых камней. Теории роста // Тонкие хим. технологии. 2013. Т. 8. № 4. С. 64–72. https://www.finechem-mirea.ru/jour/article/view/572/618
Pina S., Ribeiro V.P., Marques C.F., Maia F.R., Silva T.H., Reis R.L., Oliveira J.M. Scaffolding Strategies for Tissue Engineering and Regenerative Medicine Applications // Materials. 2019. V. 12. № 11. P. 1824. https://doi.org/10.3390/ma12111824
Bohner M. Bioresorbable Ceramics //Degradation Rate of Bioresorbable Materials: Prediction and Evaluation. Woodhead Publishing Series in Biomaterials. Cambridge: Woodhead, 2008. P. 95–114. https://doi.org/10.1533/9781845695033.2.95
Ievlev V.M., Putlyaev V.I., Safronova T.V., Evdokimov P.V. Additive Technologies for Making Highly Permeable Inorganic Materials with Tailored Morphological Architectonics for Medicine // Inorg. Mater. 2015. V. 51. № 13. P. 1297–1315. https://doi.org/10.1134/S0020168515130038
Raynaud S., Champion E., Bernache-Assollant D., Thomas P. Calcium Phosphate Apatites with Variable Ca/P Atomic Ratio I. Synthesis, Characterisation and Thermal Stability of Powders // Biomaterials. 2002. V. 23. № 4. P. 1065–1072. https://doi.org/10.1016/S0142-9612(01)00218-6
Dorozhkin S.V. Multiphasic Calcium Orthophosphate (CaPO4) Bioceramics and Their Biomedical Applications // Ceram. Int. 2016. V. 42. № 6. P. 6529–6554. https://doi.org/10.1016/j.ceramint.2016.01.062
Orlov N.K., Evdokimov P.V., Milkin P.A., Garshev A.V., Putlayev V.I., Grebenev V.V., Günster J. Phase Equilibria in CaNaPO4–CaKPO4 System and Their Influence on Formation of Bioceramics Based on Mixed Ca–K–Na Phosphates // J. Eur. Ceram. Soc. 2019. V. 39. № 16 P. 5410–5422. https://doi.org/10.1016/j.jeurceramsoc.2019.07.044
Сафронова Т.В., Путляев В.И., Филиппов Я.Ю., Шаталова Т.Б., Фатин Д.С. Керамика на основе порошка брушита, синтезированного из нитрата кальция и гидрофосфатов натрия и калия // Неорган. материалы. 2018. Т. 54. № 2. С. 210–220. https://doi.org/10.7868/S0002337X18020148
Путляев В.И., Сафронова Т.В. Новое поколение кальцийфосфатных биоматериалов: роль фазового и химического составов // Стекло и керамика. 2006. № 3. С. 30–33. https://www.elibrary.ru/item.asp?id=9233707
Сафронова Т.В., Путляев В.И. Медицинское неорганическое материаловедение в России: кальцийфосфатные материалы // Наносистемы: физика, химия, математика. 2013. Т. 4. № 1. С. 24–47. http://nanojournal.ifmo.ru/en/wp-content/uploads/2013/02/NPCM2013-41P24.pdf
Montazerian M., Zanotto E.D. A Guided Walk through Larry Hench’s Monumental Discoveries // J. Mater. Sci. 2017. V. 52. № 15. P. 8695–8732. https://doi.org/10.1007/s10853-017-0804-4
Jones J.R. Reprint of: Review of Bioactive Glass: from Hench to Hybrids // Acta Biomater. 2015. V. 23. № 5. P. 553–582. https://doi.org/10.1016/j.actbio.2015.07.019
Comesaña R., Lusquiños F., Del Val J., Quintero F., Riveiro A., Boutinguiza M., Jones J.R., Hill R.G., Pou J. Toward Smart Implant Synthesis: Bonding Bioceramics of Different Resorbability to Match Bone Growth Rates // Sci. Rep. 2015. V. 5. P. 10677. https://doi.org/10.1038/srep10677
Abou Neel E.A., Pickup D.M., Valappil S.P., Newport R.J., Knowles J.C. Bioactive Functional Materials: a Perspective on Phosphate-based Glasses // J. Mater. Chem. 2009. V. 19. № 6. P. 690–701. https://doi.org/10.1039/B810675D
Wu C., Chang J. A Review of Bioactive Silicate Ceramics // Biomed. Mater. 2013. V. 8. № 3. P. 032001. https://doi.org/10.1088/1748-6041/8/3/032001
Srinath P., Abdul Azeem P., Venugopal Reddy K. Review on Calcium Silicate-Based Bioceramics in Bone Tissue Engineering // Int. J. Appl. Ceram. Technol. 2020. V. 17. № 5. P. 2450–2464. https://doi.org/10.1111/ijac.13577
Cai Y., Zhang S., Zeng X., Wang Y., Qian M., Weng W. Improvement of Bioactivity with Magnesium and Fluorine Ions Incorporated Hydroxyapatite Coatings via Sol–Gel Deposition on Ti6Al4V Alloys // Thin Solid Films. 2009. V. 517. № 17. P. 5347–5351. https://doi.org/10.1016/j.tsf.2009.03.071
Hsu H.J., Waris R.A., Ruslin M., Lin Y.H., Chen C.S., Ou K.L. An Innovative α-Calcium Sulfate Hemihydrate Bioceramic as a Potential Bone Graft Substitute // J. Am. Ceram. Soc. 2018. V. 101. № 1. P. 419–427. https://doi.org/10.1111/jace.15181
Yang Z., Yang D.A., Zhao H. Degradation Behavior of Calcium Sulfate/β-Tricalcium Phosphate Composites in Tris // Key Eng. Mater. 2007. V. 336. P. 1635–1637. doi: 10.4028/www.scientific.net/KEM.336-338.1635
Yang D., Yang Z., Li X., Di L.Z., Zhao H. A Study of Hydroxyapatite/Calcium Sulphate Bioceramics // Ceram. Int. 2005. V. 31. № 7. P. 1021–1023. https://doi.org/10.1016/j.ceramint.2004.10.016
Shao H., Yu X., Zhang Z., Lin T., Peng J., Wang A., Liu S., Zhao M. Effect of Different CaSO4 Contents on CaSiO3–CaSO4 Porous Composite Bone Scaffolds by 3D Gel-printing // Int. J. Appl. Ceram. Technol. 2020. P. 1–6. https://doi.org/10.1111/ijac.13587
Chang M.P., Hsu H.C., Tuan W.H., Lai P.L. A Feasibility Study Regarding the Potential Use of Silica-Doped Calcium Sulfate Anhydrite as a Bone Void Filler // J. Med. Biol. Eng. 2017. V. 37. № 6. P. 879–886. https://doi.org/10.1007/s40846-017-0253-1
Kuo S.T., Wu H.W., Tuan W.H., Tsai Y.Y., Wang S.F., Sakka Y. Porous Calcium Sulfate Ceramics with Tunable Degradation Rate // J. Mater. Sci. – Mater. Med. 2012. V. 23. № 10. P. 2437–2443. https://doi.org/10.1007/s10856-012-4704-5
Yukna R.A. Clinical Evaluation of Coralline Calcium Carbonate as a Bone Replacement Graft Material in Human Periodontal Osseous Defects // J. Periodontol. 1994. V. 65. № 2. P. 177–185. https://doi.org/10.1902/jop.1994.65.2.177
Lemos A.F., Ferreira J.M.F. Porous Bioactive Calcium Carbonate Implants Processed by Starch Consolidation // Mater. Sci. Eng., C. 2000. V. 11. № 1. P. 35–40. https://doi.org/10.1016/S0928-4931(00)00134-X
Ishikawa K., Miyamoto Y., Tsuchiya A., Hayashi K., Tsuru K., Ohe G. Physical and Histological Comparison of Hydroxyapatite, Carbonate Apatite, and β-Tricalcium Phosphate Bone Substitutes // Materials. 2018. V. 11. № 10. P. 1993. https://doi.org/10.3390/ma11101993
Safarzadeh M., Ramesh S., Tan C.Y., Chandran H., Ching Y.C., Noor A.F.M., Krishnasamy S., Teng W.D. Sintering Behaviour of Carbonated Hydroxyapatite Prepared at Different Carbonate and Phosphate Ratios // Bol. Soc. Esp. Cerám. Vidr. 2020. V. 59. № 2. P. 73–80. https://doi.org/10.1016/j.bsecv.2019.08.001
Ortali C., Julien I., Drouet C., Champion E. Influence of Carbonation on the Low-Temperature Consolidation by Spark Plasma Sintering of Carbonated Calcium Phosphate Bioceramics // Ceram. Int. 2020. V. 46. № 5. P. 5799–5810. https://doi.org/10.1016/j.ceramint.2019.11.030
Ben-Nissan B. Natural Bioceramics: from Coral to Bone and Beyond // Curr. Opin. Solid State Mater. Sci. 2003. V. 7. № 4–5. P. 283–288. https://doi.org/10.1016/j.cossms.2003.10.001
Hughes E., Yanni T., Jamshidi P., Grover L.M. Inorganic Cements for Biomedical Application: Calcium Phosphate, Calcium Sulphate and Calcium Silicate // Adv. Appl. Ceram. 2015. V. 114. № 2. P. 65–76. https://doi.org/10.1179/1743676114Y.0000000219
Pietrzak W.S., Ronk R. Calcium Sulfate Bone Void Filler: a Review and a Look Ahead // J. Craniofac. Surg. 2000. V. 11. № 4. P. 327–333. https://doi.org/10.1097/00001665-200011040-00009
Vallet-Regí M., Salinas A.J. Ceramics as Bone Repair Materials //Bone Repair Biomaterials. Cambridge: Woodhead, 2019. ISBN: 9780081024515. P. 141–178. https://doi.org/10.1016/B978-0-08-102451-5.00006-8
Thomas M.V., Puleo D.A. Calcium Sulfate: Properties and Clinical Applications // J. Biomed. Mater. Res., Part B. 2009. V. 88. № 2. P. 597–610. https://doi.org/10.1002/jbm.b.31269
Cao X., Lu H., Liu J., Lu W., Guo L., Ma M., Zhang B., Guo Y. 3D Plotting in the Preparation of Newberyite, Struvite, and Brushite Porous Scaffolds: Using Magnesium Oxide as a Starting Material // J. Mater. Sci.: Mater. Med. 2019. V. 30. № 8. P. 88. https://doi.org/10.1007/s10856-019-6290-2
Huan Z., Chang J. Novel Bioactive Composite Bone Cements Based on the β-Tricalcium Phosphate – Monocalcium Phosphate Monohydrate Composite Cement System // Acta Biomater. 2009. V. 5. № 4. P. 1253–1264. https://doi.org/10.1016/j.actbio.2008.10.006
Liu W., Zhai D., Huan Z., Wu C., Chang J. Novel Tricalcium Silicate/Magnesium Phosphate Composite Bone Cement Having High Compressive Strength, in Vitro Bioactivity and Cytocompatibility // Acta Biomater. 2015. V. 21. P. 217–227. https://doi.org/10.1016/j.actbio.2015.04.012
Shu Y., Qiu F., Zhang Y., Cao W., Wu Z., Nian S., Zhou N. Novel Vaterite-Containing Tricalcium Silicate Bone Cement by Surface Functionalization Using 3-Aminopropyltriethoxysilane: Setting Behavior, in Vitro Bioactivity and Cytocompatibility // Biomed. Mater. 2017. V. 12. № 6. P. 065007. https://doi.org/10.1088/1748-605X/aa84b8
Смирнов В.В., Хайрутдинова Д.Р., Гольдберг М.А., Антонова О.С., Баринов С.М. Композиционные цементные материалы на основе сульфата и фосфата кальция для медицины // Докл. АН. 2018. Т. 483. № 2. С. 162–165. https://doi.org/10.31857/S086956520003473-3
Chen W.L., Chen C.K., Lee J.W., Lee Y.L., Ju C.P., Lin J.H.C. Structure, Properties and Animal Study of a Calcium Phosphate/Calcium Sulfate Composite Cement // Mater. Sci. Eng., C. 2014. V. 37. P. 60–67. https://doi.org/10.1016/j.msec.2013.12.034
Wang J.S., Tägil M., Isaksson H., Boström M., Lidgren L. Tissue Reaction and Material Biodegradation of a Calcium Sulfate/Apatite Biphasic Bone Substitute in Rat Muscle // J. Orthop. Transl. 2016. V. 6. P. 10–17. https://doi.org/10.1016/j.jot.2015.11.002
Смирнов В.В., Хайрутдинова Д.Р., Смирнов С.В., Антонова О.С., Гольдберг М.А., Баринов С.М. Костные цементы на основе магний замещeнных сульфатов кальция // Докл. АН. 2019. Т. 485. № 1. С. 48–52. https://doi.org/10.31857/S0869-5652485148-52
da Silva Brum I., de Carvalho J.J., da Silva Pires J.L., de Carvalho M.A.A., dos Santos L.B.F., Elias C.N. Nanosized Hydroxyapatite and β-Tricalcium Phosphate Composite: Physico-Chemical, Cytotoxicity, Morphological Properties and in Vivo Trial // Sci. Rep. 2019. V. 9. № 1. P. 1–10. https://doi.org/10.1038/s41598-019-56124-4
Kivrak N., Taş A.C. Synthesis of Calcium Hydroxyapatite-Tricalcium Phosphate (HA-TCP) Composite Bioceramic Powders and Their Sintering Behavior // J. Am. Ceram. Soc. 1998. V. 81. № 9. P. 2245–2252. https://doi.org/10.1111/j.1151-2916.1998.tb02618.x
Pena J., Vallet-Regı M. Hydroxyapatite, Tricalcium Phosphate and Biphasic Materials Prepared by a Liquid Mix Technique // J. Eur. Ceram. Soc. 2003. V. 23. № 10. P. 1687–1696. https://doi.org/10.1016/S0955-2219(02)00369-2
Hu X., Zhang W., Hou D. Synthesis, Microstructure and Mechanical Properties of Tricalcium Phosphate–Hydroxyapatite (TCP/HA) Composite Ceramic // Ceram. Int. 2020. V. 46. № 7. P. 9810–9816. https://doi.org/10.1016/j.ceramint.2019.12.254
Dorozhkin S.V., Epple M. Biological and Medical Significance of Calcium Phosphates // Angew. Chem. Int. Ed. 2002. V. 41. № 17. P. 3130–3146. https://doi.org/10.1002/1521-3773(20020902)41:17<3130:: AID-ANIE3130>3.0.CO;2-1
Scheicher H., Wendler E. Bone Replacement Material on the Basis of Carbonate and Alkali Containing Calciumphosphate Apatites: US Patent 4917702, 1990. https://patents.google.com/patent/US4917702A/en
Bonfield W., Best S.M., Barralet J.E. Method for the Preparation of Carbonated Hydroxyapatite Compositions: US Patent 6582672, 2003. https://patents.google.com/patent/US5470803A/en
Bonfield W., Gibson I.R. Process for the Preparation of Magnesium and Carbonate Substituted Hydroxyapatite: US Patent 6585946, 2003. https://patents.google.com/patent/US6585946B1/en
Ito A., Ichinose N., Ojima K., Layrolle P., Kawamura H. Zinc-Doped Tricalcium Phosphate Ceramic Material: US Patent 6090732, 2000. https://patents.google.com/patent/US6090732A/en
Aoki H., Kato K., Tabata T., Ogiso M. Ortopedic and Dental Implant Ceramic Composition and Process for Preparing Same: US Patent 4149893, 1979. https://patents.google.com/patent/US4149893A/en
Best S.M., Bonfield W., Gibson I.R., Jha L.J., San-tos J.D.D.S. Silicon-Substituted Apatites and Process for the Preparation Thereof: US Patent 6312468, 2001. https://patents.google.com/patent/US6312468B1/en
Панкратов Д.А., Долженко В.Д., Овченков Е.А., Анучина М.М., Северин А.В. Свойства железосодержащих композитов на основе наногидроксиапатита // Неорган. материалы. 2017. Т. 53. № 1. С. 94–104. https://doi.org/10.7868/S0002337X17010122
Samanta S.K., Devi K.B., Das P., Mukherjee P., Chanda A., Roy M., Nandi S.K. Metallic Ion Doped Tri-Calcium Phosphate Ceramics: Effect of Dynamic Loading on in Vivo Bone Regeneration // J. Mech. Behav. Biomed. Mater. 2019. V. 96. P. 227–235. https://doi.org/10.1016/j.jmbbm.2019.04.051
Фадеева И.В., Фомин А.С., Баринов С.М., Давыдова Г.А., Селезнева И.И., Преображенский И.И., Русаков М.К., Фомина А.А., Волченкова В.А. Синтез и свойства марганецсодержащих кальцийфосфатных материалов // Неорган. материалы. 2020. Т. 56. № 7. С. 738–745. https://elibrary.ru/item.asp?id=42963726
Фадеева И.В., Фомин А.С., Давыдова Г.А., Филиппов Я.Ю., Шапошников М.Е., Волченкова В.А., Селезнева И.И., Баринов С.М. Пористая керамика из замещенных трикальцийфосфатов для восстановления костной ткани // Материаловедение. 2018. № 9. С. 43–48. https://doi.org/10.31044/1684-579X-2018-0-9-43-48
Safronova T.V., Selezneva I.I., Tikhonova S.A., Kise-lev A.S., Davydova G.A., Shatalova T.B., Larionov D.S., Rau J.V. Biocompatibility of Biphasic α, β-Tricalcium Phosphate Ceramics in Vitro // Bioact. Mater. 2020. V. 5. № 2. P. 423–427. https://doi.org/10.1016/j.bioactmat.2020.03.007
Brown P.W. Phase Relationships in the Ternary System CaO–P2O5–H2O at 25°C // J. Am. Ceram. Soc. 1992. V. 75. № 1. P. 17–22. https://doi.org/10.1111/j.1151-2916.1992.tb05435.x
Feng S.S., Rockett T.J. The System CaO–P2O5–H2O at 200°C // J. Am. Ceram. Soc. 1979. V. 62. № 11–12. P. 619–620. https://doi.org/10.1111/j.1151-2916.1979.tb12745.x
Martin R.I., Brown P.W. Phase Equilibria among Acid Calcium Phosphates // J. Am. Ceram. Soc. 1997. V. 80. P. 1263–1266. https://doi.org/10.1111/j.1151-2916.1997.tb02973.x
Bassett H. LVI.-The Phosphates of Calcium. Part IV. The Basic Phosphates // Chem. Soc. Trans. J. 1917. V. 111. P. 620–642. https://doi.org/10.1039/CT9171100620
Martin R.I., TenHuisen, K.S., Leamy P., Brown, P.W. Enthalpies of Formation of Compounds in the P2O5–CaO–H2O System // J. Phys. Chem. B. 1997. V. 101. № 45. P. 9375–9379. https://doi.org/10.1021/jp972053h
Egan E.P., Jr., Luff B.B. Heats of Solution at 25°C. in the System CaO–P2O5–H2O // J. Chem. Eng. Data. 1966. V. 11. № 4. P. 520–532. https://doi.org/10.1021/je60031a016
Алдабергенов М.К., Балакаева Г.Т. Триангуляция системы CaO-P2O5-H2O. Анализ фазодиаграммы // Журн. физ. химии. 1998. Т. 72. № 9. С. 1543–1546.
Skinner H.C.W. Studies in the Basic Mineralizing System, CaO–P2O5–H2O // Calcif. Tissue. Res. 1974. V. 14. № 1. P. 3–14. https://doi.org/10.1007/BF02060279
Hudon P., Jung I.H. Critical Evaluation and Thermodynamic Optimization of the CaO–P2O5 System // Metall. Mater. Trans. B. 2015. V. 46. № 1. P. 494–522. https://doi.org/10.1007/s11663-014-0193-x
Ding G.H., Xie W., Jung I.H., Qiao Z.Y., Du G.W., Cao Z.M. Thermodynamic Assessment of the MgO–P2O5 and CaO–P2O5 Systems // Acta Phys.-Chim. Sin. 2015. V. 31. № 10. P. 1853–1863. https://doi.org/10.3866/PKU.WHXB201508121
Putlyaev V.I., Safronova T.V. Chemical Transformations of Calcium Phosphates during Production of Ceramic Materials on Their Basis // Inorg. Mater. 2019. V. 55. № 13. P. 1328–1341. https://doi.org/10.1134/S0020168519130028
Рудин В.Н., Комаров В.Ф., Мелихов И.В., Орлов А.Ю., Минаев В.В., Божевольнов В.Е., Зуев В.П. Способ получения суспензии гидроксиапатита: Патент RU 2122520 C1. 27.11.1998. https://elibrary.ru/item.asp?id=38118110
Сафронова Т.В., Корнейчук С.А., Путляев В.И., Филиппов Я.Ю., Шаталова Т.Б., Крутько В.К., Крутько В.К., Мусская О.Н., Уласевич С.А. Порошки фосфатов кальция, синтезированные из гидроксиапатита и водного раствора фосфорной кислоты при мольном соотношении 0.35 ≤ Са/P ≤ 1.0 // Успехи в химии и хим. технологии. 2017. Т. 31. № 15(196). С. 8–10. https://doi.org/10.24412/FiqikSg_1Ys
Сафронова Т.В., Путляев В.И., Кнотько А.В., Крутько В.К., Мусская О.Н., Уласевич С.А., Воробьева Н.А., Телицин В.Д. Кальцийфосфатная керамика в системе Са(РО3)2–Са2Р2О7 на основе порошковой смеси, содержащей гидрофосфаты кальция // Стекло и керамика. 2018. № 7. С. 37–44. https://elibrary.ru/item.asp?id=35656003
Oliveira C., Georgieva P., Rocha F., Ferreira A., de Azevedo S.F. Dynamical Model of Brushite Precipitation // J. Cryst. Growth. 2007. V. 305. № 1. P. 201–210. https://doi.org/10.1016/j.jcrysgro.2007.04.016
Баринов С.М., Вахрушев И.В., Комлев В.С., Миронов А.В., Попов В.К., Тетерина А.Ю., Федотов А.Ю., Ярыгин К.Н. Трехмерная печать керамических матриксов для инженерии костной ткани // Материаловедение. 2015. № 2. С. 50–56. https://www.elibrary.ru/item.asp?id=22945049
Gbureck U., Hölzel T., Biermann I., Barralet J.E., Grover L.M. Preparation of Tricalcium Phosphate/Calcium Pyrophosphate Structures via Rapid Prototyping // J. Mater. Sci.: Mater. Med. 2008. V. 19. № 4. P. 1559–1563. https://doi.org/10.1007/s10856-008-3373-x
Monma H. Preparation of Octacalcium Phosphate by the Hydrolysis of α-Tricalcium Phosphate // J. Mater. Sci. 1980. V. 15. № 10. P. 2428–2434. https://doi.org/10.1007/BF00550744
Fukase Y., Eanes E.D., Takagp S., Chow L.C., Brown W.E. Setting Reactions and Compressive Strengths of Calcium Phosphate Cements //J. Dent. Res. 1990. V. 69. № 12. P. 1852–1856. https://doi.org/10.1177/00220345900690121201
Friedman C.D., Costantino P.D., Takagi S., Chow L.C. BoneSource™ Hydroxyapatite Cement: a Novel Biomaterial for Craniofacial Skeletal Tissue Engineering and Reconstruction // J. Biomed. Mater. Res. 1998. V. 43. № 4. P. 428–432. https://doi.org/10.1002/(SICI)1097-4636(199824)43:4<428::AID-JBM10>3.0.CO;2-0
O’hara R., Buchanan F., Dunne N. Injectable Calcium Phosphate Cements for Spinal Bone Repair // Biomaterials for Bone Regeneration. Novel Techniques and Applications. Cambridge: Woodhead, 2014. P. 26–61. https://doi.org/10.1533/9780857098104.1.26
Wagh A.S. Calcium Phosphate Cements // Chemically Bonded Phosphate Ceramics: Twenty-First Century Materials with Diverse Applications. Amsterdam: Elsevier, 2016. 2nd ed. chapter 13. P. 165–178. https://doi.org/10.1016/B978-0-08-100380-0.00013-0
Сафронова Т.В., Корнейчук С.А., Шаталова Т.Б., Лукина Ю.С., Сивков С.П., Филиппов Я.Ю., Крутько В.К., Мусская О.Н. Керамика в системе Са2Р2О7–Са(РО3)2, полученная обжигом цементного камня на основе β-трикальцийфосфата и монокальцийфосфата моногидрата // Стекло и керамика. 2020. № 5. С. 3–13. https://www.elibrary.ru/contents.asp?id=42978894
Сафронова Т.В., Садилов И.С., Чайкун К.В., Шаталова Т.Б., Филиппов Я.Ю. Синтез монетита из гидроксиапатиата кальция и монокальцийфосфата моногидрата в условиях механической активации // Журн. неорган. химии. 2019. Т. 64. № 9. С. 916–922. https://doi.org/10.1134/S0044457X19090174
Jinawath S., Pongkao D., Suchanek W., Yoshimura M. Hydrothermal Synthesis of Monetite and Hydroxyapatite from Monocalcium Phosphate Monohydrate // Int. J. Inorg. Mater. 2001. V. 3. № 7. P. 997–1001. https://doi.org/10.1016/S1466-6049(01)00199-4
Filippov Y.Y., Orlov E.D., Klimashina E.S., Evdokimov P.V., Safronova T.V., Putlayev V.I., Rau J.V. Colloidal Forming of Macroporous Calcium Pyrophosphate Bioceramics in 3D-printed Molds // Bioact. Mater. 2020. V. 5. № 2. P. 309–317. https://doi.org/10.1016/j.bioactmat.2020.02.013
Grover L.M., Gbureck U., Young A.M., Wright A.J., Barralet J.E. Temperature Dependent Setting Kinetics and Mechanical Properties of β-TCP–Pyrophosphoric Acid Bone Cement // J. Mater. Chem. 2005. V. 15. № 46. P. 4955–4962. https://doi.org/10.1039/B507056M
Grover L.M., Gbureck U., Wright A.J., Barralet J.E. Cement Formulations in the Calcium Phosphate H2O–H3PO4–H4P2O7 System // J. Am. Ceram. Soc. 2005. V. 88. № 11. P. 3096–3103. https://doi.org/10.1111/j.1551-2916.2005.00558.x
Жданов Ю.Ф. Химия и технология полифосфатов. М.: Химия, 1979. 240 с.
Сафронова Т.В., Киселев А.С., Шаталова Т.Б., Филиппов Я.Ю., Гавлина О.Т. Синтез моногидрата двойного пирофосфата кальция/аммония Ca(NH4)2P2O7 ⋅ H2O – предшественника биосовместимых фаз кальцийфосфатной керамики // Изв. АН. Сер. хим. 2020. № 1. С. 139–147. https://elibrary.ru/item.asp?id=42303370&
Сафронова Т.В., Путляев В.И., Курбатова С.А., Шаталова Т.Б., Ларионов Д.С., Козлов Д.А., Евдокимов П.В. Свойства порошка аморфного пирофосфата кальция, синтезированного с использованием ионного обмена, для получения биокерамики // Неорган. материалы. 2015. Т. 51. № 11. С. 1269–1269. https://doi.org/10.7868/S0002337X15110093
Safronova T.V., Mukhin E.A., Putlyaev V.I., Knotko A.V., Evdokimov P.V., Shatalova T.B., Filippov Y.Y., Sidorov A.V., Karpushkin E.A. Amorphous Calcium Phosphate Powder Synthesized from Calcium Acetate and Polyphosphoric Acid for Bioceramics Application // Ceram. Int. 2017. V. 43. № 1. P. 1310–1317. https://doi.org/10.1016/j.ceramint.2016.10.085
Gras P., Rey C., André G., Charvillat C., Sarda S., Combes C. Crystal Structure of Monoclinic Calcium Pyrophosphate Dihydrate (m-CPPD) Involved in Inflammatory Reactions and Osteoarthritis // Acta Crystallogr., Sect. B. 2016. V. 72. № 1. P. 96–101. https://doi.org/10.1107/S2052520615021563
Gras P., Rey C., Marsan O., Sarda S., Combes C. Synthesis and Characterisation of Hydrated Calcium Pyrophosphate Phases of Biological Interest // Eur. J. Inorg. Chem. 2013. V. 2013. № 34. P. 5886–5895. https://doi.org/10.1002/ejic.201300955
Сафронова Т.В., Курбатова С.А., Шаталова Т.Б., Кнотько А.В., Евдокимов П.В., Путляев В.И. Порошок пирофосфата кальция, синтезированный из пирофосфорной кислоты и ацетата кальция, для получения биокерамики // Материаловедение. 2016. № 7. С. 41–48. https://elibrary.ru/item.asp?id=26388506
Soulié J., Gras P., Marsan O., Laurencin D., Rey C., Combes C. Development of a New Family of Monolithic Calcium (Pyro) Phosphate Glasses by Soft Chemistry // Acta Biomater. 2016. V. 41. P. 320–327. https://doi.org/10.1016/j.actbio.2016.05.030
Ley-Ngardigal K., Combes C., Teychené S., Bonhomme C., Coelho-Diogo C., Gras P., Rey C., Biscans B. Influence of Ionic Additives on Triclinic Calcium Pyrophosphate Dihydrate Precipitation // Cryst. Growth Des. 2017. V. 17. № 1. P. 37–50. https://doi.org/10.1021/acs.cgd.6b01128
Mayen L., Jensen N.D., Laurencin D., Marsan O., Bonhomme C., Gervais C., Gan Z. A Soft-Chemistry Approach to the Synthesis of Amorphous Calcium Ortho/pyrophosphate Biomaterials of Tunable Composition // Acta Biomater. 2020. V. 103. P. 333–345. https://doi.org/10.1016/j.actbio.2019.12.027
Fernandez E., Planell J.A., Best S.M. Precipitation of Carbonated Apatite in the Cement System α-Ca3(PO4)2–Ca(H2PO4)2–CaCO3 // J. Biomed. Mater. Res. 1999. V. 47. № 4. P. 466–471. https://doi.org/10.1002/(SICI)1097-4636(19991215)47:4<466::AID-JBM2>3.0.CO;2-R
Сафронова Т.В., Шехирев М.А., Путляев В.И., Третьяков Ю.Д. Керамические материалы на основе гидроксиапатита, полученные из растворов различной концентрации // Неорган. материалы. 2007. Т. 43. № 8. С. 1005–1014. https://elibrary.ru/item.asp?id=9550695
Сафронова Т.В., Ширяев М.А., Путляев В.И., Мурашов В.А., Проценко П.В. Керамика на основе гидроксиапатита, синтезированного из хлорида кальция и гидрофосфата калия // Стекло и керамика. 2009. № 2. С. 23–26. https://elibrary.ru/item.asp?id=18196715
Safronova T., Kuznetsov A., Korneychuk S., Putlyaev V., Shekhirev M. Calcium Phosphate Powders Synthesized from Solutions with [Ca2+]/$\left[ {{\text{PO}}_{4}^{{3 - }}} \right]$ = 1 for Bioresorbable Ceramics // Centr. Eur. J. Chem. 2009. V. 7. № 2. P. 184–191. https://doi.org/10.2478/s11532-009-0016-0
Сафронова Т.В., Путляев В.И., Филиппов Я.Ю., Владимирова С.А., Зуев Д.М., Черкасова Г.С. Синтез кальцийфосфатного порошка из формиата кальция и гидрофосфата аммония для получения биосовместимых резорбируемых бифазных керамических материалов // Стекло и керамика. 2017. № 5. С. 43–48. https://elibrary.ru/item.asp?id=29217205
Сафронова Т.В., Путляев В.И., Андреев М.Д., Филиппов Я.Ю., Кнотько А.В., Шаталова Т.Б., Евдокимов П.В. Синтез порошка фосфата кальция из лактата кальция и гидрофосфата аммония для получения биокерамики // Неорган. материалы. 2017. Т. 53. № 8. С. 874–884. https://doi.org/10.7868/S0002337X17080139
Сафронова Т.В., Путляев В.И., Кнотько А.В., Шаталова Т.Б., Савинова В.Ю. Синтез наноразмерного гидроксиапатита кальция из малата кальция и гидрофосфата аммония // Материаловедение. 2018. № 10. С. 45–48. https://doi.org/10.31044/1684-579X-2018-0-10-45-48
Сафронова Т.В., Шаталова Т.Б., Филиппов Я.Ю., Крутько В.К., Мусская О.Н., Сафронов А.С., Тошев О.У. Керамика в системе Са2Р2О7–Са(РО3)2, полученная обжигом образцов из твердеющих смесей на основе цитрата кальция и монокальцийфосфата моногидрата // Материаловедение. 2019. № 9. С. 31–40. https://doi.org/10.31044/1684-579X-2019-0-9-31-40
Сафронова Т.В., Лукина Ю.С., Сивков С.П., Тошев О.У., Казакова Г.К., Шаталова Т.Б., Филиппов Я.Ю., Малютин К.В., Азизян-Каландараг Я. Керамика на основе пирофосфата кальция, полученная обжигом цементного камня // Техника и технология силикатов. 2020. Т. 27. № 1. С. 17–20.
Сафронова Т.В., Казакова Г.К., Евдокимов П.В., Шаталова Т.Б., Кнотько А.В., Короткова А.В., Путляев В.И. Керамика на основе порошка фосфата кальция, синтезированного из сахарата кальция и гидрофосфата аммония // Материаловедение. 2016. № 3. С. 43–48. https://www.elibrary.ru/item.asp?id=25650804
Сафронова Т.В., Путляев В.И., Сергеева А.И., Куненков Э.В., Третьяков Ю.Д. Синтез нанокристаллического гидроксиапатита кальция из сахаратов кальция и гидрофосфата аммония // Докл. АН. 2009. Т. 426. № 4. С. 491–496. https://elibrary.ru/item.asp?id=12137011
Сафронова Т.В. Фазовый состав керамики на основе порошков гидроксиапатита кальция, содержащих сопутствующие продукты реакции синтеза // Стекло и керамика. 2009. № 4. С. 21–24. https://elibrary.ru/item.asp?id=18277090
Safronova T., Putlayev V., Filippov Y., Shatalova T., Karpushkin E., Larionov D., Kazakova G., Shakhta-rin Y. Calcium Phosphate Powder Synthesized from Calcium Acetate and Ammonium Hydrophosphate for Bioceramics Application // Ceramics. 2018. V. 1. № 2. P. 375–392. https://doi.org/10.3390/ceramics1020030
Сафронова Т.В., Путляев В.И., Казакова Г.К., Корнейчук С.А. Двухфазная керамика в системе СаО–Р2О5 на основе порошка, синтезированного из ацетата кальция и гидрофосфата аммония // Стекло и керамика. 2013. № 2. С. 32–38. https://www.elibrary.ru/item.asp?id=18835300
Сафронова Т.В., Путляев В.И., Кузнецов А.В., Кетов Н.А., Вересов А.Г. Свойства порошка фосфата кальция, синтезированного из ацетата кальция и гидрофосфата натрия // Стекло и керамика. 2011. № 4. С. 30–34. https://elibrary.ru/item.asp?id=16218333
Сафронова Т.В., Корнейчук С.А., Путляев В.И., Бойцова О.В. Керамика на основе гидроксиапатита кальция, синтезированного из ацетата кальция и гидрофосфата калия // Стекло и керамика. 2008. № 4. С. 19–24. https://elibrary.ru/item.asp?id=10335095
Vorndran E., Klarner M., Klammert U., Grover L.M., Patel S., Barralet J.E., Gbureck U. 3D Powder Printing of β-Tricalcium Phosphate Ceramics Using Different Strategies // Adv. Eng. Mater. 2008. V. 10. № 12. P. B67–B71. https://doi.org/10.1002/adem.200800179
Balamurugan A., Mabrouk K.E., Pina S., Bousmina M.M., Ferreira J.M.F. Melt-Derived Condensed Polymorphic Calcium Phosphate as Bone Substitute Material: An In Vitro Study // J. Am. Ceram. Soc. 2011. V. 94. № 9. P. 3023–3029. https://doi.org/10.1111/j.1551-2916.2011.04487.x
Nariai H., Motooka I., Kanaji Y., Tsuhako M. Thermal Behavior of Alkaline-Earth Metal Cyclo-tetraphosphates // Bull. Chem. Soc. Jpn. 1991. V. 64. № 10. P. 2912–2917. https://doi.org/10.1246/bcsj.64.2912
Schneider M., Jost K.H., Fichtner H. Crystal Structure of the Cyclotetraphosphate Ca2[P4O12] ⋅ 4H2O // Z. Anorg. Allg. Chem. 1983. V. 500. № 5. P. 117–122. https://doi.org/10.1002/zaac.19835000515
Schneider M., Jost K.H. Chemische, Thermoanalytische und Röntgenorgraphische Untersuchungen zur Bildung des β-Ca2[P2O7] aus dem Ca2[P4O12] ⋅ 4H2O // Z. Anorg. Allg. Chem. 1989. V. 576. № 1. P. 267–271. https://doi.org/10.1002/zaac.19895760130
Кукуева Е.В., Путляев В.И., Тихонов А.А., Сафронова Т.В. Октакальциевый фосфат как прекурсор для синтеза композитной биокерамики // Неорган. материалы. 2017. Т. 53. № 2. С. 198–205. https://doi.org/10.7868/S0002337X17020063
Brown E.H., Lehr J.R., Smith J.P., Frazier A.W. Fertilizer Materials, Preparation and Characterization of Some Calcium Pyrophosphates // J. Agr. Food Chem. 1963. V. 11. № 3. P. 214–222. https://doi.org/10.1021/jf60127a020
Гудимов Н.В., Беляков А.В. Фазы в керамике из нанопорошков фосфатов кальция с соотношением Сa/Р = 1.25, полученных методом механоактивации // Стекло и керамика. 2017. № 12. С. 42–46. https://elibrary.ru/item.asp?id=32330516
Bohner M., Santoni B.L.G., Döbelin N. β-Tricalcium Phosphate for Bone Substitution: Synthesis and Properties // Acta Biomater. 2020. V. 113. P. 23–41. https://doi.org/10.1016/j.actbio.2020.06.022
Hsu C.K. The Preparation of Biphasic Porous Calcium Phosphate by the Mixture of Ca(H2PO4)2 · H2O and CaCO3 // Mater. Chem. Phys. 2003. V. 80. № 2. P. 409–420. https://doi.org/10.1016/S0254-0584(02)00166-9
Li Y.Y., Yang D.A., Zhao H. Degradation Behavior of β-Ca3(PO4)2/β-Ca2P2O7 Bioceramics // Key Eng. Mater. 2007. V. 336. P. 1650–1653. https://doi.org/10.4028/www.scientific.net/KEM.336-338.1650
Сафина Н.М., Сафронова Т.В., Лукин Е.С. Керамика на основе фосфатов кальция с пониженной температурой спекания, содержащая резорбируемую фазу // Стекло и керамика. 2007. № 7. С. 19–24. https://www.elibrary.ru/item.asp?id=9556583
Grossin D., Rollin-Martinet S., Estournès C., Rossignol F., Champion E., Combes C., Rey C., Geoffroy C., Drouet C. Biomimetic Apatite Sintered at very Low Temperature by Spark Plasma Sintering: Physico-Chemistry and Microstructure Aspects // Acta Biomater. 2010. V. 6. № 2. P. 577–585. https://doi.org/10.1016/j.actbio.2009.08.021
Chanda A., Dasgupta S., Bose S., Bandyopadhyay A. Microwave Sintering of Calcium Phosphate Ceramics // Mater. Sci. Eng., C. 2009. V. 29. № 4. P. 1144–1149. https://doi.org/10.1016/j.msec.2008.09.008
Barralet J.E., Fleming G.J.P., Campion C., Harris J.J., Wright A.J. Formation of Translucent Hydroxyapatite Ceramics by Sintering in Carbon Dioxide Atmospheres // J. Mater. Sci. 2003. V. 38. № 19. P. 3979–3993. https://doi.org/10.1023/A:1026258515285
Champion E. Sintering of Calcium Phosphate Bioceramics // Acta Biomater. 2013. V. 9. № 4. P. 5855–5875. https://doi.org/10.1016/j.actbio.2012.11.029
Фильченко М.В., Солоненко А.П., Леонова Н.Н., Буяльская К.С., Савельева Г.Г., Голованова О.А. Изучение системы Ca(NO3)2–(NH4)2HPO4–NH4ОН–Н2О и кристаллизующейся минеральной фазы // Минералы: строение, свойства, методы исследования. 2011. № 3. С. 302–305. https://elibrary.ru/item.asp?id=32326568
Hildenbrand D.L., Giauque W.F. Ammonium Oxide and Ammonium Hydroxide. Heat Capacities and Thermodynamic Properties from 15 to 300 K // J. Am. Chem. Soc. 1953. V. 75. № 12. P. 2811–2818. https://pubs.acs.org/doi/pdf/10.1021/ja01108a007
Siemons W.J., Templeton D.H. The Crystal Structure of Ammonium Oxide // Acta Crystallogr. 1954. V. 7. № 2. P. 194–198. https://doi.org/10.1107/S0365110X54000539
Brown E.H., Lehr J.R., Frazier A.W., Smith J.P. Fertilizer Materials, Calcium Ammonium and Calcium Potassium Pyrophosphate Systems // J. Agr. Food Chem. 1964. V. 12. № 1. P. 70–73. https://doi.org/10.1021/jf60131a021
Hossner L.R., Melton J.R. Pyrophosphate Hydrolysis of Ammonium, Calcium, and Calcium Ammonium Pyrophosphates in Selected Texas Soils // Soil Sci. Soc. Am. J. 1970. V. 34. № 5. P. 801–805. https://doi.org/10.2136/sssaj1970.03615995003400050036x
Mathew M., Schroeder L.W. The Crystal Structure of Calcium Ammonium Hydrogenpyrophosphate CaNH4HP2O7 // Acta Crystallogr., Sect. B. 1977. V. 33. № 10. P. 3025–3028. https://doi.org/10.1107/S056774087701019X
Балта Д.Ф. Оптимальные условия тушения склонных к тлению твердых материалов // Научн. вестн. НИИГД Респиратор. 2019. № 4. С. 54–64. https://www.elibrary.ru/item.asp?id=41413325
Balonis M., Ma X., Kakoulli I. Phase Relations in the Calcium Carbonate/Ammonium Phosphate System under Aqueous Conditions and 25°C // J. Am. Ceram. Soc. 2020. V. 103. № 6. P. 3837–3850. https://doi.org/10.1111/jace.17047
Wazer J.R.V., Holst K.A. Structure and Properties of the Condensed Phosphates. I. Some General Considerations about Phosphoric Acids1 // J. Am. Chem. Soc. 1950. V. 72. № 2. P. 639–644. https://doi.org/10.1021/ja01158a001
Watters J.I., Loughran E.D., Lambert S.M. The Acidity of Triphosphoric Acid1 // J. Am. Chem. Soc. 1956. V. 78. № 19. P. 4855–4858. https://doi.org/10.1021/ja01600a011
Watters J.I., Sturrock P.E., Simonaitis R.E. The Acidity of Tetraphosphoric Acid // Inorg. Chem. 1963. V. 2. № 4. P. 765–767. https://doi.org/10.1021/ic50008a024
Сафронова Т.В., Путляев В.И., Иванов В.К., Кнотько А.В., Шаталова Т.Б. Порошковые смеси на основе гидрофосфата аммония и карбоната кальция для получения биосовместимой пористой керамики в системе СаО–Р2О5 // Новые огнеупоры. 2016. Т. 1. № 9. С. 45–53. https://doi.org/10.17073/1683-4518-2015-9-45-53
Jalota S., Bhaduri S.B., Tas A.C. A New Rhenanite (β‑NaCaPO4) and Hydroxyapatite Biphasic Biomaterial for Skeletal Repair // J. Biomed. Mater. Res., Part B. 2007. V. 80. № 2. P. 304–316. https://doi.org/10.1002/jbm.b.30598
Suchanek W., Yashima M., Kakihana M., Yoshimura M. β-Rhenanite (β-NaCaPO4) as Weak Interphase for Hydroxyapatite Ceramics // J. Eur. Ceram. Soc. 1998. V. 18. № 13. P. 1923–1929. https://doi.org/10.1016/S0955-2219(98)00131-9
Ando J. Phase Diagrams of Ca3(PO4)2–Mg3(PO4)2 and Ca3(PO4)2–CaNaPO4 Systems // Bull. Chem. Soc. Jpn. 1958. V. 31. № 2. P. 201–205. https://doi.org/10.1246/bcsj.31.201
Сафронова Т.В., Путляев В.И., Филиппов Я.Ю., Шаталова Т.Б., Набережный Д.О., Насриддинов А.Ф., Ларионов Д.С. Керамика на основе порошковых смесей, содержащих гидрофосфаты кальция и соли натрия (Na2CO3, Na4P2O7, NaPO3) // Неорган. материалы. 2018. Т. 54. № 7. С. 766–777. https://doi.org/10.7868/S0002337X18070187
Millet J.M., Sassoulas R., Sebaoun A. Transitions Solide ⇌ Solide Dans le Systeme CaO–Na2O–P2O5; Sous-Systeme Ca3(PO4)2–CaNaPO4 // J. Therm. Anal. 1983. V. 28. № 1. P. 131–146. https://doi.org/10.1007/bf02105285
Berak J., Znamierowska T. Phase Equilibria in the System CaO-Na2O-P2O5. Part II. The Partial System Ca(PO3)2–Na2O–P2O5 // Rocz. Chem. 1972. V. 46. № 10. P. 1697–1708.
Znamierowska T. Phase Equilibriums in the System Calcium Oxide-Potassium Oxide-Phosphorus (V) Oxide. Part II. Partial System Calcium Phosphate-Calcium Potassium Pyrophosphate-Potassium Metaphosphate-Calcium Pyrophosphate // Pol. J. Chem. 1978. V. 52. № 6. P. 1127–1134.
Knowles J.C. Phosphate Based Glasses for Biomedical Applications // J. Mater. Chem. 2003. V. 13. № 10. P. 2395–2401. https://doi.org/10.1039/B307119G
Строганова Е.Е., Михайленко Н.Ю., Мороз О.А. Биоматериалы на основе стекла: настоящее и будущее // Стекло и керамика. 2003. № 10. С. 12–16. https://elibrary.ru/item.asp?id=14969209
Morey G.W. The System H2O–NaPO3 //J. Am. Chem. Soc. 1953. V. 75. № 23. C. 5794–5797. https://doi.org/10.1021/ja01119a008
Wendrow B., Kobe K.A. The Alkali Orthophosphates. Phase Equilibria in Aqueous Solution // Chem. Rev. 1954. V. 54. № 6. P. 891–924. https://doi.org/10.1021/cr60172a001
Сумич А.И., Ещенко Г.С. Состав фосфатов, образующихся при взаимодействии жидкого стекла с растворами ортофосфорной кислоты // Тр. БГТУ. Минск: БГТУ, 2013. № 3(159). С. 90–93. https://elib.belstu.by/handle/123456789/3021
Никандров М.И., Никандров И.С., Краснов Ю.В. Исследование кристаллизации одно-, двух-и трехзамещенных фосфатов натрия // Тр. НГТУ им. Р.Е. Алексеева. 2010. № 3. С. 249–254. https://cyberleninka.ru/article/n/issledovanie-kristallizatsii-odno-dvuh-i-trehzameschennyh-fosfatov-natriya
Arifuzzaman S.M., Rohani S. Experimental Study of Brushite Precipitation // J. Cryst. Growth. 2004. V. 267. № 3–4. P. 624–634. https://doi.org/10.1016/j.jcrysgro.2004.04.024
Jokić B., Mitrić M., Radmilović V., Drmanić S., Petrović R., Janaćković D. Synthesis and Characterization of Monetite and Hydroxyapatite Whiskers Obtained by a Hydrothermal Method // Ceram. Int. 2011. V. 37. № 1. P. 167–173. https://doi.org/10.1016/j.ceramint.2010.08.032
Сафронова Т.В., Решотка Д.С., Путляев В.И., Лукин Е.С., Иванов В.К. Фазовый состав порошкового материала на основе гидроксиапатита кальция и дигидрофосфата натрия // Стекло и керамика. 2009. № 8. С. 26–28. https://www.elibrary.ru/item.asp?id=13034753
Сафронова Т.В., Путляев В.И., Кнотько А.В., Филиппов Я.Ю., Климашина Е.С., Рыжов А.П., Саиджонов Б.М. Порошковые смеси на основе гидроксиапатита кальция и солей натрия // Материаловедение. 2018. № 1. С. 43–48. https://www.elibrary.ru/item.asp?id=32322363
Сафронова Т.В., Путляев В.И., Филиппов Я.Ю., Ларионов Д.С., Евдокимов П.В., Аверина А.Е., Климашина Е.С. Иванов В.К. Пористая керамика на основе пирофосфата кальция // Новые огнеупоры. 2016. № 1. С. 46–51. https://doi.org/10.17073/1683-4518-2015-1-46-51
Song Y., Feng Z., Wang T. In Situ Study on the Curing Process of Calcium Phosphate Bone Cement // J. Mater. Sci.: Mater. Med. 2007. V. 18. № 6. P. 1185–1193. https://doi.org/10.1007/s10856-007-0138-x
Cahyanto A., Maruta M., Tsuru K., Matsuya S., Ishikawa K. Fabrication of Bone Cement that Fully Transforms to Carbonate Apatite // Dent. Mater. J. 2015. P. 2014–328. https://doi.org/10.4012/dmj.2014-328
Doi Y., Shimizu Y., Moriwaki Y., Aga M., Iwanaga H., Shibutani T., Iwayama Y. Development of a New Calcium Phosphate Cement that Contains Sodium Calcium Phosphate // Biomaterials. 2001. V. 22. № 8. P. 847–854. https://doi.org/10.1016/S0142-9612(00)00248-9
Mayen L., Jensen N.D., Desbord M., Laurencin D., Gervais C., Bonhomme C., Smith M.E., Porcher F., Elkaim E., Charvillat C., Gras P., Rey C., Soulié J., Combes C. Advances in the Synthesis and Structure of α-Canaphite: a Multitool and Multiscale Study // CrystEngComm. 2020. V. 22. № 18. P. 3130–3143. https://doi.org/10.1039/D0CE00132E
Сафронова Т.В., Сечейко П.А., Путляев В.И. Многофазная керамика на основе порошков, синтезированных из пирофосфата натрия и растворимых солей кальция с использованием механической активации // Стекло и керамика. 2012. № 8. С. 34–41. https://elibrary.ru/item.asp?id=17961832&
Driessens F.C.M., Ramselaar M.M.A., Schaeken H.G., Stols A.L.H., Van Mullem P.J., De Wijn J.R. Chemical Reactions of Calcium Phosphate Implants after Implantation in Vivo // J. Mater. Sci.: Mater. Med. 1992. V. 3. № 6. P. 413–417. https://doi.org/10.1007/BF00701237
Kannan S., Ventura J.M., Lemos A.F., Barba A., Ferreira J.M.F. Effect of Sodium Addition on the Preparation of Hydroxyapatites and Biphasic Ceramics // Ceram. Int. 2008. V. 34. № 1. P. 7–13. https://doi.org/10.1016/j.ceramint.2006.07.007
Schaeken H.G., Driessens F.C.M., Verbeeck R.M.H. Solid Solutions between β-Ca3(PO4)2 and Sodium-containing Whitlockite // Z. Anorg. Allg. Chem. 1983. V. 505. № 10. P. 48–52. https://doi.org/10.1002/zaac.19835051006
Ando J., Matsuno S. Ca3(PO4)2–CaNaPO4 System // Bull. Chem. Soc. Jpn. 1968. V. 41. № 2. P. 342–347. https://doi.org/10.1246/bcsj.41.342
Celotti G., Landi E. A Misunderstood Member of the Nagelschmidtite Family Unveiled: Structure of Ca5Na2(PO4)4 from X-ray Powder Diffraction Data // J. Eur. Ceram. Soc. 2003. V. 23. № 6. P. 851–858. https://doi.org/10.1016/S0955-2219(02)00211-X
Евдокимов П.В., Путляев В.И., Иванов В.К., Гаршев А.В., Шаталова Т.Б., Орлов Н.К., Климашина Е.С. Сафронова Т.В. Фазовые равновесия в системах трикальциевый фосфат–смешанный фосфат кальция и натрия (калия) // Журн. неорг. химии. 2014. Т. 59. № 11. С. 1462–1462. https://elibrary.ru/item.asp?id=22020388
Филиппов Я.Ю., Власихина А.А., Климашина Е.С., Евдокимов П.В., Путляев В.И. Создание трехмерных керамических структур заданной архитектуры на основе системы Ca2P2O7–CaNa2P2O7 // Стекло и керамика. 2018. № 11. С. 35–39. https://www.elibrary.ru/item.asp?id=36534780
Lin F.N., Lin C.C., Lu C.M., Lui H.C., Sun J.S. Mechanical Properties Histological Evaluation of Sintered beta-Ca2P2O7 with Na4P2O7 ⋅ 10H2O Addition // Biomaterials. 1995. V. 16. № 10. P. 793–802. https://doi.org/10.1016/0142-9612(95)99642-Y
Abrahams I., Hawkes G.E., Knowles J. Phosphorus Speciation in Sodium–Calcium–Phosphate Ceramics // J. Chem. Soc., Dalton Trans. 1997. № 9. P. 1483–1484. https://doi.org/10.1039/A701029J
Scheicher H., Wendler E. Bone Replacement Material on the Basis of Carbonate and Alkali Containing Calciumphosphate Apatites: US Patent 4917702, 1990. https://patents.google.com/patent/US4917702A/en
Suchanek W., Yashima M., Kakihana M., Yoshimura M. Hydroxyapatite Ceramics with Selected Sintering Additives // Biomaterials. 1997. V. 18. № 13. P. 923–933. https://doi.org/10.1016/S0142-9612(97)00019-7
Halouani R., Bernache-Assolant D., Champion E., Ababou A. Microstructure and Related Mechanical Properties of Hot Pressed Hydroxyapatite Ceramics // J. Mater. Sci.: Mater. Med. 1994. V. 5. № 8. P. 563–568. https://doi.org/10.1007/BF00124890
Bakunova N.V., Komlev V.S., Fedotov A.Y., Fadeeva I.V., Smirnov V.V., Shvorneva L.I., Gurin A.N., Barinov S.M. A Method of Fabrication of Porous Carbonated Hydroxyapatite Scaffolds for Bone Tissue Engineering // Powder Metall. Prog. 2008. V. 8. № 4. P. 336–342. http://www.imr.saske.sk/pmp/issue/4-2008/PMP_ Vol08_No4_p336-342.pdf
Lakhkar N.J., Lee I.-H., Kim H.-W., Salih V., Wall I.B., Knowles J.C. Bone Formation Controlled by Biologically Relevant Inorganic Ions: Role and Controlled Delivery from Phosphate-Based Glasses // Adv. Drug Delivery Rev. 2013. V. 65. № 4. P. 405–420. https://doi.org/10.1016/j.addr.2012.05.015
McBride E.D. Absorbable Metal in Bone Surgery: A Further Report on the Use of Magnesium Alloys // J. Am. Med. Assoc. 1938. V. 111. № 27. P. 2464–2467. https://doi.org/10.1001/jama.1938.02790530018007
Walker J., Shadanbaz S., Woodfield T.B., Staiger M.P., Dias G.J. Magnesium Biomaterials for Orthopedic Application: a Review from a Biological Perspective // J. Biomed. Mater. Res., Part B. 2014. V. 102. № 6. P. 1316–1331. https://doi.org/10.1002/jbm.b.33113
Tamimi F., Le Nihouannen, D., Bassett, D.C., Ibasco, S., Gbureck, U., Knowles J., Wright A., Flynn A., Komarova S.V., Barralet J.E. Biocompatibility of Magnesium Phosphate Minerals and Their Stability under Physiological Conditions // Acta Biomater. 2011. V. 7. № 6. P. 2678–2685. https://doi.org/10.1016/j.actbio.2011.02.007
Waselau M., Samii V.E., Weisbrode S.E., Litsky A.S., Bertone A.L. Effects of a Magnesium Adhesive Cement on Bone Stability and Healing Following a Metatarsal Osteotomy in Horses // Am. J. Vet. Res. 2007. V. 68. № 4. P. 370–378. https://doi.org/10.2460/ajvr.68.4.370
Moseke C., Saratsis V., Gbureck U. Injectability and Mechanical Properties of Magnesium Phosphate Cements // J. Mater. Sci.: Mater. Med. 2011. V. 22. № 12. P. 2591–2598. https://doi.org/10.1007/s10856-011-4442-0
Ostrowski N., Roy A., Kumta P.N. Magnesium Phosphate Cement Systems for Hard Tissue Applications: a Review // ACS Biomater. Sci. Eng. 2016. V. 2. № 7. P. 1067–1083. https://doi.org/10.1021/acsbiomaterials.6b00056
Гольдберг М.А., Смирнов В.В., Антонова О.С., Тютькова Ю.Б., Оболкина Т.О., Хайрутдинова Д.Р., Крохичева П.А., Баринов С.М. Комлев В.С. Керамические материалы в системе трехкальциевый фосфат–трехмагниевый фосфат // Неорган. материалы. 2020. Т. 56. № 3. С. 329–335. https://doi.org/10.31857/S0002337X20030033
Kazakova G., Safronova T., Putlayev V., Secheyko P. Synthetic Struvite and Newberyite Powders for Resorbable Ceramic Materials // Advanced Metals, Ceramics and Composites: XII China-Russia Symp. on Advanced Materials and Technologies (CRSAMT2013). Kunming: Yunnan Science and Technology, 2013. V. 1. P. 209–211.
Казакова Г.К., Сафронова Т.В., Путляев В.И., Шаталова Т.Б., Кнотько А.В. Синтез и свойства порошков для получения биорезорбируемой керамики, содержащей фазы ортофосфатов кальция и магния // Третья Всерос. науч. конф. “Успехи синтеза и комплексообразования”. 2014. С. 100. https://www.elibrary.ru/item.asp?id=24638131
Abbona F., Lundager Madsen H.E.L., Boistelle R. The Final Phases of Calcium and Magnesium Phosphates Precipitated from Solutions of High to Medium Concentration // J. Cryst. Growth. 1988. V. 89. № 4. P. 592–602. https://doi.org/10.1016/0022-0248(88)90223-0
McCarthy W.J., Smith, D.M.A., Adamowicz L., Saint-Martin H., Ortega-Blake I. An Ab Initio Study of the Isomerization of Mg- and Ca-Pyrophosphates // J. Am. Chem. Soc. 1998. V. 120. № 24. P. 6113–6120. https://doi.org/10.1021/ja972715g
Generosi A., Smirnov V.V., Rau J.V., Rossi Albertini V., Ferro D., Barinov S.M. Phase Development in the Hardening Process of Two Calcium Phosphate Bone Cements: an Energy Dispersive X-ray Diffraction Study // Mater. Res. Bull. 2008. V. 43. № 3. P. 561–571. https://doi.org/10.1016/j.materresbull.2007.04.016
Bensalem A., Ahluwalia M., Vijayaraghavan T.V., Ko Y.H. Synthesis of Amorphous MgHPO4 · x(R) [R = Ethanol; Ethylene Glycol] in Anhydrous Media // Mater. Res. Bull.1997. V. 32. № 11. P. 1473–1483. https://doi.org/10.1016/S0025-5408(97)00129-3
Boskey A.L., Posner A.S. Magnesium Stabilization of Amorphous Calcium Phosphate: a Kinetic Study // Mater. Res. Bull. 1974. V. 9. № 7. P. 907–916. https://doi.org/10.1016/0025-5408(74)90169-X
Podhajska-Kazmierczak T. Phase Equilibria in Ternary System MgO–Na2O–P2O5. The Partial System MgO–Mg3(PO4)2–Mg4Na(PO4)3–Na4P2O7 // Thermochim. Acta. 2002. V. 385. № 1–2. P. 163–169. https://doi.org/10.1016/S0040-6031(01)00715-8
Arstila H., Vedel E., Hupa L., Hupa M. Factors Affecting Crystallization of Bioactive Glasses // J. Eur. Ceram. Soc. 2007. V. 27. № 2–3. P. 1543–1546. https://doi.org/10.1016/j.jeurceramsoc.2006.04.017
Barradas A.M., Yuan H., van Blitterswijk C.A., Habibovic P. Osteoinductive Biomaterials: Current Knowledge of Properties, Experimental Models and Biological Mechanisms // Eur. Cell. Mater. 2011. V. 21. № 407. P. 29. https://doi.org/10.22203/eCM.v021a31
Hannink G., Arts J.J.C. Bioresorbability, Porosity and Mechanical Strength of Bone Substitutes: What is Optimal for Bone Regeneration? // Injury. 2011. V. 42. P. S22–S25. https://doi.org/10.1016/j.injury.2011.06.008
Woodard J.R., Hilldore A.J., Lan S.K., Park C.J., Morgan A.W., Eurell J.A., Clark S.G., Wheeler M.B., Jamison R.D., Wagoner Johnson A.J. The Mechanical Properties and Osteoconductivity of Hydroxyapatite Bone Scaffolds with Multi-Scale Porosity // Biomaterials. 2007. V. 28. P. 45–54. https://doi.org/10.1016/j.biomaterials.2006.08.021
Doernberg M.C., Rechenberg B., Bohner M. In Vivo Behavior of Calcium Phosphate Scaffolds with Four Different Pore Sizes // Biomaterials. 2006. V. 27. P. 5186–5198. https://doi.org/10.1016/j.biomaterials.2006.05.051
Šupová M. Substituted Hydroxyapatites for Biomedical Applications: a Review // Ceram. Int. 2015. V. 41. № 8. P. 9203–9231. https://doi.org/10.1016/j.ceramint.2015.03.316
Albrektsson T., Johansson C. Osteoinduction, Osteoconduction and Osseointegration // Eur. Spine J. 2001. V. 10. № 2. P. S96–S101. https://doi.org/10.1007/s005860100282
Баринов С.М., Комлев В.С. Подходы к созданию пористых материалов на основе фосфатов кальция, предназначенных для регенерации костной ткани // Неорган. материалы. 2016. Т. 52. № 4. С. 383–391. https://doi.org/10.7868/S0002337X16040023
Тихонов А.А., Евдокимов П.В., Путляев В.И., Сафронова Т.В., Филиппов Я.Ю. О выборе архитектуры остеокондуктивных биокерамических имплантатов // Материаловедение. 2018. № 8. С. 43–48. https://doi.org/10.31044/1684-579X-2018-0-8-43-48
Studart A.R., Gonzenbach U.T., Tervoort E., Gauckler L.J. Processing Routes to Macroporous Ceramics: A Review // J. Am. Ceram. Soc. 2006. V. 89. № 6. P. 1771–1789. https://doi.org/10.1111/j.1551-2916.2006.01044.x
Беляков А.В., Лукин Е.С., Сафронова Т.В., Сафина М.Н., Путляев В.И. Пористые материалы на основе фосфатов кальция // Стекло и керамика. 2008. № 10. С. 17–19. https://elibrary.ru/item.asp?id=11920795
Khallok H., Elouahli A., Ojala S., Keiski R.L., Kheribech A., Hatim Z. Preparation of Biphasic Hydroxyapatite/β-tricalcium Phosphate Foam Using the Replication Technique // Ceram. Int. 2020. V. 46. P. 22581–22591. https://doi.org/10.1016/j.ceramint.2020.06.019
Hayashi K., Kishida R., Tsuchiya A., Ishikawa K. Granular Honeycombs Composed of Carbonate Apatite, Hydroxyapatite, and β-Tricalcium Phosphate as Bone Graft Substitutes: Effects of Composition on Bone Formation and Maturation // ACS Appl. Bio Mater. 2020. V. 3. № 3. P. 1787–1795. https://doi.org/10.1021/acsabm.0c00060
Hayashi K., Kishida R., Tsuchiya A., Ishikawa K. Carbonate Apatite Micro-Honeycombed Blocks Generate Bone Marrow-Like Tissues as well as Bone // Adv. Biosyst. 2019. V. 3. № 12. P. 1900140. https://doi.org/10.1002/adbi.201900140
Hollister S.J. Porous Scaffold Design for Tissue Engineering // Nat. Mater. 2005. V. 4. № 7. P. 518–524. https://doi.org/10.1038/nmat1421
Zadpoor A.A. Bone Tissue Regeneration: the Role of Scaffold Geometry // Biomater. Sci. 2015. V. 3. № 2. P. 231–245. https://doi.org/10.1039/C4BM00291A
Shirazi S.F.S., Gharehkhani S., Mehrali M., Yarmand H., Metselaar H.S.C., Kadri N.A., Osman N.A.A. A Review on Powder-based Additive Manufacturing for Tissue Engineering: Selective Laser Sintering and Inkjet 3D Printing // Sci. Technol. Adv. Mater. 2015. V. 16. № 3. 033502(20pp). https://doi.org/10.1088/1468-6996/16/3/033502
Li X., Yuan Y., Liu L., Leung Y.S., Chen Y., Guo Y., Chai Y., Chen Y. 3D Printing of Hydroxyapatite/Tricalcium Phosphate Scaffold with Hierarchical Porous Structure for Bone Regeneration // Bio-Des. Manuf. 2020. V. 3. № 1. P. 15–29. https://doi.org/10.1007/s42242-019-00056-5
Jariwala S.H., Lewis G.S., Bushman Z.J., Adair J.H., Donahue H.J. 3D Printing of Personalized Artificial Bone Scaffolds // 3D Print. Addit. Manuf. 2015. V. 2. № 2. P. 56–64. https://doi.org/10.1089/3dp.2015.0001
Wu C., Fan W., Zhou Y., Luo Y., Gelinsky M., Chang J., Xiao Y. 3D-Printing of Highly Uniform CaSiO3 Ceramic Scaffolds: Preparation, Characterization and in Vivo Osteogenesis // J. Mater. Chem. 2012. V. 22. № 24. P. 12288–12295. https://doi.org/10.1039/C2JM30566F
Zhou J., Gao C., Feng P., Xiao T., Shuai C., Peng S. Calcium Sulfate Bone Scaffolds with Controllable Porous Structure by Selective Laser Sintering // J. Porous Mater. 2015. V. 22. № 5. P. 1171–1178. https://doi.org/10.1007/s10934-015-9993-x
Zhou Z., Buchanan F., Mitchell C., Dunne N. Printability of Calcium Phosphate: Calcium Sulfate Powders for the Application of Tissue Engineered Bone Scaffolds Using the 3D Printing Technique // Mater. Sci. Eng., C. 2014. V. 38. P. 1–10. https://doi.org/10.1016/j.msec.2014.01.027
Suwanprateeb J., Suvannapruk W., Wasoontararat K. Low Temperature Preparation of Calcium Phosphate Structure via Phosphorization of 3D-Printed Calcium Sulfate Hemihydrate Based Material // J. Mater. Sci.: Mater. Med. 2010. V. 21. № 2. P. 419–429. https://doi.org/10.1007/s10856-009-3883-1
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


