Неорганические материалы, 2021, T. 57, № 6, стр. 649-657
Композиты LiFePO4 с углеродными наноматериалами для катодов литий-ионных аккумуляторов высокой мощности
И. А. Стенина 1, *, П. В. Минакова 1, 2, Т. Л. Кулова 3, А. В. Десятов 4, А. Б. Ярославцев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Школа на Юго-Востоке им. Маршала В.И. Чуйкова
111033 Москва, Таможенный проезд, 4, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31, корп. 4, Россия
4 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: irina_stenina@mail.ru
Поступила в редакцию 18.12.2020
После доработки 26.01.2021
Принята к публикации 27.01.2021
Аннотация
С помощью простого и технологичного подхода получены композиты на основе фосфата лития-железа со структурой оливина с углеродным покрытием, включающим 5–10% углеродных нанотрубок или наночешуек. Полученные с использованием механохимической активации материалы характеризуются несколько меньшим размером частиц. При этом их электропроводность возрастает на несколько порядков, достигая для лучших образцов 8.7 × 10–2 См/см. Кроме того, полученные материалы характеризуются существенным повышением электрохимической емкости при обратимой деинтеркаляции лития, что особенно ярко проявляется при высоких скоростях заряда и разряда аккумулятора. Лучшими характеристиками отличаются композиты с углеродными нанотрубками. Так, при плотностях тока 200, 800, 1600 и 3200 мА/г разрядная емкость LFP/С/10УНТ-500 составляет 120, 97, 78 и 57 мАч/г соответственно, тогда как для исходного LFP/С эти значения составляли 70, 63, 43 и 30 мАч/г. Причиной такого эффекта является уменьшение размера частиц и формирование сетки высокопроводящих контактов между частицами катодного материала. При этом не наблюдается четкой корреляции электрохимической емкости композитов с удельной площадью поверхности или электропроводностью.
ВВЕДЕНИЕ
Энергия является одним из самых старых и в то же время самых востребованных продуктов, потребление которого до недавнего времени удваивалось за 30 лет. В последние годы наблюдается интенсивное продвижение возобновляемых источников энергии, таких как солнечные батареи, ветрогенераторы [1–3]. Для обеспечения бесперебойного энергоснабжения необходимо также использовать накопители энергии, наиболее значимыми среди которых являются металл-ионные аккумуляторы, редокс-батареи и водородный цикл [4, 5]. В отличие от интенсивно развивающихся двух последних технологий литий-ионные аккумуляторы уже прочно вошли в нашу жизнь.
В состав металл-ионных аккумуляторов входят электродные материалы и электролит [6–8]. Наряду с жидкими и гелиевыми электролитами, содержащими соль лития и апротонный растворитель [9], интенсивно разрабатываются твердые [10, 11] и полимерные электролиты [12, 13]. В то же время существенно большее внимание уделяется разработке катодных и анодных материалов, определяющих энергоемкость аккумуляторов [14, 15]. Катодные материалы обычно отличаются меньшей электрохимической емкостью, поэтому их вклад в емкость аккумулятора чаще всего является доминирующим [16].
Одними из наиболее перспективных катодных материалов являются фосфаты и силикаты лития с переходными металлами (LiMXO4, где X = P, Si, а M = Fe, Mn, Co, Ni), среди которых наиболее известен фосфат лития-железа состава LiFePO4, далее обозначенный как LFP [16]. Среди его преимуществ можно отметить низкую стоимость, стабильность, экологическую безопасность, а также малое изменение объема при циклировании (4.5%). Его теоретическая емкость составляет 170 мАч/г [17, 18]. Основным недостатком LFP является низкая электронная и, особенно, ионная проводимость [19]. Это препятствует достижению высокой, близкой к теоретической, электрохимической емкости. Решить эту проблему позволяют гетеровалентное замещение части ионов железа [20–22], получение наноразмерных [16, 23–25] и композиционных материалов с углеродом [26–28].
Углеродные покрытия часто формируют пиролизом различных органических соединений в ходе синтеза [29–32]. Это обеспечивает стабилизацию наночастиц электродных материалов [33, 34]. В то же время значительный интерес исследователей в последние годы привлекают композиты LFP с графеном [35, 36] и, особенно, с углеродными нанотрубками [37–43]. Однако получение однофазного LFP одновременно с углеродными нанотрубками или графеном затруднено, поскольку для этого требуются разные условия. Кроме того, в металл-ионных аккумуляторах часто используются и агломераты графитоподобных материалов с высокими пористостью и площадью поверхности, характеризующиеся неупорядоченным расположением слоев. Такие материалы часто называют твердым углеродом [44]. Как правило, углеродные материалы вводятся в реакционную смесь для синтеза LFP. Представляется целесообразным получение таких композитов с использованием более простого и технологичного подхода – механохимической активации. Последняя может привести к некоторому уменьшению размера частиц LFP, более равномерному покрытию и лучшему связыванию частиц катодного материала с наноразмерными модификациями углерода.
Механохимическую обработку обычно используют для активации прекурсоров при синтезе композитов углерода и LFP или его аналогов с последующим термолизом [45–49]. Есть сведения о том, что использование такого подхода приводит к улучшению электронной проводимости и циклируемости полученных композитов [50, 51]. Отметим также, что в случае натриевого аналога со структурой маричита механохимическая активация позволяет получить частично аморфизированный продукт, проявляющий высокую электрохимическую емкость [52]. При этом исследователи не проводили механохимический синтез композитов с одно- или двумерными углеродными материалами.
Целью данной работы являлся синтез катодных материалов на основе LFP с графитоподобным углеродным покрытием и углеродных нанотрубок или наночешуек с использованием механохимической активации, а также исследование их электрохимических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Углеродные нанотрубки (УНТ) и наночешуйки (УНЧ) получали методом химического осаждения из паровой фазы в проточном реакторе на фиксированном слое катализатора (MgO и Со/MgO для синтеза УНЧ и УНТ соответственно) при 750–850°C. В качестве реакционного газа использовали смесь СН4 + Н2. Шихту промывали раствором соляной кислоты для удаления катализатора, затем тщательно промывали дистиллированной водой и сушили при 90–100°С до постоянной массы [53]. Сходным образом получали аналоги УНТ и УНЧ, допированные азотом (N-УНТ и N-УНЧ), используя в качестве реакционного газа ацетонитрил. По сути, частицы УНЧ представляют собой агломераты неупорядоченно упакованных слоев графена, которые могут разрушаться при механохимической активации материала, формируя графеноподобные включения в покрытии катодного материала.
Фосфат лития-железа синтезировали из нитрата железа(III) (Sigma-Aldrich, >98%), нитрата лития (Sigma-Aldrich, >99%) и дигидрофосфата аммония (Sigma-Aldrich, >98%), стехиометрические количества которых растворяли в минимальном количестве воды. Полученный раствор выдерживали при 70°С при постоянном перемешивании до образования гомогенной суспензии, которую далее нагревали при 300°С в течение 6 ч. Для нанесения углеродного покрытия на фосфат лития-железа (LFP/C) полученный прекурсор LFP перетирали с сахарозой (25 мас. %) и отжигали при 600°C в течение 10 ч в инертной атмосфере (Ar).
Композиционные материалы на основе LFP/С и различных углеродных наноматериалов получали путем их непосредственного механического смешения. Количество углеродного наноматериала составляло 5 и 10 мас. % по отношению к LFP/C. Далее полученные композиты подвергали механической обработке в планетарной мельнице Fritch Pulverisette 7 classic line с использованием агатовых размольных стаканов и шаров в этаноле. На основании данных [54] о влиянии интенсивности помола на электрохимические характеристики фосфата лития-железа помол проводили в течение 8 ч при скорости 500 об./мин в режиме: вращение – 3 мин, пауза – 2 мин. В обозначении образца указаны углеродный материал, его количество (в мас. %), интенсивность помола (об./мин), например: LFP/C/5УНТ-500.
Рентгенофазовый анализ (РФА) проводили на дифрактометре Rigaku D/MAX 2200 (излучение CuKα) с использованием пакета программ Rigaku Application Data Processing. Размер частиц (область когерентного рассеяния (ОКР)) оценивали по уширению линий рентгенограмм по формуле Шеррера, используя в качестве стандарта LaB6.
Содержание углерода, определенное на элементном анализаторе EuroVektor EA3000, для полученных композитов LFP/С составляет 5.5 ± 0.1%.
Морфологию полученных материалов изучали на сканирующем электронном микроскопе (СЭМ) Carl Zeiss NVision 40.
Электронную проводимость измеряли на постоянном токе с помощью импедансметра Z500 PRO (Элинс, Россия) при 25°С на цилиндрических таблетках с серебряными электродами.
Электрохимическое тестирование полученных композитов проводили в гальваностатическом режиме в интервале потенциалов от 2.5 до 4.1 В при плотностях тока 20–3200 мА/г с использованием зарядно-разрядного стенда ЗРУ 50 мА–10 В в герметичных трехэлектродных ячейках. Последние собирали в перчаточном боксе в атмосфере сухого аргона, используя в качестве сепаратора нетканый полипропилен. Электролитом служил 1М раствор LiPF6 в смеси этиленкарбоната, диэтилкарбоната и диметилкарбоната (1 : 1 : 1). Электродную пасту готовили смешением композита на основе LFP/C (88%) и сажи (10%), используя в качестве связующего поливинилиденфторид (2%), предварительно растворенный в N-метилпирролидоне. Полученную массу наносили на сетку из нержавеющей стали (толщина слоя 10–15 мг/см2) и прессовали под давлением 0.1 ГПа, затем сушили при 120°С в вакууме в течение 10 ч. В качестве вспомогательного электрода и электрода сравнения использовали металлический литий. Электрохимические емкости приведены в расчете на фосфат лития-железа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рентгенограммы некоторых полученных композитов LFP/С и используемых углеродных наноматериалов представлены на рис. 1. Все линии на рентгенограммах принадлежат орторомбической модификации фосфата лития-железа (PDF-2, № 40-1499). Широкая и слабая линия с максимумом в области 2θ ~ 24°–26°, соответствующая кристаллографической плоскости (002) графена [55] или УНТ [56] и присутствующая на рентгенограммах углеродных наноматериалов, по всей видимости, маскируется интенсивным рефлексом 111 фосфата лития-железа. Уменьшение размера частиц всех образцов, подвергавшихся механической обработке, отражается в некотором уширении линий на рентгенограммах. Рассчитанные на основании этих данных значения ОКР приведены в табл. 1. Следует отметить, что с уменьшением содержания наноразмерных форм углерода сокращается размер частиц. Можно полагать, что более пластичные углеродные материалы в данном случае выступают в роли буфера, демпфирующего удары шаров. Кроме того, увеличению размера частиц способствует и замена УНТ на УНЧ (табл. 1).
Рис. 1.
Рентгенограммы композитов на основе фосфата лития-железа и углеродных наноматериалов: LFP/C (1), LFP/С/5УНТ-500 (2), LFP/С/5N‑УНТ-500 (3), LFP/С/5УНЧ-500 (4), LFP/С/5N-УНЧ-500 (5).
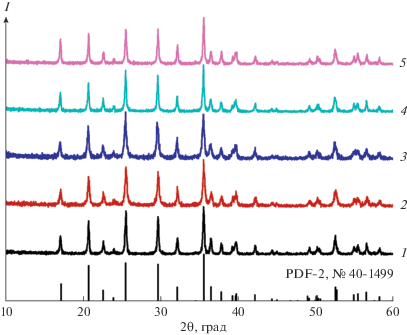
Таблица 1.
Размер частиц (ОКР) и электронная проводимость композитов LFP/С с УНТ/УНЧ
| Образец | Размер частиц, нм | Электронная проводимость, См/см |
|---|---|---|
| LFP/С | 49 | 4.6 × 10–7 |
| LFP/С/5УНТ-500 | 33 | 5.0 × 10–4 |
| LFP/С/10УНТ-500 | 37 | 5.9 × 10–3 |
| LFP/С/5N-УНТ-500 | 33 | 1.7 × 10–5 |
| LFP/С/10N-УНТ-500 | 36 | 6.7 × 10–3 |
| LFP/С/5УНЧ-500 | 42 | 6.9 × 10–3 |
| LFP/С/10УНЧ-500 | 45 | 8.7 × 10–2 |
| LFP/С/5N-УНЧ-500 | 43 | 6.8 × 10–5 |
| LFP/С/10N-УНЧ-500 | 46 | 4.4 × 10–3 |
Авторы [51] отметили, что удельная поверхность, связанная с объемной пористостью, оказывает наибольшее влияние на электрохимические свойства композитов состава LiFe0.5Mn0.5PO4/C. С этой точки зрения определенными преимуществами должны обладать композиты, в состав которых входят УНЧ, удельная площадь поверхности которых составляет 1198 и 1028 м2/г для УНЧ и N-УНЧ соответственно, тогда как для УНТ и N-УНТ соответствующие значения были заметно ниже: 598 и 287 м2/г. Причиной этого эффекта является высокая внутренняя пористость УНЧ. В результате этого удельная площадь поверхности композитов, содержащих 5% УНЧ, составила 95–97 м2/г, а с 10% УНЧ – 127–132 м2/г, тогда как для материалов, содержащих 5 и 10% УНТ, она составила 60–62 и 73–75 м2/г соответственно. Для исходного фосфата лития-железа с углеродным покрытием это значение составило 53 м2/г.
Данные электронной микроскопии также подтверждают сделанный вывод об уменьшении среднего размера частиц LFP, хотя после помола все еще сохраняются и отдельные их сростки (рис. 2). При этом на полученных микрофотографиях на поверхности LFP/C УНТ не видны (рис. 2а, 2б). Стоит отметить, что для композитов на основе титаната лития, не содержащих углеродного покрытия, они наблюдались отчетливо [57]. По всей видимости, в данном случае наличие углеродного покрытия на частицах фосфата лития-железа маскирует УНТ за счет их внедрения в углеродную оболочку. В композитах LFP/C с УНЧ и их гетерозамещенными аналогами на фоне измельченных частиц фосфата лития-железа наблюдаются крупные (до 2 мкм) агломераты УНЧ (на микрофотографиях, полученных в режиме отраженных электронов, им соответствуют более темные области (рис. 2г)).
Рис. 2.
СЭМ-изображения образцов LFP/С/10УНТ-500 (а), LFP/С/10N‑УНТ‑500 (б), LFP/С/5УНЧ-500 (в, г) во вторичных (а–в) и отраженных электронах (г).

Известно, что для достижения высокой электрохимической емкости катодный материал должен отличаться высокой скоростью процессов интекаляции/деинтеркаляции лития, которые осуществляются за счет одновременного переноса ионов лития и электронов в частицах катодного материала [16]. Задачей углеродного покрытия, наносимого на частицы LFP, является обеспечение быстрой диффузия лития по межзеренным границам. Поэтому одним из ключевых факторов для достижения работоспособности катодных материалов, особенно при высокой плотности тока, является высокая электронная проводимость, которая в определенной мере должна отражать формирование непрерывной проводящей сетки, обеспечивающей перколяцию в данном материале [28]. Из данных, представленных в табл. 1, видно, что помол с углеродными наноматериалами приводит к отчетливо выраженному повышению электронной проводимости полученных композитов на несколько порядков. Максимальные значения проводимости наблюдались для образца LFP/С/10УНЧ-500, для которого проводимость возрастала почти в 1.9 × 105 раз (табл. 1). Стоит отметить, что вопреки тому, что допирование УНТ и УНЧ азотом обычно приводит к повышению электропроводности углеродных наноматериалов, в нашем случае для полученных композитов эффект оказывается обратным. В то же время можно полагать, что при этом должно наблюдаться более плотное сцепление частиц LFP с углеродными наноматериалами за счет присутствия на поверхности последних полярных фрагментов [57].
Данные по циклированию некоторых композитов LFP/C с УНТ и УНЧ представлены на рис. 3. Зарядно-разрядные кривые весьма типичны для материалов на основе фосфата лития-железа и характеризуются отчетливо выраженным плато с потенциалом 3.4 В относительно литиевого электрода. Формирование нанокомпозитов позволяет заметно повысить электрохимическую емкость при плотности тока 20 мА/г. Для исходного композита LFP/С она составляет 132 мАч/г, а для материалов, подвергавшихся совместному помолу с УНТ, достигает 141–146 мАч/г. В то же время емкость материала LFP/С/5УНЧ-500 при первом циклировании составила 164 мАч/г, что достаточно близко к теоретической емкости. Немного уступает ему LFP/С/5N-УНЧ-500. Из представленных данных также отчетливо видно, что для исходного композита LFP/С деградация материала при циклировании выражена более ярко.
Рис. 3.
Зарядно-разрядные кривые LFP/С-500 (а), LFP/С/10УНТ-500 (б) и LFP/С/5УНЧ‑500 (в) (плотности тока (мА/г) указаны на рисунке); 20' обозначает возврат к 20 мА/г после циклирования на высоких токах.
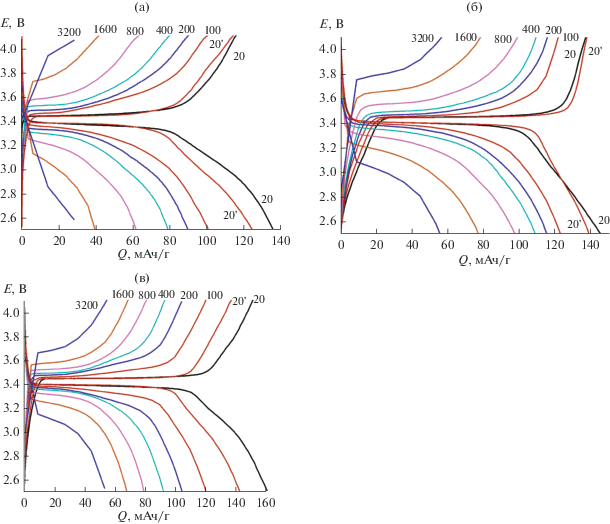
Наибольший интерес представляет циклирование исследуемых композиционных материалов при высоких плотностях тока. Именно этот параметр характеризует возможность получения на их основе аккумулятора с высокой мощностью, способного быстро заряжаться. С повышением плотности тока области, соответствующие плато, характеризуются все большим наклоном, что обусловлено ростом омического вклада (IR) в потенциал заряда (разряда), который повышается с ростом плотности тока и толщины слоя формирующейся на поверхности материала фазы (FePO4 в процессе заряда аккумулятора и LiFePO4 в процессе его разряда). При этом емкость исходного композита LFP/С все больше уступает емкости композитов, полученных при помоле с наноразмерными углеродными материалами (рис. 3). Отметим что этот эффект обусловлен в первую очередь тем, что с ростом внутреннего сопротивления катодного материала омический вклад в потенциал заряда и разряда резко возрастает и система достигает предельного потенциала, при котором процесс заряда останавливается, когда электрохимические превращения успевают пройти лишь в тонком приповерхностном слое частиц LFP/С. Именно этот фактор приводит к падению электрохимической емкости аккумулятора при высоких плотностях тока циклирования.
Изменение емкости полученных катодных материалов при циклировании с последовательно увеличивающейся плотностью тока приведены на рис. 4. После циклирования при плотности тока 3200 мА/г ее снова уменьшали до 20 мА/г. Следует заметить, что в композитах с УНТ уменьшение емкости LFP при увеличении плотности тока связано в основном с кинетическими факторами, поскольку при возвращении к плотности тока 20 мА/г электрохимическая емкость восстанавливается практически до исходной величины (деградация материала не превышает 3–4%). В то же время для композитов LFP/C с УНЧ деградация выражена более явно.
Рис. 4.
Изменение разрядной емкости при циклировании композитов на основе LFP/C и УНТ (а)/УНЧ (б); плотности тока (мА/г) приведены на рисунке.
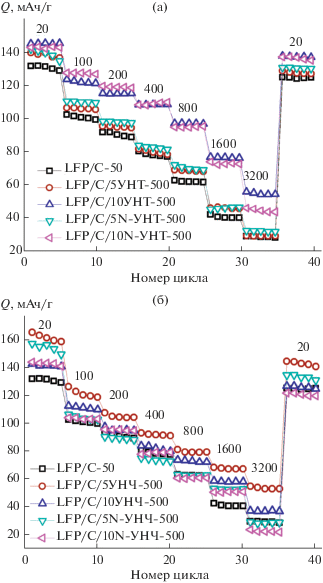
Кроме того, композиты с УНТ демонстрируют более высокую емкость во всем диапазоне скоростей заряда/разряда по сравнению с материалами, содержащими УНЧ (рис. 4). Наблюдаемый результат можно объяснить меньшим размером частиц и более равномерным распределением углеродного материала на поверхности частиц LFP/C, что подтверждается данными электронной микроскопии. Кроме того, можно полагать, что наличие УНТ в данной системе обеспечивает образование более надежной сетки высокопроводящих контактов между частицами катодного материала. При использовании для создания композитов УНТ более высокие значения емкости получены для материалов с 10 мас. % УНТ и N-УНТ (рис. 4а), что связано с их высокой электропроводностью (табл. 1). Так, при плотностях тока 200, 800, 1600 и 3200 мА/г разрядная емкость LFP/С/10УНТ-500 составляет 120, 97, 78 и 57 мАч/г соответственно. Среди композитов с УНЧ лучшие характеристики при быстром заряде/разряде показал материал LFP/С/5УНЧ-500 (рис. 4б). Его разрядная емкость составила 106, 81, 70 и 55 мАч/г при плотности тока 200, 800, 1600 и 3200 мА/г соответственно. При этом стоит заметить, что максимальной электронной проводимостью характеризовался материал состава LFP/С/10УНЧ-500, имеющий существенно более низкую емкость при повышенной плотности тока (рис. 4б). Кроме того, можно отметить, что наши исследования не подтверждают вывода авторов [51] о существенном влиянии на электрохимические свойства композитов удельной поверхности, связанной с объемной пористостью.
ЗАКЛЮЧЕНИЕ
Предложен простой и технологичный способ получения композитов на основе фосфата лития-железа со структурой оливина с углеродным покрытием, включающим 5–10% УНТ или УНЧ. Механохимическая активация смеси LFP с углеродным графитоподобным покрытием с УНТ или УНЧ приводит к некоторому снижению размера частиц LFP с одновременным ростом электропроводности композитов.
Полученные материалы также характеризуются ростом электрохимической емкости обратимой интеркаляции лития при высоких скоростях заряда и разряда аккумулятора за счет формирования сетки высокопроводящих контактов между частицами катодного материала.
Полученные результаты позволяют рассматривать такой подход в качестве перспективного для формирования композиционных катодных материалов литий-ионных аккумуляторов с высокой мощностью и высокой скоростью заряда.
Список литературы
Widén J., Carpman N., Castellucci V., Lingfors D., Olauson J., Remouit F., Bergkvist M., Grabbe M., Waters R. Variability Assessment and Forecasting of Renewables: A review For Solar, Wind, Wave and Tidal Resources // Renew. Sustain. Energy Rev. 2015. V. 44. P. 356–375.
Pearre N., Adye K., Swan L. Proportioning Wind, Solar, and in-Stream Tidal Electricity Generating Capacity to co-Optimize Multiple Grid Integration Metrics // Appl. Energy. 2019. V. 242. P. 69–77.
Yaroslavtsev A.B., Stenina I.A., Golubenko D.V. Membrane Materials for Energy Production and Storage // Pure Appl. Chem. 2020. V. 92. № 7. P. 1147–1157.
Stenina I.A., Yaroslavtsev A.B. Nanomaterials for Lithium-Ion Batteries and Hydrogen Energy // Pure Appl. Chem. 2017. V. 89. № 8. P. 1185–1194.
Dehghani-Sanij A.R., Tharumalingam E., Dusseault M.B., Fraser R. Study of Energy Storage Systems and Environmental Challenges of Batterie // Renew. Sustain. Energy Rev. 2019. V. 104. P. 192–208.
Sbordone D.A., Di Pietra B., Bocci E. Energy Analysis of a Real Grid Connected Lithium Battery Energy Storage System // Energy Procedia. 2015. V. 75. P. 1881–1887.
Lain M.J., Brandon J., Kendrick E. Design Strategies for High Power vs. High Energy Lithium Ion Cells // Batteries. 2019. V. 5. № 4. P. 64.
Ge S., Leng Y., Liu T., Longchamps R.S., Yang X.-G., Gao D., Wang D., Wang C.-Y. A New Approach to Both High Safety and High Performance of Lithium-Ion Batteries // Science Advances 2020. V. 6. № 9. P. 7633.
Ue M., Uosaki K. Recent Progress in Liquid Electrolytes for Lithium Metal Batteries // Current Opinion Electrochem. 2019. V. 17. № 1. P. 106–113.
Bachman J.C., Muy S., Grimaud A., Chang H.-H., Pour N., Lux S.F., Paschos O., Maglia F., Lupart S., Lamp P., Giordano L., Shao-Horn Y. Inorganic Solid-State Electrolytes for Lithium Batteries: Mechanisms and Properties Governing Ion Conduction // Chem. Rev. 2016. V. 116. № 1. P. 140–162.
Wu X., Pan K., Jia M., Ren Y., He H., Zhang L., Zhang S. Electrolyte for Lithium Protection: from Liquid to Solid // Green Energy & Environment. 2019. V. 4. № 4. P. 360–374.
Choudhury S., Stalin S., Vu D., Warren A., Deng Y., Biswal P., Archer L.A. Solid-State Polymer Electrolytes for High-Performance Lithium Metal Batteries // Nat. Commun. 2019. V. 10. P. 4398.
Воропаева Д.Ю., Новикова С.А., Ярославцев А.Б. Полимерные электролиты для литий-ионных аккумуляторов // Успехи химии. 2020. Т. 89. № 10. С. 1132–1155.
Roy P., Srivastava S.K. Nanostructured Anode Materials for Lithium Ion Batteries // J. Mater. Chem. A. 2015. V. 3. № 6. P. 2454–2484.
Manthiram A. A Reflection on Lithium-Ion Battery Cathode Chemistry // Nat. Commun. 2020. V. 11. P. 1550.
Ярославцев А.Б., Кулова Т.Л., Скундин А.М. Электродные наноматериалы для литий-ионных аккумуляторов // Успехи химии. 2015. Т. 84. № 8. С. 826–852.
Gong C., Xue Z., Wen S., Ye Y., Xie X. Advanced Carbon Materials/Olivine LiFePO4 Composites Cathode for Lithium Ion Batteries // J. Power Sources. 2016. V. 318. P. 93–112.
Spingler F.B., Naumann M., Jossen A. Capacity Recovery Effect in Commercial LiFePO4 // Graphite Cells. J. Electrochem. Soc. 2020. V. 167. P. 040526.
Whittingham M.S. Ultimate Limits to Intercalation Reactions for Lithium Batteries // Chem. Rev. 2014. V. 114. P. 11414–11443.
Perea A., Sougrati M.T., Ionica-Bousquet C.M., Fraisse B., Tessier C., Aldon L., Jumas J.-C. Operando 57Fe Mössbauer and XRD investigation of LixMnyFe1 –yPO4/C Composites (y = 0.50; 0.75) // RSC Adv. 2012. V. 2. P. 9517–9524.
Novikova S., Yaroslavtsev A., Yaroslavtsev S., Rusakov V., Kulova T., Skundin A. ${\text{LiF}}{{{\text{e}}}_{{1 - x}}}{\text{M}}_{x}^{{{\text{II}}}}{\text{P}}{{{\text{O}}}_{4}}$/C (MII = Co, Ni, Mg) as Cathode Materials for Lithium-Ion Batteries // Electrochim. Acta. 2014. V. 122. P. 180–186.
Yaroslavtsev S.A., Vostrov N.I., Novikova S.A., Kulova T.L., Yaroslavtsev A.B., Rusakov V.S. Study of Delithiation Process Features in LixFe0.8M0.2PO4 (M = Mg, Mn, Co, Ni) by Mössbauer Spectroscopy // J. Phys. Chem. C. 2020. V. 124. № 24. P. 13026–13035.
Yang C., Lee D.J., Kim H., Kim K., Joo J., Kim W.B., Song Y. B., Jung Y. S., Park J. Synthesis of Nano-Sized Urchin-Shaped LiFePO4 for Lithium Ion Batteries // RSC Adv. 2019. V. 9. P. 13714–13721.
Zhao Y., Peng L., Liu B., Yu G. Single-Crystalline LiFePO4 Nanosheets for High-Rate Li-Ion Batteries // Nano Lett. 2014. V. 14. № 5. P. 2849–2853.
Ahsan Z., Ding B., Cai Z., Wen C., Yang W., Ma Y., Zhang S., Song G., Javed M.S. Recent Progress in Capacity Enhancement of LiFePO4 Cathode For Li-Ion Batteries // J. Electrochem. Energy Conversion Storage. 2020. V. 18. № 1. P. 1–54.
Bi Z., Zhang X., He W., Min D., Zhang W. Recent Advances in LiFePO4 Nanoparticles with Different Morphology for High-Performance Lithium-Ion Batteries // RSC Adv. 2013. V. 3. P. 19744–19751.
Wang X., Feng Z., Hou X., Liu L., He M., He X., Huang J., Wen Z. Fluorine Doped Carbon Coating of LiFePO4 as a Cathode Material for Lithium-Ion Batteries // Chem. Eng. J. 2020. V. 379. P. 122371.
Yaroslavtsev A.B., Stenina I.A. Carbon Coating of Electrode Materials for Lithium-Ion Batteries // Surface Innovations. 2021. V. 9. № 2–3. P. 92–110. https://doi.org/10.1680/jsuin.20.00044
Wang G., Ma Z., Shao G., Kong L., Gao W. Synthesis of LiFePO4 α Carbon Nanotube Core-Shell Nanowires with a High-Energy Efficient Method for Superior Lithium Ion Battery Cathodes // J. Power Sources. 2015. V. 291. P. 209–214.
Eftekhari A. LiFePO4/C Nanocomposites for Lithium-Ion Batteries // J. Power Sources. 2017. V. 3431. P. 395–411.
Zuo D., Tian G., Li X., Chen D., Shu K. Recent Progress in Surface Coating of Cathode Materials for Lithium Ion Secondary Batteries // J. Alloys Compd. 2017. V. 706. P. 24–40.
Li P., Zhang K., Park J.H. Dual or Multi Carbonaceous Coating Strategies for Next-Generation Batteries // J. Mater. Chem. A. 2018. V. 6. P. 1900–1914.
Rong C.-B., Poudyal N., Chaubey G.S., Nandwana V., Liu Y., Wu Y.Q., Kramer M.J., Kozlov M.E., Baughman R.H., Liu J.P. High Thermal Stability of Carbon-Coated L10-FePtL10-FePt Nanoparticles Prepared by Salt-Matrix Annealing // J. Appl. Phys. V. 103. 07E131.
Iarchuk A.R., Nikitina V.A., Karpushkin E.A., Sergeyev V.G., Antipov E.V., Stevenson K.J., Abakumov A.M. Influence of Carbon Coating on Intercalation Kinetics and Transport Properties of LiFePO4 // ChemElectroChem. 2019. V. 6. № 19. P. 5090–5100.
Hu Y., Ma X., Guo P., Jaeger F., Wang Z. 3D Graphene-Encapsulated Li3V2(PO4)3 Microspheres as a High-Performance Cathode Material for Energy Storage // J. Alloys Compd. 2017. V. 723. P. 873–879.
Wang B., Jin F., Xie Y., Luo H., Wang F., Ruan T., Wang D., Zhou Y., Dou S. Holey Graphene Modified LiFePO4 Hollow Microsphere as an Efficient Binary Sulfur Host for High-Performance Lithium-Sulfur Batteries // Energy Storage Mater. 2020. V. 26. P. 433–442.
Wang G., Ma Z., Shao G., Kong L., Gao W. Synthesis of LiFePO4@carbon Nanotube Core-Shell Nanowires with a High-Energy Efficient Method for Superior Lithium Ion Battery Cathodes // J. Power Sources. 2015. V. 291. P. 209–214.
Varzi A., Ramirez-Castro C., Balducci A., Passerini S. Performance and Kinetics of LiFePO4–Carbon bi-Material Electrodes for Hybrid Devices: A Comparative Study Between Activated Carbon and Multi-Walled Carbon Nanotubes // J. Power Sources. 2015. V. 273. P. 1016–1022.
Tu X., Zhou Y., Tian X., Song Y., Deng C., Zhu H. Monodisperse LiFePO4 Microspheres Embedded with Well-Dispersed Nitrogen-Doped Carbon Nanotubes as High-Performance Positive Electrode Material for Lithium-Ion Batteries // Electrochim. Acta. 2016. V. 222. P. 64–73.
Qiao Y.Q., Feng W.L., Li J., Shen T.D. Ultralong Cycling Stability of Carbon-Nanotube/LiFePO4 Nanocomposites as Electrode Materials for Lithium-Ion Batteries // Electrochim. Acta. 2017. V. 232. P. 323–331.
Tu X., Zhou Y., Song Y. Freeze-Drying Synthesis of Three-Dimensional Porous LiFePO4 Modified with Well-Dispersed Nitrogen-Doped Carbon Nanotubes for High-Performance Lithium-Ion Batteries // Appl. Surf. Sci. 2017. V. 400. P. 329–338.
Wang Z., Lu Y. Amorphous FePO4/Carbon Nanotube Cathode Preparation via in Situ Nanoprecipitation and Coagulation in a Microreactor // ACS Omega. 2019. V. 4. № 12. P. 14790–14799.
Li W., Garg A., Le M.L.P., Ruhatiya C., Gao L., Tran V.M. Electrochemical Performance Investigation of LiFePO4/C0.15 –x (x = 0.05, 0.1, 0.15 CNTs) Electrodes at Various Calcination Temperatures: Experimental and Intelligent Modelling Approach // Electrochim. Acta. 2020. V. 330. P. 135314.
Xiao L., Cao Y., Henderson W.A., Sushko M.L., Shao Y., Xiao J., Wang W., Engelhard M.H., Nie Z., Liu J. Hard Carbon Nanoparticles as High-Capacity, High-Stability Anodic Materials for Na-Ion Batteries // Nano Energy. 2016. V. 19. P. 279.
Bian D., Sun Y., Sheng Li., Tian Y., Yang Z., Fan X., Zhang W. A Novel Process to Recycle Spent LiFePO4 for synthesizing LiFePO4/C Hierarchical Microflowers // Electrochim. Acta. 2016. V. 190. P. 134–140.
Yang Y.X., Zheng X.H., Cao H.B., Zhao C.L., Lin X., Ning P.G., Zhang Y., Jin W., Sun Z. A Closed-Loop Process for Selective Metal Recovery from Spent Lithium Iron Phosphate Batteries through Mechanochemical Activation // ACS Substainable Chem. Eng. 2017. V. 5. № 11. P. 9972–9980.
Meng Q., Duan J.G., Zhang Y.J., Dong P. Novel Efficient and Environmentally Friendly Recovering of High Performance Nano-LiMnPO4/C Cathode Powders from Spent LiMn2O4 Batteries // J. Ind. Eng. Chem. 2019. V. 80. P. 633–639.
Ivanishchev A.V., Ivanishcheva I.A., Dixit A. LiFePO4-Based Composite Electrode Material: Synthetic Approaches, Peculiarities of the Structure, and Regularities of Ionic Transport Processes // Russ. J. Electrochem. 2019. V. 55. № 8. P. 719–737.
Xu B., Dong P., Duan J.G., Wang D., Huang X.S., Zhang Y.J. Regenerating the used LiFePO4 to High Performance Cathode via Mechanochemical Activation Assisted V5+ Doping // Ceramics Int. 2019. V. 45. № 9. P. 11792–11801.
Kosova N.V., Podgornova O.A., Volfkovich Y.M., Sosenkin V.E. Optimization of the Cathode Porosity via Mechanochemical Synthesis with Carbon Black // J. Solid State Electrochem. 2021. https://doi.org/10.1007/s10008-020-04877-8
Bograchev D.A., Volfkovich Y.M., Sosenkin V.E., Podgornova O.A., Kosova N.V. The Influence of Porous Structure on the Electrochemical Properties of LiFe0.5Mn0.5PO4 Cathode Material Prepared by Mechanochemically Assisted Solid-State Synthesis // Energies. 2020. V. 13. № 3. P. 542.
Kapaev R., Chekannikov A., Novikova S., Yaroslavtsev S., Kulova T., Rusakov V., Skundin A., Yaroslavtsev A. Mechanochemical Treatment of Maricite-Type NaFePO4 for Achieving High Electrochemical Performance // J. Solid State Electrochem. 2017. V. 21. P. 2373–2380.
Kolesnikov A., Milyutina A., Desyatov A., Kolesnikov V. Electroflotation Recovery of Highly Dispersed Carbon Materials from Aqueous Solutions of Electrolyte // Sep. Purif. Technol. 2019. V. 209. P. 73–78.
Gryzlov D.Yu., Novikova S.A., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. The Effect of Particle Size on the Processes of Charging and Discharging of the LiFe0.97Ni0.03PO4/C/Ag Cathode Material // Russ. J. Electrochem. 2018. V. 54. P. 442–450.
Nethravathi C., Rajamathi M. Chemically Modified Graphene Sheets Produced by the Solvothermal Reduction of Colloidal Dispersions of Graphite Oxide // Carbon. 2008. V. 46. P. 1994–1998.
Zhu Y.-R., Wang P., Yi T.-F., Denga L., Xie Y. Improved High-Rate Performance of Li4Ti5O12/Carbon Nanotube Nanocomposite Anode for Lithium-Ion Batteries // Solid State Ionics. 2015. V. 276. P. 84–89.
Stenina I.A., Shaydullin R.R., Desyatov A.V., Kulova T.L., Yaroslavtsev A.B. Effect of Carbon and N-Doped Carbon Nanomaterials on the Electrochemical Performance of Lithium Titanate-Based Composites // Electrochim. Acta. 2020. V. 364. № 137330.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


