Неорганические материалы, 2021, T. 57, № 8, стр. 819-828
Эффект фотонной обработки поверхности мембранной фольги PdCu: водородопроницаемость и мембранный катализ
Е. Ю. Миронова 1, А. И. Донцов 2, 3, *, Н. Б. Морозова 2, С. В. Горбунов 4, В. М. Иевлев 5, А. Б. Ярославцев 1
1 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
ГСП-1, 119991 Москва, Ленинский пр., 29, Россия
2 Воронежский государственный университет
394018 Воронеж, Университетская пл., 1, Россия
3 Воронежский государственный технический университет
394006 Воронеж, ул. 20-летия Октября, 84, Россия
4 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
5 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: rnileme@mail.ru
Поступила в редакцию 01.03.2021
После доработки 06.04.2021
Принята к публикации 07.04.2021
Аннотация
Исследовано влияние фотонной обработки поверхности мембранной фольги, изготовленной прокаткой слитка твердого раствора Pd–Cu, на проницаемость водорода. Показано, что такая обработка приводит к очистке поверхности мембран от продуктов сорбции и существенно повышает проницаемость мембран по водороду при температурах до 300°С. Использование реактора с очищенной мембраной из сплава PdCu позволяет повысить выход водорода в процессе парового риформинга метанола в присутствии катализатора Ni0.2Cu0.8/Ce0.3Zr0.7O2 – δ по сравнению с традиционным проточным реактором за счет смещения термодинамического равновесия при выводе водорода из зоны реакции. В наиболее явном виде эффект фотонной очистки поверхности мембраны проявляется при рассмотрении выхода высокочистого водорода в зоне пермеата. Если при 360°С выход высокочистого водорода в реакторе, содержащем мембрану с очищенной поверхностью, повышался всего на 15%, то при 260°С выигрыш за счет фотонной очистки мембраны оказался пятнадцатикратным. Причиной этого является различие значений проницаемости мембран по водороду при низких температурах и их постепенное сближение при высоких.
ВВЕДЕНИЕ
Развитие промышленности неизбежно приводит к ухудшению экологической ситуации. Далеко не последний вклад в эти процессы вносит производство энергии. Вследствие этого поднимается вопрос о необходимости перехода на новые альтернативные и, в первую очередь, возобновляемые источники энергии (солнечные батареи, ветрогенераторы) [1, 2]. Однако для бесперебойного энергоснабжения они должны работать в паре с накопителями энергии, среди которых одни из наиболее эффективных основаны на использовании водородного цикла [3]. В то же время при использовании водорода, получаемого риформингом биомассы [4] или биоспиртов [5], топливные элементы также могут рассматриваться как возобновляемые источники энергии. Этими факторами обусловлено принятие рядом стран концепций развития водородной энергетики [6].
В настоящее время мировой уровень производства водорода достиг 115 млн т в год, причем подавляющая часть водорода получается риформингом природного газа и угля. Поскольку бóльшая его часть потребляется в процессах производства аммиака, метанола и в нефтепереработке, требования, предъявляемые к чистоте водорода, чаще всего невелики. Однако при переходе к водородной энергетике ситуация кардинально изменится, поскольку около 90% производимых топливных элементов являются низкотемпературными и примеси СО даже на уровне миллионных долей приводят к существенным потерям производительности [2]. В то же время наиболее экономичные и распространенные способы получения водорода сводятся к конверсии углеводородов или угля. Основным побочным продуктом при этом является СО [7].
В последние годы значительное внимание уделяется пиролизу природного газа, протекающему при температурах выше 1100–1200°C [8]:
(1)
${\text{С}}{{{\text{H}}}_{4}} = {\text{C}} + 2{{{\text{H}}}_{2}},\,\,\Delta H_{{298{\text{ K}}}}^{0} = + 74.8\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}.$Этот процесс также позволяет получать водород с низким содержанием СО. Понизить температуру его проведения можно использованием катализаторов [9–12]. Однако получаемый таким образом водород аккумулирует лишь половину потенциальной энергии метана, что в сочетании с высокой энергозатратностью обуславливает низкую эффективность использования метана с этой целью. Отмечается также и низкая востребованность получаемого таким образом углерода [13].
С этой точки зрения эффективен паровой риформинг метанола, основным побочным продуктом которого является CO2
(2)
$\begin{gathered} {\text{С}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{C}}{{{\text{O}}}_{2}} + 3{{{\text{H}}}_{2}}, \\ \Delta H_{{{\text{298 K}}}}^{0} = 50\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Этот процесс чаще всего осуществляется на катализаторах на основе меди, никеля или благородных металлов, нанесенных на оксидные носители [5, 14]. Активность катализатора зависит от развитости его поверхности (размера частиц) [15, 16]. Кроме того, активность и селективность катализаторов удается оптимизировать, используя биметаллические сплавы [17–20]. Важную роль в реакции парового риформинга играют и носители, которые не только обеспечивают сорбцию паров воды, но также могут активно участвовать в окислительно-восстановительных процессах и в ионном переносе [21, 22].
Однако высокая производительность этой реакции обычно достигается лишь при температурах порядка 350°С, при которых полностью избавиться от примеси CO не удается. Для очистки водорода используются различные мембраны, включая полимерные и углеродные [23–25]. Их общим недостатком является невысокая селективность, повысить которую удается лишь при использовании палладиевых мембран. Более высокая скорость очистки достигается при использовании сплавов палладия с медью, серебром и рутением [26–29]. Следует отметить, что важную роль в эффективности процессов переноса играет поверхность таких мембран [30]. Повысить их проницаемость по водороду можно, в частности, с помощью очистки поверхности [31].
Использование мембранного катализа позволяет проводить одновременно процессы получения водорода и его очистки [32–34], увеличить выход основного продукта за счет его вывода из сферы реакции [35–37]. Один из возможных путей повышения эффективности процессов мембранного катализа – повышение чистоты поверхности мембранной фольги.
Цель работы – оценка влияния фотонной обработки поверхности мембранной фольги на водородопроницаемость и эффективность процесса получения водорода паровой конверсией метанола в реакторе на мембранах из сплава PdCu.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение мембран и катализаторов. Образцы тонкой фольги для изготовления мембран получали в процессе многостадийной прокатки слитка состава Pd–52 ат. % Сu. Для гомогенизации твердого раствора слиток отжигали в течение 5 ч в вакууме 6 × 10–3 Па при температуре 1000°С. Первичную деформацию слитка проводили без нагревания на двухвалковом прокатном стане с обжатием 18–20% за проход. При достижении суммарной степени обжатия 70–80% заготовку отжигали при 950°С в течение 3 ч. Последующую прокатку полосы от толщины 2 мм до 100 мкм проводили в несколько стадий на четырехвалковом стане при комнатной температуре. При достижении суммарной степени обжатия 50–55% полосу отжигали при 900–950°С в течение 90–105 мин в зависимости от толщины заготовки. Холодную прокатку до 20 мкм проводили на двадцативалковом стане (с использованием валков диаметром 8 мм). Перед прокаткой полосу толщиной 100 мкм отжигали в вакууме при 850°С в течение 30 мин.
Полученную фольгу промывали в ультразвуковой ванне (ODA-LQ07, рабочая частота 40 Гц) с ацетоном в течение 30 мин. Для полного упорядочения структуры фольги (β-фаза) проводили цикл термообработки: нагревание до 850°С–охлаждение до комнатной температуры [38]. Для очистки поверхности мембранной фольги использовали фотонную обработку (ФО) в вакууме 10–3 Па излучением импульсных ксеноновых ламп типа ИНП 16/250 (спектр излучения 0.2–1.2 мкм) в установке УОЛП-1. ФО проводили последовательностью из 10 импульсов длительностью 1 с каждый. Восстановление упорядочения атомной структуры фольги проводили в цикле: нагревание в вакууме до 850°С–охлаждение до комнатной температуры.
Носитель состава Ce0.3Zr0.7O2 – δ был приготовлен методом соосаждения с использованием оксинитрата циркония ZrO(NO3)2 (99% ALDRICH) и нитрата церия Ce(NO3)3 ∙ 6H2O (99.995%) при pH 9 по методике [39]. Осадок шестикратно промывали водой, центрифугировали в течение 5 мин со скоростью 6000 об./мин и замораживали в чашках Петри при –12°С. После размораживания осадок декантировали, промывали водой и сушили при комнатной температуре в течение 2 суток. Полученные на первой стадии гидратированные оксиды циркония и церия отжигали в течение 5 ч при 600°С с целью формирования твердого раствора оксидов со структурой флюорита. Затем полученный носитель был поочередно пропитан водными растворами Сu(NO3)2 · 3H2O (>98%) и Ni(NO3)2 · 6H2O (≥98.5% ALDRICH) в количествах, рассчитанных так, чтобы суммарное содержание металлов составило 20% от массы носителя, а соотношение никеля и меди в растворе составляло 1 : 4. Приготовленную суспензию диспергировали с использованием ультразвуковой ванны Soniprep в течение 10 мин и выпаривали в сушильном шкафу при 100°С. Полученные катализаторы отжигали на воздухе при 400°С 1 ч и обрабатывали потоком газовой смеси Н2 (5%)/Ar (20 см3/мин) в течение 3 ч при 350°С для восстановления металлов.
Физико-химическое исследование мембранной фольги и катализаторов. Фазовый анализ образцов проводили на дифрактометрах Rigaku D/MAX 2200 и ARL X`TRA (излучение CuKα). Дифрактограммы обрабатывали с помощью пакета программ Rigaku Application Data Processing. Для оценки среднего размера частиц катализатора из спектра рентгеновской дифракции использовали формулу Шеррера
(3)
$d = \frac{{k\lambda }}{{{{{\left( {{{B}^{2}} - {{b}^{2}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}\cos \theta }},$Морфологию поверхности мембранной фольги исследовали методом атомно-силовой микроскопии (АСМ, Solver Pro EC).
Элементный состав поверхности образцов фольги оценивали методом оже-электронной спектроскопии с использованием анализатора DESA-100. Количественный анализ состава проведен по коэффициентам выхода.
Оценку эффективности ФО поверхности фольги проводили методом циклической вольт-амперометрии [40, 41] по величинам коэффициента диффузии водорода (D, см2/с) и комплексного параметра водородопроницаемости (KD, моль/(см2 с1/2)), а также по степени чувствительности к циклированию потенциала [42].
Площадь удельной поверхности катализаторов измеряли методом низкотемпературной адсорбции азота (БЭТ) на газоанализаторе ASAP-2020N (Micromeritics Co).
Измерение проницаемости мембран по водороду. Диффузионная ячейка мембранного реактора разделялась мембраной на две несообщающиеся камеры пермеата и ретентата. Для герметизации мембран в реакторе одновременно использовали два типа прокладок: из меди и углеродного материала Графлекс, что позволяло избежать повреждения поверхности мембраны и приваривания прокладок к фольге. Активная площадь мембраны составила 1.1 см2. Мембранный реактор нагревали в температурном интервале от 190 до 400°С, постоянство температуры при этом контролировали регулятором температуры OVEN TRM 201 (термопара хромель–копель).
В зону ретентата подавали водород особой чистоты со скоростью 20 см3/мин, а в зону пермеата – аргон со скоростью 20 см3/мин. Часть водорода диффундировала через мембрану в зону пермеата в поток газа-носителя. Концентрацию водорода в камерах ретентата и пермеата определяли на хроматографе Chrom-4 с детектором по теплопроводности, вводя газовую смесь краном-дозатором в хроматографическую колонку (фаза CaA Zeosorb, газ-носитель Ar). Хроматограммы обрабатывали с помощью программы Ecochrom.
Коэффициент проницаемости рассчитывали по формуле
Проведение каталитических испытаний. Для экспериментов по паровому риформингу метанола образец катализатора массой 0.3 г, смешанного с гранулированным кварцем (фракция 1–3 мм), помещали в зону ретентата мембранного реактора. Жидкую смесь метанола с водой (мольное соотношение 1 : 1) со скоростью 1 см3/ч сначала подавали в испаритель жидкостным инфузионным насосом 1235N (фирма Atom Medical Corporation, Япония). Из испарителя пары спирта и воды в потоке аргона со скоростью 20 см3/мин поступали в реактор на катализатор. Процесс проводили в интервале температур 250–350°С.
Жидкие продукты реакции конденсировали на выходе из реактора в стеклянном приемнике, охлаждаемом до 0°С. Газовый поток направляли на хроматографический анализ. Анализ оксидов углерода проводили на колонке с активированным углем СКТ хроматографа ЛХМ-8МД с детектором по теплопроводности, а водорода – на колонке с цеолитом СаА-Цеосорб хроматографа Chrom-4 с детектором по теплопроводности. Расчет хроматограмм осуществляли с помощью программы Ecochrom. Выход продуктов реакции рассчитывали, как количество соответствующего продукта реакции (моль/ч), полученного с 1 г металлов катализатора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
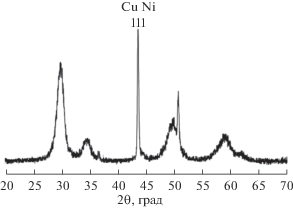
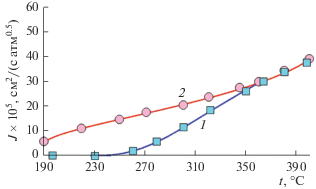
Характеризация образцов мембранной фольги и катализаторов. Дифрактограмма на рис. 1 характеризует структуру фольги после проведения одного цикла нагревание в вакууме до 850°С–охлаждение. Из нее следует, что восстанавливается β‑фаза со средним размером области когерентного рассеяния не менее 1 мкм.
Морфологию поверхности фольги до ФО характеризует АСМ-изображение на рис. 2а. Шероховатость находится в пределах 30 нм, средняя высота рельефа на разных участках поверхности – 150–200 нм, максимальная высота – около 300 нм. Рельеф поверхности отражает следы деформации, а также наличие других артефактов процесса прокатки и последующей термообработки.
Рис. 2.
АСМ-изображения (а, б) и распределения высот рельефа поверхности (в, г) образца до (а, в) и после ФО (б, г).
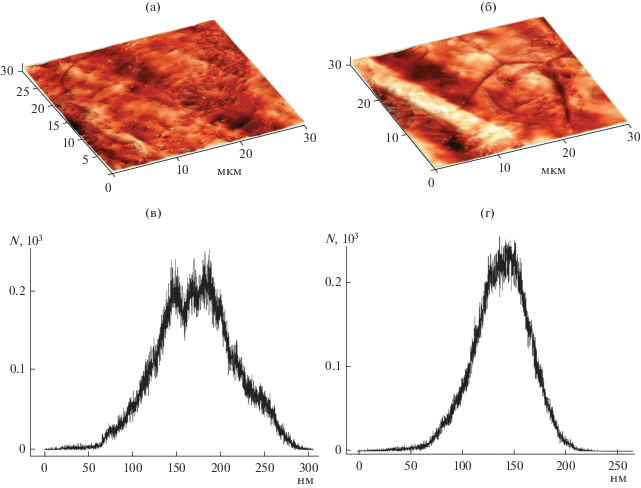
На рис. 2б приведены АСМ-сканы поверхности фольги после ФО. Шероховатость находится в пределах 40 нм, средняя высота рельефа на разных участках поверхности – 120–150 нм, максимальная высота – около 250 нм. Из сравнения рис. 2a и 2б можно сделать вывод, что ФО приводит к сужению распределения высот рельефа. Это свидетельствует об удалении части артефактов процесса прокатки с поверхности фольги.
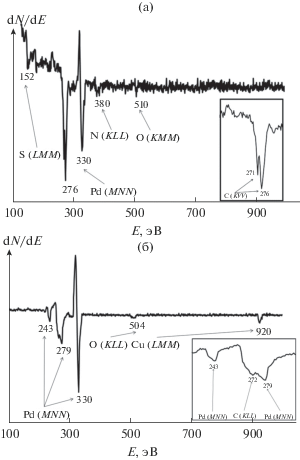
На оже-электронном спектре поверхности исходной фольги (рис. 3а) регистрируются переходы: LMM (152 эВ), соответствующий сере, KVV (271 и 276 эВ) – углероду, MNN (330 эВ) – палладию, KLL (380 эВ) – азоту, KVV (510 эВ) – кислороду. Расщепление линии углерода со смещением на 4 эВ от стандартного положения (272 эВ (KLL)) обусловлено тем, что углерод может находиться в форме нанокристаллического графита. Переходы, соответствующие атомам меди, не выявлены. Рассчитанный элементный состав приведен в табл. 1.
Таблица 1.
Элементный состав (ат. %) поверхности фольги до и после ФО
| Компонент | Pd | Cu | C | O | N | S |
| До ФО | 40 | 0 | 34 | 5 | 4 | 17 |
| После ФО | 42 | 47 | 7 | 4 | – | – |
Оже-электронный спектр поверхности фольги после ФО (рис. 3б) содержит переходы: MNN (330, 279, 243 эВ), соответствующий палладию, LMM (920 эВ) – меди, KLL (272 эВ) – углероду и KLL (504 эВ) – кислороду, что свидетельствует о практически полном удалении с поверхности артефактов проката.
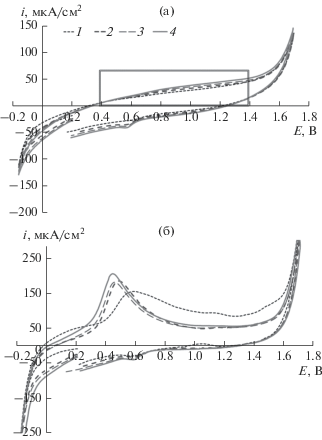
Из данных вольтамперометрии (рис. 4а) следует, что поверхность исходной Pd–Cu-фольги не чувствительна к циклированию потенциала, о чем свидетельствует отсутствие локального максимума в области потенциала 0.3–0.5 В, характеризующего процесс ионизации атомарного водорода. Большая часть центров адсорбции водорода блокирована продуктами сорбции, что проявляется небольшим перегибом на анодной ветви кривой в области потенциала 0.8–1.2 В [41]. Рассчитанный на основании этих данных коэффициент диффузии водорода имеет величину ≈3.5 × × 10–9 см2/с, а параметр водородопроницаемости – 2 × 10–9 моль/(см2 с1/2).
ФО приводит к ионизации водорода в первом циклировании при потенциале 0.6 В. При переходе от 1-го к 4-му циклу максимум тока увеличивается и смещается в область меньшего потенциала. Коэффициент диффузии увеличивается до D – 4.8 × 10–9 см2/с, а коэффициент водородопроницаемости увеличивается в 2 раза, достигая 4.1 × × 10–9 моль/(см2 с1/2), в результате разблокирования центров сорбции водорода на поверхности фольги.
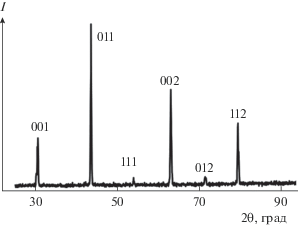
На рис. 5 приведена дифрактограмма полученного катализатора Ni0.2Cu0.8/Ce0.3Zr0.7O2 – δ. Линии сплава CuNi на рентгенограмме узкие, и размер области когерентного рассеяния для них составляет более 50 нм. При этом максимумы рефлексов сплава CuNi располагаются между позициями, характерными для индивидуальных образцов меди и никеля с кубической структурой. Рассчитанное значение параметра кубической элементарной ячейки для него составляет 3.6162 ± ± 0.0007 Å. Линии смешанного оксида оказываются существенно более широкими, что соответствует размеру области когерентного рассеяния 5.9 ± 0.08 нм. В то же время средний размер частиц образца, оцененный по значению удельной площади поверхности (43 ± 2 м2/г), составляет 140 нм. Поскольку в образцах катализатора доминирует оксид, характеризующийся гораздо меньшим размером частиц, они, по-видимому, образуют агломераты.
Проницаемость мембран по водороду. Необходимыми стадиями для прохождения водорода через мембрану являются: адсорбция его молекул на поверхности, диссоциация (часто эти стадии объединяют под названием диссоциативная адсорбция), проникновение в объем (растворение), диффузия и выход с поверхности. Если растворимость и диффузия полностью определяются природой сплава, из которого состоит мембрана, то первая и последняя стадии определяются состоянием поверхности. При прокатке на поверхности мембраны накапливаются продукты сорбции углерода. Кроме того, на ее поверхности происходит сорбция газов из окружающей среды. Значительная часть поверхности при этом исключается из процесса переноса. Поэтому можно ожидать, что ее очистка может привести к повышению проницаемости, аналогичному нанесению на мембрану поверхностных структур из палладия, существенно повышающих площадь поверхности, что описано, например, в работе [30].
Температурные зависимости проницаемости по водороду мембраны из сплава PdCu толщиной 20 мкм до и после двусторонней ФО показывают, что такая обработка позволяет существенно увеличить проницаемость мембраны по водороду при температурах до 320°С (рис. 6). Выше 350°С ее значения совпадали с таковыми для необработанной мембраны. Причем эффект повышения проницаемости тем больше, чем ниже температура проведения эксперимента. Отметим, что авторам [30] за счет электрохимического нанесения на поверхность столбиков палладия с сечением в виде “звездочек” также удалось повысить проницаемость мембран только при низких температурах. Очевидно, именно в этой области проницаемость мембран контролируется в первую очередь сорбционными процессами, тогда как при высоких температурах процесс лимитируется диффузией водорода в объеме образца.
Паровая конверсия метанола. Использование в катализе мембран с обработанной поверхностью должно повысить эффективность процессов, протекающих при сравнительно невысоких температурах. Именно поэтому был выбран процесс парового риформинга метанола (ПРМ). Основными продуктами ПРМ на катализаторе Ni0.2Cu0.8/Ce0.3Zr0.7O2 – δ являлись водород и диоксид углерода, образующиеся по реакции (2).
С ростом температуры выход водорода возрастает, достигая значений, соответствующих полному превращению метанола. В то же время повышение температуры способствует и более активному протеканию побочного процесса с образованием монооксида углерода (4), что приводит к понижению селективности ПРМ по водороду выше 350°С. Кроме того, примеси СО негативно влияют на эффективность процесса переноса водорода:
(4)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{OH}} \to 2{{{\text{H}}}_{2}} + {\text{CO}}, \\ \Delta {{H}_{{{\text{298 K}}}}} = + 92.0\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Проведены кинетические исследования активности катализатора Ni0.2Cu0.8/Ce0.3Zr0.7O2 – δ в процессе ПРМ в традиционном проточном реакторе с варьированием времени контакта. Выход водорода уменьшается с увеличением времени контакта (величины обратной скорости подачи метанола). Конверсия метанола, напротив, возрастала с ростом как времени контакта, так и температуры. Экспериментальные результаты удовлетворительно описываются формальным кинетическим уравнением первого порядка. По зависимости логарифма констант скорости ПРМ от обратной температуры была рассчитана кажущаяся энергия активации изучаемого процесса (64 ± 7 кДж/моль). Такие величины энергии активации типичны для процессов ПРМ, протекающих в кинетической области.
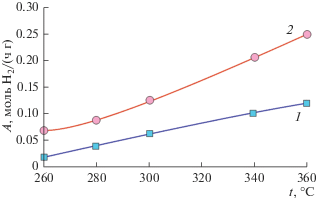
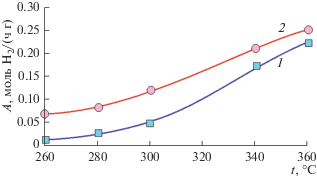
Использование реактора с очищенной мембраной из сплава PdCu позволяет заметно повысить выход водорода по сравнению с традиционным проточным реактором при использовании катализатора Ni0.2Cu0.8/Ce0.3Zr0.7O2 – δ (рис. 7). Причиной этого является смещение термодинамического равновесия за счет вывода из зоны реакции водорода, являющегося одним из основных продуктов реакции.
Рис. 7.
Температурные зависимости выхода водорода в традиционном реакторе (1) и суммарного выхода водорода при проведении процесса ПРМ в мембранном реакторе с катализатором Ni0.2Cu0.8/Ce0.3Zr0.7O2 – δ (2).
Следует заметить, что сам сплав PdCu имеет близкую природу и строение со сплавом NiCu, используемым в качестве катализатора, и также может ускорять процесс ПРМ. Для того чтобы определить возможный вклад собственной каталитической активности мембраны, процесс был проведен в том же реакторе без катализатора. При этом суммарный выход водорода в отсутствие катализатора оказался пренебрежимо малым и достигал значения 0.0038 моль Н2 на моль спирта при температуре 400°С, в то время как при проведении процесса ПРМ в мембранном реакторе в присутствии катализатора выход водорода повышался почти на порядок.
Это связано с меньшей поверхностью мембраны по сравнению с NiCu-катализатором (1.9 × 10–3 и 43 м2/г соответственно). Однако значимую роль играет и то, что используемый катализатор является композиционным и его активность во многом определяется сопряжением реакций, протекающих на поверхности металла и оксида. В связи с этим активность катализатора определяется сорбцией молекул воды и метанола на границах раздела катализатора и носителя [43]. Малая протяженность этих границ в силу наличия лишь точечных контактов обуславливает низкий вклад мембраны в каталитическую реакцию.
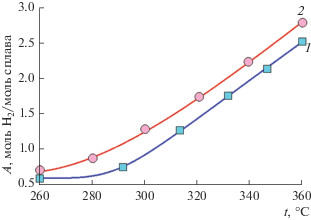
В наиболее явном виде эффект ФО поверхности мембраны проявляется при рассмотрении выхода высокочистого водорода, не содержащего примесей, в зоне пермеата при проведении процесса ПРМ в мембранном реакторе из сплава PdCu в присутствии катализатора Ni0.2Cu0.8/Ce0.3Zr0.7O2 – δ. В реакторе, содержащем мембрану с очищенной поверхностью, во всем диапазоне температур он оказался существенно выше, чем в реакторе с неочищенной мембраной (рис. 8). При этом если при 360°С выход высокочистого водорода повышался всего на 15%, то при 260°С выигрыш за счет ФО мембраны оказался пятнадцатикратным. Причиной этого является значительное различие величин проницаемости мембран по водороду при низких температурах и постепенное их сближение при высоких.
Рис. 8.
Температурные зависимости выхода водорода в зоне пермеата при проведении процесса ПРМ: на исходной мембране (1) и после ФО ее поверхности (2).
Стоит отметить, что с возрастанием скорости потока аргона, отводящего диффундирующий через мембрану водород, от 20 до 70 см3/мин происходит увеличение степени выведения чистого водорода и производительности по чистому водороду, которое оказывается более заметным при температурах до 350°С. При дальнейшем нагревании этот показатель понижается вследствие образования монооксида углерода, снижающего проницаемость мембраны. В силу того же фактора после проведения продолжительных каталитических экспериментов (10–15 ч) при температурах до 400°С проницаемость мембран по водороду может снижаться в 3–4 раза. В то же время после регенерации мембраны смесью водорода (5 об. %) с аргоном при 350°С в течение 2 ч водородопроницаемость возвращается к исходным значениям.
На основании изучения влияния температуры на водородопроницаемость был проведен расчет кажущейся энергии активации переноса водорода через мембрану. Полученные значения для мембран в процессе ПРМ оказались на 66% больше величины, полученной перед использованием мембраны в каталитическом реакторе (25 кДж/моль в процессе ПРМ и 15 кДж/моль перед катализом). Это также подтверждает наличие конкурентной адсорбции водорода и других продуктов реакции парового риформинга метанола (наиболее вероятно, СО) на входной поверхности мембраны, а также ее отравление образующимся монооксидом углерода.
Разумеется, процесс переноса водорода во многом зависит и от материала, из которого изготовлена мембрана. Поэтому представляло интерес сопоставить работу в процессе конверсии спиртов сплава PdCu с одним из лучших материалов для очистки водорода состава Pd–In(6%)–Ru(0.5%). Выход водорода в процессе парового риформинга в реакторе с данной мембраной оказался всего на 12% ниже, чем на PdCu с очищенной поверхностью. Однако выход чистого водорода в зоне пермеата практически во всем интервале температур оказался вдвое меньше (рис. 9). Таким образом, мембрана из сплава PdCu с поверхностью, очищенной ФО, показала существенно лучшие характеристики в процессе парового риформинга как с аналогичной мембраной с поверхностью, очищенной лишь промывкой спиртом, так и с мембраной из сплава Pd–In(6%)–Ru(0.5%).
ЗАКЛЮЧЕНИЕ
Полученные данные наглядно демонстрируют значимость очистки поверхности фольги из сплава PdCu с помощью ФО для процессов выделения высокочистого водорода. Максимальные преимущества полученных мембран достигаются при фильтрации водорода при сравнительно низких температурах. Эффективность процесса парового риформинга метанола можно существенно повысить посредством ФО поверхности мембраны излучением мощных импульсных ксеноновых ламп.
Предварительная очистка мембран позволяет не только существенно повысить проницаемость водорода при температурах до 320°С, но и добиться повышения выхода высокочистого водорода при осуществлении парового риформинга метанола в мембранном реакторе.
Список литературы
Widén J., Carpman N., Castellucci V., Lingfors D., Olauson J., Remouit F., Bergkvist M., Grabbe M., Waters R. Variability Assessment and Forecasting of Renewables: A Review for Solar, Wind, Wave and Tidal Resources // Renewable Sustainable Energy Rev. 2015. V. 44. P. 356–375. https://doi.org/10.1016/j.rser.2014.12.019
Yaroslavtsev A.B., Stenina I.A., Golubenko D.V. Membrane Materials for Energy Production and Storage // Pure Appl. Chem. 2020. V. 92. № 7. P. 1147–1157. https://doi.org/10.1515/pac-2019-1208
Kaur M., Pal K. Review on Hydrogen Storage Materials and Methods from an Electrochemical Viewpoint // J. Energy Storage. 2019. V. 23. P. 234–249. https://doi.org/10.1016/j.est.2019.03.020
Tsodikov M.V., Arapova O.V., Konstantinov G.I., Bukhtenko O.V., Ellert O.G., Nikolaev S.A., Vasil’kov A.Y. The Role of Nanosized Nikel Particles in Microwave-Assisted Dry Reforming of Lignin // Chem. Eng. J. 2017. V. 309. P. 628–637. https://doi.org/10.1016/j.cej.2016.10.031
Lytkina A.A., Orekhova N.V., Yaroslavtsev A.B. Catalysts for the Steam Reforming and Electrochemical Oxidation of Methanol // Inorg. Mater. 2018. V. 54. № 13. P. 1315–1329. https://doi.org/10.1134/S0020168518130034
World Energy Outlook. 2019. Paris: Int. Energy Agency, 2019. 860 p.
Tsodikov M.V., Kurdymov S.S., Konstantinov G.I., Murzin V.Y., Bukhtenko O.V., Maksimov Y.V. Core-Shell Bifunctionalcatalyst for Stream Methane Reforming Resistant to H2S: Sctivity and Structure Evolution // Int. J. Hydrogen Energy. 2015. V. 40. P. 2963–2970. https://doi.org/10.1016/j.ijhydene.2015.01.016
Sánchez-Bastardo N., Schlögl R., Ruland H. Methane Pyrolysis for CO2-Free H2 Production: A Green Process to Overcome Renewable Energies Unsteadiness // Chem. Ing. Tech. 2020. V. 92. P. 1596–1609. https://doi.org/10.1002/cite.202000029
Torres D., Pinilla J.L., Suelves I. Screening of Ni–Cu Bimetallic Catalysts for Hydrogen and Carbon Nanofilaments Production via Catalytic Decomposition of Methane Appl. Catal., A. 2018. V. 559. P. 10–19. https://doi.org/10.1016/j.apcata.2018.04.011
Ouyang M.Z., Boldrin P., Maher R.C., Chen X.L., Liu X.H., Cohen L.F., Brandon N.P. A Mechanistic Study of the Interactions between Methane and Nickel Supported on Doped Ceria // Appl. Catal., B. 2019. V. 248. P. 332–340. https://doi.org/10.1016/j.apcatb.2019.02.038
Pudukudy M., Yaakob Z., M. Jia Q., Takriff M.S. Catalytic Decomposition of Methane over Rare Earth Metal (Ce and La) Oxides Supported Iron Catalysts // Appl. Surf. Sci. 2019. V. 467–468. P. 236–248. https://doi.org/10.1016/j.apsusc.2018.10.122
Nishii H., Miyamoto D., Umeda Y., Hamaguchi H., Suzuki M., Tanimoto T., Harigai T., Takikawa H., Suda Y. Catalytic Activity of Several Carbons with Different Structures for Methane Decomposition and by-Produced Carbons // Appl. Surf. Sci. 2019. V. 473. P. 291–297. https://doi.org/10.1016/j.apsusc.2018.12.073
Pinaeva L.G., Noskov A.S., Parmon V.N. Prospects for the Direct Catalytic Conversion of Methane into Useful Chemical Products // Catal. Ind. 2017. V. 9. P. 283–298. https://doi.org/10.1134/S2070050417040067
He J., Yang Z., Zhang L., Li Y., Pan L. Cu Supported on ZnAl-LDHs Precursor Prepared by in-situ Synthesis Method on g-Al2O3 as Catalytic Material with High Catalytic Activity for Methanol Steam Reforming // Int. J. Hydrogen Energy. 2017. V. 42. P. 9930–9937. https://doi.org/10.1016/j.ijhydene.2017.01.229
Águila G., Jiménez J., Guerrero S., Gracia F., Chornik B., Quinteros S., Araya P. A Novel Method for Preparing High Surface Area Copper Zirconia Catalysts. Influence of the Preparation Variables // Appl. Catal., A. 2009. V. 360. P. 98–105.
Sá S., Hugo S., Brandão L., José M.S., Adélio M. Catalysts for Methanol Steam Reforming–A Review // Appl. Catal., B. 2010. V. 99. P. 43–57.
Jones S.D., Neal L.M., Hagelin-Weaver H.E. Steam Reforming of Methanol Using Cu–ZnO Catalysts Supported on Nanoparticle Alumina // Appl. Catal., B. 2008. V. 84. P. 631–642.
Conant T., Karim A.M., Lebarbier V., Wang Y., Girgsdies F., Schlögl R., Datye A. Stability of Bimetallic Pd–Zn Catalysts for the Steam Reforming of Methanol // J. Catal. 2008. V. 257. P. 64–70.
Amjad U., Vita A., Galletti C., Pino L., Specchia S. Comparative Study on Steam and Oxidative Steam Reforming of Methane with Noble Metal Catalysts // Ind. Eng. Chem. Res. 2013. V. 52. P. 15428–15436. https://doi.org/10.1021/ie400679h
Lytkina A.A., Orekhova N.V., Ermilova M.M., Belenov S.V., Guterman V.E., Efimov M.N., Yaroslavtsev A.B. Bimetallic Carbon Nanocatalysts for Methanol Steam Reforming in Conventional and Membrane Reactors // Catal. Today. 2016. V. 268. P. 60–67. https://doi.org/10.1016/j.cattod.2016.01.003
Wang L.-C., Liu Q., Chen M., Liu Y.-M., Cao Y., He H.-Y., Fan K.-N. Structural Evolution and Catalytic Properties of Nanostructured Cu/ZrO2 Catalysts Prepared by Oxalate Gel-Coprecipitation Technique // J. Phys. Chem. 2007. V. 111. P. 16549–16557. https://doi.org/10.1021/jp075930k
Lytkina A.A., Orekhova N.V., Ermilova M.M., Yaroslavtsev A.B. The Influence of the Support Composition and Structure (MxZr1 –xO2 –d) of Bimetallic Catalysts on the Activity in Methanol Steam Reforming // Int. J. Hydrogen Energy. 2018. V. 43. P. 198–207. https://doi.org/10.1016/j.ijhydene.2017.10.182
Ockwig N.W., Nenoff T.M. Membranes for Hydrogen Separation// Chem. Rev. 2007. V. 107. № 10. P. 4078–4110.
Briceño K., Montanè D., Garcia-Valls R., Iulianelli A., Basile A. Fabrication Variables Affecting the Structure and Properties of Supported Carbon Molecular Sieve Membranes for Hydrogen Separation // J. Membr. Sci. 2012. V. 415. P. 288–297. https://doi.org/10.1016/j.memsci.2012.05.015
Sazali N., Mohamed M.A., Salleh W.N.W. Membranes for hydrogen separation: a significant review // Int. J. Adv. Manuf. Technol. 2020. V. 107. P. 1859–1881. https://doi.org/10.1007/s00170-020-05141-z
Fernandez E., Medrano J.A., Melendez J., ParcoM., Viviente J.L., Van Sint Annaland M., Gallucci F., Pacheco Tanaka D.A. Preparation and Characterization of Metallic Supported Thin Pd–Ag Membranes for Hydrogen Separation // Chem. Eng. J. 2016. V. 305. P. 182–190. https://doi.org/10.1016/j.cej.2015.09.119
Zhao C., Sun B., Jiang J., Xu W. H2 Purification Process with Double Layer bcc-PdCu Alloy Membrane at Ambient Temperature // Int. J. Hydrogen Energy. 2020. V. 45. P. 17540–17547. https://doi.org/10.1016/j.ijhydene.2020.04.250
Иевлев В.М., Прижимов А.С., Донцов А.И. Структура межфазной границы alfa-betta в твердом растворе PdCu// Физика твердого тела. 2020. Т. 62. № 1. С. 53–58.
Lee S.M., Xu N., Kim S.S., Li A., Grace J. R., Lim J.C., Boyd T., Ryi S.K., Susdorf A., Schaadt A. Palladium/Ruthenium Composite Membrane for Hydrogen Separation from the Off-Gas of Solar Cell Production via Chemical Vapor Deposition // J. Membr. Sci. 2017. V. 541. P. 1. https://doi.org/10.1016/j.memsci.2017.06.093
Petriev I.S., Lutsenko I.S., Voronin K.A., Pushankina P.D., Baryshev M.G. Hydrogen Permeability of Surface-Modified Pd-Ag Membranes at Low Temperatures. IOP Conf. Ser.: Mater. Sci. Eng. 2020. 791 012058.
Иевлев В.М., Донцов А.И., Морозова Н.Б., Рошан Н.Р., Сербин О.В., Прижимов А.С., Солнцев К.А. Способы очистки поверхности мембранной фольги твердых растворов на основе палладия // Неорган. материалы. 2020. Т. 56. № 10. С. 1117–1122. https://doi.org/10.31857/S0002337X2010005X
Басов Н.Л., Ермилова М.М., Орехова Н.В., Ярославцев А.Б. Мембранный катализ в процессах дегидрирования и производства водорода // Успехи химии. 2013. Т. 82. № 4. С. 352–368.
Helmi A., Fernandez E., Melendez J., Tanaka D.A.P., Gallucci F., van Sint Annaland M. Fluidized Bed Membrane Reactors for Ultra Pure H2 Production–A Step forward towards Commercialization // Molecules. 2016. V. 21. № 376. https://doi.org/10.3390/molecules21030376
Franchi G., Capocelli M., De Falco M., Piemonte V., Barba D. Hydrogen Production via Steam Reforming: A Critical Analysis of MR and RMM // Membranes. 2020. V. 10. № 10. https://doi.org/10.3390/membranes10010010
Liguori S., Iulianelli A., Dalena F., Piemonte V., Huang Y., Basile A. Methanol steam reforming in an Al2O3 Supported thin Pd-Layer Membrane Reactor over Cu/ZnO/Al2O3 Catalyst // Int. J. Hydrogen Energy. 2014. V. 39. P. 18702–18710. https://doi.org/10.1016/j.ijhydene.2013.11.113
Mironova E.Yu., Lytkina A.A., Ermilova M.M., Efimov M.N., Zemtsov L.M., Orekhova N.V., Karpacheva G.P., Bondarenko G.N., Yaroslavtsev A.B., Muraviev D.N. Ethanol and Methanol Steam Reforming on Transition Metal Catalysts Supported on Detonation Synthesis Nanodiamonds for Hydrogen Production // Int. J. Hydrogen Energy. 2015. T. 40. № 8. C. 3557–3565. https://doi.org/10.1016/j.ijhydene.2014.11.082
Piskin F., Öztürk T. Combinatorial Screening of Pd–Ag–Ni Membranes for Hydrogen Separation // J. Membr. Sci. 2017. V. 524. P. 631–636. https://doi.org/10.1016/j.memsci.2016.11.066
Иевлев В.М., Донцов А.И., Белоногов Е.К., Канныкин С.В., Солнцев К.А. Превращения α ⇆ β в фольге твердого раствора Pd–57Cu (ат. %), полученной способом прокатки// Неорган. материалы. 2017. Т. 53. № 11. С. 1181–1188. https://doi.org/10.7868/S0002337X17110082
Стенина И.А., Воропаева Е.Ю., Вересов А.Г., Капустин Г.И., Ярославцев А.Б. Влияние величины pH осаждения и термообработки на свойства гидратированного оксида циркония // Журн. неорган. химии. 2008. Т. 53. № 3. С. 397–403.
Uluc A.V., Moa J.M.C., Terryn H., Böttger A.J. Hydrogen Sorption and Desorption Related Properties of Pd-Alloys Determined by Cyclic Voltammetry // J. Electroanal. Chem. 2014. V. 734. P. 53–60. https://doi.org/10.1016/j.jelechem.2014.09.021
Wvarezza R.C., Montemayor M.C., Fatas E. Electrochemical Study of Hydrogen Absorption in Polycrystalline Palladium // J. Electroanal. Chem. 1991. V. 313. P. 291–301.
Морозова Н.Б., Введенский А.В., Максименко А.А., Донцов А.И. Токнослойная многоцикловая катодно-анодная хроноамперометрия процессов инжекции/экстракции атомарного водорода в металл с учетом стадии фазограничного обмена // Электрохимия. 2018. Т. 54. № 4. С. 395–407. https://doi.org/10.7868/S0424857018040023
Стенина И.А., Ярославцев А.Б. Границы раздела в материалах для водородной энергетики // Мембраны и мембранные технологии. 2019. Т. 9. № 3. С. 165–173. https://doi.org/10.1134/S2218117219030064
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы