Неорганические материалы, 2021, T. 57, № 8, стр. 838-845
Ионоселективные свойства KxV2O5 · nH2O
Н. В. Подвальная 1, *, Г. С. Захарова 1
1 Институт химии твердого тела УрО Российской академии наук
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: podnat@inbox.ru
Поступила в редакцию 21.12.2020
После доработки 19.03.2021
Принята к публикации 22.03.2021
Аннотация
Методом гидролитического осаждения с использованием VOSO4 ∙ 3H2O и НCl синтезированы соединения с общей формулой ${{{\text{K}}}_{x}}{\text{V}}_{х}^{{{\text{4}} + }}{\text{V}}_{{{\text{2}} - х}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (0.1 ≤ х ≤ 0.33, 0.2 ≤ n ≤ 0.5). В присутствии гидрата сульфата ванадила при молярном отношении 0.1 ≤ KVO3/VOSO4 · 3H2O ≤ 1.0 формируется ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ характеризующийся максимальным содержанием четырехвалентного ванадия. Синтезированные соединения предложены в качестве электродного материала твердофазных ионоселективных электродов. Наилучшими характеристиками обладает электрод с мембраной на основе ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ проявляющей чувствительность к катионам калия в интервале 1 ≤ ${\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}$ ≤ 4 с угловым коэффициентом калибровочной кривой 56 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}} \right. \kern-0em} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}$ при 3.6 ≤ рН ≤ 7.0. Определены коэффициенты селективности электродов в ряду одно-, двух- и трехзарядных катионов.
ВВЕДЕНИЕ
Ионоселективные электроды широко применяются в различных областях промышленности, науке, медицине, сельском хозяйстве, при мониторинге окружающей среды [1, 2]. Классический ионоселективный электрод состоит из цилиндрического корпуса с сенсорной мембраной, внутреннего электрода сравнения и внутреннего раствора с постоянной концентрацией определяемого иона. Потенциал электрода, возникающий за счет обмена ионами между исследуемым раствором и мембраной электрода, пропорционален концентрации определяемого иона в растворе. Для улучшения эксплуатационных свойств ионоселективных электродов в последнее десятилетие были разработаны твердоконтактные электроды, в которых ионоселективная мембрана непосредственно наносится на поверхность инертного материала с электронной проводимостью. В качестве инертного материала в таких электродах используют платину, золото, графит и др. [3].
Важное место среди ионоселективных электродов занимают электроды с мембранами на основе ионофоров, селективно связывающих ионы в растворах и делающих мембраны проницаемыми по отношению к определяемому иону [4]. В составе мембран традиционных калийселективных электродов используется ионофор валиномицин C54H90N6O18, позволяющий определять содержание ионов калия в растворах в интервале 1 ≤ ${\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}$ ≤ 5 с угловым коэффициентом 57.3 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}} \right. \kern-0em} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}$ [5]. Высокая селективность к ионам калия достигается благодаря соответствию ионного радиуса K+ размеру макроцикла валиномицина. Введение в состав мембраны на основе валиномицина многослойных углеродных нанотрубок приводит к увеличению интервала чувствительности к ионам калия (1 ≤ ${\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}$ ≤ 6) [6]. Однако валиномицин относится к биологически токсичным веществам, а электроды на его основе поглощают воду из растворов, что вызывает нестабильность потенциала в процессе эксплуатации электрода. Поэтому в настоящее время активно продолжается поиск новых ионоселективных материалов для определения ионов калия в растворе.
В качестве электродноактивного вещества предложен гексацианоферрат(III) кобальта-калия KxCoy[Fe(CN)6], применение которого позволяет определять концентрацию ионов калия в растворе в интервале 1 ≤ ${\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}$ ≤ 5 с угловым коэффициентом 48–54 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}} \right. \kern-0em} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}$ [7]. Более широкий интервал чувствительности к ионам калия (1 ≤ ≤ ${\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}$ ≤ 6) достигается при использовании в составе мембраны каликсарена 1,3-(ди-4-оксибутанол)-каликс [4]арен-краун-5, при этом угловой коэффициент равен 51 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}} \right. \kern-0em} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}$ [8]. Новым подходом к улучшению характеристик ионоселективных электродов является применение в качестве электродноактивного вещества термодинамически стабильных оксидных соединений переходных металлов. Так, использование MoO3 [9] и KSr2Nb5O15 [10] в составе мембраны позволяет увеличить селективность и уменьшить время отклика калийселективных электродов. В качестве электродноактивных веществ предложены безводные фазы внедрения MxV2O5 (M – Li, Na, K, Cs, Ca и др.) [11], кристаллографические особенности структуры которых создают благоприятные условия для процессов интеркаляции/деинтеркаляции катионов [12].
Наиболее привлекательными ионоселективными материалами являются соединения на основе гидратированного пентаоксида ванадия V2O5 · nH2O [13], отличающиеся подвижной квазиодномерной слоистой структурой, в межслоевом пространстве которой находятся молекулы воды и гидратированные катионы [14]. Большая интеркаляционная емкость данных соединений обеспечивается отрицательным зарядом ванадий-кислородных слоев. Интеркаляция катионов приводит лишь к изменению межслоевого расстояния без изменения структуры гидратов на основе V2O5 · nH2O. Высокая подвижность катионов также достигается за счет их движения по сетке водородных связей из молекул воды.
Цель настоящей работы – исследование ионоселективных свойств гидратированной фазы внедрения KxV2O5 · nH2O, отличающeйся различным содержанием ионов четырехвалентного ванадия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали метаванадат калия KVO3, гидрат сульфата ванадила VOSO4 ∙ 3H2O, соляную кислоту НCl квалификации не ниже “х. ч.”. Соединения KxV2O5 · nH2O получали методом гидролитического осаждения из 0.02–0.15 М растворов KVO3 при температуре 80°С в течение 2 ч. Требуемое значениe рН раствора устанавливали гидратом сульфата ванадила, варьируя молярным соотношением 0.1 ≤ KVO3/ VOSO4 · 3H2O ≤ 3.0. В результате образовывался темно-зеленый осадок, который отфильтровывали, промывали водой и сушили на воздухе при комнатной температуре. Также для сравнения методом гидролитического осаждения с использованием соляной кислоты для создания рН реакционной среды синтезировали KxV2O5 · nH2O. Кислотность среды изменяли в интервале 1 ≤ рН ≤ 2.
Содержание ионов калия определяли методом атомной абсорбционной спектроскопии в пламени ацетилен + воздух на приборе Perkrin–Elmer. Определение суммарного содержания ванадия проводили титрованием солью Мора в присутствии фенилантраниловой кислоты, концентрации ванадия(IV) – перманганатом калия. Рентгенофазовый анализ образцов выполняли на дифрактометре Shimadzu XRD 7000. Исследования образцов методом ИК-Фурье-спектроскопии проводили на спектрометре Spectrum Оne (Perkin–Elmer). Текстурные характеристики (удельную поверхность, пористость) определяли методом низкотемпературной адсорбции азота на анализаторе Gemini VII (Micromeritics). Морфологию образцов изучали на сканирующем электронном микроскопе (СЭМ) JEOL JSM 6390 LA, совмещенном с энергодисперсионным рентгеновским анализатором EX-23010BU. Термогравиметрический анализ выполняли на воздухе на термоанализаторе STA 449 F3 Jupiter (Netzsch).
Электроды на основе KxV2O5 · nH2O были изготовлены согласно методике [9]. Измерение потенциала проводили иономером И-130.2М в режиме вольтметра с точностью ±1 мВ в растворах хлорида калия концентрацией 10–1–10–5 моль/л. Для определения коэффициентов селективности использовали метод непрерывных растворов [15].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Методом гидролитического осаждения с использованием VOSO4 ∙ 3H2O и НCl синтезирован KxV2O5 · nH2O, изоструктурный гидратированному оксиду ванадия(V) V2O5 · nH2O [16]. В присутствии VOSO4 ∙ 3H2O в зависимости от молярного соотношения KVO3/VOSO4 · 3H2O образуется KxV2O5 · nH2O с различным содержанием четырехвалентного ванадия. Соединение состава ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ характеризующееся максимальным содержанием четырехвалентного ванадия, формируется при 2.8 ≤ рН ≤ 3.0 и 0.1 ≤ ≤ KVO3/VOSO4 · 3H2O ≤ 1.0. При молярном отношении 1.0 < KVO3/VOSO4 · 3H2O ≤ 3.0 и рН ∼ 3.2 количество четырехвалентного ванадия в осадках ${{{\text{K}}}_{x}}{\text{V}}_{х}^{{{\text{4}} + }}{\text{V}}_{{{\text{2}} - х}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ изменяется в пределах 0.25 ≤ ≤ x ≤ 0.29. Использование HCl в процессе синтеза ванадатов гидролитическим методом осаждения является традиционным подходом. При этом образуются ванадаты калия, содержание четырехвалентного ванадия в которых значительно меньше по сравнению с образцами, полученными в присутствии VOSO4 · 3H2O. Установлено, что в системе KVO3–HCl–H2O с уменьшением рН раствора содержание четырехвалентного ванадия в осадках также уменьшается. При рН 1 формируется ванадат состава ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$ Содержание воды в KxV2O5 · nH2O зависит от относительной влажности воздуха и, согласно данным термогравиметрического анализа, изменяется в пределах 0.1 ≤ n ≤ 0.7. Следует отметить, что наибольшее содержание воды наблюдается в образцах с максимальным содержанием четырехвалентного ванадия.
Дифрактограммы ванадатов KxV2O5 · nH2O, полученных с использованием гидрата сульфата ванадила и соляной кислоты, и структурного аналога V2O5 ⋅ nH2O представлены на рис. 1. Соединения кристаллизуются в моноклинной сингонии (пр. гр. С12/m1) с параметрами кристаллической решетки, представленными в табл. 1. Рассчитанные значения хорошо согласуются с данными для гидратированного оксида ванадия(V) (ICSD № 74-3093). Аналогично V2O5 ⋅ nH2O на дифрактограммах ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ имеются рефлексы 00l, подтверждающие их слоистое строение. Наличие рефлексов hkl в образцах свидетельствует о частичной потере слоистой ориентации V–O-слоев при внедрении K+ в межслоевое пространство. Подобное разупорядочение слоистой структуры наблюдается при интеркаляции V2O5 ⋅ nH2O катионами ${\text{NH}}_{4}^{ + }$ [17], Na+, тетраметиламмония (CH3)4N+ [18] и K+ [19]. Величина межслоевого расстояния в ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (d00l = 10.973 Å) меньше аналогичной величины для ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (d00l = 11.171 Å). Вероятно, это связано с увеличением электростатического взаимодействия катионов калия, расположенных в межслоевом пространстве, c отрицательно заряженными V–O-слоями ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ отличающегося высоким содержанием K+ [20]. Межслоевое расстояние в синтезированных соединениях KxV2O5 · nH2O меньше межслоевого расстояния в V2O5 ⋅ 1.6H2O, равного 11.57 Å [21]. Очевидно наличие конкурирующего влияния на величину межслоевого расстояния электростатического взаимодействия между катионами K+ и отрицательно заряженными V–O-слоями, приводящего к уменьшению межслоевого расстояния, и степени гидратации, вызывающей его увеличение.
Рис. 1.
Дифрактограммы порошков ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1), ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (2) и позиции брэгговских пиков V2O5 ∙ nH2O по данным ICSD (No. 74-3093).
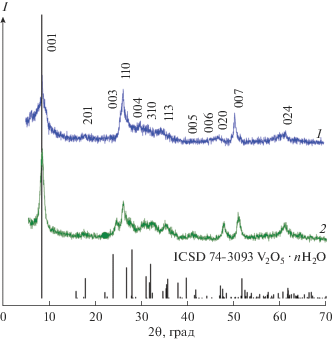
Таблица 1.
Параметры элементарной ячейки KxV2O5 · nH2O и V2O5 · nH2O (ICSD № 74-3093)
| Фаза | a, Å | b, Å | c, Å | β, град | V, Å3 |
|---|---|---|---|---|---|
| ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | 11.323(2) | 3.599(6) | 10.973(9) | 99.45 | 441.21(3) |
| ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ | 11.565(1) | 3.613(2) | 11.171(4) | 92.50 | 466.38(2) |
| V2O5 · nH2O (ICSD № 74-3093) | 11.722 | 3.57 | 11.52 | 88.65 | 481.95 |
Оценка среднего размера кристаллитов KxV2O5 · · nH2O с различным содержанием четырехвалентного ванадия была проведена с использованием уравнения Шеррера
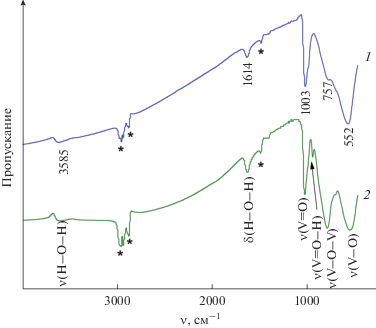
где D – размер кристаллитов, k – безразмерный коэффициент формы частиц (постоянная Шеррера), β – ширина пика на половине его высоты, ${{\theta }}$ – брэгговский угол, λ – длина волны рентгеновского излучения. Расчет вели по интенсивным и хорошо разрешенным пикам 00l. Средний размер кристаллитов ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ равен ~5 и 9 нм соответственно. Увеличение размера частиц при формировании KxV2O5 · nH2O в сильно кислой среде, вероятно, обусловлено процессами агрегации частиц под действием HCl, являющейся более сильным электролитом по сравнению с VOSO4 ∙ 3H2O [22].ИК-спектры полученных соединений в области колебаний V–O-связей подобны спектрам ксерогелей V2O5 ⋅ 1.6H2O [23] и KxV2O5 · 3H2O [24] (рис. 2). В области 3560–3585 см–1 наблюдаются полосы, характерные для валентных колебаний молекул воды. Полосы деформационных колебаний кристаллогидратной воды проявляются при ~1614 см–1. В ИК-спектре ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ отличающегося максимальным содержанием четырехвалентного ванадия, отсутствует характерная полоса поглощения при ~924 см–1, ответственная за валентные колебания связей V…OН [25]. Эти данные свидетельствуют о частичном переходе ионов ванадия(IV) из ванадий-кислородных слоев в межслоевое пространство в виде ванадил-ионов VO2+ [12].
Рис. 2.
ИК-спектры порошков ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1) и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (2) (звездочкой обозначены полосы вазелинового масла).
Электронно-микроскопические исследования показали, что KxV2O5 · nH2O, полученный с использованием гидрата сульфата ванадила, образован частицами стержневой морфологии диаметром 40–70 нм и длиной 0.5–1.5 мкм, агломерированными в ансамбли, подобные цветам диаметром 2–3 мкм (рис. 3а). Порошок KxV2O5 · nH2O, синтезированный в присутствии соляной кислоты, формируется в виде частиц неправильной формы, состоящих из сросшихся пластин и стержней размером до 10 мкм (рис. 3б). Очевидно, что морфология продуктов гидролиза зависит от условий получения KxV2O5 · nH2O и определяется содержанием четырехвалентного ванадия в образцах. Чистота синтезированных продуктов и отсутствие каких-либо посторонних примесей подтверждены энергодисперсионным рентгеновским микроанализом (рис. 3в).
Рис. 3.
СЭМ-изображения ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}{\text{.2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (а), ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (б) и спектр рентгеновского энергодисперсионного микроанализа ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (в) (дополнительный пик от углерода обусловлен подложкой, применяемой для фиксации образца).

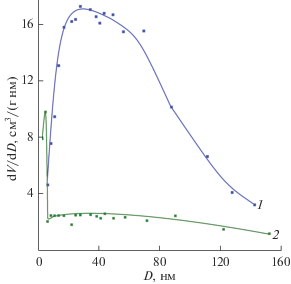
Согласно результатам исследования низкотемпературной адсорбции азота, удельная поверхность образцов ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ равна 19.5 и 1.0 м2/г соответственно. Полученные результаты хорошо согласуются с размером кристаллитов указанных соединений. Широкое распределение пор по размерам для ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (от 18 до 75 нм) свидетельствует о наличии мезо- и макропор в структуре соединения (рис. 4). Для ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ преимущественный размер пор лежит в узком интервале и равен ~4 нм. Очевидно, что текстурные свойства KxV2O5 · nH2O зависят от типа используемого реагента (HCl или VOSO4 · 3H2O), участвующего в реакции гидролитического осаждения с последующей кристаллизацией продукта синтеза.
Рис. 4.
Кривые распределения пор по размерам для соединений ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1) и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$(2).
Соединения KxV2O5 · nH2O с различным содержанием четырехвалентного ванадия исследовали в качестве электродноактивного вещества для определения концентрации ионов калия в растворе. Зависимости потенциалов электродов ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (электрод I) и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (электрод II) от величины рН раствора представлены на рис. 5а. Установлено, что потенциал электрода I практически не реагирует на изменение концентрации ионов водорода в растворе в интервале 3.6 ≤ рН ≤ 7.0. При использовании электрода II постоянный потенциал системы наблюдается в более узком диапазоне 5.0 ≤ рН ≤ 6.0. Вероятно, сужение рабочего интервала рН для электрода II обусловлено диффузионными затруднениями ионов калия при его интеркаляционных взаимодействиях с ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O,}}$ обладающим менее развитой удельной поверхностью. Исследование чувствительности к ионам калия электродов на основе KxV2O5 · nH2O проводили при рН 6.0, где слабо выражена зависимость его потенциала от кислотности среды. Электроды I и II проявляют ионоселективные свойства в интервале 1 ≤ ${\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}$ ≤ ≤ 4 с угловыми коэффициентами калибровочных кривых, равными 56 и 50 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}} \right. \kern-0em} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}$ соответственно (рис. 5б). Полученные результаты свидетельствуют о том, что угловой коэффициент калибровочных кривых зависит от содержания четырехвалентного ванадия в образцах, повышенное содержание которого приводит к формированию соединений KxV2O5 · nH2O с развитой удельной поверхностью, наличию мезо- и макропор, снимающих диффузионные затруднения K+ в процессах интеркаляции/деинтеркаляции. Потенциал исследуемой системы определяется следующей реакцией, описывающей образование твердого раствора внедрения:
(2)
$\begin{gathered} {{{\text{K}}}_{x}}{\text{V}}_{х}^{{{\text{4}} + }}{\text{V}}_{{{\text{2}} - х}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + z{{{\text{K}}}^{ + }} + z{{{\text{e}}}^{ - }} \leftrightarrow \\ \leftrightarrow {{{\text{K}}}_{{x + z}}}{\text{V}}_{х}^{{{\text{4}} + }}{\text{V}}_{{{\text{2}} - х}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Рис. 5.
Зависимости потенциала электродов на основе ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (1) и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (2) от рН раствора (a), концентрации ионов калия при рН 6 (б) и времени выдержки в растворах хлорида калия с концентрацией 10–3 моль/л (в).
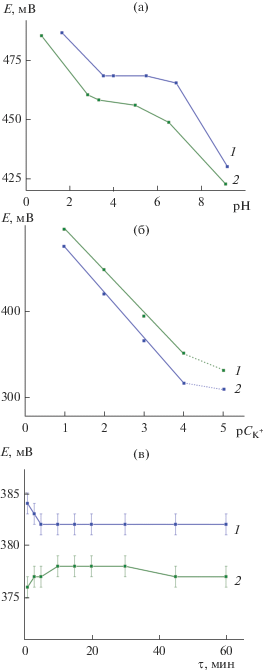
Установлено, что время установления стационарного потенциала составляет ~1 мин и изменяется только в пределах ошибки измерений (рис. 5в).
Для установления влияния посторонних ионов на селективность изучаемых электродов были определены значения потенциометрических коэффициентов селективности $\left( {{{K}_{{{{{\text{K}}}^{ + }}{\text{/}}{{{\text{M}}}^{{n + }}}}}}} \right)$ в присутствии мешающих катионов (табл. 2). Мешающие катионы по степени их влияния на работу электродов можно расположить в следующей последовательности:
Таблица 2.
Значения потенциометрических коэффициентов селективности $\left( {{{K}_{{{{{{{\text{K}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{K}}}^{ + }}} {{{{\text{M}}}^{{n + }}}}}} \right. \kern-0em} {{{{\text{M}}}^{{n + }}}}}}}}} \right)$ электродов на основе ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (электрод I) и ${{{\text{K}}}_{{{\text{0}}{\text{.1}}}}}{\text{V}}_{{{\text{0}}{\text{.1}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.9}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.5{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ (электрод II)
| Элек-трод | ${{K}_{{{{{{{\text{K}}}^{ + }}} \mathord{\left/ {\vphantom {{{{{\text{K}}}^{ + }}} {{{{\text{M}}}^{{n + }}}}}} \right. \kern-0em} {{{{\text{M}}}^{{n + }}}}}}}}$ | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Li+ | Na+ | Rb+ | Cs+ | Co2+ | Cu2+ | Ni2+ | Ca2+ | Ba2+ | Sr2+ | Al3+ | |
| I | 7.9 × 10–3 | 1.0 × 10–2 | 1.0 × 10–2 | 1.4 × 10–2 | 1.6 × 10–2 | 1.7 × 10–2 | 1.8 × 10–2 | 2.2 × 10–2 | 2.5 × 10–2 | 2.5 × 10–2 | 2.6 × 10–2 |
| II | 7.0 × 10–3 | 1.2 × 10–2 | 1.6 × 10–2 | 1.6 × 10–2 | 1.8 × 10–2 | 2.5 × 10–2 | 2.7 × 10–2 | 1.7 × 10–2 | 1.6 × 10–2 | 2.5 × 10–2 | 3.3 × 10–2 |
Al3+ > Sr2+ = Ba2+ > Ca2+ > Ni2+ > Co2+ > Cu2+ > > Cs+ > Rb+ = Na+ > Li+ (электрод I),
Al3+ > Ni2+ > Sr2+ = Cu2+ > Co2+ > Ca2+ > Ba2+ > > Cs+ = Rb+ > Na+ > Li+ (электрод II).
Электроды на основе KxV2O5 · nH2O селективны к ионам калия в присутствии однозарядных катионов и умеренно селективны в случае двух- и трехзарядных катионов. Исследования ионоселективных свойств позволили установить, что электрод на основе ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ обладает лучшими электродными характеристиками (угловой коэффициент калибровочной кривой 56 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}} \right. \kern-0em} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}$), определяемыми текстурными свойствами соединений.
ЗАКЛЮЧЕНИЕ
Показано, что в зависимости от типа используемого вещества, создающего требуемую кислотность реакционной массы для осуществления процесса гидролитического осаждения с последующей кристаллизацией продукта реакции, образуются гидратированные фазы внедрения с общей формулой ${{{\text{K}}}_{x}}{\text{V}}_{х}^{{{\text{4}} + }}{\text{V}}_{{{\text{2}} - х}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ с широкой областью гомогенности по ионам калия и четырехвалентного ванадия, различающиеся морфологией и текстурными свойствами. Гидрат сульфата ванадила, применяемый для установления требуемой величины рН раствора, дополнительно выполняет роль источника четырехвалентного ванадия, что позволяет синтезировать образцы KxV2O5 · nH2O с его повышенным содержанием. Предложенный метод синтеза является простым и низкозатратным. Установлено, что KxV2O5 · nH2O может быть использован в качестве электродного материала при изготовлении твердофазных ионоселективных электродов.
Применение ${{{\text{K}}}_{{{\text{0}}{\text{.33}}}}}{\text{V}}_{{{\text{0}}{\text{.33}}}}^{{{\text{4}} + }}{\text{V}}_{{{\text{1}}{\text{.67}}}}^{{{\text{5}} + }}{{{\text{O}}}_{{\text{5}}}} \cdot {\text{0}}.2{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ в составе мембраны позволяет определять содержание ионов калия в растворе в интервале 1 ≤ ${\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}$ ≤ 4 с угловым коэффициентом калибровочной кривой 56 ${{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}} \right. \kern-0em} {{\text{р}}{{С}_{{{{{\text{K}}}^{ + }}}}}}}.$
Список литературы
Crespo G.A. Recent Advances in Ion-Selective Membrane Electrodes for in Situ Environmental Water Analysis // Electrochim. Acta. 2017. V. 245. P. 1023–1034. https://doi.org/10.1016/j.electacta.2017.05.159
Babacka J., Ivaska A., Lewenstram A. Potentiometric Ion Sensors // Chem. Rev. 2008. V. 108. P. 329–351. https://doi.org/10.1021/cr068100w
Michalska A. All-Solid-State Ion Selective and All-Solid-State Reference Electrodes // Electroanalysis. 2012. V. 24. P. 1253–1265. https://doi.org/10.1002/elan.201200059
Михельсон К.Н., Пешкова М.А. Химические сенсоры на основе ионофоров: достижения и перспективы // Успехи химии. 2015. Т. 84. № 6. С. 555–578. https://doi.org/10.1070/RCR4506
Van de Velde L., D’Angremont E., Olthuis W. Solid Contact Potassium Selective Electrodes for Biomedical Applications – a Review // Talanta. 2016. V. 160. P. 56–65.https://doi.org/10.1016/j.talanta.2016.06.050
Mousavi Z., Teter A., Lewenstam A., Maj-Zurawska M., Ivaska A., Bobacka J. Comparison of Multi-Walled Carbon Nanotubes and Poly(3-octylthiophene) as Ion-to-Electron Transducers in All-Solid-State Potassium Ion-Selective Electrodes // Electroanalysis. 2011. V. 23. P. 1352–1358. https://doi.org/10.1002/elan.201000747
Gao Z., Zhou X., Wang G., Li P., Zhao Z. Potassium Ion-Selective Electrode Based on a Cobalt(II) – Hexacyanoferrate Film-Modified Electrode // Anal. Chim. Acta. 1991. V. 244. P. 39–48. https://doi.org/10.1016/S0003-2670(00)82476-9
Zine N., Bausells J., Vocanon F., Lamartine R., Asfari Z., Teixidor F., Crespo E., Oliveira I.M., Samitier J., Errachid A. Potassium-ion Selective Solid Contact Microelectrode Based on a Novel 1,3-(di-4-oxabutanol)-calix[4]arene-crown-5 Neutral Carrier // Electrochim. Acta. 2006. V. 51. P. 5075–5079. https://doi.org/10.1016/j.electacta.2006.03.060
Zakharova G.S., Fattakhova Z.A., Zhu Q., Enyashin A.N. Ion Sensor Activity of α-MoO3 Prepared Using Microwave-Assisted Hydrothermal Synthesis // J. Elecrtoanal. Chem. 2019. V. 840. P. 187–192. https://doi.org101016/j.jelechem.2019.03.072
Teixeiraa M.F.S., Freitasa B.H., Seraphimb P.M., Salmazoa L.O., Nobrea M.A., Lanfredi S. Development of an Electrochemical Sensor for Potassium Ions Based on KSr2Nb5O15 Modified Electrode // Procedia Chem. 2009. V. 1. P. 293–296. https://doi.org/10.1016/j.proche.2009.07.073
Подвальная Н.В., Волков В.Л. Электродные материалы ${\text{M}}_{x}^{{n + }}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}$ // Материаловедение. 2006. № 8. С. 16–23.
Galy J., Darriet J., Casalot A., Goodenough J.B. Structure of the MxV2O5-β and MxV2 –yTyO5-β Phases // J. Solid State Chem. 1970. V. 1. P. 339–348.
Подвальная Н.В., Захарова Г.С. Синтез и ионоселективные свойства (NH4)xV2O5 · nH2O // Журн. неорган. химии. 2020. Т. 65. № 7. С. 880–887. https://doi.org/10.31857/S0044457X20070156
Aldebert P., Baffier N., Charbi N., Livage J. Layered Structure of Vanadium Pentoxide Gels // Mater. Res. Bull. 1981. V. 16. № 6. P. 669–676. https://doi.org/10.1016/0025-5408(81)90266-X
Окунев М.С., Хитрова Н.В., Корниенко О.И. Оценка селективности ионоселективных электродов // Журн. аналит. химии. 1982. Т. 37. № 1. С. 5–13.
Petkov V., Trikalitis P.N., Bozin E.S., Billinge S.J.L., Vogt T., Kanatzidis V.G. Structure of V2O5 · nH2O Xerogel Solved by the Atomic Pair Distribution Function Technique // J. Am. Chem. Soc. 2002. V. 124. № 34. P. 10157–10162. https://doi.org/10.1023/A:1020750522264
Najdoski M., Koleva V., Samet A. Effect of Deposition Conditions on the Electrochromic Properties of Nanostructured Thin Films of Ammonium Intercalated Vanadium Pentoxide Xerogel // J. Phys. Chem. C. 2014. V. 118. P. 9636–9646. doi: 10.21./jp4127122
Durupthy O., Steunou N., Coradin T., Maquet J., Bonhomme C., Livage J. Influence of the pH and Ionic Strength on Vanadium(V) Oxides Formation from V2O5 · nH2O Gels to Crystalline NaV3O8 · 1.5H2O // J. Mater. Chem. 2005. V. 15. P. 1090–1098. https://doi.org/10/1039/b414893b
Ивакин А.А., Кручинина М.В., Корякова О.В. Додекаванадаты щелочных металлов и кальция со смешанной степенью окисления ванадия // Журн. неорган. химии. 1987. Т. 32. № 12. С. 3075–3080.
Волков В.Л., Захарова Г.С., Ивакин А.А. Рентгенографические характеристики и области гомогенности ксерогелей поливанадатов // Журн. неорган. химии. 1987. Т. 32. № 5. С. 1069–1073.
Livage J. Synthesis of Polyoxovanadates via “Chimie Douce” // Coord. Chem. Rev. 1998. V. 178-180. P. 999–1018. https://doi.org/10.1016/S0010-8545(98)00105-2
Selbin J. The Chemistry of Oxovanadium(IV) // Chem. Rev. 1965. V. 65. № 2. P. 153–170.
Baddour R., Pereira-Ramas J.P., Messina R., Perichon J. A Thermodynamic, Structural and Kinetic Study of the Electrochemical Lithium Intercalation into the Xerogel V2O5 · 1.6H2O in a Propylene // J. Electroanal. Chem. 1991. V. 314. № 1–2. P. 81–101. https://doi.org/10.1016/0022-0728(91)85430-W
Manikandan R., Raj C.D., Rejesh M., Kim B.C., Park S., Yu K.H. Vanadium Pentoxide with H2O, K+, and Na+ Spacer between Layered Nanostructures for High-Performance Symmetric Electrochemical Capacitors // Adv. Mater. Interfaces. 2009. V. 5. P. 1–13. https://doi.org/10.1002/admi.201800041
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. M.: Mir, 1991. 536 p.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


