Неорганические материалы, 2021, T. 57, № 8, стр. 852-860
Фазовые равновесия в трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{2 - }}$
М. А. Сухаренко 1, *, И. К. Гаркушин 1, А. В. Зубкова 1
1 Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: sukharenko_maria@mail.ru
Поступила в редакцию 03.03.2021
После доработки 08.04.2021
Принята к публикации 09.04.2021
Аннотация
Проведено разбиение на симплексы термодинамическим методом, описано химическое взаимодействие и построено древо фаз трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}.$ Проведен расчет температур плавления и составов эвтектических сплавов двойной BaBr2–BaSO4, квазидвойной NaBr–BaSO4 систем методом Шредера, а также стабильных треугольников NaBr–BaBr2–BaSO4 и NaBr–Na2SO4–BaSO4 трехкомпонентной взаимной системы методом Мартыновой–Сусарева. Методом ДТА подтверждено разбиение системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ и проведено экспериментальное исследование фазовых треугольников. Выявлены температуры плавления и составы сплавов, отвечающих точкам нонвариантных равновесий. Описаны равновесные состояния для каждого элемента тройной взаимной системы, построено древо кристаллизации. Проведен расчет основных термодинамических параметров тройных эвтектических сплавов.
ВВЕДЕНИЕ
Сульфат бария в силу низкой растворимости в воде и в соляной кислоте не является токсичным для организма человека в отличие от всех растворимых солей бария, поэтому его применяют в качестве рентгеноконтрастного вещества для рентгенографического исследования органов пищеварения, а также в качестве контрастирующего агента в хирургии [1–3], так как тяжелые атомы бария хорошо поглощают рентгеновское излучение.
Мелкодисперсный сульфат бария применяется в нефтедобыче для приготовления буровых растворов. Этот способ можно реализовать непосредственно в условиях буровой, что обеспечит существенную экономию времени и средств [4].
Поскольку сульфат бария нерастворим в органических растворителях, он применяется как клеевая краска. Он используется также в качестве наполнителя для фото- и писчей бумаги, для линолеума и пластмасс и для некоторых лакокрасочных материалов [5, 6]. Ионы бария способствуют окрашиванию пламени в зеленый цвет, поэтому сульфат бария применяют как цветовой компонент для пиротехнических средств.
Благодаря столь широкой области применения свойства сульфата бария (оптические, люминесцентные, радиационные) исследуются во всем мире [7, 8], предлагаются методы получения наночастиц и нанопоршков BaSO4 [9].
Исследование фазовых диаграмм различных солевых систем, включающих сульфат бария, является актуальной задачей современного материаловедения, поскольку разработка новых составов и изучение их свойств невозможны без детального исследования фазовых диаграмм [10].
Цель настоящей работы – изучение фазовых равновесий в трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }},$ а также расчет термодинамических параметров тройных эвтектических сплавов.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Исследована фазовая диаграмма трехкомпонентной взаимной системы Na+,Ba2+||Cl–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ [11], в которой протекает реакция обмена
Квадрат составов данной системы разбивается стабильной диагональю NaCl–BaSO4 на два стабильных треугольника – NaCl–BaCl2–BaSO4 и NaCl–Na2SO4–BaSO4, в каждом из которых образуется тройная эвтектика. Предполагается, что фазовая диаграмма трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ будет иметь одинаковую топологию с системой Na+,Ba2+||Cl–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}.$
Трехкомпонентная взаимная система Na+, Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ состоит из четырех индивидуальных веществ. Термические и термодинамические свойства простых веществ, входящих в состав системы, приведены в табл. 1 [12, 13]. Элементами огранения трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ являются четыре двухкомпонентные эвтектические системы: NaBr–BaBr2, NaBr–Na2SO4, Na2SO4–BaSO4, BaBr2–BaSO4 [14–16].
Разбиение на симплексы трехкомпонентной взаимной системы провели термодинамическим методом [17]. В системе Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ в точке полной конверсии K протекает реакция обмена
По данным, представленным в табл. 1, провели термодинамический расчет ${{\Delta }_{r}}H_{{{\text{298}}}}^{^\circ }$ и ${{\Delta }_{r}}G_{{{\text{298}}}}^{^\circ }{\text{:}}$
Таким образом, для стандартных условий получаем
Как видно из термодинамических характеристик, равновесие смещено в сторону пары солей NaBr и BaSO4. Это будет стабильная диагональ квадрата составов.
Рассчитаем тепловой эффект и энергию Гиббса для этой реакции при температуре, приближенной к температуре начала реакции. Для этого воспользуемся данными [18]. Предположим, что реакция начинает протекать при 900 К. Исходные данные для расчета при этой температуре сведены в табл. 2
Таблица 2.
Энтальпия и энергия Гиббса образования индивидуальных компонентов системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ при 900 К
| Вещество | ΔfH900, кДж/моль | ΔfG900, кДж/моль |
|---|---|---|
| NaBr | –37.95 | –296.70 |
| Na2SO4 | –1429.64 | –1028.71 |
| BaBr2 | –784.52 | –648.17 |
| BaSO4 | –1532.90 | –1130.86 |
Получаем следующие значение теплового эффекта и энергии Гиббса:
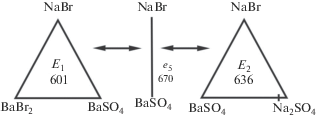
Как видно из расчетов, реакция протекает в прямом направлении. Продуктами реакции будет стабильная пара солей NaBr и BaSO4. Секущая NaBr–BaSO4 представляет собой общий элемент двух стабильных треугольников: NaBr–BaBr2–BaSO4 и NaBr–Na2SO4–BaSO4. На рис. 1 приведено древо фаз трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{2 - }}.$
Рис. 1.
Древо фаз трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}.$
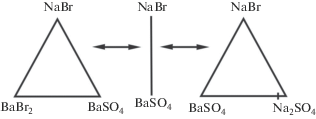
На основании приведенного древа фаз проведем прогноз числа и состава кристаллизующихся фаз в каждом симплексе системы. В стабильном треугольнике NaBr–BaBr2–BaSO4 кристаллизующимися фазами будут являться соли, лежащие в вершинах треугольника: NaBr, BaBr2, BaSO4. В стабильном треугольнике NaBr–Na2SO4–BaSO4 будут кристаллизоваться следующие твердые фазы: NaBr, BaSO4, ограниченный твердый раствор (ОТР) на основе сульфата натрия (фаза α).
Из четырех двухкомпонентных систем огранения исследуемой трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{2 - }}$ в литературе приведены данные по трем системам.
Двухкомпонентная система NaBr–Na2SO4. По системе имеются следующие данные [14]:
1) наблюдается образование двойной эвтектики с температурой плавления 625°С и составом 55 экв. % Na2SO4 + 45 экв. % NaBr, твердые фазы: NaBr, α-Na2SO4;
2) двойная эвтектика образуется при 640°С и составе 58 экв. % Na2SO4 + 42 экв. % NaBr, твердые фазы: NaBr, α-Na2SO4.
Экспериментально нами подтвержден второй вариант, поэтому для дальнейших исследований принимаем его.
Двухкомпонентная система NaBr–BaBr2. По системе имеются следующие данные [15]:
1) в системе происходит образование эвтектики с температурой плавления 592°С и составом 59.5 экв. % BaBr2, твердые фазы: NaBr, BaBr2;
2) образование двойной эвтектики происходит при температуре 596°С и составе 60 экв. % BaBr2;
3) эвтектика образуется при 594°С и 42 мол. % BaBr2.
Экспериментально подтвержден второй состав – 60 экв. % BaBr2 + 40 экв. % NaBr. Температура плавления эвтектики, определенная экспериментально, составила 625°С.
Двухкомпонентная система Na2SO4–BaSO4. В системе со стороны сульфата натрия образуется ограниченный твердый раствор на основе α-Na2SO4 с максимумом температуры кристаллизации при 917°С и 83 экв. % Na2SO4; образуется эвтектика при температуре 913°С и составе 80 экв. % Na2SO4 + + 20 экв. % BaSO4. Твердые фазы – α-BaSO4 и α‑ОТР на основе сульфата натрия [16].
Для неизученных двойной BaBr2–BaSO4 и квазидвойной NaBr–BaSO4 систем проведем расчет температур плавления и составов двойных эвтектических сплавов методом Шредера [19]
(1)
$\ln {{x}_{i}} = \frac{{{{\Delta }_{m}}{{H}_{i}}\left( {{{T}_{e}} - {{T}_{{m,i}}}} \right)}}{{R{{T}_{{m,i}}}{{T}_{e}}}},$Результаты расчета приведены в табл. 3.
Таблица 3.
Составы и температуры плавления двойных эвтектических сплавов е4 и е5, рассчитанные методом Шредера
| Компонент | Состав системы | Температура плавления | ||
|---|---|---|---|---|
| мол. % | экв. % | К | оС | |
| BaBr2–BaSO4 | ||||
| BaBr2 | 15.0 | 15.0 | 1074 | 801 |
| BaSO4 | 85.0 | 85.0 | ||
| NaBr–BaSO4 | ||||
| NaBr | 90.0 | 81.5 | 984 | 711 |
| BaSO4 | 10.0 | 18.5 | ||
Для расчета содержания компонентов и температур плавления эвтектических смесей в стабильных треугольниках трехкомпонентной взаимной системы воспользуемся расчетным методом Мартыновой–Сусарева [20] с использованием программного комплекса [21], в который занесены данные по температурам плавления исходных веществ, температурам плавления и составам эвтектических смесей и квазидвойной эвтектики.
Полученные в результате расчета данные по температурам плавления и составам сплавов тройных эвтектик для стабильных треугольников трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{2 - }}$ сведены в табл. 4.
Таблица 4.
Результаты расчета температур плавления и составов тройных эвтектических сплавов в стабильных треугольниках трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$
| Система | Содержание компонентов, мол. % | Содержание компонентов, экв. % | Температура плавления эвтектических смесей | |||||
|---|---|---|---|---|---|---|---|---|
| 1-й | 2-й | 3-й | 1-й | 2-й | 3-й | К | °C | |
| NaBr–Na2SO4–BaSO4 | 55.5 | 38.3 | 6.2 | 38.4 | 53.0 | 8.6 | 903 | 630 |
| NaBr–BaBr2–BaSO4 | 53.7 | 40.3 | 6.0 | 36.7 | 55.1 | 8.2 | 857 | 584 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование фазовых равновесий в трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{2 - }}$ и элементах ее огранения проводили с помощью дифференциального термического анализа (ДТА) [22–24] на установке с верхним подводом термопар. Установка включает печь шахтного типа, в которую опускаются платиновые микротигли (изделия № 108-1, № 108-2, № 108-3 по ГОСТ 13498-68) с исследуемым составом и с индифферентным веществом – свежепрокаленным Al2O3 (“ч. д. а.”). Холодные спаи термостатировали при 0°С с помощью сосуда Дьюара с тающим льдом. Сигнал от термопар поступал на АЦП и преобразовывался в цифровой сигнал с выводом на компьютер. На нем фиксировали температурную и дифференциальную кривые [25, 26]. Градуировку термопары осуществляли по известным температурам плавления и образования полиморфных модификаций безводных неорганических солей [12, 13, 27]. Исследования проведены до 750°С.
Скорость нагрева (охлаждения) образцов составляла 10–15 К/мин. Точность измерения температур ±2.5 К при точности взвешивания составов ±0.0001 г на аналитических весах VIBRA HT. Составы всех смесей, используемых в настоящей работе, выражены в мол. % (при использовании расчетов) и экв. % (в экспериментах). Температуры в расчетных формулах приведены в Кельвинах, в эксперименте – в градусах Цельсия. Масса исходных смесей составляла 0.3 г.
В работе использовались следующие реактивы: NaBr – “х. ч.” (ТУ 6-09-5331-87, содержание основного вещества 99.9%), BaBr2 – “х. ч.” (ТУ 6-09-3633-79, содержание основного вещества 99.9%), Na2SO4 – “ч. д. а.” (ТУ 6-09-04-80-82, содержание основного вещества 99.0 мас. %), BaSO4 – “ч. д. а.” (ГОСТ 4463-76, содержания основного вещества 99.0%). Температуры плавления исходных солей, определенные методом ДТА (при точности измерения ±2.5°С), равны: NaBr – 747°С, BaBr2 – 857°С, Na2SO4– 884°C, т.е. влияние имеющихся примесей на температуры плавления исходных солей незначительно. Поэтому для всех четырех солей были приняты литературные данные [12, 13]. Исходные реактивы были предварительно высушены и после охлаждения в сухом боксе помещены в бюксы, а бюксы – в эксикатор с осушителем (силикагель).
Для подтверждения литературных данных было проведено экспериментальное исследование двухкомпонентной системы NaBr–BaBr2. Выявлено некоторое несоответствие литературных данных и эксперимента. Установлены следующие координаты двойной эвтектики: состав 40 экв. % NaBr + + 60 экв. % BaBr2, температура плавления 625°С. В дальнейших исследованиях использованы полученные нами данные.
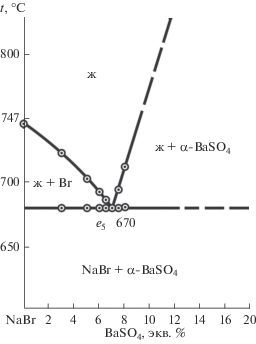
С целью подтверждения разбиения на симплексы методом ДТА была исследована квазибинарная система NaBr–BaSO4. t-х-диаграмма стабильной секущей NaBr–BaSO4 приведена на рис. 2. Выявлены характеристики эвтектического сплава: температура плавления 670°С, состав 7 экв. % BaSO4 + 93 экв. % NaBr.
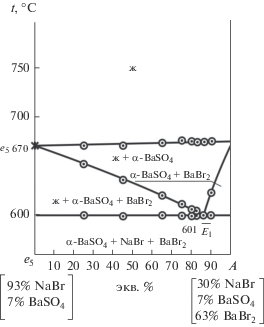
Проекция фазового комплекса трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{2 - }}$ на квадрат составов приведена на рис. 3. По системе BaBr2–BaSO4 приняты расчетные данные табл. 2. Для экспериментального изучения стабильного треугольника NaBr–BaBr2–BaSO4 в поле кристаллизации сульфата бария был выбран двумерный политермический разрез, исходящий из квазибинарной эвтектики е5 параллельно двойной стороне квадрата составов NaBr–BaBr2 – е5A (е5 [93 экв. % NaBr + 7 экв. % BaSO4], А [30 экв. % NaBr + 7 экв. % BaSO4 + 63 экв. % BaBr2]). t–х-диаграмма разреза приведена на рис. 4. Выявлена температура плавления тройной эвтектики Е1 (601°С) и соотношение в ней компонентов NaBr и BaBr2. При изучении политермического разреза BaSO4 → $\overline {{{E}_{1}}} \to {{E}_{1}},$ проведенного из вершины сульфата бария через направление на эвтектику $\overline {{{Е}_{1}}} $ с постоянным соотношением компонентов NaBr и BaBr2, выявлен состав тройной эвтектики: 39.5 экв. % NaBr + 58.5 экв. % BaBr2 + 2 экв. % BaSO4.
Рис. 3.
Проекция фазового комплекса трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ на квадрат составов.
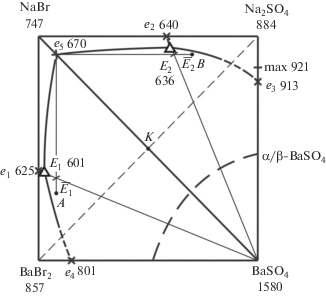
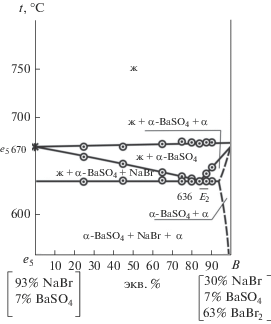
Для экспериментального изучения стабильного треугольника NaBr–Na2SO4–BaSO4 в поле кристаллизации сульфата бария был выбран двумерный политермический разрез e5B (е5 [93 экв. % NaBr + 7 экв. % BaSO4], B [30 экв. % NaBr + 7 экв. % BaSO4 + 63 экв. % Na2SO4]). t-х-диаграмма разреза приведена на рис. 5. Пересечением ветвей вторичной кристаллизации и эвтектической прямой определена температура плавления тройного эвтектического сплава E2 (636°С) и соотношение в нем компонентов NaBr и Na2SO4. При исследовании политермического разреза BaSO4 → $\overline {{{E}_{2}}} \to {{E}_{2}}$ был выявлен состав сплава тройной эвтектики Е2: 40 экв. % NaBr + 55 экв. % Na2SO4 + 5 экв. % BaSO4.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате термодинамического расчета энтальпий и энергий Гиббса реакции обмена при стандартной температуре и при 900 К установлено, что стабильными продуктами реакции являются соли NaBr и BaSO4. Тройная взаимная система является необратимо-взаимной со стабильной диагональю NaBr–BaSO4. Экспери-ментальное исследование методом ДТА подтвердило квазибинарный характер системы, из t–х-диаграммы которой (рис. 2) видно, что ликвидус представлен двумя ветвями кристаллизации – бромида натрия и сульфата бария. Фазовая диаграмма представлена четырьмя полями: однофазное поле жидкого состояния (Ж), поле совместного существования двух твердых фаз – NaBr + α-BaSO4, два двухфазных поля – Ж + + NaBr и Ж + α-BaSO4. В табл. 5 приведено сравнение данных, полученных на основе расчета методом Шредера и экспериментального изучения стабильной диагонали. Эвтектическому составу соответствует фазовое равновесие Ж ⇄ NaBr + + α-BaSO4.
Таблица 5.
Сравнение данных расчета по методу Шредера и эксперимента для состава квазидвойной эвтектики e5
| Прогноз/эксперимент/погрешность | Состав, экв. % | T, К | |
|---|---|---|---|
| 1-й компонент | 2-й компонент | ||
| Прогноз | 81.5 | 18.5 | 984 |
| Эксперимент | 93.0 | 7.0 | 943 |
| Погрешность определения | 11.5 | 4% | |
На t–х-диаграмме разреза е5А (рис. 4) линия первичной кристаллизации представлена в виде плавной кривой, она соответствует кристаллизации из расплава сульфата бария (α-модификация). Линия вторичной кристаллизации представлена двумя ветвями. Ветвь ${{e}_{5}}{{\bar {E}}_{1}}$ соответствует совместной кристаллизации сульфата бария (α-модификация) и бромида натрия. Ветвь $A{{\bar {E}}_{1}}$ соответствует совместной кристаллизации сульфата бария (α‑модификация) и бромида бария. В стабильном треугольнике NaBr–BaBr2–BaSO4 кристаллизуются три твердые фазы: бромид натрия, бромид бария и сульфат бария (α-фаза). Эти фазы подтверждают прогноз числа и состава кристаллизующихся фаз (рис. 1).
t–х-диаграмма разреза е5В (рис. 5) показывает, что ликвидус представлен плавной кривой, которая отвечает кристаллизации из расплава сульфата бария (α-модификация). Линия вторичной кристаллизации представлена двумя ветвями: сульфата бария и бромида натрия (ветвь $А{{\bar {E}}_{2}}$), сульфата бария и фазы α (ветвь $B{{\bar {E}}_{2}}$). В стабильном треугольнике кристаллизуются три твердые фазы: бромид натрия, фаза α и сульфат бария (α-модификация), что подтверждает прогноз числа и состава кристаллизующихся фаз.
В табл. 6 приведены температуры плавления и составы тройных эвтектических сплавов по данным расчета методом Мартыновой–Сусарева и по данным эксперимента, проведенного методом ДТА. Видно, что погрешность определения незначительна.
Таблица 6.
Сравнение данных расчета методом Мартыновой–Сусарева и эксперимента для температур плавления и составов тройных эвтектических сплавов Е1 и Е2
| Прогноз/результат/погрешность | Состав, экв. % | T, К | ||
|---|---|---|---|---|
| 1-й компонент | 2-й компонент | 3-й компонент | ||
| NaBr–BaBr2–BaSO4 | ||||
| Прогноз | 36.7 | 55.1 | 8.2 | 857 |
| Результат | 39.5 | 58.5 | 2.0 | 874 |
| Погрешность определения | 3.9 | 2% | ||
| NaBr–Na2SO4–BaSO4 | ||||
| Прогноз | 38.4 | 53.0 | 8.6 | 903 |
| Результат | 40.0 | 55.0 | 5.0 | 909 |
| Погрешность определения | 2.4 | 0.6% | ||
Проекция ликвидуса трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ на квадрат составов представлена четырьмя полями кристаллизации: бромида натрия, бромида бария, сульфата бария (α- и β-модификации; α/β-переход BaSO4 на квадрате составов (рис. 4) указан приближенно пунктиром) и ОТР на основе сульфата натрия (фаза α). Максимальное поле кристаллизации принадлежит сульфату бария – самому тугоплавкому компоненту, что также подтверждает необратимость превращения нестабильной пары солей Na2SO4 и BaBr2 в стабильные NaBr и BaSO4. В табл. 7 приведены фазовые равновесия для различных элементов фазовой диаграммы трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}.$ Полученные результаты позволили построить древо кристаллизации трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ (рис. 6). Видно, что самая низкоплавкая эвтектика Е1 (601°С) принадлежит стабильному треугольнику NaBr–BaBr2–BaSO4.
Таблица 7.
Фазовые равновесия в трехкомпонентной взаимной системе Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$
| Элементы диаграммы | Фазовое равновесие |
|---|---|
| Поля | |
| е1Е1е5Е2е2 | Ж ⇄ NaBr |
| e1E1e4 | Ж ⇄ BaBr2 |
| e2E2e3 | Ж ⇄ α |
| e4E1e5E2e3 | Ж ⇄ α-BaSO4 |
| Линии | |
| е1Е1 | Ж ⇄ NaBr + BaBr2 |
| e4E1 | Ж ⇄ BaBr2 + α-BaSO4 |
| E1e5E2 | Ж ⇄ NaBr + α-BaSO4 |
| е2Е2 | Ж ⇄ NaBr + α |
| е3Е2 | Ж ⇄ α + α-BaSO4 |
| Точки | |
| Е1 | Ж ⇄ NaBr + BaBr2 + α-BaSO4 |
| Е2 | Ж ⇄ NaBr + α + α-BaSO4 |
Рис. 6.
Древо кристаллизации трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}.$
Для квазидвойного и тройных эвтектических сплавов е5, Е1 и Е2 трехкомпонентной взаимной системы был проведен расчет основных термодинамических свойств. Результаты расчета сведены в табл. 8.
Таблица 8.
Результаты расчета термодинамических свойств изученных эвтектических составов е5, E1 и E2
| Эвтектический состав, экв. % | ΔmSe | ΔmHe | ΔmHV, МДж/м3 | ρ, кг/м3 |
Ср | |||
|---|---|---|---|---|---|---|---|---|
| Дж/(моль К) | Дж/(г К) | кДж/моль | кДж/кг | Дж/(моль К) | Дж/(кг К) | |||
| е5: 943К; 93% NaBr + 7% BaSO4 |
25.6 | 0.24 | 24.1 | 223.9 | 741.3 | 3311.5 | 53.3 | 494.8 |
| E1: 874К; 39.5% NaBr + + 58.5% BaBr2 + + 2% BaSO4 |
26.8 | 0.14 | 23.4 | 125.9 | 438.2 | 3480.8 | 54.7 | 293.5 |
| E2: 909К; 40% NaBr + + 55% Na2SO4 + + 5% BaSO4 |
23.4 | 0.19 | 21.3 | 173.0 | 528.9 | 3057.0 | 83.4 | 678.1 |
ЗАКЛЮЧЕНИЕ
Проведено разбиение на симплексы трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ термодинамическим методом, которое подтверждено данными ДТА. Построены древо фаз и древо кристаллизации системы. Рассчитаны температуры плавления и составы эвтектических сплавов двойной BaBr2–BaSO4 и квазидвойной NaBr–BaSO4 систем методом Шредера. Расcчитаны температуры плавления и составы сплавов тройных эвтектик стабильных треугольников трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ методом Мартыновой–Сусарева и показана удовлетворительная сходимость расчетных и экспериментальных данных.
Проведено экспериментальное исследование стабильных треугольников трехкомпонентной взаимной системы Na+,Ba2+||Br–,${\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}$ методом ДТА. Выявлены координаты тройных эвтектических сплавов, для которых выполнен расчет основных термодинамических свойств.
Список литературы
Кутырева М.П., Ханнанов А.А., Улахович Н.А. и др. Рентгеноконтрастное средство на основе бария сульфата и способ его получения: Патент РФ 2603480. Б.И. № 33. 3 с.
Захаров В.Д., Кислицына Н.М., Новиков С.В и др. Анализ результатов хирургического лечения макулярных разрывов большого диаметра с применением различных модификаций методики “Инвертированного лоскута” с использованием в качестве контрастирующего агента оригинальной суспензии “Витреоконтраст” // Практическая медицина. 2018. № 5. С. 128–134.
Максакова Е.А. Возможности рентгеноскопии с использованием сульфата бария в диагностике аксиальных грыж пищеводного отдела диафрагмы // Бюллетень медицинских интернет-конференций. 2014. Т. 4. № 11. С. 1212.
Овчинников П.В., Кузнецов Ю.С., Артамонов В.Ю. и др. Волновая технология приготовления бурового раствора, утяжеленного тонкодисперсным сульфатом бария // Строительство нефтяных и газовых скважин на суше и море. 2020. № 5. С. 47–51. https://doi.org/10.33285/0130-3872-2020-5(329)-47-51
Бузинер Л.Ю. Пигменты и функциональные наполнители для порошковых красок в ассортименте фирмы “Афая” // Лакокрасочные материалы и их применение. 2015. № 12. С. 13–15.
Володина В.В., Репин В.В. Возможность использования синтетического сульфата бария для улучшения оптических свойств лакокрасочных материалов строительного назначения // Лакокрасочные материалы и их применение. 2016. № 3. С. 28–29.
Chanthimaab N., Prongsamronga P., Kaewkhaoabc J., Limsuwancd P. Simulated Radiation Attenuation Properties of Cement Containing with BaSO4 and PbO // Procedia Eng. 2012. V. 32. P. 976–981.
Hosseini S., Farhadi K., Banisaeid S. Improving Particle Size of BaSO4 with a Unique Glycerol Base Method and Its Impact on the Negative Active Material of the Lead-Acid Battery // J. Energy Storage. 2019. V. 21. P. 139–148.
Jiaa Z., Haoa S., Liub K. Synthesis of BaSO4 Nanoparticles with a Membrane Reactor: Parameter Effects on Membrane Fouling // J. Membr. Sci. 2017. V. 543. P. 277–281.
Гаркушин И.К., Рагрина М.С., Сухаренко М.А. Название статьи // Журн. неорган. химии. 2018. Т. 63. № 1. С. 94–98. https://doi.org/10.7868/S0044457X18010130
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И., Верещитина И.П. Справочник по плавкости систем из безводных неорганических солей. Т. 2. М.-Л.: АН СССР, 1961. 585 с.
Термические константы веществ. Вып. X. Ч. 1. Таблицы принятых значений: Li, Na / Под ред. Глушко В.П. М., 1981. 297 с.
Термические константы веществ. Вып. IX. Таблицы принятых значений: Be, Mg, Ca, Sr, Ba, Ra / Под ред. Глушко В.П. М., 1979. 574 с.
Диаграммы плавкости солевых систем. Ч. III / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. 204 с.
Диаграммы плавкости солевых систем. Ч. I / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. 416 с.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И., Верещитина И.П. Справочник по плавкости систем из безводных неорганических солей. Т. 1. Двойные системы. М.-Л.: АН СССР, 1961. 848 с.
Бергман А.Г., Бухалова Г.А. Термодинамические взаимоотношения в тройных взаимных системах с комплексообразованием // Изв. Сектора физ.-хим. анализа, 1952. Т. 21. С. 228–249.
Barin I., Platzki G. Thermochemical Data of Pure Substances. VCH Verlagsgesellschaft mbH, D-6945 1 Weinheim. Federal Republic of Germany. 1995. Third Edition. 1885 p.
Гаркушин И.К., Колядо А.В., Дорохина Е.В. Расчет и исследование фазовых равновесий в двойных системах из органических веществ. Екатеринбург: УрО РАН, 2011. 191 с.
Гаркушин И.К., Сухаренко М.А., Дёмина М.А. Физико-химический анализ в материаловедении: уч. пособие. Самара: Самар.гос.техн. ун-т, 2014. 414 с.
Мощенская Е.Ю. Програмный комплекс для моделирования фазовых диаграмм “состав-температура” и “состав-ток” в физико-химическом анализе солевых и металлических систем / Свид. РФ 2006613134. 2006.
Словарь-справочник по физико-химическому анализу / Сост. Гаркушин И.К., Истомова М.А. Самара: Самар. гос. тех. ун-т, 2012. 237 с.
Егунов В.П. Введение в термический анализ. Самара: ПО “СамВен”, 1996. 270 с.
Шестак Я. Теория термического анализа. Физико-химические свойства неорганических веществ; Пер.с англ. М.: Мир, 1987. 456 с.
Мощенский Ю.В. Дифференциальный сканирующий колориметр ДСК-500 // Приборы и техника эксперимента. 2003. № 6. С. 143.
Мощенский Ю.В. Микрокалориметр ДСК: Метод. указ. к лаб. работе. Самара: Самар. гос. техн. ун-т, 2004. 19 с.
Берг Л.Г. Введение в термографию. М.: Наука, 1969. С. 395.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы