Неорганические материалы, 2021, T. 57, № 9, стр. 954-961
Модифицированные в смеси NH3 + H2O + H2O2 пористые частицы кремнезема: структура, заполнение оксидом кобальта и активность в конверсии CO
Д. А. Еуров 1, *, Д. А. Кириленко 1, М. В. Томкович 1, Т. Н. Ростовщикова 2, М. И. Шилина 2, О. В. Удалова 3, Д. А. Курдюков 1
1 Физико-технический институт им. А.Ф. Иоффе Российской академии наук
194021 Санкт-Петербург, Политехническая ул., 26, Россия
2 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, Россия
3 ФИЦ химической физики им. Н.Н. Семенова Российской академии наук
119334 Москва, пр. Косыгина, 4, к. 1, Россия
* E-mail: edan@mail.ru
Поступила в редакцию 01.04.2021
После доработки 20.05.2021
Принята к публикации 21.05.2021
Аннотация
Методом химического травления сферических микро-мезопористых частиц кремнезема в смеси аммиак + вода + пероксид водорода получены частицы, содержащие крупные мезопоры (5–25 нм) и микропоры (0.6–2 нм). Удельные поверхность и объем пор частиц составляют 510 м2/г и 0.8 см3/г соответственно. С использованием метода капиллярной пропитки в порах частиц синтезирован Co3O4 (2–4 мас. %). Исследованы состав и структура полученных материалов. Продемонстрированы каталитическая активность и стабильность композитных частиц Co3O4/SiO2 в процессе окисления CO.
ВВЕДЕНИЕ
В настоящее время мезопористый кремнезем благодаря таким характеристикам, как: большие удельная поверхность и объем пор, варьируемые морфология и размер пор, химическая и температурная стойкость, биосовместимость, находит применение в катализе [1], адсорбции [2], молекулярной сепарации [3], биомедицине [4], оптоэлектронике [5] и других областях. Особый интерес представляют сферические частицы мезопористого кремнезема одинакового размера. Такие частицы при использовании, например, в катализе или хроматографии могут формировать плотнейшую упаковку, что, в свою очередь, обуславливает одинаковую скорость массопереноса веществ (внутри пор и вне частиц) [6]. Монодисперсные сферические частицы мезопористого кремнезема перспективны также для применения в биомедицине в качестве носителей в системах доставки лекарств [7–9].
Как правило, сферические частицы мезопористого кремнезема синтезируют посредством гидролиза кремнийсодержащих прекурсоров на поверхности мицелл, образованных молекулами поверхностно-активного вещества (ПАВ). Длина молекул используемого ПАВ определяет размер пор в синтезируемых частицах. В большинстве случаев в качестве порообразующего вещества используют цетилтриметиламмоний бромид (ЦТАБ) или децилтриметиламмоний бромид (ДТАБ), в результате чего получаемые частицы кремнезема обладают мезопорами со средним размером не более 3 нм.
Для различных технических и медицинских применений требуется получать частицы с порами большего размера. В частности, в работе [5] продемонстрирована возможность применения частиц кремнезема, обладающих мезопорами до 15 нм, в качестве матрицы для диспергирования углеродных квантовых точек, перспективных в качестве люминофоров для белых светодиодов. Для высокоэффективной жидкостной хроматографии оптимальными являются частицы, имеющие сквозные поры размером более 8 нм, которые обеспечивают быстрый массоперенос веществ [10]. В работе [9] показано, что при использовании частиц кремнезема для доставки лекарств больший размер мезопор обеспечивает большее количество загружаемого и доставляемого препарата на единицу поверхности носителя, а также бóльшую скорость высвобождения препарата.
Как правило, для увеличения мезопор в частицах кремнезема применяют два подхода. Первый основан на добавлении в реакционную смесь органического соединения (например, триметилбензола), молекулы которого встраиваются внутрь мицелл ПАВ [11, 12]. Второй заключается в использовании ПАВ с более длинной гидрофобной частью [12, 13]. Описанные подходы влияют на процесс синтеза частиц и, вследствие этого, на их параметры (размер и форму). Избежать этого позволяет постсинтетическая обработка частиц, например, травление монодисперсных сферических мезопористых (диаметр пор 3 нм) частиц кремнезема в спирто-водно-аммиачной среде в автоклаве при 120°С [14]. После обработки размер и форма частиц сохраняются, при этом они обладают крупными мезопорами размером более 10 нм и макропорами до 100 нм.
В данном исследовании разработан подход к получению сферических частиц кремнезема, обладающих крупными (до 25 нм) мезопорами. Частицы получены методом жидкостного химического травления микро-мезопористых частиц SiO2 в смеси аммиак + вода + пероксид водорода при обычных условиях. Разработанный метод позволил увеличить средний диаметр мезопор c 2.5 до ~20 нм и сохранить большие удельную поверхность и объем пор в частицах. В поры полученных частиц введен оксид кобальта Co3O4. Известно, что оксиды кобальта являются эффективными катализаторами окисления монооксида углерода кислородом [15], способными конкурировать с благородными металлами. Однако их использование ограничено недостаточно высокой стабильностью в условиях катализа. Стабилизация оксида кобальта в порах синтезированного мезопористого кремнезема обеспечила его устойчивость в каталитическом окислении СО.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали следующие вещества и реагенты: ЦТАБ C16H33N(CH3)3Br (99+%, Acros); аммиак водный NH3 (24 мас. % NH3, ≥99.99%); этанол C2H5OH (95 мас. %); деионизованная вода Н2О (10 МОм); тетраэтоксисилан (ТЭОС) Si(OC2H5)4 (99+%, Acros); метакрилоксипропилтриметоксисилан (МПТМОС) H2C=C(CH3)CO2(CH2)3Si(OCH3)3 (98%, Aldrich); соляная кислота HCl (37 мас. %, ≥99.99%); пероксид водорода H2O2 (30–35 мас. %, ≥99.99%); гексагидрат нитрата кобальта Co(NO3)2∙6H2O (98%, Aldrich).
Микро-мезопористые сферические частицы кремнезема с размером пор 0.6–4 нм синтезировали согласно разработанной ранее методике путем основного гидролиза кремнийсодержащих прекурсоров (ТЭОС и МПТМОС) в смеси NH3 + + H2O + C2H5OH + ЦТАБ [16, 17]. Мольное соотношение реагентов (ТЭОС + 20 мол. % МПТМОС) : : NH3 : H2O : C2H5OH : ЦТАБ составило 1 : 60 : 370 : : 230 : 0.2, масса раствора 1 кг. Температура реакционной смеси составляла 60°С, продолжительность синтеза – 2 ч. Для удаления органики синтезированные частицы отмывали в спиртовом растворе HCl (0.01 M), затем отжигали в потоке O2 при температуре 400°С в течение 5 ч. Удельные поверхность и объем пор синтезированных частиц составили 1600 м2/г и 0.55 см3/г соответственно [16].
Для модификации пористой структуры (увеличения размера мезопор) в стеклянный стакан, содержащий навеску частиц кремнезема (0.5 г), вливали свежеприготовленный водный раствор H2O2 (3 M) и NH3 (10 M) объемом 50 мл. Полученную суспензию нагревали при перемешивании до температуры 65°С и выдерживали в течение 1 ч, после чего охлаждали на воздухе до комнатной температуры. Обработанные таким образом частицы три раза промывали в деионизованной воде и высушивали при температуре 100°C.
Введение Co3O4 в поры частиц включало несколько этапов. На первом этапе навеску частиц кремнезема пропитывали 2M водным раствором Co(NO3)2∙6H2O при обычных условиях, затем смесь высушивали при 70°C. После этого температуру образца повышали до 300°C с шагом 10°C/мин. Далее проводили термообработку при 300°C при обычных условиях в течение 3 ч. Были изготовлены 2 образца с содержанием Co3O4 2 и 4 мас. % исходя из массового соотношения частиц кремнезема и нитрата кобальта.
Исследования пористой структуры частиц проводили на анализаторе ASAP 2020 фирмы Micromeritics при температуре 77 K с применением азота в качестве адсорбата. Размер пор рассчитывали с помощью встроенного программного обеспечения с использованием нелокальной теории функционала плотности (НТФП). Значение удельной поверхности рассчитывали по методу БЭТ, удельный объем пор определяли при относительном давлении p/p0 = 0.994. Исследования методом просвечивающей электронной микроскопии (ПЭМ) выполняли с использованием микроскопа Jeol JEM-2100F (ускоряющее напряжение 200 кВ, разрешение по точкам 0.19 нм), оснащенного энергодисперсионным рентгеновским спектрометром.
Исследование каталитической активности частиц Co3O4/SiO2 в реакции каталитического окисления монооксида углерода проводили в проточном режиме при температурах 50–250°С, циклами нагревания–охлаждения (2–4 цикла). Перед тестированием образцы прогревали в токе He при 370°С в течение 30 мин. Регулировку температуры осуществляли с помощью программатора Ursamar-RK42 (Германия). Состав исходной смеси (об. %): 1CO, 1O2, 98Не. Анализ содержания СО и СО2 в реакционной смеси проводили с помощью хроматографа “Кристалл 2000”. Условия хроматографического анализа: детектор по теплопроводности, колонка с неподвижной фазой Porapak-Q длиной 1 м, температура колонки 30°С, скорость потока газа-носителя (Не) 10 см3/мин, для обработки данных использовался программный комплекс “Экохром”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рассмотрим возможный механизм формирования крупных мезопор (размером 10–25 нм) при травлении микро-мезопористых частиц кремнезема в смеси NH3 + Н2О + H2O2. Частицы изначально состоят из кластеров плотноупакованных трубок SiO2, в стенках которых и между которыми имеются микропоры размером 0.6–2 нм [16, 17]. Средний внутренний диаметр трубок равен ~2.5 нм, толщина их стенок ~0.5 нм, размер кластера, равный длине трубок, составляет 10–15 нм [16]. По-видимому, образование крупных мезопор происходит посредством объединения соседних мезопор внутри кластера, т.е. за счет удаления стенок между соседними трубками SiO2 (рис. 1). Ранее подобный процесс реализован при травлении мезопористых частиц кремнезема в аммиаке при 120°С в автоклаве [14]. Растворение кремнезема начинается с мест с наибольшей химической активностью, а именно, с силанольных групп. Фактически из-за очень высокой удельной поверхности (1600 м2/г по БЭТ [16]) микро-мезопористый кремнезем ближе по составу к поликремниевой кислоте, чем к диоксиду кремния. Наибольшее количество силанолов, очевидно, находится на стенках микропор, поскольку они имеют наибольшую кривизну и в этих местах наиболее вероятно (из-за пространственных ограничений) возникновение оборванных связей в кремнекислородном каркасе и образование одиночных силанолов. Наличие пероксида водорода в травителе дополнительно повышает поверхностную концентрацию силанолов. В работе [18] показано, что молекулы H2O2 адсорбируются как силанольными группами, так и силоксановыми связями на поверхности кремнезема [18]. При взаимодействии продуктов разложения H2O2 с –Si–O–Si– возможно образование двух групп –Si–OH (рис. 1).
Рис. 1.
Схематичное изображение процесса образования крупных мезопор в процессе травления микро-мезопористых частиц кремнезема SiO2.
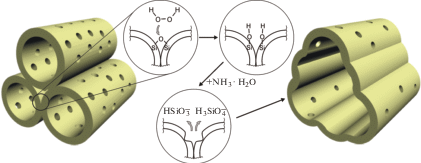
При взаимодействии OH−, H2O, ${\text{NH}}_{4}^{ + }$ с кремнеземом происходит образование ионов ${\text{HSiO}}_{3}^{ - }$ и ${{{\text{H}}}_{{\text{3}}}}{\text{SiO}}_{4}^{ - }.$ По-видимому, далее гидратированные гидросиликат-ионы диффундируют к внешним границам кластера (рис. 1), где вновь образуется гидратированный аморфный SiO2. Стенки формирующихся более крупных пор имеют бóльшую толщину и меньшую кривизну, поэтому их поверхность менее химически активна.
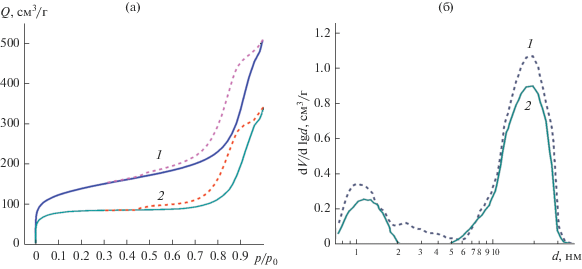
Обнаружено, что частицы после травления сохраняют сферическую форму (рис. 2). На изображениях, полученных методом ПЭМ, видны поры (области светлого контраста) размером ~10–20 нм. На ПЭМ-изображении поверхности частиц наблюдается шероховатость (~20–30 нм), сравнимая с размером крупных пор. На рис. 3 представлена изотерма адсорбции азота при 77 К для частиц после травления (рис. 3а, кривая 1). Результаты ПЭМ коррелируют с данными азотной адсорбционной порометрии. На изотерме адсорбции наблюдается гистерезис в диапазоне относительных давлений 0.5 ≤ p/p0 ≤ 1.0, что обусловлено капиллярной конденсацией в крупных мезопорах. Расчет методом НТФП показывает широкое распределение пор по размерам, от долей до нескольких десятков нанометров. Вероятно, поры размерами 0.6–2 нм сохранились от исходной структуры частиц до травления и находятся в стенках крупных пор (рис. 1). Рассчитанные значения удельной поверхности и объема пор составили 513 м2/г (по БЭТ) и 0.79 см3/г соответственно. По-видимому, именно благодаря более активной поверхности микро-мезопористого кремнезема его травление протекает в существенно более “мягких” условиях по сравнению с работой [14] (120°С в автоклаве), что приводит к формированию материала с большей пористостью. Так, объем пор частиц после травления составляет ~0.8 см3/г, что на ~0.15 см3/г больше, чем объем пор исходных микро-мезопористых частиц. По-видимому, часть гидросиликат-ионов выходит из пор в раствор и не образует снова SiO2∙H2O.
Рис. 2.
ПЭМ-изображения частицы SiO2 (а) и ее поверхности (б) после обработки смесью NH3 + H2O + H2O2.

Рис. 3.
Изотермы адсорбции азота при 77 K (а) и распределение пор по размерам, рассчитанное методом НТПФ (б), частиц SiO2 (1) и Co3O4/SiO2 (2).
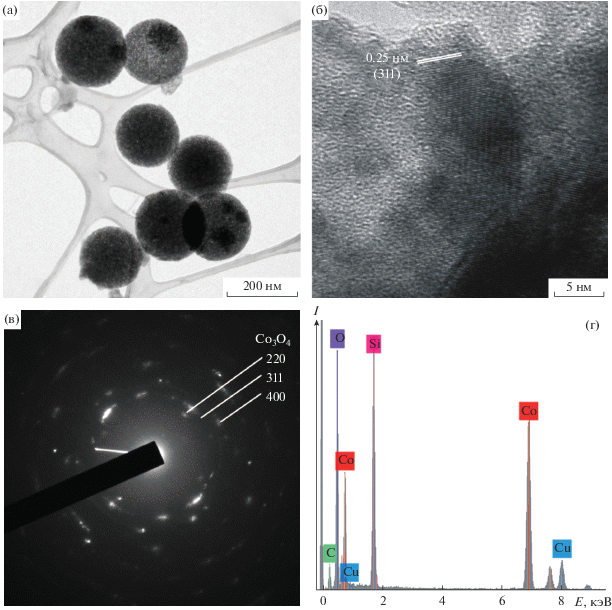
На рис. 4а представлено ПЭМ-изображение частиц после введения Co3O4 с использованием метода капиллярной пропитки. Здесь и далее приведены результаты структурных исследований образца Co3O4/SiO2 с 4% оксида кобальта. На изображении видно, что полученные композитные частицы имеют более темный контраст по сравнению с исходными частицами (рис. 2а), вероятно, вследствие наличия в них более тяжелого элемента Со, обуславливающего большее поглощение электронов. На увеличенном изображении приповерхностной области (рис. 4б) виден кристаллит (темная область), наблюдаемое в нем межплоскостное расстояние соответствует d311 = 0.25 нм в Co3O4. На ПЭМ-изображениях наблюдаются кристаллиты Co3O4 размерами от единиц до десятков нанометров. На электронной микродифракционной картине от композитных частиц (рис. 4в) наблюдаются дифракционные рефлексы Co3O4 (JCPDS 00-042-1467). Можно сделать вывод, что основной кристаллической фазой является Co3O4. При этом нельзя полностью исключить возможность формирования аморфных оксида или силиката кобальта, особенно в микропорах частиц кремнезема. Результаты элементного анализа подтверждают наличие кобальта и отсутствие примесей других элементов в составе частиц (рис. 4г). Сигнал меди в рентгеновском спектре возникает от медной сетки, поддерживающей ПЭМ-образец. По результатам азотной адсорбционной порометрии (рис. 3), значения удельной поверхности и объема пор составили 410 м2/г и 0.61 см3/г соответственно.
Рис. 4.
ПЭМ- (а) и ВРПЭМ-изображения (б), микродифракционная картина (в) и энергодисперсионный рентгеновский спектр (г) частиц Co3O4/SiO2 (на рис. б, в приведены характерное межплоскостное расстояние и положения дифракционных рефлексов Co3O4 соответственно).
Каталитическая активность композитных частиц Co3O4/SiO2 с содержанием Co3O4 2 и 4 мас. % исследована на примере каталитического окисления монооксида углерода в смеси CO + O2 + He. На рис. 5 приведены данные по температурной зависимости конверсии СО, полученной с использованием частиц Co3O4/SiO2 (4 мас. % Co3O4) в двух последовательных циклах нагрева и охлаждения. Видно, что 50%-ная конверсия CO достигается при температуре около 160°С, a 100%-ная – 210°С, характерные значения t50 и t100 лишь незначительно меняются при многократных испытаниях образцов. Как видно из табл. 1, для образца с меньшим содержанием Co3O4 (2 мас. %) получены близкие и даже чуть меньшие значения температур 50%- и 90%-ной конверсии СО. Это может быть связано с более узким распределением частиц Co3O4 по размерам в образце с его меньшим содержанием.
Рис. 5.
Зависимости конверсии CO от температуры реакции для частиц Co3O4/SiO2 с массовым содержанием оксида кобальта 4 мас. % (сплошные линии, светлые символы – нагрев, пунктирные линии, темные символы – охлаждение) для первого (1) и второго (2) циклов нагрева–охлаждения.
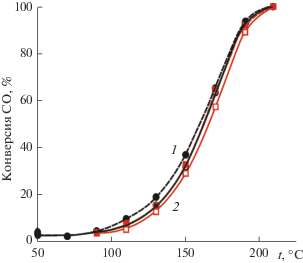
Таблица 1.
Температуры 50%- и 90%-ной конверсии СО в 2 последовательных циклах нагревания и охлаждения на образцах с различным содержанием Co3O4
| Co3O4, мас. % | Цикл | t50, °С | t90, °С | ||
|---|---|---|---|---|---|
| нагрев | охлаждение | нагрев | охлаждение | ||
| 4 | 1 2 |
160 165 |
162 162 |
186 191 |
187 187 |
| 2 | 1 2 |
158 163 |
160 160 |
180 183 |
182 181 |
Для оксидов кобальта, нанесенных на γ- или α-Al2O3, 100%-ная конверсия СО в избытке кислорода достигается при температурах выше 200 и 300°С соответственно [19, 20]. Для катализаторов Co3O4/MCM-41 с 6% Co3O4, более близкого состава с синтезированными нами образцами, величины 50%- и 100%-ной конверсии в зависимости от условий синтеза лежат в интервалах 180–152 и 285–222°С [21]. Отметим, что приведенные значения конверсии СО также получены для реакционной смеси с большим содержанием СО и избытком кислорода (4% СО, 20% O2, Не), что должно способствовать более эффективному окислению. Данных о возможности повторного использования образцов в указанных работах не приведено. Поскольку окисление СО весьма чувствительно к условиям проведения процесса (концентрация и соотношение компонентов в реакционной смеси, скорость потока газа-носителя, конструкция реактора и др.), корректное сопоставление данных возможно только для катализаторов, протестированных в одинаковых условиях. Для одной из перспективных каталитических систем на основе Со-модифицированных цеолитов с содержанием оксида кобальта 2.8 мас. % температура t50 в условиях, аналогичных нашей работе, составила 190°С в режиме нагрева и лишь затем понизилась до 170°С при повторном использовании катализатора в режиме охлаждения [22]. Использование синтезированных в работе частиц Co3O4/SiO2 обеспечивает значение t50 в интервале 165–160°С. Эффективное действие катализаторов сохраняется при повторном использовании образцов.
ЗАКЛЮЧЕНИЕ
Разработана методика получения частиц с крупными мезопорами (более 10 нм) методом химического травления микро-мезопористых частиц в смеси аммиак + вода + пероксид водорода. Предложен механизм формирования крупных мезопор за счет объединения соседних пор нанометрового размера посредством обратимого растворения кремнезема с образованием гидросиликат-ионов. Методами ПЭМ и азотной адсорбционной порометрии показано, что полученные частицы имеют сферическую форму, содержат мезопоры (размером 5–25 нм) и микропоры (0.6–2 нм). Удельные поверхность и объем пор частиц составляют 510 м2/г и 0.79 см3/г соответственно.
С использованием метода капиллярной пропитки в порах частиц синтезирован Co3O4 (2–4 мас. %). Продемонстрировано, что композитные частицы Co3O4/SiO2 обладают большими значениями удельной поверхности и объема пор (до 410 м2/г и 0.61 см3/г). Исследована активность композитных частиц в каталитическом окислении монооксида углерода кислородом. По эффективности действия синтезированные частицы Co3O4/SiO2 сопоставимы и даже чуть превосходят известные катализаторы на основе оксидных нанопористых носителей и Co3O4. Величины t50 для образцов с 2 и 4 мас. % Co3O4 близки к 160°С, а полная конверсия СО достигается при температурах вблизи 200°С. Важным достоинством предложенных композитных материалов является сохранение их эффективности при повторном использовании.
Список литературы
Verma P., Kuwahara Y., Mori K., Raja R., Yamashita H. Functionalized Mesoporous SBA-15 Silica: Recent Trends and Catalytic Applications // Nanoscale. 2020. V. 12. P. 11333–11363. https://doi.org/10.1039/D0NR00732C
Ramasamy D.L., Puhakka V., Iftekhar S., Wojtuś A., Repo E., Ben Hammouda S., Iakovleva E., Sillanpää M. N- and O-Ligand Doped Mesoporous Silica-Chitosan Hybrid Beads for the Efficient, Sustainable and Selective Recovery of Rare Earth Elements (REE) from Acid Mine Drainage (AMD): Understanding the Significance of Physical Modification and Conditioning of the Polymer // J. Hazard. Mater. 2018. V. 348. P. 84–91. https://doi.org/10.1016/j.jhazmat.2018.01.030
Yang J., Lin G.-S., Mou C.-Y., Tung K.-L. Mesoporous Silica Thin Membrane with Tunable Pore Size for Ultrahigh Permeation and Precise Molecular Separation // ACS Appl. Mater. Interfaces. 2020. V. 12. P. 7459−7465.https://doi.org/10.1021/acsami.9b21042
Wang Y., Zhao Q., Han N., Bai L., Li J., Liu J., Che E., Hu L., Zhang Q., Jiang T., Wang S. Mesoporous Silica Nanoparticles in Drug Delivery and Biomedical Applications // Nanomedicine: NBM. 2015. V. 11. P. 313–327. https://doi.org/10.1016/j.nano.2014.09.014
Eurov D.A., Kurdyukov D.A., Medvedev A.V., Kirilenko D.A., Tomkovich M.V., Golubev V.G. Micro-Mesoporous Submicron Silica Particles with Pore Size Tunable in a Wide Range: Synthesis, Properties and Prospects for LED Manufacturing // Nanotechnology. 2021. V. 32. P. 215604. https://doi.org/10.1088/1361-6528/abe66e
Unger K.K., Kumar D., Grün M., Büchel G., Lüdtke S., Adam Th., Schumacher K., Renker S. Synthesis of Spherical Porous Silicas in the Micron and Submicronsize Range: Challenges and Opportunities for Miniaturized High-Resolution Chromatographic and Electrokinetic Separations // J. Chromatogr. A. 2000. V. 892. P. 47–55. https://doi.org/10.1016/s0021-9673(00)00177-1
Asefa T., Tao Z. Biocompatibility of Mesoporous Silica Nanoparticles // Chem. Res. Toxicol. 2012. V. 25. P. 2265–2284. https://doi.org/10.1021/tx300166u
Vivero-Escoto J.L., Slowing I.I., Trewyn B.G., Lin V.S.-Y. Mesoporous Silica Nanoparticles for Intracellular Controlled Drug Delivery // Small. 2010. V. 6. P. 1952–1967. https://doi.org/10.1002/smll.200901789
Horcajada P., Rámila A., Pérez-Pariente J., Vallet-Regi M. Influence of Pore Size of MCM-41 Matrices on Drug Delivery Rate // Microporous Mesoporous Mater. 2004. V. 68. P. 105–109. https://doi.org/10.1016/j.micromeso.2003.12.012
Unger K.K., Skudas R., Schulte M.M. Particle Packed Columns and Monolithic Columns in High-Performance Liquid Chromatography-Comparison and Critical Appraisal // J. Chromatogr. A. 2008. V. 1184. P. 393–415https://doi.org/10.1016/j.chroma.2007.11.118
Beck J.S., Vartuli J.C., Roth W.J., Leonowicz M.E., Kresge C.T., Schmitt K.D., Chu T.W.C., Olson D.H., Sheppard E.W., McCullen S.B., Higgins J.B., Schlenker J.L. A New Family of Mesoporous Molecular Sieves Prepared with Liquid Crystal Templates // J. Am. Chem. Soc. 1992. V. 114. P. 10834–10843https://doi.org/10.1021/ja00053a020
Jana S.K., Mochizuki A., Namba S. Progress in Pore-Size Control of Mesoporous MCM-41 Molecular Sieve Using Surfactant Having Different Alkyl Chain Lengths and Various Organic Auxiliary Chemicals // Catal. Surf. 2004. V. 8. P. 1–13. https://doi.org/10.1023/B:CATS.0000015110.85694.d9
Knežević N.Ž., Durand J.-O. Large Pore Mesoporous Silica Nanomaterials for Application in Delivery of Biomolecules // Nanoscale. 2015. V. 7. P. 2199–2209. https://doi.org/10.1039/C4NR06114D
Стовпяга Е.Ю., Грудинкин С.А., Курдюков Д.А., Кукушкина Ю.А., Нащекин А.В., Соколов В.В., Yakovlev D.R., Голубев В.Г. Монодисперсные сферические мезо-макропористые частицы кремнезема: синтез и адсорбция биомакромолекул // ФТТ. 2016. Т. 58. С. 2256–2261. https://doi.org/10.21883/ftt.2016.11.43751.144
Royer S., Duprez D. Catalytic Oxidation of Carbon Monoxide over Transition Metal Oxides // ChemCatChem. 2011. V. 3. P. 24–65. https://doi.org/10.1002/cctc.201000378
Kurdyukov D.A., Eurov D.A., Kirilenko D.A., Kukushkina J.A., Sokolov V.V., Yagovkina M.A., Golubev V.G. High-Surface Area Spherical Micro-Mesoporous Silica Particles // Microporous Mesoporous Mater. 2016. V. 223. P. 225–229https://doi.org/10.1016/j.micromeso.2015.11.018
Kurdyukov D.A., Eurov D.A., Sokolov V.V., Golubev V.G. Tailoring the Size and Microporosity of Stöber Silica Particles // Microporous Mesoporous Mater. 2018. V. 258. P. 205–210. https://doi.org/10.1016/j.micromeso.2017.09.017
Żegliński J., Piotrowski G.P., Piękoś R. A Study of Interaction between Hydrogen Peroxide and Silica Gel by FTIR Spectroscopy and Quantum Chemistry // J. Mol. Struct. 2006. V. 794. P. 83–91https://doi.org/10.1016/j.molstruc.2006.01.043
Zhang L., Dong L., Yu W., Liu L., Deng Y., Liu B., Wan H., Gao F., Sun K., Dong L. Effect of Cobalt Precursors on the Dispersion, Reduction, and CO Oxidation of CoOx/γ-Al2O3 Catalysts Calcined in N2 // J. Colloid Interface Sci. 2021. V. 355. P. 464–471. https://doi.org/10.1016/j.jcis.2010.11.076
Hattori M., Nakakura S., Katsui H., Goto T., Ozawa M. High CO Reactivity of Cobalt Oxide Catalyst Deposited on Alumina Powders by Rotary Chemical Vapor Deposition // Mater. Lett. 2021. V. 284. P. 128922. https://doi.org/10.1016/j.matlet.2020.128922
Hassan H.M.A., Betiha M.A., Elshaarawy R.F.M, Samy El-Shall M. Promotion Effect of Palladium on Co3O4 Incorporated within Mesoporous MCM-41 Silica for CO Oxidation // Appl. Surf. Sci. 2017. V. 402. P. 99–107. https://doi.org/10.1016/j.apsusc.2017.01.061
Shilina M.I., Rostovshchikova T.N., Nikolaev S.A., Udalova O.V. Polynuclear Co-oxo Cations in the Catalytic Oxidation of CO on Co-Modified ZSM-5 Zeolites // Mater. Chem. Phys. 2019. V. 223. P. 287–298. https://doi.org/10.1016/j.matchemphys.2018.11.005
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


