Неорганические материалы, 2021, T. 57, № 9, стр. 1008-1017
Синтез субмикронных порошков замещенных фосфатов кальция Са3 – хNa2х(PO4)2 в неводной среде для стереолитографического формирования биокерамики
Д. С. Ларионов 1, П. В. Евдокимов 1, 2, А. В. Гаршев 1, 2, Д. А. Козлов 1, В. И. Путляев 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова, Факультет наук о материалах
119991 Москва, Ленинские горы, 1, стр. 73, Россия
2 Московский государственный университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: valery.putlayev@gmail.com
Поступила в редакцию 02.12.2020
После доработки 24.04.2021
Принята к публикации 25.04.2021
Аннотация
Проведено сравнение способов синтеза трикальцийфосфата (ТКФ) β-Са3(РО4)2 и замещенных фосфатов кальция Ca3– xNa2x(PO4)2 (x = 0.5 и 1 – твердый раствор А и натриевый ренанит β-CaNaPO4 соответственно) осаждением и золь–гель-методом в среде этиленгликоля (ЭГ). Охарактеризованы фазовый состав и микроморфология порошков синтезированных фосфатов. При температурах выше 110°С и медленном добавлении (ди)гидрофосфата аммония к этиленгликоляту кальция из растворов осаждается кристаллический β-ТКФ (средний размер частиц менее 200 нм). При синтезе замещенных фосфатов натрия-кальция сольволиз натриевых фосфатов препятствует конгруэнтному осаждению и требует корректировки состава раствора; осажденный из раствора этилата натрия и этиленгликолята кальция в ЭГ (мольное соотношение более 2) порошок при 800°С кристаллизуется в структуре ренанита (размер частиц менее 500 нм). В рамках золь–гель-синтеза в качестве фосфатного компонента применен триэтилфосфат (ТЭФ); для гелеобразования использованы сольволиз ТЭФ в ЭГ и образование сложноэфирных полимеров при взаимодействии лимонной кислоты с ЭГ (метод Печини). Продукты термолиза гелей при 600–800°С содержат значительные количества остаточного углерода. Гранулометрические характеристики и спекаемость порошков фосфатов кальция, осажденных из растворов в ЭГ, позволяют применять их для наполнения фотосуспензий, используемых при формировании остеокондуктивной биокерамики с помощью стереолитографической 3D-печати.
ВВЕДЕНИЕ
Резорбируемые фосфаты кальция представляют значительный интерес в качестве неорганической основы материалов, предназначенных для регенерации костной ткани [1]. С точки зрения выбора химического состава, переход к резорбируемым фосфатам – это переход от гидроксиапатита (ГА) Са10(РО4)6(ОН)2 к фосфатам с меньшим отношением Са/Р – трикальцийфосфату (ТКФ) β-Са3(РО4)2 [2] или его замещенным аналогам Са3 –хМ2х(РО4)2 (М = Na, K) [3]. В системах Са3(РО4)2–СаМРО4 в зависимости от состава и температуры синтеза возможно образование фаз на основе как ТКФ, так и низкотемпературной β‑СаМРО4 и высокотемпературной α‑Са3 –хМ2х(РО4)2 фаз со структурой ренанита, обладающих большей резорбируемостью (растворимостью) по сравнению с ТКФ [4–8]. Дополнительный фактор, влияющий на растворимость, – размер кристаллитов [9], что обуславливает закономерный интерес к синтезу наноразмерных порошков.
Порошки резорбируемых фосфатов используют в качестве наполнителей при создании композитов или формируют из них биокерамику. В любом случае имплантат должен обладать остеокондуктивными свойствами (способностью к прорастанию кости в имплантат), обусловленными связной системой макропор с размерами не менее 100 мкм [10]. Универсальным методом формирования такой структуры является 3D-печать, в частности, стереолитография, обладающая высоким пространственным разрешением [11]. Существуют определенные требования к гранулометрическому составу порошков фосфатов, используемых в стереолитографической печати: оптимальный средний размер частиц 100–500 нм, узкое распределение частиц по размерам, регулярный габитус частиц [12]. Таким образом, синтез субмикронных порошков резорбируемых фосфатов востребован и с точки зрения их дальнейшего формования в макропористый имплантат.
В отличие от ГА резорбируемые фосфаты со структурой ТКФ и ренанита не могут быть синтезированы осаждением из раствора, а являются, в большинстве работ, продуктами высокотемпературных твердофазных реакций, что неизбежно приводит к крупнозернистым порошкам с широким распределением частиц по размерам [9, 13]. Альтернативой твердотельному (керамическому) синтезу являются процессы в неводных средах, например, осаждение из неводных растворов и золь–гель-процесс [14]. В литературе есть сведения о синтезе ТКФ в водно-метанольных [15] и водно-этиленгликольных растворах [16, 17]. Ранее нами был предложен синтез нанокристаллического ТКФ осаждением из неводных этиленгликольных растворов по схеме
(1)
$\begin{gathered} 3{{\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{О}}} \right)}_{2}}{\text{Ca}} + 2{\text{A}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{4}} \to \\ \to \,\,{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{\kern 1pt} \downarrow + \,\, \ldots , \\ \end{gathered} $Схемы золь–гель-синтезов разработаны в основном для ГА, причем как для водных [19], так и для водно-органических растворов [20]. В отношении синтеза ТКФ сведений практически нет [21], и, насколько нам известно, их нет для фосфатов со структурой ренанита. Основные проблемы золь–гель-синтеза фосфатов кальция связаны с выбором эффективного гелеобразующего агента и фосфатного компонента [14, 22]. Последний не должен вступать в реакцию с солью кальция и вызывать преждевременное осаждение фосфата с образованием грубодисперсной суспензии. Довольно часто в качестве фосфатного реагента выбирают алкилфосфаты (RO)3 – n(OH)nP=O (n = 0, 1, 2) [20, 22, 23] и алкилфосфиты (RO)3P [14]; они же выступают и в роли гелеобразователей. Успех золь–гель-синтеза (полнота гелеобразования) напрямую зависит от скорости гидролиза, что определяется скоростью гидролиза фосфатного гелеобразователя. Определенную роль (сопоставимую с таковой в случае классического золь–гель-синтеза по методу Печини [24]) в образовании олигомеров играет мостиковый координирующий растворитель – этиленгликоль (ЭГ) НO–СН2–СН2–ОН, способный координировать катион кальция и образовывать сложноэфирную связь. Следует, однако, отметить, что способность к гелеообразованию у алкилфосфорных соединений значительно хуже, чем у таких классических гелеобразующих агентов, как, например, тетраэтоксисилан (ТЭОС) или алкоголяты титана.
Целью данной работы стало изучение возможности синтеза нанокристаллических порошков замещенных фосфатов кальция Са3 – хNa2х(РО4)2 заданного химического и фазового составов в среде неводного растворителя (ЭГ) методами осаждения и золь–гель для их последующего использования при изготовлении остеокондуктивных (макропористых) костных имплантатов стереолитографической 3D-печатью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез этиленгликолятов кальция и натрия. Гидрид кальция (Русхим № 4857) помещали в безводный ЭГ (Sigma-Aldrich № 293237-1L, 200–1000 ppm воды по Фишеру). Синтез проводили согласно реакции (2) до полного растворения гидрида кальция при слабом нагревании; при этом раствор приобретал слабый желтоватый оттенок
(2)
$\begin{gathered} {\text{Ca}}{{{\text{Н}}}_{2}} + 2\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}} \right){{\left( {{\text{ОН}}} \right)}_{2}} \to \\ \to \,\,{{\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{О}}} \right)}_{{\text{2}}}}{\text{Ca}} + 2{{{\text{H}}}_{2}}{\kern 1pt} \uparrow . \\ \end{gathered} $Этилат натрия (Sigma-Aldrich № 156248-500G) растворяли в безводном ЭГ, при этом проходил его сольволиз по реакции (3); раствор имел слабый желтоватый оттенок
(3)
$\begin{gathered} {\text{NaO}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{5}} + \left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}} \right){{\left( {{\text{ОН}}} \right)}_{2}} \to \\ \to \,\,{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{ОNa}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}. \\ \end{gathered} $Получение раствора алкилфосфатов в ЭГ. Оксид фосфора(V) (Sigma-Aldrich, 214701-500G) растворяли при охлаждении в безводном ЭГ (соотношение Р2О5 : спирт = 0.1 моль вещества на литр растворителя) с получением смеси моно- и диалкилфосфатов
(4)
$\begin{gathered} {{{\text{Р}}}_{{\text{2}}}}{{{\text{О}}}_{5}} + \left( {{{{\text{С}}}_{2}}{{{\text{Н}}}_{4}}} \right){{\left( {{\text{ОН}}} \right)}_{2}} \to \\ \to \,\,{{\left( {\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}} \right)\left( {{\text{ОН}}} \right){\text{О}}} \right)}_{{\text{2}}}}\left( {{\text{ОН}}} \right){\text{Р = О}} + \\ + \,\left( {\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}} \right)\left( {{\text{ОН}}} \right){\text{О}}} \right){{\left( {{\text{ОН}}} \right)}_{{\text{2}}}}{\text{Р = О}}. \\ \end{gathered} $Синтез замещенных фосфатов кальция осаждением в ЭГ. Для проведения синтеза коммерческий NH4H2PO4 (Sigma-Aldrich № 216003-500G) служил в качестве фосфатного реагента. Кальцийсодержащим реагентом являлся полученный ранее этиленгликолят кальция (раствор 0.2М). В качестве источника натрия использовали раствор этилата натрия (раствор 0.2М). Дигидрофосфат аммония растворяли в ЭГ при температуре 60–80°С (0.05М). Ранее нами обсуждался вопрос о превращении гидрофосфата аммония в дигидрофосфат при нагревании выше 110°C и связанное с этим заметное увеличение растворимости фосфата (0.6 г при 25°C и 1.8 г в 100 г ЭГ при 80°C) [18]. При температурах 25–150°C растворы быстро сливали или медленно добавляли (≈0.5 мл/мин) друг к другу
(5)
$\begin{gathered} 3{{\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{О}}} \right)}_{{\text{2}}}}{\text{Ca}} + 2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{4}} \to \\ \to \,\,{\text{C}}{{{\text{a}}}_{{\text{3}}}}{{{\text{(P}}{{{\text{O}}}_{{\text{4}}}})}_{2}}{\kern 1pt} \downarrow + {\text{ }}6{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{{{\text{(OН)}}}_{{\text{2}}}} + 2{\text{N}}{{{\text{H}}}_{3}}{\kern 1pt} \uparrow , \\ \end{gathered} $(6)
$\begin{gathered} {{\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{О}}} \right)}_{{\text{2}}}}{\text{Ca}} + {\text{NaO(OH)}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{4}} + \\ + \,\,{\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{4}} \to {\text{CaNaP}}{{{\text{O}}}_{{\text{4}}}}{\kern 1pt} \downarrow + \\ + \,\,3{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{{{\text{(OН}})}_{2}} + {\text{N}}{{{\text{H}}}_{3}}{\kern 1pt} \uparrow . \\ \end{gathered} $Осадок перемешивали при температуре сливания в течение 0.25–2 ч, осаждали центрифугированием, промывали этиловым спиртом, а затем высушивали в сушильном шкафу при температуре 90°С в течение суток.
Осаждение фосфатов кальция из растворов в ЭГ проводили в трехгорлой колбе с обратным холодильником и термометром при перемешивании магнитной мешалкой, фосфатный реагент вводили при помощи капельной воронки.
Синтез замещенных фосфатов кальция методом золь–гель. Для синтеза использовали коммерческие трибутилфосфат (ТБФ) и триэтилфосфат (ТЭФ) (Sigma-Aldrich № 216003-500G) в качестве фосфатных реагентов. Кальцийсодержащим реагентом служил полученный ранее этиленгликолят кальция (раствор 0.2М), источником натрия – предварительно полученный этилат натрия (раствор 0.2М в ЭГ). Эфиры фосфорной кислоты растворяли в ЭГ при комнатной температуре (0.05М). Далее растворы этиленгликолята кальция и этилата натрия сливали, а к полученному раствору добавляли избыток раствора лимонной кислоты (Sigma-Aldrich 27487-250G-F) в ЭГ (0.1М) и нагревали до 90°C. В случае выпадения осадка добавляли раствор лимонной кислоты. После этого добавляли рассчитанное количество раствора фосфорного эфира и нагревали до 150°C. В ходе длительного упаривания происходило потемнение раствора и постепенное гелеобразование. Полученные гели дополнительно высушивали и подвергали термической обработке при 600°C.
Рентгенофазовый анализ (РФА) проводили на рентгеновском дифрактометре Rigaku D/Max-2500 с вращающимся анодом (Япония). Съемка осуществлялась в режиме на отражение (геометрия Брэгга–Брентано) в кварцевых кюветах без усредняющего вращения с использованием CuKср-излучения. Качественный анализ полученных рентгенограмм проводили с использованием базы данных ICDD PDF-2.
Распределение частиц по размерам находили методом динамического рассеяния света на приборе Zetasizer Nano ZS в диапазоне 0.3 нм–10 мкм, а также на приборе лазерной дифракции Fritsch Analysette-22 в диапазоне 0.2 мкм–100 мкм.
Растровая электронная микроскопия (РЭМ) и рентгеноспектральный микроанализ (РСМА) проведены на растровых электронных микроскопах с автоэмиссионным источником LEO SUPRA 50VP и NVision 40 (Carl Zeiss, Германия). Ускоряющее напряжение электронной пушки составляло 2–21 кВ. Изображения получали во вторичных электронах при увеличениях до 200 000×. Для оценки однородности распределения фаз и элементного состава образцов проводили РСМА при помощи электронного микроскопа NVision 40, снабженного системой энергодисперсионного микроанализа INCA Energy+ (Oxford Instruments, Великобритания), а также при помощи электронного микроскопа Leo SUPRA0VP, оснащенного системой энергодисперсионного микроанализа INCA Energy 300 (Oxford Instruments, Великобритания) при ускоряющих напряжениях 15–21 кВ.
Содержание воды в растворителях определяли на кулонометрическом титраторе 756 KF Coulometer (metrohm ion analysis) по методу Фишера.
Расчет геометрической плотности высушенных на воздухе образцов в виде столбиков (после проведения шлифовки для механических испытаний) осуществляли, измеряя массу образцов (с точностью до 10–4 г) и линейные размеры (с точностью до 10 мкм, микрометр).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез замещенных фосфатов кальция-натрия осаждением из этиленгликольных растворов
Синтез ТКФ. Гидрид кальция растворяли в ЭГ по реакции (2) исходя из концентрации 0.2М в течение суток вплоть до полного растворения. Реакция протекает медленно, с постепенным выделением водорода, без нагрева реакционной смеси. Фосфаты аммония предварительно сушили, затем измельчали в планетарной мельнице, после чего готовили растворы исходя из концентрации 0.05М. Этилат натрия растворяли в ЭГ из расчета концентрации 0.2М. В результате быстрого растворения образовывался слегка желтоватый раствор.
Основные черты схемы, описываемой реакцией (1), в случае синтеза ТКФ: сохранение стехиометрии исходных растворов в стехиометрии осадка; плохая растворимость фосфатов кальция в ЭГ – в принципе, позволяют синтезировать осаждением в среде ЭГ замещенные фосфаты Ca3 – хNa2х(PO4)2. Однако наши предыдущие попытки [18] синтезировать натриевый ренанит CaNaPO4 по реакции
(7)
$\begin{gathered} {{\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{О}}} \right)}_{{\text{2}}}}{\text{Ca}} + {\text{HCOONa}} + {\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{4}} \to \\ \to \,\,{\text{CaNaP}}{{{\text{O}}}_{4}}{\kern 1pt} \downarrow + \,\,2{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{{{\text{(OH)}}}_{2}} + {\text{HCOON}}{{{\text{H}}}_{{\text{4}}}}, \\ \end{gathered} $а также замещенный фосфат произвольного состава
(8)
$\begin{gathered} \left( {3--х} \right){{\left( {{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{О}}} \right)}_{{\text{2}}}}{\text{Ca}} + 2х{\text{HCOONa}} + \\ + \,\,2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{4}} \to {\text{C}}{{{\text{a}}}_{{3--х}}}{\text{N}}{{{\text{a}}}_{{2х}}}{{({\text{P}}{{{\text{O}}}_{4}})}_{2}}{\kern 1pt} \downarrow + \\ + \,\,\left( {6--2х} \right){{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{{{\text{(OH}})}_{2}} + \\ + \,\,2х{\text{HCOON}}{{{\text{H}}}_{4}} + \left( {2--2х} \right){\text{N}}{{{\text{H}}}_{3}} \\ \end{gathered} $не привели к успеху. В определенной степени это отражает и безуспешную попытку осадить ортофосфат натрия Na3PO4, используя те же реагенты, что и в реакциях выше. Поскольку константа автопротолиза для ЭГ рKs = 15.6 ближе к таковой для воды, чем, скажем, для этилового спирта (14 и 19.14 соответственно) [25], то для гидролизуемых солей возможно протекание сольволиза в ЭГ
(9)
$\begin{gathered} {\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} + {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{{{\text{(OH}})}_{2}} \leftrightarrow \\ \leftrightarrow \,\,{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{ОNa}} + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{HP}}{{{\text{O}}}_{4}}. \\ \end{gathered} $По данным, приведенным в [26], константа равновесия (9) может быть оценена как Kгидр ≈ ≈ 5.7 × 10–3 при 30°С (оценка исходя из Kгидр = = Ks(ЭГ)/Kа3(Н3РО4) дает близкую по порядку величину 5.4 × 10–4) и 3.5 × 10–3 при 197°С. Таким образом, реакция сольволиза слабо экзотермична (исходя из вышеприведенных данных ΔсольвН° ≈ ≈ –8.6 кДж) и сдвиг равновесия (9) влево может быть достигнут при нагревании и введении в реакционную смесь избытка этиленгликолята натрия. При повышении температуры растут растворимости обоих фосфатов натрия (причем растворимость Na3PO4 превышает таковую для Na2HPO4), а растворимость С2Н4(ОН)ОNa падает [26]
(10)
$\begin{gathered} 3{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}\left( {{\text{ОН}}} \right){\text{ОNa}} + {\text{N}}{{{\text{H}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{2}}}}{\text{P}}{{{\text{O}}}_{4}} \to \\ \to \,\,{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} + 3{{{\text{С}}}_{{\text{2}}}}{{{\text{Н}}}_{{\text{4}}}}{{\left( {{\text{ОН}}} \right)}_{2}} + {\text{N}}{{{\text{H}}}_{3}}. \\ \end{gathered} $Чтобы проверить возможность осаждения ортофосфата натрия добавляли раствор дигидрофосфата аммония к раствору этиленгликолята натрия исходя из стехиометрии реакции (10). В ходе реакции происходило небольшое помутнение раствора, при центрифугировании которого образовывалось незначительное количество аморфного осадка. Полное высушивание полученного продукта указывало на малую степень осаждения. Важно отметить, что при остывании раствора происходило постепенное растворение осадка, что несколько противоречит данным [26] об увеличении растворимости фосфатов натрия при нагревании. Возможным решением проблемы будет использование концентрированных растворов прекурсоров, в первую очередь этилата натрия, что увеличит пересыщение раствора, с одной стороны, и сдвинет равновесие (9) в сторону осаждения фосфата натрия – с другой.
Синтез натрийзамещенных фосфатов кальция осаждением из этиленгликольных растворов. Синтез натриевого ренанита проводили согласно реакции (6), а состава, отвечающему фазе А Ca3 – xNa2x(PO4)2 (x = 0.5) – при одновременном протекании реакций (5) и (6). Для этого приготовленный раствор дигидрофосфата аммония добавляли к раствору, содержащему этиленгликоляты кальция и натрия в заданном соотношении. Температура принимающего раствора составляла 110°С, время добавления варьировалось от 15 до 120 мин. После окончания сливания растворов полученная реакционная смесь перемешивалась в течение 10 мин, после чего происходило центрифугирование, промывание этиловым спиртом и сушка в течение 24 ч при 90°С.
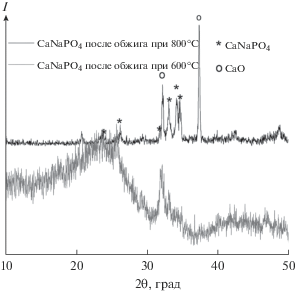
Согласно данным РФА (рис. 1) можно сделать вывод о возможности образования кристаллического ренанита уже при температуре синтеза. Тем не менее, уже на стадии получения осадков заметна примесь ГА. Термическая обработка полученных образцов приводит по этой причине к образованию заметной доли β-ТКФ. Образование ГА несомненно указывает на остаточное количество воды в составе растворителей и исходных веществ. Взаимодействие же ГА с ренанитом при высоких температурах может приводить к увеличению доли ТКФ в конечном составе керамики.
Рис. 1.
Рентгенограммы полученных порошков состава, соответствующего ренаниту (а), фазе А (б), до и после обжига.
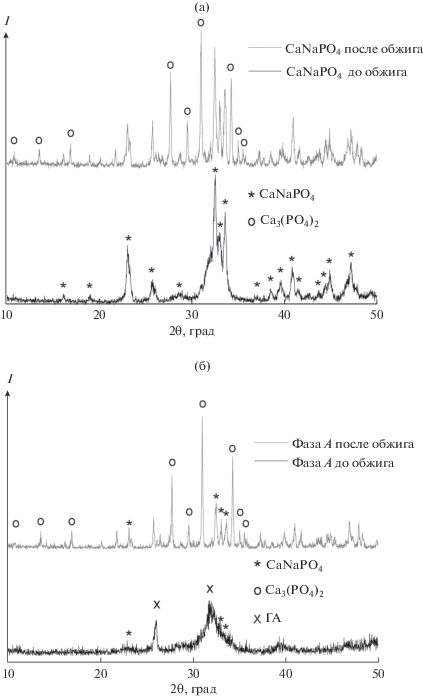
Растворимость натриевых солей как в воде, так и, частично, в ЭГ может приводить к отклонению состава керамики от ожидаемого соотношения Ca/Na. На это также указывают данные проведенного элементного анализа (РСМА), согласно которым общее содержание натрия примерно в два раза ниже содержания кальция в образце. Был проведен синтез ренанита с избытком (в том числе, четырехкратным) этиленгликолята натрия относительно стехиометрического состава. По результатам РФА (рис. 2) можно сделать вывод о необходимости использования избытка источника натрия при получении натрийзамещенных фосфатов кальция осаждением из растворов в ЭГ.
Рис. 2.
Рентгенограмма порошка, обожженного при 1000°С, полученного осаждением в избытке этиленгликолята натрия.
По данным РЭМ (рис. 3) можно сделать вывод о наличии выраженной сферической формы частиц, отвечающих фазе ренанита (рис. 3а–3в), при этом можно отметить рост размера частиц при увеличении времени реакции. Необходимо также отметить и наличие кристаллитов пластинчатой формы, характерной для ТКФ и ГА. Наиболее ярко она проявляется для осадков, отвечающих фазе А. По данным динамического светорассеяния для порошков, полученных при разном времени сливания (рис. 4), можно сделать вывод о постепенном увеличении размера частиц с увеличением времени синтеза, что может быть использовано при направленном синтезе частиц заданных размера и формы. По данным РЭМ, в керамических образцах (рис. 5) присутствуют хорошо оформленные частицы субмикронного размера (от 200 до 500 нм для ренанита и около 1 мкм для ТКФ).
Рис. 3.
Микрофотография порошка, полученного по реакции осаждения в течение 30 мин (а); РЭМ-изображение образца, полученного осаждением в течение 120 мин (б); сравнение формы частиц ренанита (в) и состава, отвечающего фазе А (г).

Рис. 4.
Данные динамического светорассеяния для осадков, полученных с разной скоростью протекания реакции.
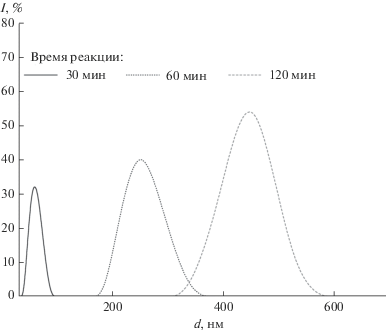
Рис. 5.
Микрофотографии образцов, полученных обжигом осадков, составы которых отвечают ренаниту (а) и фазе А (б).

Синтез замещенных фосфатов кальция-натрия методом золь–гель. Золь–гель-метод был опробован с использованием разных источников фосфора – растворов ТЭФ, ТБФ и пентаоксида фосфора в ЭГ (по реакции (4)). Источниками кальция служили помимо этиленгликолята кальция ацетат и нитрат кальция. Выбор солей кальция обусловлен возможностью образования кислот, что может способствовать катализу процессов этерификации.
В случае использования алкилфосфатов на основе пентаоксида фосфора и ЭГ при незначительном нагревании происходило выпадение осадка фосфата кальция, что может свидетельствовать о большой реакционной способности таких фосфатных прекурсоров. В случае ТЭФ и ТБФ осаждение отсутствовало, что говорит о термической устойчивости эфиров. Это позволило нагреть реакционные смеси до более высоких температур и провести упаривание. В обоих вышеописанных подходах не происходило образования геля (в отличие от данных [20]), поэтому было решено применить метод Печини, использующий лимонную кислоту. Это позволит избежать выпадения осадка за счет комплексообразующего действия цитрат-ионов на катионы кальция и будет способствовать гелеобразованию.
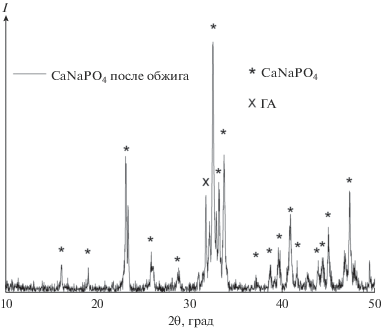
Для проведения синтеза в модификации Печини использовали коммерческие ТБФ и ТЭФ в качестве фосфатных реагентов, выбор которых был обусловлен прочностью молекул этих алкилфосфатов, что позволяет избежать преждевременного образования осадка фосфата кальция и, следовательно, неравномерного распределения компонентов в конечном продукте. В ходе длительного упаривания происходило постепенное потемнение раствора и увеличение вязкости с последующим гелеобразованием, которое отсутствовало для подобных систем без лимонной кислоты. Полученные гели дополнительно высушивали, измельчали и подвергали термической обработке в течение 2 ч при 600 и 800°C. Продукты термолиза гелей содержат значительные количества остаточного углерода, что, в принципе, позволяет использовать их для метода стереолитографической 3D-печати, имея в виду улучшение разрешения печати за счет поглощения рассеянного излучения мелкодисперсным углеродом. Данные РФА указывают на неполноту процесса разложения геля и, как следствие, кристаллизации порошков даже при относительно высоких температурах (рис. 6).
Таким образом, сравнение ТЭФ и менее склонного к гидролизу ТБФ для целей гелеобразования по методу Печини не выявило существенных различий. Для составов, рассчитанных на стехиометрию как ренанита, так и ТКФ, возникает примесь оксида кальция, что может свидетельствовать о необходимости изначальной корректировки состава геля.
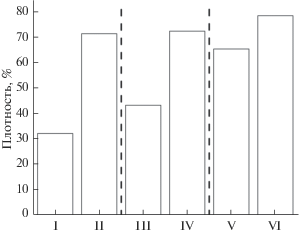
Синтезированные из растворов в ЭГ методом осаждения и методом Печини микрокристаллические порошки обладают высокой активностью в процессах спекания (1000°С, 2 ч) в сравнении с порошками, синтезированными твердофазным методом (рис. 7). Морфологические характеристики и активность к спеканию порошков на основе β-СаNaPO4 делают их приемлемыми для изготовления макропористой биокерамики методами стереолитографической 3D-печати.
Рис. 7.
Изменение плотности при спекании керамики из ренанита: I и III – порошок, полученный синтезом в ЭГ при 110°С (перемешивание 2 ч, сушка при 90°С) (I) и методом Печини (обжиг 600°С, 2 ч) (III), II и IV – образцы I и III после обжига при 1000°С в течение 2 ч соответственно; V и VI – ренанит, синтезированный твердофазным методом при 900°С и обожженный при 1000°С в течение 2 ч соответственно.
ЗАКЛЮЧЕНИЕ
Разработана методика синтеза натрийзамещенных фосфатов кальция в среде этиленгликоля, заключающаяся в медленном добавлении этиленгликольного раствора гидрофосфатов аммония к раствору этиленгликолятов Са и Na при температурах выше 110°С. При осаждении CaNaPO4 из раствора выпадает мелкодисперсный осадок, представляющий собой слабо закристаллизованный ренанит (с примесью гидроксиапатита при наличии остаточной воды в реакционной смеси) в виде равноосных частиц с размерами от 100 до 400 нм в зависимости от условий синтеза. К недостаткам методики следует отнести необходимость использования избытка источника натрия, что может быть связано с заметной растворимостью фосфатов натрия в этиленгликоле и протеканием сольволиза.
Применение золь–гель-метода в модификации Печини позволяет получить гели из этиленгликолевых растворов, содержащих соли кальция и алкилфосфатов в присутствии лимонной кислоты. Термическая обработка гелей при температурах выше 600°С приводит к образованию плохо закристаллизованного мелкодисперсного продукта. К недостаткам данного способа следует отнести большой расход растворителя, длительное время синтеза и возможное образование продуктов разложения органических соединений кальция, что может вызвать необходимость изначальной корректировки состава геля. В этой связи методика осаждения натрийзамещенных фосфатов кальция из растворов в этиленгликоле видится предпочтительной.
Синтезированные из растворов в этиленгликоле методом осаждения и методом Печини субмикронные порошки обладают высокой активностью в процессах спекания по сравнению с порошками, синтезированными твердофазным методом. Морфологические характеристики и активность к спеканию порошков на основе β-СаNaPO4 делают их приемлемыми для изготовления макропористой биокерамики методами стереолитографической 3D-печати.
Список литературы
Habraken W., Habibovic P., Epple M., Bohner M. Calcium Phosphates in Biomedical Applications: Materials for the Future? // Mater. Today. 2016. V. 19. № 2. P. 69–87.
Dorozhkin S.V., Epple M. Biological and Medical Significance of Calcium Phosphates // Angew. Chem.-Int. Ed. 2002. T. 41. № 17. P. 3130–3146.
Berger G., Gildenhaar R., Ploska U. Rapid Resorbable, Glassy Crystalline Materials on the Basis of Calcium Alkali Orthophosphates // Biomaterials. 1995. V. 16. P. 1241–1248. https://doi.org/10.1016/0142-9612(95)98131
Ando J. Phase Diagrams of Ca3(PO4)2–Mg3(PO4)2 and Ca3(PO4)2–CaNaPO4 // Bull. Chem. Soc. Jpn. 1958. V. 31. P. 201–205.
Znamierowska T. Uklad Ca3(PO4)2–CaKPO4–CaNaPO4. Czesc I // Zesz. Nauk. Politech. Sl. 1982. V. 709. P. 33–43.
Znamierowska T. Uklad Ca3(PO4)2–CaKPO4–CaNaPO4. Czesc II // Zesz. Nauk. Politech. Sl. 1982. V. 709. P. 45–56.
Евдокимов П.В., Путляев В.И., Иванов В.К., Гаршев А.В., Шаталова Т.Б., Орлов Н.К., Климашина Е.С., Сафронова Т.В. Фазовые равновесия в системах трикальциевый фосфат – смешанный фосфат кальция и натрия (калия) // Журн. неорган. химии. 2014. Т. 59. № 11. С. 1462–1471.
Орлов Н.К., Путляев В.И., Евдокимов П.В., Сафронова Т.В., Климашина Е.С., Милькин П.А. Резорбция кальцийфосфатной биокерамики Ca3 –xM2x(PO4)2 (M = Na, K) в модельных растворах // Неорган. материалы. 2018. Т. 54. № 5. С. 523–531.
Lapczyna H., Galea L., Wьst S., Bohner M. et al. Effect of Grain Size and Microporosity on the in vivo Behaviour of в-Tricalcium Phosphate Scaffolds // Eur. Cells Mater. 2014. V. 28. P. 299–319.
Eggli P.S., Mueller W., Schenk R.K. Porous Hydroxyapatite and Tricalcium Phosphate Cylinders with Two Different Pore Size Ranges Implanted in the Cancellous Bone of Rabbits // Clin. Orthop. Relat. Res. 1988. V. 232. P. 127–137.
Tikhonov A., Evdokimov P., Klimashina E., Tikhonova S., Karpushkin E., Scherbackov I., Dubrov V., Putlayev V. Stereolithographic Fabrication of Three-Dimensional Permeable Scaffolds from Cap/Pegda Hydrogel Biocomposites for Use as Bone Grafts // J. Mech. Behav. Biomed. Mater. 2020. V. 110(103922).
Sun C., Zhang X. The Influences of the Material Properties on Ceramic Micro–Stereolithography // Sens. Actuators, A. 2002. V. 101. № 3. P. 364–370.
Bohner M., Le Gars Santoni B., Dцbelin N. в-Tricalcium Phosphate for Bone Substitution: Synthesis and Properties // Acta Biomater. 2020. V. 113. P. 23–41.
Ben-Nissan B., Green D.D., Kannangara G.S.K., Chai C.S., Milev A. 31P NMR Studies of Diethyl Phosphite Derived Nanocrystalline Hydroxyapatite // J. Sol-Gel Sci. Technol. 2001. V. 21. P. 27–37.
Jong-Shing Bow et al. Structural Characterization of Room-Temperature Synthesized Nano-Sized B-Tricalcium Phosphate // Biomaterials. 2004. V. 25. P. 3155–3161.
Jinhui Tao et al. Controls of Tricalcium Phosphate Single-Crystal Formation from Its Amorphous Precursor by Interfacial Energy // Cryst. Growth Design. 2009. V. 9. P. 3144–3160
Galea L., Bohner M. et al. Control of the Size, Shape and Composition of Highly Uniform, Non-Agglomerated, Sub-Micrometer b-Tricalcium Phosphate and Dicalcium Phosphate Platelets // Biomaterials. 2013. V. 34. P. 6388–6401.
Ларионов Д.С., Кузина М.А., Евдокимов П.В., Гаршев А.В., Орлов Н.К., Путляев В.И. Синтез кальцийфосфатных порошков в неводных средах для стереолитографической 3d-печати // Журн. неорган. химии. 2020. Т. 65. № 3. С. 309–319.
Beganskiene A., Dudko O., Sirutkaitis R., Giraitis R. Water Based Sol-Gel Synthesis of Hydroxyapatite // Mater. Sci. (Medziagotyra). 2003. V. 9. № 4. P. 383–386.
Jillavenkatesa A., Condrate Sr. R.A. Sol-Gel Processing of Hydroxyapatite // J. Mater. Sci. 1998. V. 33. P. 4111–4119.
Matsumoto N., Yoshida K., Hashimoto K., Toda Y. Preparation of Beta-Tricalcium Phosphate Powder Substituted with Na/Mg Ions by Polymerized Complex Method // J. Am. Ceram. Soc. 2010. V. 93. № 11. P. 3663–3670.
Livage J., Barboux P., Vandenborre M.T., Schmutz C., Taulelle F. Sol-Gel Synthesis of Phosphates // J. Non-Cryst. Solids. 1992. V. 147&148. P. 18–23.
Kjellin P., Rajasekharan A.K., Currie F., Handa P. Investigation of Calcium Phosphate Formation from Calcium Propionate and Triethylphosphate // Ceram. Int. 2016. V. 42. P. 14061–14065.
Pechini M.P. Method of Preparing Lead and Alkaline Earth Titanates and Niobates and Coating Method Using the Same to form a Capacitor: US Patent 3330697. 1967, July 11.
Крешков А.П. Основы аналитической химии. М.: Химия, 1970. С. 417.
Kurzin A.V., Evdokimov A.N., Golikova V.S., Fedorov V.A. Solubility of Potassium and Sodium Orthophosphates in Ethylene Glycol // Russ. J. Appl. Chem. 2012. V. 85. № 5. P. 841–842.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы