Неорганические материалы, 2021, T. 57, № 9, стр. 1025-1032
Формирование биоактивной поверхности композиционных титановых имплантатов
Т. С. Петровская 1, *, Н. Е. Торопков 1
1 Национальный исследовательский Томский политехнический университет
634050 Томск, пр. Ленина, 30, Россия
* E-mail: pts@tpu.ru
Поступила в редакцию 17.11.2020
После доработки 30.04.2021
Принята к публикации 07.05.2021
Аннотация
Исследована возможность повышения функциональности композиционных титановых имплантатов путем модификации оксидированной поверхности с целью придания ей биоактивных свойств. Показано, что нанесение на поверхность оксидированного титана структурированного кальций-силикофосфатного слоя, полученного золь–гель-способом, существенно изменяет ее морфологию, обеспечивает пористость и высокое значение удельной поверхности 18.0 ± 0.5 м2/г. Благодаря золь–гель-пленкe поверхность покрытия титана приобретает гидрофильность, а также адсорбционную и химическую активность за счет поверхностных центров с избыточным зарядом SiO–Hδ+ и Si–OHδ–. Взаимодействие поверхности с раствором SBF приводит к образованию на ней аморфных и кристаллических фосфатов кальция. Полученные результаты позволяют прогнозировать биоактивное поведение оксидированных титановых имплантатов, покрытых золь–гель-пленкой, в условиях живого организма.
ВВЕДЕНИЕ
Восстановление функций поврежденной кости, несущей большие механические нагрузки, осуществляется с помощью металлических имплантатов, среди которых несомненными преимуществами обладают титан и его сплавы. Никакие другие материалы не могут сравниться с ним по прочности, стабильности, биосовместимости. Кроме того, модуль упругости титана лучше других подходит к модулю упругости кости, в результате чего нагрузка имплантата на кость оказывается минимальной. По этой причине и другим, о чем будет сказано дальше, в современной клинической практике ортопедии и зубопротезирования приоритет отдается имплантатам на основе титана и его сплавов [1].
Хорошо известно, что искусственный материал для лечения и восстановления кости должен отвечать требованиям биосовместимости и соответствовать структурно-химической и биомеханической характеристикам естественной костной ткани. Устройства и протезы, изготовленные из ортопедических биоматериалов, в идеале должны работать без сбоев на протяжении всей жизни пациента. Клиническая практика показала, что эффективность титановых имплантатов существенно возрастает при нанесении биосовместимых биоактивных покрытий, которые способны обеспечить создание единой функциональной биомеханической системы имплантат–кость [2]. Динамика остеогенеза при применении титановых имплантатов с биоактивными покрытиями намного выше. Сроки реабилитации больных могут отличаться в 2 раза.
В отличие от биоинертных покрытий на основе диоксида титана, обеспечивающих механическое сцепление имплантата и кости, биоактивные покрытия, содержащие фосфаты кальция, обеспечивают биоактивную фиксацию. Необходимо, однако, отметить, что практика имплантации в ортопедии и травматологии требует дифференцированного подхода, учитывающего тип костной ткани и характер травмы, возрастные и иные особенности пациента, цели и срок введения имплантата. Таким образом, сохраняется актуальность задачи целенаправленного регулирования физико-химических свойств покрытия для выполнения конкретных функций.
Биоактивная фиксация определяется как межфазное соединение имплантата с тканью кости посредством формирования биологически активного гидроксиапатитового слоя на поверхности имплантата. Важным преимуществом биоактивной фиксации является то, что биоактивная связь образуется на границе имплантат/кость с силой, равной или большей, чем прочность кости [3].
Свойство биоактивности как способности искусственного материала принимать участие в биологических процессах с образованием новой костной ткани на своей поверхности и впоследствии интегрироваться с биологической костью чаще всего связывают с кальциевыми фосфатами. В настоящее время среди исследователей существует согласие в том, что на образование костной ткани оказывают влияние структурные, поверхностные, физико-химические свойства фосфатов кальция. Кроме того, существенную роль играют высвобождаемые ими ионы кальция и фосфора; они активируют и стимулируют естественные физиологические процессы, направленные на регенерацию кости [4, 5]. Из этого следует, что имплантированные материалы, обеспечивающие постепенный выход ионов кальция и фосфата из имплантата в среду организма, обладающие соответствующим набором структурных и поверхностных свойств, активно взаимодействующие с окружающей биосистемой, будут способствовать образованию костной ткани на границе имплантат/нативная кость.
Среди методов формирования покрытий на титане широко используется метод микроплазменного оксидирования. Он позволяет обрабатывать изделия любой формы и формировать в поверхностных слоях металла керамикоподобные структуры без изменения геометрических параметров деталей. Метод обеспечивает высокую адгезию покрытия к титану, что является основой надежности медицинского изделия в эксплуатации. То и другое важно при изготовлении имплантатов. Применение гидроксиапатита (ГА) в составе электролита позволило авторам [6] получить покрытия, содержащие оксиды кальция и фосфора в количестве до 13 и более 30 мас. % соответственно.
Из изложенного очевидно, что оксидные покрытия на титане могут приобрести или усилить биоактивность при повышении содержания в них ионов кальция и фосфата, а также путем модификации их поверхности, сопровождаемой повышением поверхностной энергии, обусловленным развитием рельефа, увеличением шероховатости и пористости, гидрофильности и растворимости.
Целью настоящей работы является исследование возможности повышения функциональности оксидированного титана путем формирования биологически активного слоя на его поверхности в виде золь–гель-пленки, содержащей оксиды кальция, фосфора и кремния.
В качестве аналогов рассмотрены оксидные биоактивные стекла, синтезированные золь–гель-методом, которые образуют апатит на своей поверхности при помещении в биологическую среду. Образование костеподобного апатита происходит на поверхности диоксида кремния, полученного золь–гель-методом [3]. Особенность этих материалов заключается в плотности силанольных групп Si–OH, присутствие которых в гелевых продуктах ускоряет кристаллизацию ГА, что в свою очередь обусловливает биоактивность материала [7]. Согласно этой логике, структурные и поверхностные свойства оксидных покрытий, содержащих ионы Ca2+ и ${\text{PO}}_{4}^{{3 - }},$ могут быть улучшены путем нанесения тонкого слоя из золь–гель-раствора, содержащего названные ингредиенты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оксидные покрытия формировались на подготовленных подложках из технически чистого титана ВТ 1-00 методом микроплазменного оксидирования на стандартной установке в насыщенном ГА растворе ортофосфорной кислоты (10%-ная H3PO4) в условиях избытка высокодисперсного ГА. Толщина покрытий в 15–20 мкм обеспечивалась обработкой в микродуговом режиме при значениях напряжения 120–250 В, тока 0.05 A/мм2 и времени обработки от 2 до 20 мин. Толщину покрытий определяли расчетом, исходя из точного определения геометрических размеров и изменения массы в процессе оксидирования.
Методика приготовления полидисперсных коллоидных пленкообразующих растворов (ПОР) приведена в [8]. ПОР наносили на оксидированную поверхность титана с толщиной оксидной пленки 15–20 мкм методом вытягивания со скоростью 20–30 см/мин. Формировали последовательно 3 слоя с высушиванием каждого при температуре 60°С.
Толщину пленок оценивали эллипсометрическим методом. С помощью лазерного эллипсометра ЛЭФ-3М (длина волны лазерного излучения λ = 6328 нм) определяли оптическую толщину и показатель преломления пленок, вычисляя затем толщину по формуле
где δ0 – приращение разности оптического хода; n – показатель преломления, измеренный в 10 точках поверхности. Ошибка определения показателя преломления и толщины составляла 0.015 и 0.1% соответственно.Морфологию поверхности исследовали комплексно. Общая структура и рельеф поверхностных слоев покрытий и пленок изучались с помощью атомно-силовой микроскопии (АСМ) с использованием сканирующей зондовой нанолаборатории Интегра-Аура (NT-MDT, Россия) в “полуконтактном” режиме с разрешением до 1 нм и полем сканирования до 120 × 120 мкм. Также исследовались шероховатость и профиль поверхности золь–гель-пленок, полученных методом вытягивания, их пористость, удельная поверхность. Оценка шероховатости поверхности проводилась путем измерения высотных параметров – Ra (средняя высота неровностей профиля, мкм) и Rz (высота максимальных и минимальных неровностей профиля по десяти точкам, мкм) – и анализа ЗD-изображений поверхности, полученных с помощью бесконтактного ЗD-профилометра MICRO MEASURE 3D station (STIL, Франция). Измерения проводили на образцах без специальной обработки в зоне сканирования ~0.5–0.6 мм по осям x и y и до 15 мкм по оси z с шагом сканирования 2–8 нм и коэффициентом сглаживания 0.025–0.080. Анализ полученных профилей проводился с использованием компьютерной программы Mountains Map Universal v.2.0.13. Данные получали в виде 3D-изображений поверхности, записи профиля, гистограмм выступов и впадин, а также статистической характеристики рельефа поверхности. Профиль поверхности образцов измеряли также на профилометре-профилографе Talysurf 5-120 (Taylor Hobson, Англия).
Микроструктуру поверхности образцов исследовали на сканирующем электронном микроскопе (СЭМ) JEOL JSM-7500FA (Япония). Одновременно проводили энергодисперсионный элементный анализ образцов, выдержанных в SBF (simulated body liquid), с применением приставки EDX с построением спектра характеристического излучения с разрешением 0.34 эВ. Параметры съемки и масштаб указаны на СЭМ-снимках. Поверхностная пористость и размер пор покрытий оценивались по изображениям. Для определения пористости измерялись общая площадь поверхности снимка и площадь пор. Отношение суммарной площади пор ко всей площади поверхности снимка характеризует поверхностную пористость.
Удельную поверхность определяли многоточечным методом БЭТ по низкотемпературной адсорбции азота с помощью автоматического газоадсорбционного анализатора Tristar 3020.
Кислотно-основные свойства поверхности золь–гель-пленок исследованы методом рН-метрии [9] путем измерения значения рН водной суспензии золь–гель-дисперсий, соответствующих составу пленок, во времени. Использовали универсальный ионометр ЭВ – 74, в качестве фонового раствора – дистиллированную воду. Фиксировали изменение кислотности до наступления адсорбционно-десорбционного равновесия (не больше 2 ч). О значении изоточки судили по перегибу на кинетической кривой рНсусп = f(τ), который наблюдается через 5 мин контакта и характеризует кислотность воздушно-сухого состояния поверхности – рНсусп; далее оценивали кислотность поверхности равновесия ${\text{рН}}_{{{\text{сусп}}}}^{{{\text{равн}}}}{\text{,}}$ которое наступает в течение 1 ч. Ошибка определения рН составляла 0.05 единиц.
Рентгенофазовый анализ пленок проводили с помощью рентгеновского дифрактометра Shimadzu XRD-7000 (CuKα-излучение). Идентификацию фаз – с применением базы данных ICDD PDF4.
Для оценки биоактивности поверхности in situ использована методика с применением модельной внеклеточной жидкости тела SBF [10], состав которой приведен в табл. 1. Значение рН на уровне 7.4 поддерживалось добавлением TRIS-буфера. Образцы взвешивались на весах высокой точности, помещались в раствор SBF и выдерживались в течение заданного периода при поддержании температуры раствора на уровне 37 ± 0.5°C.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование физико-химических процессов в полидисперсных растворах на основе тетраэтоксисилана, ортофосфорной кислоты и хлорида кальция в диапазоне составов (мас. %): 10–50 CaO, 5–40 P2O5, 10–85 SiO2 (отношение Ca/P = 1.6) показало, что при содержании оксида кремния более 50% растворы обладают пленкообразующими свойствами, благодаря чему из них получены пленки на различных поверхностях. Микроструктура пленок формируется кремнийкислородными и фосфоркислородными атомными группами, в которые включены октаэдры [CaO6]. В пленках присутствует вода (сохраняющаяся при обжиге до 800°С), поверхностные гидроксильные и силанольные группы Si–OH [8, 11], обусловливающие гидрофильность поверхности.
В данной работе пленки толщиной от 80 до 150 мкм получали методом вытягивания из ПОР на поверхности кремния и оксидированного титана ВТ 1-00. Закрепление пленки на поверхности подложки обеспечивается путем сушки и последующей термической обработки при 550–600°С. В процессе термообработки происходит ряд физико-химических процессов (коалесценция и агрегация частиц полидисперсного раствора; выделение газообразных продуктов; формирование оксидного слоя), сопровождающихся дифференциацией пленкообразующей системы по составу с образованием микрообластей, в которых идентифицируются фазы разных форм диоксида кремния SiO2 и фосфатов кальция. Процессы дифференциации приводят к структурированию пленки и образованию рельефной поверхности. При этом пленка прочно связывается с поверхностью подложки.
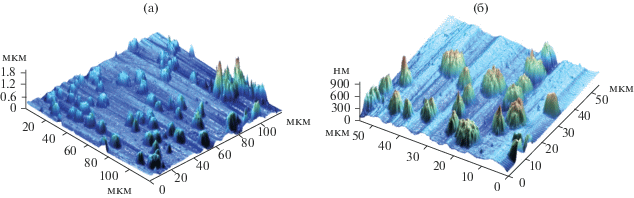
На рис. 1 приведены изображения поверхности пленки (52% SiO2) на кремнии, полученные методом АСМ. Поверхность отличается разнообразием рельефа, который формируется над базовым слоем пленки элементами трех типов. Наибольшее распространение имеют кратеры, обусловливающие равномерную пористость поверхности и образующиеся в результате выхода газовой фазы. Диаметр кратеров варьируется в диапазоне 1–5 мкм. По их периметру на границе раздела фаз, по всей вероятности, начинаются образование и последующий рост кристаллитов, что обусловливает структурирование пленки. В пользу такого заключения говорит факт наличия пор и полостей внутри агрегатов кристаллитов, поперечный размер которых не превышает 10 мкм.
На рис. 2 представлены изображения и профили поверхности оксидированного титана, а также оксидированного титана, покрытого золь–гель-пленкой, в табл. 2 – значения параметров шероховатости этих двух видов поверхности.
Рис. 2.
3D-изображения и профили оксидированной поверхности титана (а) и оксидированной поверхности титана, покрытой золь–гель-пленкой (б).
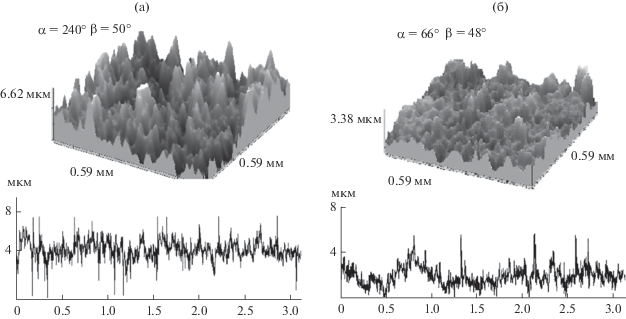
Таблица 2.
Значения параметров шероховатости Ra и Rz
| Вид поверхности | Оксидиро-ванная | Оксидированная + + золь–гель-пленка |
| Ra, мкм | 0.58 | 0.54 |
| Rz, мкм | 5.79 | 4.80 |
Представленные данные, а также статистическая обработка результатов шероховатости поверхности (рис. 3) показывают, что поверхность образцов имеет выраженную шероховатость. Для оксидированной поверхности титана с золь–гель-покрытием и без него высотный параметр Ra практически не изменяется, а Rz уменьшается на 20% по сравнению с поверхностью без пленки. Поверхность, покрытая пленкой, имеет явный двухуровневый рельеф, где параметры Ra и Rz отличаются на порядок. При этом между наиболее высокими выступами выделяются характерные области понижения рельефа (рис. 2) размером 200–400 мкм. Наноструктурированная золь–гель-пленка изменяет морфологию оксидированной поверхности титана, незначительно сглаживая, но дополняя и развивая ее рельеф.
Рис. 3.
Морфология поверхности образцов оксидированного титана (а, в) и оксидированного титана с золь–гель-покрытием (б, г): гистограммы высоты выступов по поверхности (а, б), АСМ-изображения поверхности (в, г).
Одной из универсальных физико-химических характеристик поверхности твердого тела является кислотно-основной параметр, зависящий от природы вещества, способа его получения, химического состава. Согласно современным представлениям, поверхность твердого тела представляет собой набор поверхностных центров льюисовского и бренстедовского типов, достаточно прочно связанных с твердым телом и взаимодействующих между собой под влиянием внешних воздействий [9].
На рис. 4 представлены зависимости кислотности среды от времени взаимодействия образцов с водой. Нелинейная зависимость кинетических кривых обусловлена наличием в системе химических соединений. Значения рН поверхности образцов в ряду составов изменяется от 3.8 до 10.8 в зависимости от температуры термообработки (60 и 600°С). Такой диапазон значений является иллюстрацией факта разнообразия поверхностей с точки зрения наличия типов поверхностно-активных центров.
Рис. 4.
Кривые изменения кислотности образцов, отожженных при 60 (а) и 600°С (б), для образцов с содержанием P2O5 5 (1), 18 (2), 30 мас. % (3) (срок созревания ПОР 2 суток).
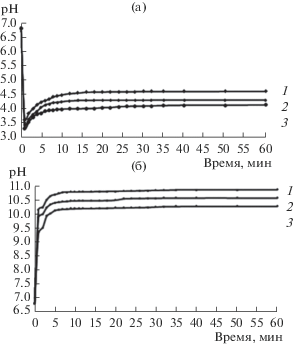
Для образов, высушенных при температуре 60°С, в начальный момент опыта происходит резкое уменьшение значения рН, что свидетельствует о кислотном характере поверхности пленок (рис. 4а). С увеличением содержания оксида фосфора от 5 до 30 мас. % кислотность поверхности возрастает. На ней преобладают кислотные центры Бренстеда, характеризующиеся интервальным значением рН 3.9–4.5, и механизм адсорбции может быть представлен следующей схемой [9]:
Для образцов, отожженных при 600°С, значение рН в начальный момент времени резко увеличивается (рис. 4б), что свидетельствует о том, что образец представляет собой основание Бренстеда.
Находясь на воздухе, образец адсорбирует протоны молекул воды на основных центрах. Оставшиеся гидроксо-группы менее прочно связываются с кислотными центрами и при внесении в растворитель переходят в раствор, что приводит к увеличению основности среды. Через 10 с начинается химическое взаимодействие частично дегидратированной поверхности с молекулами воды по диссоциативному механизму, который может быть представлен следующей схемой:
Диссоциация воды протекает по гетеролитическому механизму. Отделившийся ион водорода присоединяется к кислороду -О–, что приводит к дальнейшему увеличению рН. Для образцов, полученных на 7 сутки созревания ПОР, ход кривых имеет идентичный характер.
Таким образом, в зависимости от химического состава и температуры обработки на поверхности пленки образуются активные центры с избыточным положительным и отрицательным зарядом SiO–Hδ+ и Si–OHδ–, ответственные за ее адсорбционную и химическую активность.
Адсорбционная активность поверхности также связана с пористостью и удельной поверхностью. Удельная поверхность образцов составляет 18.0 ± 0.5 м2/г, размер пор варьируется от 5 до 17 нм, что в совокупности с наличием активных центров обусловливает адсорбционные свойства поверхности.
Экспериментальные образцы с двухслойными покрытиями (оксидный и золь–гель-слой) выдерживали в SBF. В течение первых двух суток происходит растворение покрытия, что сопровождается потерей массы, в последующий период – постепенное осаждение на поверхность соединений из раствора и увеличение массы образца. После 2 недель выдержки в растворе SBF увеличение массы образцов составило 2.5%, после 4 недель – 7.4%.
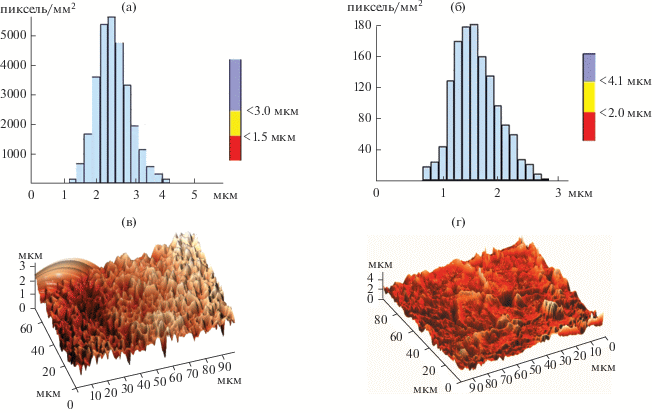
На рис. 5 приведены микрофотографии и результаты элементного анализа поверхности образцов с нанесенной золь–гель-пленкой, демонстрирующие образование кристаллов на поверхности образцов и их рост по мере пребывания образцов в растворе SBF. В то же время на оксидированной поверхности титана кристаллы не образуются, осаждение ионов из раствора приводит к образованию частиц округлой формы, которые укрупняются с увеличением времени выдержки в растворе, но остаются рентгеноаморфными.
Рис. 5.
Микрофотографии (а–в, ж–и) и результаты элементного анализа (г–е, к–м) оксидированной поверхности титана без (а–е) и с нанесенной золь–гель-пленкой (ж–м).
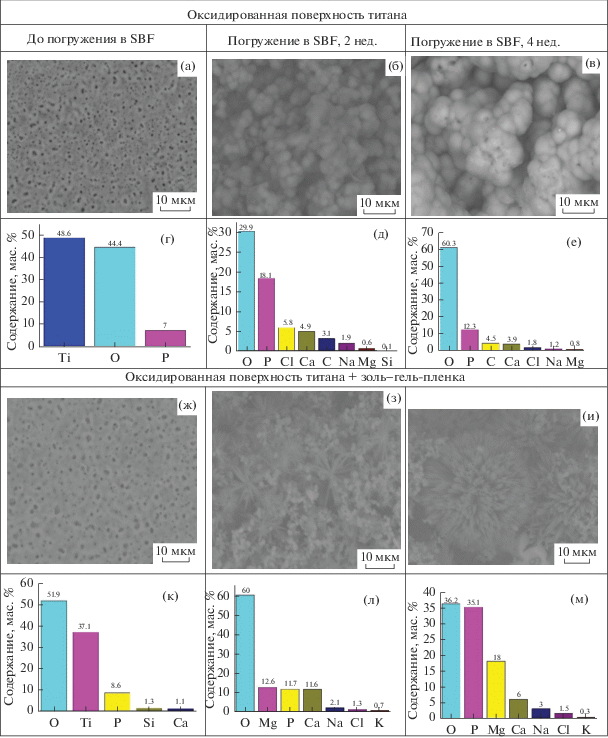
На оксидированной поверхности титана с золь–гель-покрытием образуются частицы игольчатой формы, размеры которых увеличиваются со временем выдержки в SBF; pH раствора изменяется в пределах щелочной реакции, что способствует кристаллизации кальциевых фосфатов, о чем свидетельствует рост содержания ионов кальция и фосфора на поверхности материала. РФА показал наряду с аморфной фазой наличие ГА и пирофосфата кальция, на грани обнаружения – хлорапатита.
За 4 недели эксперимента концентрация ионов Са и Р на оксидированной поверхности титана увеличилась на 3.9 и 5.3 мас. % соответственно, а на оксидированной поверхности с золь–гель-покрытием – на 10 и 26.4 мас. % соответственно.
ЗАКЛЮЧЕНИЕ
Нанесение на оксидированную поверхность титана наноструктурированной кальций-силикофосфатной пленки, полученной золь–гель-методом, изменяет ее морфологию, дополняя и развивая рельеф, обеспечивая пористость и высокую удельную поверхность, равную 18.0 ± 0.5 м2/г.
Благодаря золь–гель-пленке поверхность покрытия титана приобретает гидрофильность, а также адсорбционную и химическую активность за счет поверхностных центров с избыточным положительным и отрицательным зарядом SiO–Hδ+ и Si–OHδ–.
Совокупность поверхностных свойств обусловливает активное взаимодействие поверхности с раствором SBF, обмен ионами кальция и фосфата. В процессе минерализации интерфейса участвуют силанольные группы −SiOH, они связывают ионы кальция, способствуя формированию аморфных и кристаллических фосфатов кальция.
Высокая удельная поверхность, адсорбционная активность, гидрофильность, наличие развитого рельефа позволяют прогнозировать биоактивное поведение материала с такой поверхностью в условиях живого организма.
Список литературы
Asri R., Harun W., Samykano M. et al. Corrosion and Surface Modification on Biocompatible Metals: a Review // Mater. Sci. Eng. 2017. № 77. P. 1261–1274. https://doi.org/10.1016/j.msec.2017.04.102
Priyadarshini B., Rama M., Chetan & Vijayalakshmi U. Bioactive Coating as a Surface Modification Technique for Biocompatible Metallic Implants: a Review // J. Asian Ceram. Soc. 2019. V. 7. № 4. P. 397–406. https://doi.org/10.1080/21870764.2019.1669861
Sepulveda P., Jones J., Hench L. Bioactive Materials for Tissue Engineering Scaffolds // Polak J., Hench L., Kemp P. Future Strategies for Tissue and Organ Replacement. London: Imperial College Press, 2002. P. 3–24.
Jeong J., Kim D., Shim J. et al. Bioactive Calcium Phosphate Materials and Applications in Bone Regeneration // Biomater. Res. 2019. V. 23. № 4. https://doi.org/10.1186/s40824-018-0149-3
Kim H.D., Jang H. L., Ahn H.Y., Lee H.K., Park J., Lee E.S., Lee E.A., Jeong Y.H., Kim D.G., Nam K.T., Hwang N.S. Biomimetic Whitlockite Inorganic Nanoparticles-Mediated in situ Remodeling and Rapid Bone Regeneration // J. Biomaterials. 2017. V. 112. P. 31–43.
Petrovskaya T.S., Vereschagin V.I. Effectiveness of the Technologies of Titanium Implants Covering // Key Eng. Mater. 2015. V. 670. P. 183–188.
Laczka M., Cholewa K., Laczka-Osyczka A. Gel-Derived Powders of CaO–P2O5–SiO2 System as a Starting Material to Production of Bioactive Ceramic // J. Alloys Compd. 1997. V. 248. № 1. P. 42–51.
Petrovskaya T.S., Borilo L.P. Production of SiO2–P2O5–CaO–(Na2O) Structured Films // Glass Ceram. 2012. V. 69. № 1–2. P. 25–29.
Иконникова К.В., Иконникова Л.Ф., Минакова Т.С., Саркисов Ю.С. Теория и практика рН-метрического определения кислотно-основных свойств поверхности твердых тел. Томск: Изд-во Томского политехнического ун-та, 2011. 85 с.
Kokubo T., Takadama H. How Useful is SBF in Predicting in vivo Bone Bioactivity? // Biomaterials. 2006. V. 27. № 15. P. 2907–2915. https://doi.org/10.1016/j.biomaterials.2006.01.017
Айлер Р.К. Химия кремнезема. М.: Мир, 1982. 416 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы