Неорганические материалы, 2022, T. 58, № 1, стр. 76-82
Физико-химические свойства и остеоинтеграция титановых имплантов с биоактивными кальций-фосфатными покрытиями, полученными детонационным напылением
А. С. Скрябин 1, *, П. А. Цыганков 2, В. Р. Веснин 1, Б. А. Паршин 1, В. В. Зайцев 1, Ю. С. Лукина 1
1 Московский государственный технический университет им. Н.Э. Баумана
105005 Москва, ул. 2-я Бауманская, 5, к. 1, Россия
2 Universidad Industrial de Santander
68000 Bucaramanga, Carrera 27 # Calle 9, Colombia
* E-mail: terra107@yandex.ru
Поступила в редакцию 16.07.2021
После доработки 28.09.2021
Принята к публикации 30.09.2021
- EDN: LVZJZF
- DOI: 10.31857/S0002337X22010110
Аннотация
Детонационное напыление рассматривается как перспективное для нанесения биокерамических кальций-фосфатных покрытий на различные импланты благодаря возможности реализации таких режимов, в которых нежелательные термические эффекты минимальны. В работе данным методом на поверхность титановых подложек (цилиндры и хирургические винты) нанесены покрытия (толщиной до ≈100 мкм) на основе частиц нестехиометрического гидроксиапатита (ГАП) с атомарным отношением Ca/P ≈ 1.45–1.50. На основании комплексного изучения покрытий методами рентгенофазового анализа, рамановской спектроскопии, электронной и оптической микроскопии, а также энергодисперсионного анализа показано, что в реализованных условиях исходный ГАП в процессе напыления претерпевал ряд изменений, что приводило к образованию трикальцийфосфатов (ТКФ) (α-ТКФ и β-ТКФ) наряду с ГАП и аморфными фосфатами. В результате стехиометрическое отношение Ca/P смещалось в сторону бóльших значений (до Ca/P ≈ 1.65–1.67). In vivo оценки эффективности остеоинтеграции проведены путем сравнения биологических реакций с контрольными образцами (хирургическими винтами без покрытия) и с обработанными винтами на лабораторных животных (крысах линии Вистар). Гистологические и томографические исследования прижизненного и аутопсийного материала показали, что полученные покрытия стимулировали хондрогенный остеогенез в области контакта импланта с костью. Установлено, что указанные эффекты проявляются при временах не менее 60 ± 5 сут от имплантации.
ВВЕДЕНИЕ
Тенденции современного медицинского материаловедения связаны, во-первых, с разработкой и исследованием свойств новых керамических материалов на основе фосфатов кальция, улучшающих остеоинтеграцию протезных изделий [1, 2]. При этом особое внимание уделяется [3] различным вариантам нестехиометрических апатитов с общей формулой Ca10– x(PO4)6 –xYx(OH)2 –x, где комплекс Y соответствует ионам моногидрофосфата [HPO4]2– или карбонатной группы [CO3]2– [4], или силикат-ионам [SiO4]4– [5]. Кроме того, изучаются соединения, в которых металлы (например, Fe) [6] замещают ионы кальция. Во-вторых, они обусловлены разработкой методов нанесения покрытий таких материалов на различные импланты (как металлические, так и неметаллические). При этом газотермические методы [7] рассматриваются как наиболее перспективные для напыления высокоадгезионных покрытий биоактивных керамик на поверхности материалов.
Детонационное напыление [8], в отличие от других газотермических методов (и, прежде всего, плазменного напыления [9–11]), реализуется в условиях достаточно сложной и нестационарной пространственно-временной динамики давления (наличие химического пика, отраженных ударных волн и волны разряжения) на подложке. Характерные значения давления на подложке в среднем составляют p ≈ 5–15 атм. При этом температура Tp напыляемых частиц в среднем равна ≈0.8–0.9 от их температуры плавления Tm [12]. Для плазменного напыления давление в потоке составляет p ≈ 1 атм, а температура частиц зачастую превышает Tm [13]. Кроме того, детонационное напыление характеризуется возможностью гибкого управления параметрами процесса в достаточно широких пределах, что способствует нанесению покрытий в различных режимах (как в “щадящих” условиях слабых, так и “интенсивных” сильных ударных волн). Известные литературные данные о свойствах кальций-фосфатных покрытий, полученных детонационным напылением, относительно малочисленны [14–19]. Информация об их фазово-химических свойствах и составе различается, что неудивительно, т.к. отсутствует массив обобщенных данных о комплексном влиянии свойств напыляемых частиц фосфатов, параметров процесса и т.д. А кроме того, в опубликованных исследованиях достаточно мало данных о биосовместимости полученных покрытий и in vitro или in vivo оценок эффективности остеоинтеграции имплантов с такими покрытиями, что затрудняет прогноз перспективности данного направления.
Поэтому в данной работе изучено детонационное напыление дисперсных фракций нестехиометрического гидроксиапатита (ГАП) на титановые подложки, которые рассматриваются как системы для моделирования различных элементов крепления (хирургические винты, пластины и т.д.).
Целью представленного исследования являлось изучение физико-химических свойств покрытий и установление особенностей биологического ответа, который вызывают импланты с такими покрытиями в организме реципиента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходного сырья использован коммерческий кальцийдефицитный нестехиометрический ГАП (99.0%) с дисперсностью частиц dp ≤ ≤ 50 мкм производства ООО “Битека” (г. Одинцово, Россия), в структуре которого присутствовал ион моногидрофосфата [HPO4]2–.
Напыление проводили на два вида изделий. Для in vivo оценок остеоинтеграции использованы стандартные (ООО “Конмет”, г. Москва) хирургические винты (пины) из титана Grade 4 длиной 11 мм с резьбой Сп1.2 × 0.7 длиной 7 мм. Поверхность резьбы подвергалась пескоструйной обработке изготовителем. Ввиду того, что размер штифтов мал и затруднительно провести качественное исследование фазово-химического состава нанесенного покрытия, проводилось напыление (при тех же режимных параметрах, что и на пины) на поверхность цилиндрических образцов (диаметр 10, высота 2.3 мм) из сплава ВТ-6, поверхность которого предварительно также подвергалась пескоструйной обработке.
Фосфатные покрытия получали методом детонационного напыления на установке CCDS2000 (ИГиЛ РАН, г. Новосибирск) [20] с использованием ацетилена в качестве топлива (стехиометрическое объемное отношение ацетилен : кислород ≈ 2.075).
Рентгенофазовый анализ покрытия выполнен на дифрактометре ДРОН-3М (излучение CuKα) в диапазоне 2θ от 20° до 65° с шагом 0.02°. Интерпретация рентгеновских спектров выполнена с использованием базы данных ICDD PDF-2. Средний размер области когерентного рассеяния (ОКР) исходных частиц и в покрытии рассчитан по формуле Шеррера. На практике этим параметром пользуются для количественной характеризации размеров кристаллитов кальций-фосфатов [21, 22].
Кристалличность CI оценивалась по рентгеновскому спектру по методике [11]
где Ac – площадь на рентгеновском спектре под обнаруженными кристаллическими фазами и AΣ– полная площадь под рентгеновским спектром. Обнаруженные кристаллические рефлексы были аппроксимированы функциями Гаусса (от 25 до 30 аппроксимаций). Вычисления проведены численно в программной среде Python® с использованием стандартных библиотек scipy, lmfit и numpy.Рамановская спектроскопия (в диапазоне сдвигов ≈300–2000 см–1) проводилась на приборе Ntegra Spectra. Источником возбуждающего излучения являлся твердотельный лазер LM473 с длиной волны 473 нм и пятном фокусировки 300 нм. Интерпретация рамановских спектров проведена с использованием данных [23–27]. Морфология покрытия изучена с помощью с помощью оптической (микроскоп Carl Zeiss AxioImager Z2m с конфокальной приставкой LSM700) и электронной (электронный микроскоп Thermo Fisher Scientific Quattro S) микроскопии. Атомарное отношение Ca : P определено с помощью системы энергодисперсионного анализа EDAX Octane Elect plus.
Таблица 1.
Рентгенографические характеристики исходного сырья и покрытия на подложке
| dhkl,Å | hkl | Фаза |
|---|---|---|
| Исходный порошок | ||
| 3.44 | 002 | ГАП |
| 2.82 | 211 | ГАП |
| 2.72 | 300 | ГАП |
| 2.64 | 202 | ГАП |
| 2.27 | 310 | ГАП |
| 1.94 | 222 | ГАП |
| 1.84 | 213 | ГАП |
| 1.72 | 004 | ГАП |
| Покрытие на титане | ||
| 4.15 | 150 | α-ТКФ |
| 3.90 | 202 | α-ТКФ |
| 3.67 | 132 | α-ТКФ |
| 3.44 | 1.0.10 | β-ТКФ |
| 2.90 | 170 | α-ТКФ |
| 2.80 | 211 | ГАП |
| 2.71 | 300 | ГАП |
| 2.62 | 220 | β-ТКФ |
| 2.26 | 310 | ГАП |
| 2.16 | 311 | α-ТКФ |
| 1.94 | 222 | α-ТКФ |
| 1.84 | 320 | ГАП |
| 1.82 | 213 | α-ТКФ |
| 1.78 | 2.0.20 | β-ТКФ |
| 1.73 | 004 | ГАП |
Хирургическая фиксация пинов проводилась в губчатом слое мыщелков и компактном (кортикальном) слое диафиза бедренной кости крысы линии Вистар на относительно небольшой выборке животных (8 животных). В бедренной кости лабораторного животного фиксировались 4 импланта по схеме: в позиции “на животе” в левую бедренную кость – контроль (пины без покрытия), в правую бедренную кость – опыт (пины с покрытием). Оценка эффективности остеоинтеграции имплантов заключалась в сравнении биологического ответа организма реципиента на фиксированные импланты с покрытиями и без них. Информация об этом получена с помощью компьютерной томографии прижизненного и аутопсийного (30 ± 5, 60 ± 5 и 90 ± 5 сут после имплантации) материала, а также его гистологического исследования. Фиксация аутопсийного материала была проведена в 10%-ном растворе забуференного формалина при +4°С в течение 24 ч. Исследование выполнено на микротомографе SkySkan 1178. Разрешение матрицы составляло 1024 × 1024 пикселя. Размер вокселя составлял 84 мкм. Визуализация и 3D-реконструкция проводилась в программном обеспечении VSG Aviso. Образцы для гистологических исследований фиксировали в нейтральном формалине, заливали в парафин, получали срезы толщиной 4 мкм, окрашивали гематоксилином и эозином. Их изучали при стандартной световой микроскопии, фазово-контрастной и поляризационной микроскопиях в микроскопе Leica DM 4000 B LED с камерой Leica DFC 7000 T.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследования морфологии показали, что покрытие достаточно равномерно распределялось по поверхности пина и имело плотную и стеклоподобную структуру (рис. 1а). При увеличении (рис. 1б) видно, что нанесенное покрытие имело относительно развитую внешнюю поверхность. Такой характер поверхности (наличие впадин, застывших структур сложной формы, множества фрагментов исходных частиц, испытавших деформацию при взаимодействии с подложкой и т.д.) объясняется сложным влиянием теплогазодинамических процессов в тормозившемся на подложке гетерофазном детонационном потоке, содержащем дисперсные фракции ГАП. При этом важно отметить, что в покрытии не обнаружено видимых посторонних включений, обусловленных, например, разрушением подложки при напылении и выходом металлических конкрементов во внешние слои покрытия, которые потенциально могли бы приводить к воспалительным реакциям с последующим остеолизом контактирующей с имплантом костной ткани.
Рис. 1.
Изображение поверхности титанового пина с нанесенным покрытием: оптическая (а) и электронная (б) фотографии.

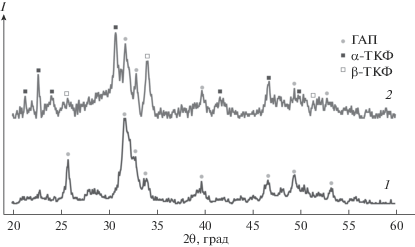
На рис. 2 представлены данные рентгенофазового анализа исходного ГАП и полученных покрытий. В исходном порошке были обнаружены фазы кристаллического ГАП гексагональной сингонии (PDF № 9-432), а также аморфных фосфатов кальция (АФК), о чем свидетельствует наличие аморфного гало в диапазоне 2θ от 25° до 35°. В спектре напыленного покрытия, наряду с исходным ГАП и АКФ, зарегистрированы трикальций фосфаты (ТКФ): α-ТКФ моноклинной сингонии (PDF № 9-348) и β-ТКФ ромбоэдрической сингонии (PDF № 9-169). Зарегистрированные межплоскостные расстояния и соответствующие им фазы представлены в табл. 1. Степень кристалличности исходных частиц, оцененная по спектру [11], составляла CI ≈ 25% при среднем размере ОКР D = 16.5 нм, рассчитанном по уравнению Шеррера. После напыления степень кристалличности в покрытии существенно не изменилась и составила CI ≈ 23% при D = 22.2 нм.
Рис. 2.
Рентгеновские спектры исходного порошка (1) и нанесенного покрытия (2) с указанием зарегистрированных фаз.
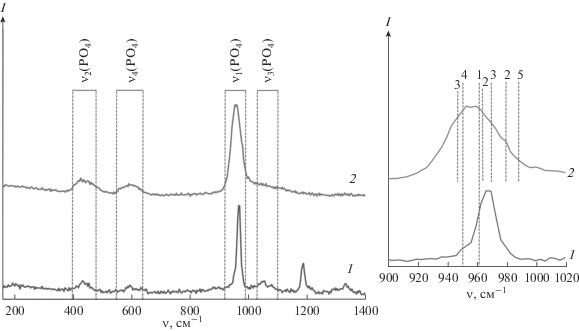
Данные рамановской спектроскопии свидетельствовали об обнаружении основных пиков фосфатов кальция (рис. 3) как в исходных частицах, так и в покрытии. При этом данные свидетельствовали о фазово-химических превращениях, что выражалось в изменении спектра (особенно в области с характерной величиной сдвига ≈960 см–1, соответствующей ν1(PO4)). Ширина на полувысоте β увеличилась с 16 до 41 см–1, что было вызвано в основном образованием различных фаз ТКФ. Существенного изменения β, соответствующего АФК (со сдвигом ≈950 см–1), не обнаружено. В покрытии также обнаружены следы пирофосфата кальция (ПФК) с характерным сдвигом ≈990 см–1 [26], который не был зарегистрирован рентгенофазовым анализом.
Рис. 3.
Рамановские спектры исходного порошка (1) и нанесенного покрытия (2) с указанием обнаруженных сдвигов, соответствующих следующим соединениям: 1 – ГАП, 2 – α-ТКФ, 3 – β-ТКФ, 4 – АФК, 5 – ПКФ.
Также важно отметить, что в процессе напыления менялось соотношение Ca : P c ≈1.45–1.50 у исходных частиц до ≈1.65–1.67 в покрытии. Это обусловлено необратимыми химическими реакциями, происходящими при нагреве частиц до ≈600–800°С при формировании покрытия [25].
По нашим предположениям, в процессе детонационного напыления кальцийдефицитный ГАП превращался в α-ТКФ, который является метастабильной фазой (при достигнутых температурах подложки) с последующей трансформацией в β-ТКФ при температурах ниже 760°С. Появление в системе α-ТКФ обусловлено структурным сходством между α-ТКФ и ГАП (в кристаллической структуре высокотемпературной фазы ТКФ есть участки, похожие на таковые в структуре ГАП) [28].
Отметим, что полученные покрытия в целом характеризовались наличием биосовместимых фаз фосфатов (ГАП, α-ТКФ, β-ТКФ и АФК). При этом не зарегистрировано присутствие значительного количества CaO, типичного для напыленных плазмой покрытий [7, 9, 11] и проявляющего ряд нежелательных биологических реакций [29]. Характерные значения CI находились в диапазоне степеней кристалличности, достигаемых методом плазменного напыления (CI ≈ 17–55%) [30, 31]. Размер ОКР был несколько ниже (для плазменного напыления D ≈ 67.4–106.2 нм).
Увеличение соотношения Са : Р в покрытии обусловлено потерей фосфатных ионов под влиянием теплогазодинамических процессов при взаимодействии гетерофазного детонационного потока с подложкой. В связи с использованием кальцийдефицитного ГАП потеря фосфат-ионов компенсирует недостаток кальция, не приводя к образованию значительного количества СаО.
В результате гистологического исследования на in vivo моделях установлено, что фиксируемые эффекты, влияющие на остеоинтеграцию имплантов, проявлялись не ранее 60 ± 5 сут после имплантации. Вокруг непокрытых титановых пинов в некоторых образцах появлялись соединительно-тканные капсулы разной степени зрелости и неравномерной толщины, хотя в большинстве образцов соединительно-тканные капсулы не обнаружены. При этом стенки отверстий от пинов образованы костными балками обычной структуры без дистрофических изменений, вероятно, из-за того, что капсулы могли быть очень тонкими и легко удалялись при вывинчивании пинов в процессе приготовления препаратов. Принципиальных отличий между капсулами в кортикальном и губчатом слоях нет. На этих сроках имплантации в гистологическом материале, полученном на пинах с покрытиями, визуализированы незрелые капсулы с выраженной васкуляризацией и большим количеством макрофагов и гигантских многоядерных клеток, окружающих фрагменты ГАП.
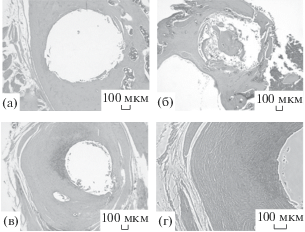
При бóльших временах (90 ± 5 сут) в препаратах, полученных из образцов с контрольными титановыми пинами, обнаружены зрелые плотные и тонкие фиброзные капсулы, состоявшие из плотно расположенных и параллельно ориентированных коллагеновых волокон и немногочисленных фибробластов между ними, со слабой лимфо-макрофагальной инфильтрацией и васкуляризацией (рис. 4а). При этом в губчатом слое образовывались более зрелые капсулы по сравнению с кортикальной (рис. 4б). При модификации пинов нанесением покрытий на основе ГАП (рис. 4в, 4г) вокруг них формировались зрелые плотные фиброзные капсулы с минимальной васкуляризацией и воспалительной инфильтрацией. В составе капсул обнаружены участки фиброзного хряща, что может говорить о начале хондрогенного остеогенеза в области дефекта.
Рис. 4.
Данные гистологического исследования аутопсийного материала (90 ± 5 сут после имплантации): контроля в кортикальной (а) и губчатой (б) кости; опыта в кортикальной кости – стандартная (в) и фазово-контрастная (г) микроскопия.
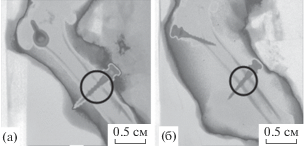
Данные гистологии подтверждены результатами КТ с определением рентгеновских плотностей и типов окружающих имплант тканей. На рис. 5 представлены некоторые типичные данные КТ-визуализации аутопсийного материала правой задней лапы крысы. Кругами отмечены области с различной рентгеновской плотностью окружающих тканей. Более темные области соответствовали более плотным веществам (титану и костной ткани). Показано, что в случае импланта с покрытием вокруг него формируются темные области, соответствующие более плотной ткани (хрящ и кость), чем в случае контрольных пинов.
ЗАКЛЮЧЕНИЕ
С помощью детонационного напыления получены кальций-фосфатные покрытия (толщиной до ≈50–100 мкм) на титановых хирургических пинах, содержавшие ГАП, α-ТКФ, β-ТКФ, а также аморфную фазу и следы ПФК. Кристалличность покрытия составила CI ≈ 23% при размере ОКР 22.2 нм. Стехиометрическое соотношение Ca : P ≈ ≈ 1.65–1.67.
In vivo оценки на лабораторных животных (крысы линии Вистар) показали, что нанесение указанных покрытий приводило к стимуляции остеоинтеграции имплантов за времена не менее 60 ± 5 сут после имплантации. Гистологически показано, что механизм остеогенеза в области дефекта (на интерфейсе кость/имплант) хондрогенный.
Список литературы
Сафронова Т.В. Неорганические материалы для регенеративной медицины // Неорган. материалы. 2021. Т. 57. № 5. С. 467–499.
Dorozhkin S.V. Functionalized Calcium Orthophosphates (CaPO4) and Their Biomedical Applications // J. Mater. Chem. B. 2019. V. 7. № 47. P. 7471–7489.
Лукина И.С., Зайцев В.В., Эрхова Л.В., Крутько Д.П., Гаврюшенко Н.С., Леменовский Д.А. Макропористые кальцийфосфатные матриксы, полученные по технологии самосхватывающихся цементов // Неорган. материалы. 2021. Т. 57. № 1. С. 81–88.
Combes Ch., Cazalbou S., Rey Ch. Apatite Biominerals // Minerals. 2016. V. 6. № 34. P. 1–25.
Casarrubios L., Gómez-Cerezo N., Sánchez-Salcedo S., Feito M.J., Serrano M.C., Saiz-Pardo M., Ortega L., de Pablo D., Díaz-Güemes I., Fernández-Tomé B., Enciso S., Sánchez-Margallo F.M., Portolés M.T., Arcos D., Vallet-Regí M. Silicon Substituted Hydroxyapatite/VEGF Scaffolds Stimulate Bone Regeneration in Osteoporotic Sheep // Acta Biomater. 2020. V. 101. P. 544–553.
Goldberg M.A., Gafurov M.R., Murzakhanov F.F., Fomin A.S., Antonova O.S., Khairutdinova D.R., Pyataev A.V., Makshakova O.N., Konovalov A.A., Leonov A.V., Akhmedova S.A., Sviridova I.K., Sergeeva N.S., Barinov S.M., Komlev V.S. Mesoporous Iron(III)-Doped Hydroxyapatite Nanopowders Obtained via Iron Oxalate // Nanomaterials. 2021. V. 11. № 811. P. 1–21. https://www.sciencedirect.com/science/article/pii/ S1742706119307123?via%3Dihub – !
Kaur S., Bala N., Khosla Ch. Characterization of Thermal-Sprayed HAP and HAP/TiO2 Coatings for Biomedical Applications // J. Therm. Spray Technol. 2018. V. 27. № 5. P. 1356–1370.
Smurov I., Ulianitskiy V. Computer Controlled Detonation Spraying: a Spraying Process Upgraded to Advanced Applications // WIT Trans. Eng. Sci. 2011. V. 71. P. 265–276.
Калита В.И., Комлев Д.И., Радюк А.А., Комлев В.С., Шамрай В.Ф., Сиротинкин В.П., Федотов А.Ю. Зависимость фазового состава фосфатных плазменных покрытий от температуры подложки и гидротермической обработки // Неорган. материалы. 2021. Т. 57. № 6. С. 627–631.
Demnati I., Parco M., Grossin D., Fagoaga I., Drouet C., Barykin G., Combes C., Braceras I., Goncalves S., Rey C. Hydroxyapatite Coating on Titanium by a Low Energy Plasma Spraying Mini-Gun // Surf. Coat. Technol. 2012. V. 206. № 8–9. P. 2346–2353.
Khor K.A., Cheang P. Characterization of Thermal Sprayed Hydroxyapatite Powders and Coatings // J. Therm. Spray Technol. 1994. V. 3. P. 45–50.
Batraev I.S., Prokhorov E.S., Ul’yanitskii V.Y. Acceleration and Heating of Powder Particle by Gas Detonation Products in Channels with a Conical Passage // Combust. Explos. Shock Waves. 2014. V. 50. № 3. P. 315–322.
Kuroda S., Kawakita J., Watanabe M., Katanoda H. Warm Spraying – a Novel Coating Process Based on High-Velocity Impact of Solid Particles // Sci. Technol. Adv. Mater. 2008. V. 9. № 3. P. 033002.
Nosenko V., Strutynska N., Vorona I., Zatovsky I., Dzhagan V., Lemishko S., Epple M., Prymak O., Baran N., Ishchenko S., Slobodyanik N., Prylutskyy Yu., Klyui N. Temchenko V. Structure of Biocompatible Coatings Produced from Hydroxyapatite Nanoparticles by Detonation Spraying // Nanoscale Res. Lett. 2015. V. 10. P. 464.
Klyui M.I., Temchenko V.P., Gryshkov O.P., Dubok V.A., Kladko V.P., Kuchuk A.V., Dzhagan V.M., Yukhymchuk V.O., Kiselov V.S. Bio-SiC Ceramics Coated with Hydroxyapatite Using Gas-Detonation Deposition: An Alternative to Titanium-Based Medical Implants // Funct. Mater. 2013. V. 20. № 2. P. 163–171.
Erkmen Z.E. The Effect of Heat Treatment on the Morphology of D-Gun Sprayed Hydroxyapatite Coatings // J. Biomed. Mater. Res. 1999. V. 48. № 6. P. 861–868.
Klyui N., Sliepkin O., Tsabiy L., Temchenko V., Chorniy V., Zatovsky I. Gas Detonation Deposition Technology – New Prospectives for Production of Ca-Phosphate Biocompatible Coatings onto Medical Implants // IEEE 9th Int. Conf. “Nanomaterials: Applications & Properties” (Odessa, Ukraine, 15–20 Sept. 2019). 2019 P. 02BA04-1–02BA04-3.
Цыганков П.А., Скрябин А.С., Телех В.Д., Локтионов Е.Ю., Челмодеев Р.И. Взаимодействия запыленных ударных волн с трехмерными каркасами углеродных нанокомпозитов в технологиях нанесения биосовместимых покрытий // Изв. РАН. Сер. физ. 2018. V. 82. № 4. C. 380–385.
Tsygankov P.A., Skryabin A.S., Krikorov A.A., Chelmodeev R.I., Vesnin V.R., Parada-Becerra F.F. Formation of a Combined Bioceramics Layer on Titanium Implants // J. Phys.: Conf. Ser. 2019. V. 1386. P. 012011.
Ulianitsky V., Shtertser A., Zlobin S., Smurov I. Computer-Controlled Detonation Spraying: from Process Fundamentals Toward Advanced Applications // J. Therm. Spray Techol. 2011. V. 20. № 4. P. 791–801.
Kotian R., Rao P., Madhyastha P. X-ray Diffraction Analysis of Hydroxyapatite-Coated in Different Plasma Gas Atmosphere on Ti and Ti–6Al–4V // Eur. J. Dent. 2017. V. 11. №. 4. P. 438–446.
Sa Y., Guo Y., Feng X., Wang M., Li P., Gao Y., Yang X., Jiang T. Are Different Crystallinity-Index-Calculating Methods of Hydroxyapatite Efficient and Consistent? // New J. Chem. 2017. V. 41. № 13. P. 5723–5731.
Koutsopoulos S. Synthesis and Characterization of Hydroxyapatite Crystals: A Review Study on the Analytical Methods // J. Biomed. Mater. Res. 2002. V. 62. № 4. P. 600–612.
Nosenko V.V., Yaremko A. M., Dzhagan V. M., Vorona I.P., Romanyuk Yu. A., Zatovsky I. V. Nature of Some Features in Raman Spectra of Hydroxyapatite-Containing Materials // J. Raman Spectrosc. 2016. V. 47. № 6. P. 726–730.
Demnati I., Grossin D., Combes Ch., Rey Ch. Plasma-Sprayed Apatite Coatings: Review of Physical-Chemical Characteristics and Their Biological Consequences // J. Med. Biol. Eng. 2014. V. 34. № 1. P. 1–7.
Gras P., Rey C., Marsan O., Sarda S., Combes C. Synthesis and Characterisation of Hydrated Calcium Pyrophosphate Phases of Biological Interest // Eur. J. Inorg. Chem. 2013. V. 2013. № 34. P. 5886–5895.
Ben-Nissan B. Advances in Calcium Phosphates Biomaterials. Berlin: Springer, 2014. 547 p.
Safronova T., Putlayev V., Shekhirev M. Resorbable Calcium Phosphates Based Ceramics // Powder Metall. Met. Ceram. 2013. V. 52. № 5–6. P. 357–363.
Heimann R.B. Plasma-Sprayed Hydroxylapatite Coatings as Biocompatible Intermediaries between Inorganic Implant Surfaces and Living Tissue // J. Therm. Spray. Technol. 2018. V. 27. P. 1212–1237.
Cao N., Dong J., Wang Q., Ma Q., Xue Ch., Li M. An Experimental Bone Defect Healing with Hydroxyapatite Coating Plasma Sprayed on Carbon/Carbon Composite Implants // Surf. Coat. Technol. 2010. V. 205. № 4. P. 1150–1156.
Xue W., Tao Sh., Liu X., Zheng X., Ding Ch. In vivo Evaluation of Plasma Sprayed Hydroxyapatite Coatings Having Different Crystallinity // Biomaterials. 2004. V. 25. № 3. P. 415–421.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы