Неорганические материалы, 2022, T. 58, № 10, стр. 1101-1110
Ликвационная плавка в системе LiAlSi2O6–Na2SO4–NaF как метод получения фторида лития
Л. М. Делицын 1, *, Р. В. Кулумбегов 1, В. А. Синельщиков 1, О. С. Попель 1, М. Г. Сульман 2
1 Объединенный институт высоких температур Российской академии наук
127412 Москва, ул. Ижорская, 13, стр. 2, Россия
2 Тверской государственный технологический университет
170026 Тверь, наб. А. Никитина, 22, Россия
* E-mail: delitzin@ihed.ras.ru
Поступила в редакцию 10.03.2022
После доработки 24.05.2022
Принята к публикации 07.08.2022
- EDN: OQOHSI
- DOI: 10.31857/S0002337X22100062
Аннотация
Исследован метод получения фторида лития из природного сподумена (LiAlSi2O6), основанный на ликвационной плавке в системе LiAlSi2O6–Na2SO4–NaF. Изучено формирование двух несмешивающихся расплавов: силикатного и солевого, которые вследствие низкого межфазного натяжения легко отделяются друг от друга. Солевой расплав является концентратором Li+, который находится в нем в виде LiF. Извлечение Li+ из LiAlSi2O6 в солевой расплав достигает 75%. Силикатный расплав содержит мелкие капли солевого расплава, которые выщелачиваются водой. В результате взаимодействия между Na2SO4 и NaF образуется двойная соль Na3SO4F которая вступает в реакцию со сподуменом, в результате чего образуются промежуточные соединения, в том числе Li3AlF6.
ВВЕДЕНИЕ
Литий – один из наиболее востребованных металлов в современных отраслях промышленности: в производстве керамики, смазочных материалов в авиационных двигателях, металлургии, атомной энергетике, в качестве накопителя электроэнергии и др. Литий-ионные аккумуляторы (ЛИА) становятся основным сегментом использования лития, превысив 35% от его мирового потребления в 2015 г. В 2020 г. уже более 60% мирового потребления лития приходилось на рынок ЛИА, сырьем для производства которых является Li2CO3.
Кроме того, широкое применение находят и другие соединения лития, одним из которых является LiF, используемый в смеси с фторидом бериллия в качестве растворителя для жидкосолевых ядерных реакторов [1]. Он также используется в оптической и поляризационной микроскопии, спектроскопии и других областях.
Из нескольких крупнейших, детально разведанных месторождений с утвержденными запасами лития в России не введено в эксплуатацию ни одного. Общие запасы лития в России, по данным [2], оцениваются в 8 млн т, в т.ч. ~7.0 млн т в месторождениях Кольского полуострова и ~1 млн т в Восточно-Саянском регионе [2, 3]. Поэтому необходимость промышленного освоения месторождения лития является стратегически важной задачей, актуальность которой очевидна в связи с необходимостью снятия зависимости от импорта [4, 5]. Данные [2, 6, 7] подчеркивают большой потенциал отечественной литиевой базы, способный удовлетворить потребности промышленности на много лет.
В настоящее время основным методом вскрытия сподумена является сернокислотный метод. Долгое время промышленным способом переработка литийсодержащих руд являлся метод сульфатного вскрытия [8, 9] с получением сульфата лития. В основу щелочного метода переработки литиевых руд положено их спекание с известью или известняком с получение гидроксида лития.
Известны работы Плющева В.Е. [10] по применению Na2SO4 и K2SO4 для получения сульфата лития в расплавах. Приемлемые выходы сульфата лития были получены при использовании K2SO4. При использовании в качестве компонента шихты Na2SO4 максимальное извлечение лития в солевой расплав не превышает 50%. РФА показал, что при спекании сподумена с Na2SO4 образуется вязкая масса, т.н. “сподуменовое стекло” [9], что делает невозможным вскрытие сподумена с использованием Na2SO4 [11]. В результате был сделан вывод о бесперспективности использования сульфата натрия для получения сульфата лития из сподумена [10]. Недостатком метода с использованием сульфата калия является его дороговизна.
Ранее [12] была показана эффективность использования NaF для извлечения редкоземельных элементов из силикатно-солевых систем. В этой связи в данной работе для извлечения лития из сподумена предложено использование смеси Na2SO4 + NaF.
Цель работы – изучение влияния параметров ликвационной плавки в системе LiAlSi2O6–Na2SO4–NaF на извлечение фторида лития. Полученные данные могут быть использованы в разработке технологии переработки Колмозерских сподуменовых руд с целью получения из них фторида лития.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения экспериментальных исследований были использованы: природный минерал сподумен (LiAlSi2O6, месторождение Васин Мыльк (Кольский полуостров)), содержащий 6% Li2O; Na2SO4 (“х. ч.” ООО “Группа компаний Химпром”); NaF (“ч. д. а.”, ООО “Группа компаний Химпром”); H2SO4 (“х. ч.”, ГОСТ 4204-77, ООО “Воскресенский завод фосфорных кислот”); HF 45%-ная (“х. ч.”, ГОСТ 10484-78, Уральское ПО “Галоген”).
Сподумен, являющийся инертным материалом, для активации был подвержен декрипитации при 1050–1080°С в течение 60 мин для перехода кристаллической α-фазы в β-фазу. При этом его кристаллическая структура изменяется и становится схожей по текстуре с природными цеолитами. В таком кристалле возможно проведение обмена ионов лития на катионы других щелочных металлов.
После декрипитации вспученный материал просеивали на лабораторном рассеве У1-ЕРЛ-10 для отделения фракции <200 мкм от примесей марганцевых минералов, полевого шпата и др. Шихту готовили смешением сподумена (10–80%) с Na2SO4 (5–80%) и NaF (10–70%). Термическую обработку шихты (10–100 г) осуществляли в муфельной печи ПМ-14М1П-1250Т при температуре 580–1050°C в течение 60 мин на воздухе с открытой поверхностью расплава в корундовых или фарфоровых тиглях. По окончании экспериментов продукты плавления закаливали на стальной холодной плите. Потеря массы в экспериментах составляла 0.2–0.5%. Полученный солевой расплав выщелачивали дистиллированной водой при постоянном перемешивании на магнитной мешалке MSH-300 BIOSAN в течение 2 ч при комнатной температуре. Количество воды брали из расчета недопущения растворения LiF (растворимость в воде при комнатной температуре 0.12% [13]). После этого нерастворимый остаток отфильтровывали и высушивали при 105°С, фильтрат упаривали досуха. Силикатный расплав истирали на лабораторном истирателе КМ-1 до фракции <100 мкм и выщелачивали в дистиллированной воде при отношении Ж : Т = 3 : 1.
Концентрацию лития и натрия определяли с помощью пламенно-фотометрического анализатора ПФА-378.
Определение термических эффектов в системе LiAlSi2O6–Na2SO4–NaF проводили на термоанализаторе STD Q600, который позволяет одновременно осуществить термогравиметрический (ТГ) и дифференциальный сканирующий калориметрический (ДСК) анализы. Максимальная температура нагрева составляла 1100°С при скорости нагрева 10°С/мин на воздухе в платиновых микротиглях.
Продукты плавления исследовали петрографическим методом в прозрачных и полированных шлифах с помощью сканирующего электронного микроскопа JSM-5 (JEOL) и методом рентгенофазового анализа (РФА) с использованием дифрактометров ДРОН-2 и Proto’s AXRD Benchtop (CuKα-излучение). Идентификация фаз проводилась на основе баз данных Crystallography Open Database (COD) и Pcpdfwin-JCPDS.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
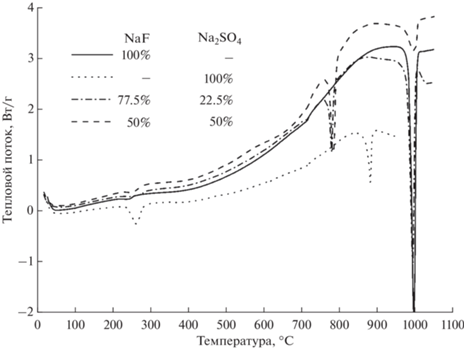
На рис. 1 представлены кривые ДСК для NaF, Na2SO4 и их смесей. Температуры плавления, определенные по положению минимумов на ДСК-кривых для чистых NaF и Na2SO4, составили 997 и 882°С соответственно, что хорошо согласуется с данными [14].
Минимум, наблюдаемый в низкотемпературной области 260°С для ДСК-кривой Na2SO4, обусловлен эндотермическим процессом, связанным с полиморфным переходом вещества. На ДСК-зависимостях для смесей NaF + Na2SO4 минимум, соответствующий плавлению NaF, наблюдается при температуре, равной температуре плавления чистого NaF. При этом с уменьшением доли NaF в смеси его амплитуда падает, а положение практически не изменяется. В то же время минимум, соответствующий плавлению Na2SO4, в смесях NaF + Na2SO4 не проявляется. На ДСК-зависимостях появляется минимум в области температур 784°С (рис. 1), который соответствует температуре плавления двойной соли NaF·Na2SO4 (Na3SO4F) [15]. Таким образом, при взаимодействии NaF с Na2SO4 образуется двойная соль Na3SO4F, что подтверждено методом РФА. Отсутствие на ДСК-кривой смеси NaF + Na2SO4 минимума, отвечающего плавлению Na2SO4, объясняется избытком NaF. Для образования двойной соли мольное отношение NaF : Na2SO4 = 1 : 1. Введение сподумена в систему Na2SO4–NaF отражается на кривой ДСК появлением нового минимума при температуре 620°С (рис. 2). Одновременно исчезает минимум при температуре 784°С, соответствующий плавлению двойной соли Na3SO4F, при этом минимум, отвечающий плавлению NaF, практически не меняется.
Рис. 2.
ДСК-кривые для смесей LiAlSi2O6 + Na2SO4 + NaF с различным содержанием LiAlSi2O6 (соотношение массовых долей Na2SO4 : NaF = 1 : 1).
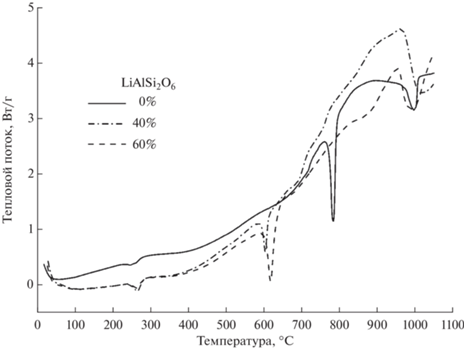
Вероятно, при температуре 620°С происходит взаимодействие между компонентами системы с образованием новых фаз: NaAlSi2O6, NaAlSi3O8, Li3AlF6, Na3SO4F, Li2SO4, NaLiSO4, что подтверждается данными РФА.
Отсутствие на ДСК-кривой минимума плавления (784°С) двойной соли, в отличие от NaF, в присутствии сподумена указывает на то, что Na3SO4F вступает в реакцию со сподуменом еще в твердой фазе.
Экспериментально установлено, что оптимальная температура ликвации расплавов в системе LiAlSi2O6–Na2SO4–NaF равна 1050°С. Ликвация расплавов протекает очень быстро, фактически расход тепла требуется только на достижение температуры полного плавления шихты, после чего расплавы распадаются на две несмешивающиеся жидкие фазы, которые вследствие низкого межфазного натяжения легко разделяются на два слоя: силикатный и солевой.
Результаты экспериментальных исследований ликвации расплавов в системе LiAlSi2O6–Na2SO4–NaF нанесены на основание правильной треугольной призмы в виде проекции изотермических сечений при температуре 1050°С (рис. 3). Область ликвации занимает 70% площади диаграммы.
Рис. 3.
Положение области несмешивающихся расплавов (изотерма 1050°С) на фазовой диаграмме системы LiAlSi2O6–Na2SO4–NaF: I – два несмешивающихся расплава (область L1 + L2): разрез LiAlSi2O6–точка 32 при массовом отношении Na2SO4 : NaF = 1 : 1; разрез LiAlSi2O6–точка 39 при массовом отношении Na2SO4 : NaF = 1 : 3; А–B – несмешиваемость расплавов при содержании Na2SO4 5%, А–С – несмешиваемость расплавов при содержании NaF 15%, II – нет полного плавления.

Полученные данные свидетельствуют о значительном влиянии NaF на расширение поля ликвации расплавов в сторону боковой грани LiAlSi2O6–NaF при соответствующем снижении расхода Na2SO4. Предел плавления в системе LiAlSi2O6–Na2SO4–NaF на изотерме 1050°С ограничивается содержанием сподумена 80%.
Всего в системе нами было изучено 3 разреза, положения которых показаны на рис. 3: 1 – разрез LiAlSi2O6–точка 32 на боковой грани Na2SO4–NaF при их массовом отношении 1 : 1; 2 – разрез LiAlSi2O6–точка 39 на боковой грани Na2SO4–NaF при их массовом отношении 1 : 3; 3 – боковая грань системы LiAlSi2O6–NaF. Для других разрезов (LiAlSi2O6–точка 44, LiAlSi2O6–Na3SO4F, А–В и А–С) были изучены только точки с ликвацией расплавов. Точки на линии А–В отделяют область ликвации от системы LiAlSi2O6–Na2SO4, в которой, по данным [9, 10], находится область образования тугоплавких и очень вязких расплавов, непригодных для получения сульфата лития. Реакция между компонентами системы начинается при температуре ~580°С (рис. 4) с образованием сульфатов лития.
Рис. 4.
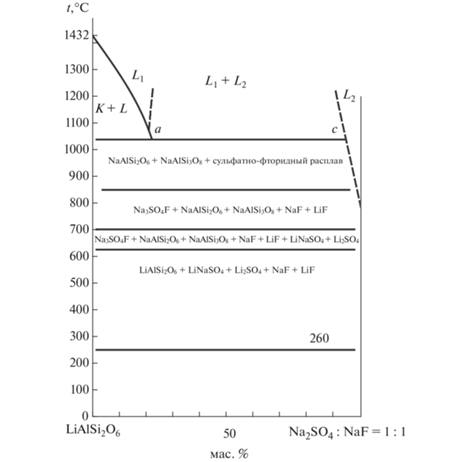
Сечение LiAlSi2O6–точка 39 (рис. 3); K и L – соответственно кристаллическая и жидкая фазы неуточненного состава.
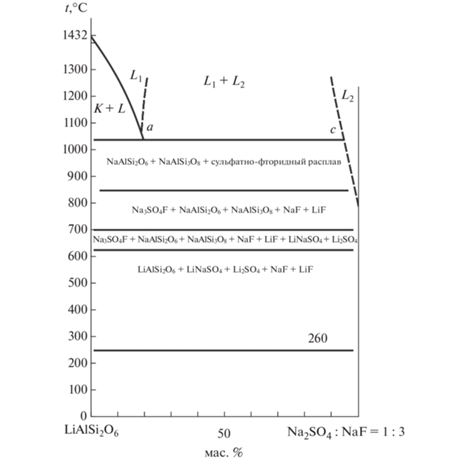
В низкотемпературной области разреза LiAlSi2O6– точка 39 (массовое отношение Na2SO4 : NaF = 1 : 3) в спеках присутствуют LiAlSi2O6, NaLiSO4 и Li2SO4, NaF и LiF. С повышением температуры вместо LiAlSi2O6 фиксируются щелочные алюмосиликаты NaAlSi2O6 и NaAlSi3O8, сульфаты лития отсутствуют. Ниже линии ликвидуса вместе с NaAlSi2O6 и NaAlSi3O8 находится сульфатно-фторидный расплав. Выше линии ликвидуса при температуре 1020°С (линия а–с) в равновесии сосуществуют два несмешивающихся расплава: силикатный и солевой (сульфатно-фторидный). Для лучшего разделения расплавов в области ликвации и их анализа все дальнейшие эксперименты проводились при 1050°С.
Область ликвации расплавов на изотерме 1050°С ограничивается содержанием LiAlSi2O6 80–81% (рис. 3). Со стороны Na2SO4–NaF область ликвации проведена при содержании LiAlSi2O6 ~ 5%, поскольку при его содержании в шихте 10% расплавы распадаются на две жидкие фазы.
Поведение компонентов на разрезе LiAlSi2O6–точка 32 (Na2SO4 : NaF = 1 : 1) почти такое же, как на разрезе LiAlSi2O6–точка 39 (Na2SO4 : NaF = 1 : 3) (рис. 5). Небольшое отличие состоит лишь в том, что область ликвации ограничивается содержанием LiAlSi2O6 76–77% (рис. 3).
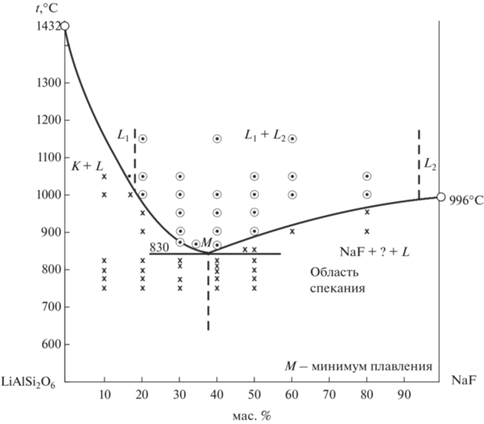
Боковая грань LiAlSi2O6–NaF представляет собой частное сечение взаимной системы LiAlSi2O6–NaF–NaAlSi2O6–LiF (рис. 6).
На изотерме 1050°С область двух несмешивающихся расплавов ограничивается содержанием LiAlSi2O6 80% с силикатной стороны системы и ~5–8% c фторидной. Ниже 1000°С имеются две ветви кристаллизации, пересекающиеся в точке M, где две жидкие фазы находятся в равновесии с кристаллическими фазами: левее точки минимума M (t = 830°C) с алюмосиликатами, правее точки M (t = 830°C) с фторидами. По нашим данным, в системе Na2SO4–NaF никаких фаз кроме NaF·Na2SO4 не обнаруживается, что соответствует исследованиям [16].
Поскольку система LiAlSi2O6–NaF–Na2SiO4 относится к классу взаимных, число компонентов в которых превышает 5, изобразить коноды, связывающие равновесные жидкие фазы, составы которых известны (табл. 1), представляет собой достаточно сложную задачу. Чтобы изобразить их на диаграмме, потребуется точное определение количественного химического состава равновесных жидкостей, что планируется выполнить в дальнейших исследованиях.
Таблица 1.
Фазовый состав продуктов плавления системы LiAlSi2O6–Na2SO4–NaF (t = 1050°С)
| Продукт плавления | Основные кристаллические фазы | Примеси кристаллических фаз |
|---|---|---|
| Солевой расплав | NaF, Na3SO4F, LiF | – |
| Силикатный расплав | Стекло | LiF |
| Упаренный фильтрат | Na3SO4F, NaF | LiF |
| Нерастворимый остаток | LiF | Na3AlF6 (следы) |
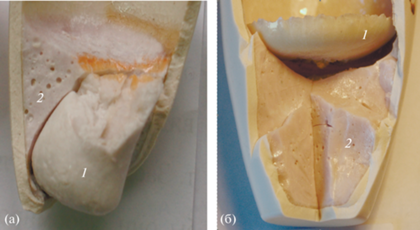
В зависимости от состава шихты солевой расплав либо тонет и находится в донной части тигля под слоем силикатного расплава (рис. 7а), либо всплывает над силикатным расплавом (рис. 7б).
Рис. 7.
Ликвация расплавов в системе LiAlSi2O6–Na2SO4–NaF (t = 1050°С): а – 40% LiAlSi2O6, 45% Na2SO4, 15% NaF, солевой расплав находится в донной части тигля; б – 70% LiAlSi2O6, 7.5% Na2SO4, 22.5% NaF, солевой расплав находится в верхней части тигля; 1 – кристаллизованный солевой расплав, 2 – закаленный силикатный расплав (мас. %).
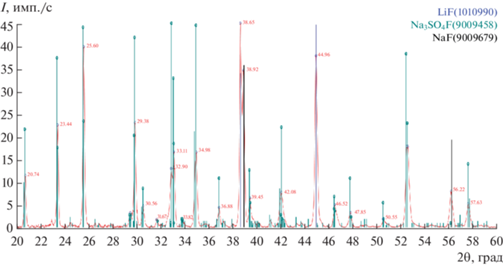
По данным РФА (табл. 1), закристаллизованный солевой расплав представлен смесью кристаллов LiF, NaF и Na3SO4F (рис. 8).
При выщелачивании солевого расплава расчетным количеством воды в раствор переходят NaF и Na3SO4F, в нерастворимом остатке остаются LiF и следы Na3AlF6 (рис. 9).
Закаленный силикатный расплав находится в аморфном состоянии. В нем обнаружена фаза LiF, однако наблюдается смещение пиков, что может быть связано с влиянием аморфной фазы (рис. 10).
Содержание LiF в силикатном расплаве составляет от 2 до 3 мас. %, остальное количество LiF концентрируется в солевом расплаве. В упаренном фильтрате содержание LiF колеблется от 0.9 до 1.1 мас. %, нерастворимый остаток на 95–97 мас. % состоит из LiF. В структуре закаленного силикатного расплава, представленного стеклом, содержатся мелкие (0.1–3 мкм (рис. 11) и реже до 100–200 мкм) капли солевого расплава. Наличие мелких капель солевого расплава в силикатной матрице, вероятно, связано с их малыми размерами, малой массой и высокой вязкостью силикатного расплава, что не позволяет им слиться с основным солевым слоем. Подобное взаимоотношение жидких фаз вызывает тонкую опалесценцию стекла.
Рис. 11.
Структура закаленного силикатного расплава системы LiAlSi2O6–Na2SO4–NaF: а – тонкая опалесценция стекла с солевыми капельками диаметром <1 мкм, б – солевые капли 1 в стеклянной матрице 2.

Солевые капли легко выщелачиваются водой из растертого до фракции <100 мкм силикатного стекла, образуя ямки травления (рис. 12).
Рис. 12.
Структура закаленного силикатного расплава системы LiAlSi2O6–Na2SO4–NaF до (а), после выщелачивания водой (б).

Методом РФА установлено, что состав капель солевого расплава в силикатной матрице аналогичен составу основного солевого слоя и представлен LiF, Na3SO4F и NaF.
При постоянном содержании сподумена в системе LiAlSi2O6–Na2SO4–NaF соотношение солей Na2SO4 : NaF оказывает влияние на концентрацию Li+ в солевом расплаве (табл. 2).
Таблица 2.
Зависимость концентрации Li+ в продуктах ликвации от отношения Na2SO4 : NaF в шихте (t = 1050°С, содержание LiAlSi2O6 70%)
| Na2SO4 : NaF | Концентрация Li+, мас. % | |
|---|---|---|
| силикатный расплав | солевой расплав | |
| 0.33 | 0.61 | 10.8 |
| 0.5 | 0.89 | 9.5 |
| 1.0 | 0.6 | 8.7 |
| 1.6 | 0.7 | 6.0 |
Максимальное извлечение Li+ из сподумена получено при составе шихты (мас. %): 70% LiAlSi2O6–7.5% Na2SO4 + 22.5% NaF и составляет 75%. Отношение концентрации Li+ в солевом расплаве к концентрации Li+ в силикатном расплаве зависит от состава шихты и колеблется от 9 до 18.
ЗАКЛЮЧЕНИЕ
Впервые показано, что ликвационная плавка может быть использована для получения фторида лития из сподумена. Система LiAlSi2O6–Na2SO4–NaF характеризуется широким полем двух несмешивающихся расплавов: силикатного и солевого. Количество NaF оказывает влияние на расширение поля ликвации расплавов. Показано, что Na2SO4 и NaF взаимодействуют с образованием двойной соли Na3SO4F, которая вступает в реакцию со сподуменом на стадии спекания. Солевой расплав является концентратором Li+, который находится в нем в виде LiF. Содержание Li+ в солевом расплаве при разном составе шихты составляет от 6.0 до 10.8%, в силикатном расплаве – от 0.6 до 0.89 мас. %. Извлечение Li+ из сподумена в солевой расплав составляет 75%.
Данный способ переработки сподумена может оказаться привлекательным, поскольку при короткой технологической схеме конечным результатом является готовый продукт – фторид лития. Силикатный расплав, содержащий 0.60–0.89% Li+, может быть использован в производстве керамики [17].
Список литературы
Ignatiev V., Feynberg O., Kormilitsyn M. et al. Molten Salt Actinide Recycler and Transforming System without and with Th–U Support: Fuel Cycle Flexibility and Key Material Properties // Ann. Nucl. Energy. 2014. V. 64. P. 408–420.
Юсупов Т.С., Исупов В.П., Владимиров А.Г., Загорский В.Е. и др. Исследование вещественного состава и разделимости минералов техногенного сырья // Физико-технические проблемы разработки полезных ископаемых. 2014. № 6. С. 144–150.
Владимиров А.Г., Ляхов Н.З., Загорский В.Е., Макагон В.М. и др. Литиевые месторождения сподуменовых пегматитов Сибири // Химия в интересах устойчивого развития. 2012. № 20. С. 3–20.
Мелентьев Г.Б. Литиевый потенциал России // Редкие Zемли. 2016. Вып. 2(7). С. 150–163.
Наумов А.В. Литий: сверхвозможности суперметалла // Редкие Zемли. 2016. Вып. 2(7). 2016. С. 140–149.
Морозова Л.Н. Колмозерское литиевое месторождение редкометальных пегматитов: новые данные по редкоэлементному составу (Кольский полуостров) // Литосфера. 2018. Т. 18. № 1. С. 82–98. https://doi.org/10.24930/1681-9004-2018-18-1-082-098
Морозова Л.Н., Серов П.А., Кунакузин Е.Л., Борисенко Е.С. и др. Кольский редкометальный пегматитовый пояс: основные черты геологического строения // Тр. Ферсмановской научной сессии ГИ КНЦ РАН. 2020. Т. 17. С. 374–378.
Отроушко Ю.И., Бучихин П.И., Алексеева В.В. и др. Литий, его химия и технология. М.: Атомиздат, 1960. С. 201.
Плющев В.Е., Степин Б.Д. Химия и технология соединений лития, рубидия и цезия. М.: Химия, 1970. С. 407.
Плющев В.Е. Исследование взаимодействия минералов, содержащих редкие щелочные элементы, с солями и окислами в процессах спекания и сплавления. VI. О взаимодействии сподумена с сульфатом натрия // Химия и хим. технология. 1961. № 3. С. 463–470.
Кулифеев В.К., Миклушевский В.В., Ватулин И.И. Литий. М.: МИСИС, 2006. С. 126–127.
Делицын Л.М. Механиз ликвации в природных и технологических силикатно-солевых расплавах – концентраторах редких земель и ниобия. М.: ГЕОС, 2018. 408 с.
Киргинцев А.Н., Трушникова Л.Н., Лавреньтева В.Г. Растворимость неорганических веществ в воде. Л.: Химия, 1972. С. 9.
Волков А.И., Жарский И.М. Большой химический справочник. Минск: Современная школа, 2005. 608 с.
Посыпайко В.И., Алексеева Е.А. Диаграммы плавкости солевых систем. Тройные системы. М.: Химия, 1977. С. 310–311.
Посыпайко В.И., Алексеева Е.А. Диаграммы плавкости солевых систем. Многокомпонентные системы. М.: Химия, 1977. С. 67–70.
Кичкайло О.В., Левицкий И.А. Особенности структуры и свойств сподуменовой керамики, полученной методом шликерного литья // Огнеупоры и техническая керамика. 2004. № 11. С. 34–38.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы