Неорганические материалы, 2022, T. 58, № 10, стр. 1069-1078
Влияние олова и титана на электрохимические свойства обогащенных литием катодных материалов
Л. С. Печень 1, *, Е. В. Махонина 1, А. Е. Медведева 1, Ю. А. Политов 1, А. М. Румянцев 2, Ю. М. Коштял 2
1 Институт общей и неорганической химии им. Н.С. Курнакова
Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Физико-технический институт им. А.Ф. Иоффе Российской
академии наук
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
* E-mail: lidia.s.maslennikova@gmail.com
Поступила в редакцию 21.04.2022
После доработки 09.06.2022
Принята к публикации 14.06.2022
- EDN: EEMMDB
- DOI: 10.31857/S0002337X22100116
Аннотация
Изучено влияние введения катионов олова и титана в состав обогащенных литием катодных материалов на их электрохимические показатели. Исследуемые образцы получены методом совместного соосаждения прекурсоров с последующей твердофазной реакцией с источником лития и олова (титана). Катодные материалы изучены методами РФА, СЭМ, РСМА и испытаны в литиевых полуячейках в режиме гальваностатического циклирования при разных плотностях тока. Материал, допированный титаном, показал значительно бóльшую удельную разрядную емкость (270 мАч/г) по сравнению с недопированным материалом и материалом с оловом (230 мАч/г). При увеличении тока заряда/разряда образец с добавкой титана показал также лучшую стабильность циклирования среди всех материалов. Помимо этого, оба допированных материала продемонстрировали меньший гистерезис напряжений по сравнению с исходным образцом.
ВВЕДЕНИЕ
Среди кандидатов на роль перспективных катодных материалов литий-ионных аккумуляторов (ЛИА) оксиды с высоким содержанием лития с общей формулой Li1 +xM1 –xO2 занимают одну из лидирующих позиций с точки зрения интенсивности исследования. Огромное количество работ, например [1–5], посвящено изучению состава, структуры и свойств данного, уже отдельно выделившегося, класса оксидных катодных материалов, общую формулу которых также представляют как yLi2MnO3·(1 – y)LiM'O2, где M' – чаще всего сочетание Mn, Ni, Co. Несмотря на большое количество работ, нет четкого понимания причин деградации таких материалов при использовании в качестве активного вещества катода ЛИА.
Структуру обогащенных литием оксидов рассматривают и как интегрированную из двух фаз: тригональной (пр. гр. $R\bar {3}m$) и моноклинной (пр. гр. C2/m) [6–8], и как твердый раствор на основе моноклинной фазы (пр. гр. C2/m) [9, 10]. Авторы работы [11] на основании синтеза обогащенных литием оксидов с разным размером частиц и их исследования, в том числе методом РФА в процессе электрохимического циклирования, предполагают, что образование однофазной или двухфазной системы для данных соединений зависит от размера частиц. Тот факт, что функциональные свойства оксидов зависят не только от размера частиц, но и от метода синтеза и морфологии, также освещен в ряде работ [12–14].
Основные обсуждаемые в литературе проблемы катодных материалов с высоким содержанием лития связаны с предполагаемой структурной перестройкой фазы Li2MnO3 (при рассмотрении двухфазной модели) или в целом материала в результате процессов, происходящих во время электрохимической активации при высоких значениях напряжения [15]. Активация сопровождается необратимой емкостью при разряде, что связывают с необратимым уходом части кислорода и лития главным образом с поверхности частиц [16–18], а постепенно, возможно, и из объема [16]. Прирост емкости на заряде и разряде после активации соотносят с электрохимической работой образовавшегося MnO2 или MO2 со смешанным составом по металлу [19]. В литературе также говорят о постепенной миграции переходных металлов (ПМ) в освободившиеся в процессе деинтеркаляции литиевые позиции [20, 21], что в свою очередь приводит к дальнейшей структурной перестройке в дефектную шпинелеподобную фазу в ходе электрохимического циклирования [20, 21].
Вышеизложенные проблемы ведут к падению емкости и напряжения в процессе циклирования, что неблагоприятно для практического применения материалов. Однако, несмотря на большое число проблем, оксиды с избытком лития рассматривают как один из наиболее перспективных классов катодных материалов благодаря их высокой разрядной емкости (более 220 мАч/г) при достаточно высоком напряжении разряда (порядка 3.5 В и выше).
Допирование является одним из способов модифицирования оксидных катодных материалов, с помощью которого, меняя локальное окружение, можно стабилизировать структуру оксидов, улучшить диффузию ионов лития, предотвратить миграцию ПМ в литиевые позиции и т.д., что положительно сказывается на электрохимических показателях материалов. Замещение преимущественно проводят либо за счет одного из входящих в состав ПМ [22–25] или их суммы [26–28], либо по позициям лития [29, 30]. Есть ряд работ по анионному замещению, в которых допирование осуществляют в позиции кислорода [21, 31].
В настоящей работе проведено замещение дорогостоящего и токсичного кобальта (Co3+) катионами более легкого элемента титана (Ti4+) и более тяжелого олова (Sn4+). Четырехвалентный титан относится к d0-катионам, которые в ряде работ рассматриваются как предпочтительные допанты на места ПМ [32, 33]. Авторы работы [34] на основании результатов расчета методом функционала плотности (DFT) показали, что предпочтительным является замещение титаном ионов кобальта [32–34]. Sn4+ имеет полностью заполненные d-орбитали (d10) и также рассматривается как один из перспективных элементов замещения ПМ. Катионам олова не свойственно тетраэдрическое окружение, что благоприятно при введении этого допанта, поскольку в шпинелеподобной фазе, образующейся в процессе циклирования, металлы расположены как в октаэдрических, так и в тетраэдрических позициях [35]. Ионные радиусы Ti4+ и Sn4+ равны 0.605 и 0.690 Å соответственно, что соотносится с ионными радиусами входящих в состав ПМ (для Mn4+ – 0.530 Å, для Co3+ – 0.545 Å, для Ni2+ – 0.690 Å) с учетом их случайного распределения в структуре LiMO2. Все синтезированные материалы проанализированы методами РФА, масс-спектрометрии с индуктивно-связанной плазмой (ICP-MS), сканирующей электронной микроскопии (СЭМ) и испытаны в качестве активного вещества катода в литиевых полуячейках в режиме гальваностатического циклирования. Рассмотрено влияние вводимых допантов на функциональные электрохимические характеристики катодных материалов на основе синтезированных оксидов. Показано, что введение титана положительно сказывается на увеличении удельной разрядной емкости и улучшении стабильности циклирования обогащенного литием оксида в сравнении с недопированным оксидом. Допированные оловом и титаном материалы также показали значительно меньший гистерезис напряжений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катодных материалов. Допированные титаном и оловом образцы получали методом совместного соосаждения исходного карбонатного прекурсора состава Mn0.68Ni0.17Co0.15CO3 с дальнейшей твердофазной реакцией с необходимым количеством моногидрата гидроксида лития LiOH·H2O и TiO2 или SnO2 для допированных образцов (обозначения LR-Ti, LR-Sn), а также LiOH·H2O и Co3O4 (обозначение LR-Co) для образца сравнения. Синтез карбонатного прекурсора более подробно описан в наших предыдущих работах [14, 36]. Титан и олово вводили на твердофазной стадии в количестве 2 ат. % от общего количества ПМ за счет кобальта. После проведения твердофазной реакции все материалы подвергали температурной обработке на воздухе в две стадии: отжиг при 480°C в течение 6 ч и высокотемпературный отжиг при 900°C в течение 12 ч. Состав конечного соединения для допированных оксидов можно представить формулами Li1.2(Mn0.67Ni0.17Co0.15Ti(Sn)0.02)0.8O2.
Методы исследования. Полученные оксиды охарактеризованы методом РФА с уточнением структуры методом Ритвельда. Дифрактометрические исследования проводили при комнатной температуре на рентгеновском дифрактометре Bruker D8 Advance (CuKα-излучение, λ = 0.15418 нм, 45 кВ/250 мА) в режиме θ/2θ-сканирования в интервале углов 5°–80° с шагом 0.02°. Сбор данных осуществляли с помощью программного комплекса BrukerDIFFRACplus, анализ – с помощью программ EVA, TOPAS.
Морфологию и микроструктуру, а также равномерность распределения элементов по объему полученных оксидов изучали с помощью СЭМ (микроскоп NVision-40 (Carl Zeiss)) с применением метода рентгеноспектрального микроанализа (РСМА, EDX).
Распределение частиц по размерам измеряли с использованием лазерного анализатора размеров частиц Analysette 22 MicroTec Plus.
Содержание металлов в полученных образцах определяли методом масс-спектрометрии с индуктивно-связанной плазмой (ICP-MS) на приборе Agilent 7500ce (Agilent Technologies Inc.).
Электрохимические испытания. Все синтезированные оксиды испытаны в качестве активного материала катода ЛИА. Испытания проводили в литиевых полуячейках на зарядно-разрядных стендах Neware CT-4008-5V10mA-164 в режиме гальваностатического циклирования (режим постоянного тока, постоянного напряжения (CCCV) на заряде и режим постоянного тока (CC) на разряде). Выбранный диапазон напряжений для испытаний 2.5–4.7 В. Ток заряда во время циклирования – 20 или 80 мА/г, ток разряда варьировали от 20 до 600 мА/г. Все ячейки с исследуемыми катодными материалами были предварительно сформированы по следующей схеме: по 2 цикла заряда/разряда в диапазонах 2.5–4.3, 2.5–4.5, 2.5–4.6 и 2.5–4.7 В. Все формировочные циклы проводили при токе заряда и разряда 20 мА/г. Данная схема выбрана для постепенной активации фазы Li2MnO3. После формировки катодные материалы испытывали в трех режимах: 1) в диапазоне напряжений 2.5–4.7 В при токе заряда/разряда 20 мА/г; 2) в диапазоне 2.5–4.7 В при 80 мА/г и 3) в том же диапазоне напряжений при 80 мА/г, при этом ток разряда постепенно повышали с 80 до 600 мА/г.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Бóльшая часть пиков на дифрактограммах всех образцов хорошо описываются структурой с тригональной ячейкой, пр. гр. $R\bar {3}m$ (рис. 1). На дифрактограммах оксидов наблюдаются также пики моноклинной фазы с пр. гр. C2/m. Пики моноклинной фазы сильно уширены и перекрываются с рефлексами для тригональной модификации, поэтому достоверно оценить параметры ячейки и размер областей когерентного рассеяния (ОКР) для данной фазы не представляется возможным. Несмотря на перекрывание пиков, по более интенсивным линиям тригональной фазы можно определить ее параметры ячейки и размеры ОКР (табл. 1).
Рис. 1.
Дифрактограммы синтезированных оксидов (звездочкой на примере LR-Co обозначены пики кремниевого стандарта).
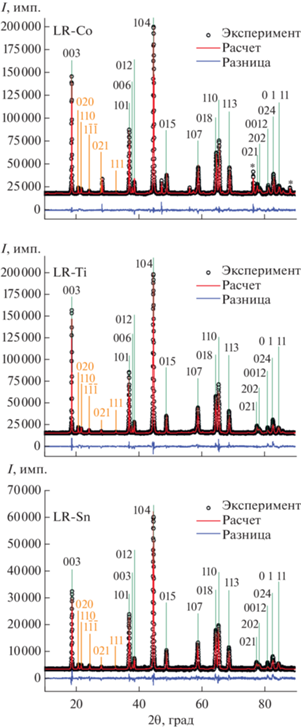
Таблица 1.
Размер ОКР и параметры элементарной ячейки тригональной фазы образцов
| Образец | LR-Co | LR-Ti | LR-Sn |
|---|---|---|---|
| ОКР, нм | 100(8) | 110(30) | 49(2) |
| a, Å | 2.84678(6) | 2.85010(11) | 2.8525(4) |
| c, Å | 14.2180(5) | 14.2272(10) | 14.2332(19) |
| V, Å3 | 99.788(5) | 100.086(10) | 100.29(3) |
Зависимость уширения пиков от дифракционного угла была описана методом Вильямсона–Холла. Для образца LR-Ti уширение пиков близко к приборному; более того, основной вклад в уширение вносят именно микронапряжения в образце, поэтому для этого оксида можно заключить, что размер ОКР больше 100 нм. Наименьший размер ОКР наблюдается для образца LR-Sn. Из табл. 1 видно, что параметры элементарных ячеек LR-Ti и LR-Sn бóльше, чем для недопированного оксида, что соотносится с бóльшими ионными радиусами Ti4+ и Sn4+ по сравнению с Co3+и Mn4+.
Морфология полученных оксидов схожа (рис. 2); размер первичных частиц составляет в среднем 400–800 нм для всех образцов, однако наблюдаются и отдельные частицы порядка 1–1.5 мкм, в большем количестве для образца LR-Co.
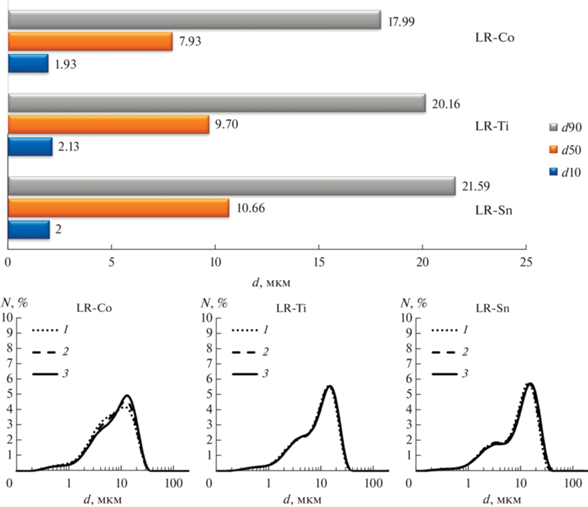
Распределение агломератов по размерам приведено на рис. 3 в виде диаграммы для величин d10, d50, d90 и дифференциальных кривых распределения трех последовательных измерений. Видно, что величины d10, d50 и d90 для образцов близки; все оксиды имеют асимметричное одномодальное распределение агломератов с плечом в сторону более мелкого размера вторичных частиц, наибольшее количество агломератов с меньшим размером наблюдается для недопированного образца LR-Co. Таким образом, введение допантов приводит к небольшому увеличению размера вторичных частиц.
Рис. 3.
Величины d10, d50, d90 и дифференциальные кривые распределения агломератов по размерам (цифрами отмечены номера измерений) для полученных оксидов.
Данные элементного анализа методом ICP-MS показали значения, близкие к заложенным при синтезе. Данные РСМА подтвердили равномерное распределение всех элементов, в том числе олова и титана, по объему частиц (рис. 4).
С помощью энергодисперсионной спектроскопии определены атомные концентрации элементов по выбранным областям (от 6 до 8). Полученные значения во всех областях близки к заложенным при синтезе: Mn/∑M : Ni/∑M : Co/∑M = 0.67 : 0.17 : 0.17 для LR-Co и Mn/∑M : Ni/∑M : Co/∑M : Ti(Sn)/∑M = = 0.67 : 0.17 : 0.15 : 0.02 для LR-Ti/LR-Sn. Отклонения составили не более 3%. Таким образом, все металлы, включая олово и титан, распределены равномерно на микроуровне.
Во время проведения формировочных циклов у допированного титаном образца при первом заряде до 4.5 В и соответствующем разряде наблюдаются наибольшие величины емкости по сравнению с двумя другими оксидами (рис. 5). Прирост емкости на этом цикле соотносится с длинным плато при 4.5 В на зарядных кривых, которое соответствует окислению кислорода в процессе активации фазы Li2MnO3 (рис. 5а–5в). Плато при ~4.5 В наблюдается и на последующих формировочных циклах при повышении напряжения до 4.6 В. Для LR-Co и LR-Sn это плато исчезает раньше, чем для LR-Ti. Для LR-Ti наблюдается интенсивный прирост разрядной емкости вплоть до 270 мАч/г в последнем формировочном цикле, в то время как емкости LR-Co, LR-Sn на этом цикле достигают только 220 мАч/г. Величина необратимой емкости характеризует необратимое окисление кислорода с выделением молекулярного кислорода и лития. Для образцов LR-Co и LR-Sn суммарная величина необратимой емкости за циклы формировки больше, чем для образца, допированного титаном, что может свидетельствовать о частичной обратимости процесса окисления кислорода в последнем образце.
Рис. 5.
Зарядно-разрядные кривые формировочных циклов (цифрами обозначены номера циклов) для образцов LR-Co (а), LR-Ti (б), LR-Sn (в) и зарядно-разрядные кривые циклирования с плотностью тока 20 мА/г с 1-го по 55-й цикл для тех же образцов (г), (д) и (е) соответственно.
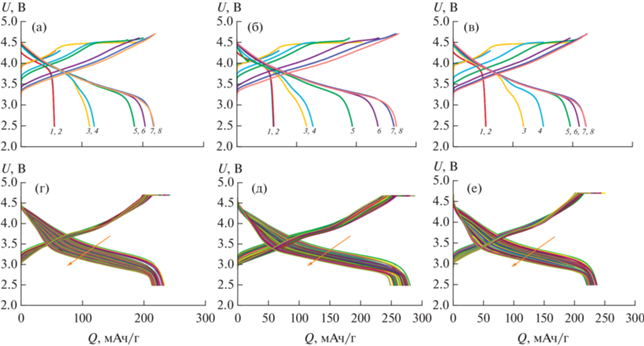
Зарядно-разрядные кривые с 1-го по 55-й цикл дальнейшего циклирования с плотностью тока 20 мА/г показаны на рис. 5г–5e. Емкость всех образцов на первых циклах еще выше, чем на последнем цикле формировки. По абсолютной величине емкости оксид LR-Ti значительно превосходит другие материалы, однако к 55-му циклу падение разрядной емкости для всех оксидов примерно одинаково и составляет порядка 10%.
Во время циклирования значительно падает и напряжение разряда. Зависимости разрядной энергии в Втч/кг оксидов в зависимости от номера цикла приведены на рис. 6. Падение разрядной энергии при токе 20 мА/г (рис. 6а) также близко для всех исследуемых материалов, однако для недопированного образца падение больше.
Рис. 6.
Зависимости разрядной энергии для исследуемых материалов при циклировании с плотностями тока 20 (а) и 80 мА/г (б).
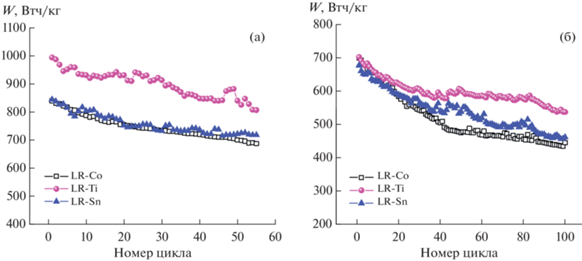
Зависимость разрядной энергии от номера цикла при циклировании с плотностью тока 80 мА/г приведена на рис. 6б. При этом токе начальные значения разрядной энергии оксидов близки друг к другу, однако их циклируемость значительно различается. Так, для недопированного оксида падение энергии к 100-му циклу составило практически 35%, в то время как для оксидов LR-Ti и LR-Sn – 23 и 32% соответственно. Хотя падение энергии к 100-му циклу близко для материалов LR-Co и LR-Sn, разрядная энергия LR-Sn до 80-го цикла превышает значение разрядной энергии LR-Co. Таким образом, введение олова также несколько стабилизирует структуру материла.
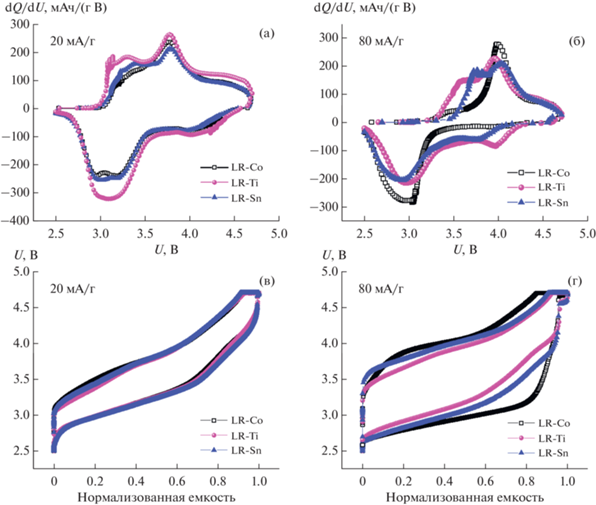
Кривые dQ/dU на 30-м цикле при заряде/разряде с плотностью тока 20 мА/г показаны на рис. 7а, на 70-м цикле при плотности тока 80 мА/г – на рис. 7б, а соответствующие им зарядно-разрядные кривые, отражающие гистерезис напряжения, на рис. 7в, 7г. При токе заряда 80 мА/г (рис. 7б) на катодной ветви dQ/dU кривых сложно разделить окислительно-восстановительные пики. Можно отметить, что образец сравнения LR-Со в отличие от допированных образцов имеет только один анодный пик, характеризующий окисление никеля (кобальта) в материале. При плотности тока 20 мА/г (рис. 7а) кривые dQ/dU схожи для всех образцов, однако пик на анодной кривой в области 3.1–3.3 В, который может быть отнесен к окислению марганца, заметно более выражен в допированном титаном образце. Это может быть связано с тем, что редокс-процесс марганецсодержащей фазы, образующейся в результате структурной перестройки, в образцах LR-Co, LR-Sn в большей степени необратим, по всей видимости, в результате кинетических затруднений при окислении, которые снимаются в образце с титаном. Таким образом, в образце с титаном по сравнению с другими материалами бóльшая часть марганца работает обратимо, что вносит свой вклад в величину удельной емкости. Величины гистерезиса при циклировании током 20 мА/г также схожи для всех оксидов (рис. 7в). При большем токе оба допированных материала показывают значительно меньшее значение гистерезиса напряжения (рис. 7г), что может говорить о том, что при введении как титана, так и олова подавляется неблагоприятная перестройка материала в шпинелеподобную фазу.
ЗАКЛЮЧЕНИЕ
Введение титана в состав обогащенного литием катодного материала значительно увеличивает его разрядные емкость и энергию за счет обратимой работы формирующейся марганецсодержащей фазы. Этот фактор также способствует улучшению стабильности циклирования и уменьшению гистерезиса напряжений для материала с добавкой титана. Материал, допированный оловом, также показал меньший гистерезис напряжений по сравнению с материалом сравнения, вероятно, за счет подавления неблагоприятной структурной перестройки в процессе циклирования.
Список литературы
Ramesha R.N., Bosubabu D., Kartick Babu M.G., Ramesha K. Tuning of Ni, Mn, and Co (NMC) Content in 0.4(LiNixMnyCozO2)·0.4(Li2MnO3) toward Stable High-Capacity Lithium-Rich Cathode Materials // ACS Appl. Energy Mater. 2020. V. 3. P. 10872–10881. https://doi.org/10.1021/acsaem.0c01897
Croy J.R., Gallagher K.G., Balasubramanian M., Long B.R., Thackeray M.M. Quantifying Hysteresis and Voltage Fade in xLi2MnO3·(1 – x)LiMn0.5Ni0.5O2 Electrodes as a Function of Li2MnO3 Content // J. Electrochem. Soc. 2014. V. 161. P. A318–A325. https://doi.org/10.1149/2.049403jes
Makhonina E.V., Maslennikova L.S., Volkov V.V., Medvedeva A.E., Rumyantsev A.M., Koshtyal Yu.M., Maximov M.Yu., Pervov V.S., Eremenko I.L. Li-Rich and Ni-Rich Transition Metal Oxides: Coating and Core-Shell Structures // Appl. Surf. Sci. 2019. V. 474. P. 25–33. https://doi.org/10.1016/j.apsusc.2018.07.159
Ji X., Xia Q., Xu Y., Feng H., Wang P., Tan Q. A Review on Progress of Lithium-Rich Manganese-Based Cathodes for Lithium Ion Batteries // J. Power Sources. 2021. V. 487. P. 29362. https://doi.org/10.1016/j.jpowsour.2020.229362
Ates M.N., Mukerjee S., Abraham K.M. A Search for the Optimum Lithium Rich Layered Metal Oxide Cathode Material for Li-Ion Batteries // J. Electrochem. Soc. 2015. V. 162. P. A1236–A1245. https://doi.org/10.1149/2.0481507jes
Viji M., Budumuru A.K., Hebbar V., Gautam S., Chae K.H., Sudakar C. Influence of Morphology and Compositional Mixing on the Electrochemical Performance of Li-Rich Layered Oxides Derived from Nanoplatelet-Shaped Transition Metal Oxide–Hydroxide Precursors // Energy Fuels. 2021. V. 35. P. 4533–4549. https://doi.org/10.1021/acs.energyfuels.0c04061
Guo L., Tan X., Mao D., Zhao T., Song L., Kang X., Wang H., Sun L., Chu W. Improved Electrochemical Activity of the Li2MnO3-Like Superstructure in High-Nickel Li-Rich Layered Oxide Li1.2Ni0.4Mn0.4O2 and Its Enhanced Performances via Tungsten Doping // Electrochim. Acta. 2021. V. 370. P. 137808. https://doi.org/10.1016/j.electacta.2021.137808
Bian X., Zhang R., Yang X. Effects of Structure and Magnetism on the Electrochemistry of the Layered Li1 +x(Ni0.5Mn0.5)1 –xO2 Cathode Material // Inorg. Chem. 2020. V. 59. P. 17535–17543. https://doi.org/10.1021/acs.inorgchem.0c02766
Shukla A.K., Ramasse Q.M., Ophus C., Duncan H., Hage. F., Chen G. Unravelling Structural Ambiguities in Lithium- and Manganese-Rich Transition Metal Oxides // Nat. Commun. 2015. V. 6. P. 8711. https://doi.org/10.1038/ncomms9711
Genevois C., Koga H., Croguennec L., Mentrier M., Delmas C., Weill F. Insight into the Atomic Structure of Cycled Lithium-Rich Layered Oxide Li1.20Mn0.54Co0.13Ni0.13O2 Using HAADF STEM and Electron Nanodiffraction // J. Phys. Chem. C. 2015. V. 119. P. 75–83. https://doi.org/10.1021/jp509388j
Li J., Shunmugasundaram R., Doig R., Dahn J.R. In Situ X-ray Diffraction Study of Layered Li–Ni–Mn–Co Oxides: Effect of Particle Size and Structural Stability of Core–Shell Materials // Chem. Mater. 2016. V. 28. P. 162–171. https://doi.org/10.1021/acs.chemmater.5b03500
Zheng J., Gu M., Genc A., Xiao J., Xu P., Chen X., Zhu Z., Zhao W., Pullan L., Wang C., Zhang J.-G. Mitigating Voltage Fade in Cathode Materials by Improving the Atomic Level Uniformity of Elemental Distribution // Nano Lett. 2014. V. 14. P. 2628–2635. https://doi.org/10.1021/nl500486y
Fu F., Yao Y., Wang H., Amine K., Sun. S.-G., Shao M. Structure Dependent Electrochemical Performance of Li-Rich Layered Oxides in Lithium-Ion Batteries // Nano Energy. 2017. V. 35. P. 370–378. https://doi.org/10.1016/j.nanoen.2017.04.005
Печень Л.С., Махонина Е.В., Румянцев А.М., Коштял Ю.М., Первов В.С., Еременко И.Л. Влияние метода синтеза на функциональные свойства обогащенных по литию сложных оксидов состава Li1.2Mn0.54Ni0.13Co0.13O2 // ЖНХ. 2018. Т. 63. № 12. С. 1522–1529. https://doi.org/10.1134/S0044457X18120176
Chernyavsky V., Kim A., Koshtyal Yu., Rumyantsev A., Popovich A., Maximov M.Yu. Structural Features of Complete and Partial Activation of Li-Rich Cathodes Studied by in-situ XRD // Electrochim. Acta. 2022. V. 414. P. 140237. https://doi.org/10.1016/j.electacta.2022.140237
Nachimuthu S., Huang H.-W., Lin K.-Y., Yu C., Jiang J.-C. Direct Visualization of Lattice Oxygen Evolution and Related Electronic Properties of Li1.2Ni0.2Mn0.6O2 Cathode Materials // Appl. Surf. Sci. 2021. V. 563. P. 150334. https://doi.org/10.1016/j.apsusc.2021.150334
Seo D.-H., Lee J., Urban A., Malik R., Kang S., Ceder G. The Structural and Chemical Origin of the Oxygen Redox Activity in Layered and Cation-Disordered Li-Excess Cathode Materials // Nat. Chem. 2016. V. 8. P. 692–697. https://doi.org/10.1038/nchem.2524
Rana J., Papp J.K., Lebens-Higgins Z., Zuba M., Kaufman L.A., Goel A., Shmuch R., Winter M., Whittingham M.S., Yang W., McCloskey B.D., Piper L.F.J. Quantifying the Capacity Contributions during Activation of Li2MnO3 // ACS Energy Lett. 2020. V. 5. P. 634–641. https://doi.org/10.1021/acsenergylett.9b02799
Akhilash M., Salini P.S., John B., Mercy T.D. A Journey through Layered Cathode Materials for Lithium Ion Cells – from Lithium Cobalt Oxide to Lithium-Rich Transition Metal Oxides // J. Alloys Compd. 2021. V. 869. P. 159239. https://doi.org/10.1016/j.jallcom.2021.159239
Ye D., Zeng G., Nogita K., Ozawa K., Hankel M., Searles D., Wang L. Understanding the Origin of Li2MnO3 Activation in Li-Rich Cathode Materials for Lithium-Ion Batteries // Adv. Func. Mater. 2015. V. 25. P. 7488–7496. https://doi.org/10.1002/adfm.201503276
Wang T., Zhang C., Li S., Shen X., Zhou L., Huang Q., Liang C., Wang Z., Wang X., Wei W. Regulating Anion Redox and Cation Migration to Enhance the Structural Stability of Li-Rich Layered Oxides // ACS Appl. Mater. Interface. 2021. V. 13. P. 12159–12168. https://doi.org/10.1021/acsami.1c01351
Liang X., Wu H., Chen H., Mercy T.D. Improving Electrochemical Performance of Li1.2Ni0.13Co0.13Mn0.54O2 Cathode Material by Al3+ Doping // Int. J. Electrochem. Sci. 2016. V. 11. P. 9164–9174. https://doi.org/10.20964/2016.11.30
Kou Y., Han E., Zhu L., Liu L., Zhang Z. The Effect of Ti Doping on Electrochemical Properties of Li1.167Ni0.4Mn0.383Co0.05O2 for Lithium-Ion Batteries // Solid State Ionics. 2016. V. 296. P. 154–157. https://doi.org/10.1016/j.ssi.2016.09.020
Печень Л.С., Махонина Е.В., Медведева А.Е., Румянцев А.М., Коштял Ю.М., Политов Ю.А., Головешкин А.С., Еременко И.Л. Влияние допантов на функциональные свойства катодных материалов с высоким содержанием лития для литий-ионных аккумуляторов // ЖНХ. 2021. Т. 66 № 5. С. 682–694. https://doi.org/10.31857/S0044457X21050147
Makhonina E., Pechen L., Medvedeva A., Politov Yu., Rumyantsev A., Koshtyal Yu., Volkov V., Goloveshkin A., Eremenko I. Effects of Mg Doping at Different Positions in Li-Rich Mn-Based Cathode Material on Electrochemical Performance // Nanomaterials. 2022. V. 12. P. 156. https://doi.org/10.3390/nano12010156
Liu Y., Zhang Z., Gao Y., Yang G., Li C., Zheng J., Dou A., Wang Q., Su M. Mitigating the Voltage Decay and Improving Electrochemical Properties of Layered-Spinel Li1.1Ni0.25Mn0.75O2.3 Cathode Material by Cr Doping // J. Alloys Compd. 2016. V. 657. P. 37–43. https://doi.org/10.1016/j.jallcom.2015.10.060
Dong S., Zhou Y., Hai C., Zeng J., Sun Y., Shen Y., Li X., Ren X., Sun G., Zhang G., Wu Z. Understanding Electrochemical Performance Improvement with Nb Doping in Lithium-Rich Manganese-Based Cathode Materials // J. Power Sources. 2020. V. 462. P. 228185. https://doi.org/10.1016/j.jpowsour.2020.228185
Huang Z., Li X., Liang Y., He Z., Chen H., Wang Z., Guo H. Structural and Electrochemical Characterization of Mg-doped Li1.2[Mn0.54Ni0.13Co0.13]O2 Cathode Material for Lithium Ion Batteries // Solid State Ionics. 2015. V. 282. P. 88–94. https://doi.org/10.1016/j.ssi.2015.10.005
Jin Y., Xu Y., Ren F., Ren P. Mg-Doped Li1.133Ni0.2Co0.2Mn0.467O2 in Li Site as High-Performance Cathode Material for Li-ion Batteries // Solid State Ionics. 2019. V. 336. P. 87–94. https://doi.org/10.1016/j.ssi.2019.03.020
Huang Z., Wang Z., Jing Q., Guo H., Li X., Yang Z. Investigation on the Effect of Na Doping on Structure and Li-ion Kinetics of Layered LiNi0.6Co0.2Mn0.2O2 Cathode Material // Electrochim. Acta. 2016. V. 192. P. 120–126. https://doi.org/10.1016/j.electacta.2016.01.139
Zhang P., Zhai X., Huang H., Zhou J., Li X., He X., Guo Z. Synergistic Na+ and F– co-oping Modification Strategy to Improve the Electrochemical Performance of Li-Rich Li1.20Mn0.54Ni0.13Co0.13O2 Cathode // Ceram. Int. 2020. V. 46. P. 24723–24736. https://doi.org/10.1016/j.ceramint.2020.06.263
Taylor Z.N., Perez A.J., Coca-Clemente J.A., Braga F., Drewett N.E., Pitcher M.J., Thomas W.J., Dyer M.S., Collins C., Zanella M., Johnson T., Tay S., Tang C., Dhanak V.R., Claridge J.B., Hardwick L.J., Rosseinsky M.J. Stabilization of O–O Bonds by d0 Cations in Li4 +xNi1 –xWO6 (0 ≤ x ≤ 0.25) Rock Salt Oxides as the Origin of Large Voltage Hysteresis // J. Am. Chem. Soc. 2019. V. 141. P. 7333–7346. https://doi.org/10.1021/jacs.8b13633
Okubo M., Yamada A. Molecular Orbital Principles of Oxygen-Redox Battery Electrodes // ACS Appl. Mater. Interface. 2017. V. 9. P. 36463–36472. https://doi.org/10.1021/acsami.7b09835
Liang C., Kong F., Longo R.C., Zhang C., Nie Y., Zheng Y., Cho K. Site-dependent Multicomponent Doping Strategy for Ni-Rich LiNi1 – 2yCoyMnyO2 (y = 1/12) Cathode Materials for Li-Ion Batteries // J. Mater. Chem. A. 2017. V. 5. P. 25303–25313.
Paulus A., Hendrickx M., Bercx M., Karakulina O.M., Kirsanova M.A., Lamoen D., Haderman J., Abakumov A.M., Van Bael M.K., Hardy A. An in-depth Study of Sn Substitution in Li-Rich/Mn-Rich NMC as a Cathode Material for Li-Ion Batteries // Dalton Trans. 2020. V. 49. P. 10486–10497. https://doi.org/10.1039/D0DT01047B
Pechen L.S., Makhonina E.V., Rumyantsev A.M., Koshtyal Yu.M., Goloveshkin A.S., Volkov V.V., Politov Yu.A., Eremenko I.L. Synthesis and Electrochemical Performance of Li-Rich xLi2MnO3·(1 – x)LiMn1/3Ni1/3Co1/3O2 (x = 0.2–0.5) Cathode Materials for Lithium-Ion Batteries // IOP Conf. Ser.: Mater. Sci. Eng. 2019. V. 525. P. 012042. https://doi.org/10.1088/1757-899X/525/1/01204
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы