Неорганические материалы, 2022, T. 58, № 11, стр. 1261-1267
Супрамолекулярные соединения лантана и неодима с фталевой кислотой
Б. Т. Усубалиев 1, М. К. Муншиева 2, С. Р. Мамедова 2, *, Ф. Б. Алиева 2, Э. М. Мовсумов 3
1 Азербайджанский государственный университет нефти и промышленности, Научно-исследовательский институт “Геотехнологические проблемы нефти, газа и химии”,
AZ 1001 Баку, пр. Азадлыг, 20, Азербайджан
2 Институт катализа и неорганической химии им. Академика М. Нагиева Национальной академии наук Азербайджана
AZ 1143 Баку, пр. Г. Джавида, 113, Азербайджан
3 Азербайджанский государственный аграрный университет
AZ 2000 Гянджа,
пр. Ататюрка, 262, Азербайджан
* E-mail: iradam@rambler.ru
Поступила в редакцию 14.02.2022
После доработки 20.08.2022
Принята к публикации 22.08.2022
- EDN: DMVIGD
- DOI: 10.31857/S0002337X22100153
Аннотация
Комплексом физико-химических исследований установлены состав и химическая формула впервые синтезированных соединений лантана и неодима с фталевой кислотой. Показано, что они имеют схожие химические формулы – La2(L)3·7H2O и Nd2(L)3·6H2O. Рассмотрен ход термической деструкции синтезированных соединений. Предложенная схематическая структура комплекса La состоит из зигзагообразных полимерных 2D-слоев, которые, сшиваясь с молекулами воды, превращаются в 3D-структуру – супрамолекулу.
ВВЕДЕНИЕ
В научной литературе имеется достаточное количество публикаций, посвященных люминесцирующим комплексным соединениям лантаноидов с органическими лигандами и их практическому применению в различных отраслях науки и промышленности: в качестве защитных покрытий [1], люминесцентных зондов [2], сигнальной части в хемосенсорах [3]. Одним из важнейших практических направлений является использование комплексов лантаноидов в качестве светоизлучающего слоя в органических светоизлучающих диодах, лазерах [4].
Лантаноидные ионы имеют уникальный характерный спектр испускания, положение пиков в котором при смене лигандов практически постоянно, изменяются только интенсивность и характер (расщепление) спектров. Поэтому задача поиска новых люминесцирующих комплексных соединений сводится к подбору (высокой вероятности образования триплетного уровня, его оптимального расположения по отношению к излучающему уровню лантаноида, хорошей координирующей способности) для каждого иона лантаноида.
При получении люминесцирующих координационных соединений лантаноидов с органическими лигандами учитывают их фото- и термическую стабильность [5–11]. В этом отношении заметное преимущество имеют координационные соединения лантаноидов с ароматическими карбоновыми кислотами, обладающие не только хорошими поглощающими свойствами, но также фото- и термической стабильностью. Преимуществом этих комплексных соединений является наличие в молекуле лиганда хромофора, эффективно поглощающего энергию возбуждения, что позволяет увеличить квантовый выход люминесценции соединения [12–26]. Поэтому синтез и исследование люминесцирующих карбоксилатов редкоземельных элементов является весьма актуальной задачей.
Цель данной работы – синтез, физико- и структурно-химический анализы комплексных соединений лантана и неодима с фталевой кислотой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При исследовании были применены методы элементного, рентгенофазового анализов, ИК-спектроскопии и термогравиметрии.
Рентгенофазовый анализ проводили на приборе CommanderSample ID (CoupledTwoTheta) c медным катодом.
ИК-спектры поглощения снимали на приборе Nicole 1810 фирмы ThermoScientific в области 400–4000 см–1. Образцы готовили в виде суспензий в вазелиновом масле при комнатной температуре.
Термический анализ проводили на дериватографе STA-449, F-3 (ФРГ) в азотной среде.
Элементный анализ на С, Н выполнен на анализаторе СHNSO$\left\langle {\left\langle E \right\rangle } \right\rangle $ фирмы ERBA. Содержание металлов рассчитывали из кривой потери массы по количеству оксидов, полученных после нагревания на дериватографе до 900°С.
Синтез комплексных соединений. Для синтеза комплексных соединений использовали лантан азотнокислый, неодим сернокислый 8-водный, соду NaHCO3 (“х. ч.”) и фталевую кислоту (“х. ч.”).
Взвешивали две навески фталевой кислоты по 0.498 г (0.003 моль) и каждую растворяли в 50 мл дистиллированной воды с прибавлением к каждой 0.5040 г (0.006 моль) NaHCO3. К полученным горячим растворам постепенно прибавляли 1.9586 г (0.002 моль) и 1.443 г (0.002 моль) водорастворимых солей La(NO)3·H2O (“х. ч.” 99.9%) и Nd2(SO4)3·H2O (“х. ч.” 99.9%) соответственно.
Отфильтрованные осадки сначала промывали несколько раз дистиллированной теплой водой, а потом бензолом и высушивали вначале на воздухе, а затем в сушильном шкафу при 50°С. Получены порошки белого и светло-фиолетового цвета соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
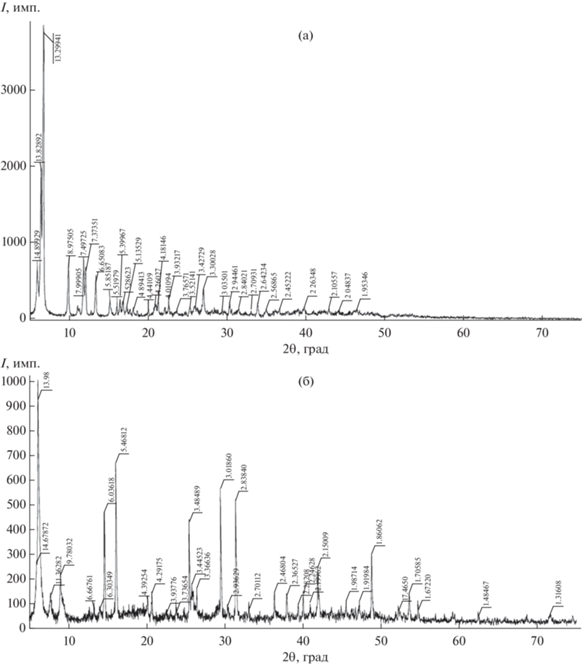
Рентгенограммы синтезированных соединений представлены на рис. 1. Анализ рентгенограмм показал, что полученные соединения состоят из одной фазы и высококристалличны. Максимумы присутствуют на всей дифрактограмме, т.е. соединения имеют высокую симметрию: 13.82°, 13.29°, 7.51° для La-фталата и 13.98°, 10.94°, 6.02° для Nd-фталата. Как видно из дифрактограмм, они не идентичны, хотя можно было ожидать идентичности исходя из соображений, что эти редкоземельные элементы (Lа,Nd) находятся в первой изоструктурной группе, т.е. в первой пятерке в ряду лантаноидов.
Элементный состав синтезированных образцов комплексных соединений представлен в табл. 1.
Таблица 1.
Результаты элементного анализа образцов
| Соединение | Молекулярная масса | Брутто-формула | Содержание, % (найдено/вычислено) | ||
|---|---|---|---|---|---|
| La, Nd | C | H | |||
| La2(o-C6H4(COO)2)3(H2O)7 | 895.82 | La2C24H26O19 | 30.12/31.00 | 31.49/32.16 | 2.98/2.92 |
| Nd2(o-C6H4(COO)2)3(H2O)6 | 888.48 | Nd2C24H24O18 | 32.45/32.81 | 32.43/32.78 | 2.72/2.61 |
По результатам химического элементного анализа можно сделать вывод, что составы полученных соединений отвечают химическим формулам гептаакватрифталата дилантана (III) и гексаакватрифталата динеодима (III) и они не изоструктурны (рис. 1а и 1б).
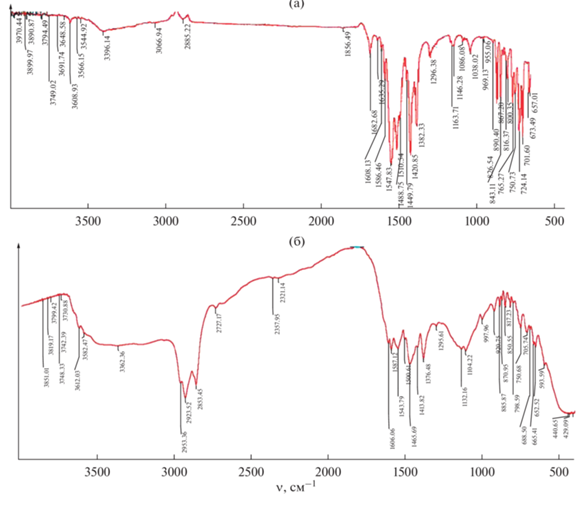
ИК-спектроскопическое исследование комплексных соединений показало, что в ИК-спектрах (рис. 2) в областях 1586, 1465, 1548, 1421 и 1510, 1382 см–1; 1587, 1465, 1544, 1414 и 1501, 1376 см–1 соответственно появляются четкие полосы, которые относятся к асимметричным (νas) и симметричным (νs) полосам поглощения карбоксильных групп фталевых дианионов. Разница между νas и νs, которая соответственно составляет 121, 127 и 128 см–1; 122, 130 и 125 см–1, показывает, что карбоксилатные анионы фталевых кислот имеют хелатную функцию [13, 14].
Кроме того, в ИК-спектрах имеются широкие полосы в области 3600–3200 см–1 (максимум 3362 cм–1), относящиеся к молекулам кристаллизационной воды. В ИК-спектрах также обнаружены полосы при 1608 и 1606 см–1 соответственно, отвечающие деформационным колебаниям молекул воды (НОН), что еще раз подтверждает наличие кристаллизационной воды в составе комплексных соединений.
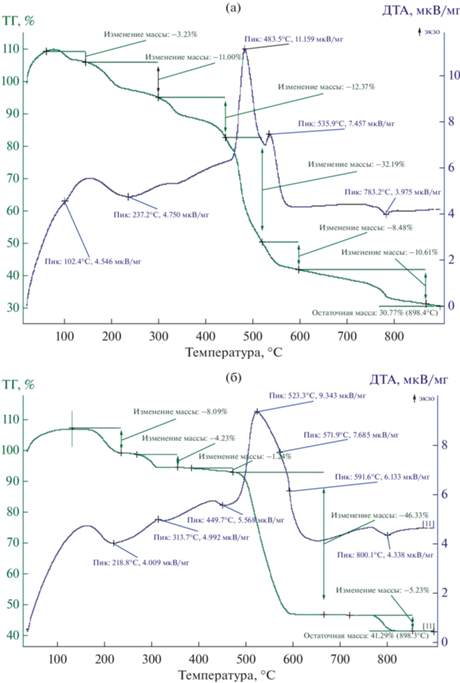
Для определения количества, температуры удаления кристаллизационной воды и в целом характера термической деструкции комплексных соединений проведен термогравиметрический анализ в температурной области 20–900°С (скорость нагревания 10°С/мин, эталон Al2O3, атмосфера N2).
Из кривых термического анализа (рис. 3) комплексных соединений видно, что разложение фталата лантана происходит с эндотермическим эффектом с максимумом при температуре 102.4°C и соответствует удалению 1.5 молекул воды. При этом экспериментальная потеря массы составляет 3.23% (вычислено 3.08%). Второй эндотермический эффект появляется при температуре 237.2°C и также соответствует удалению 5.5 молекул воды. При этом экспериментальная потеря массы составляет 11.0% (вычислено 10.05%).
Начиная приблизительно с 300°C происходит разложение безводного комплексного соединения, что сопровождается сначала эндотермическим эффектом с максимумом при температуре 343.4°C с переходом на экзотермический эффект с максимумами при 483.5 и 535.9°С. Это говорит о том, что при разложении безводного комплекса образуются промежуточные соединения и происходит их выгорание. На ДТА-кривой при слишком высокой температуре появляется четкий, но неглубокий эндотермический эффект с максимумом при 783.2°С. Этот эффект соответствует разложению оксалата лантана, который получается при поэтапном разложении и выгорании безводного комплексного соединения фталата лантана. Конечным продуктом термолиза является La2O3, экспериментальный эффект составляет 32.12% (вычислено 36.35%). Следует подчеркнуть, что при получении оксида лантана используются только атомы кислорода карбоксильных анионов, потому что на кривой ТГ не наблюдается повышения массы.
Схема термической деструкции комплексного соединения фталата лантана представлена ниже:
Второй комплекс – Nd-фталат – устойчив до температуры 148°С. Важно отметить, что комплексное соединение с семью молекулами воды устойчиво до температуры 80°С.
После 148°C начинается разложение комплексного соединения, которое сопровождается неглубоким, но четким эндотермическим эффектом с максимумом при 177.3°С. Этот эффект соответствует удалению двух молекул воды. При этом экспериментальная потеря массы составляет 4.52% (вычислено 4.01%). Сразу после этого на кривой ДТА появляется широкий неглубокий эндотермический эффект с максимумом при 252.5°С. При этом экспериментальная потеря массы составляет 8.00% (вычислено 8.2%), что соответствует удалению четырех молекул воды. После удаления кристаллизационной воды начинается разложение безводного комплексного соединения. Интенсивное выгорание органической части молекулы происходит в узком температурном интервале 510–600°C с ярко выраженным экзотермическим эффектом с максимумом 548.7°С. При экзотермическом процессе экспериментальная потеря массы составляет 48.0% (вычислено 49%), что соответствует полному выгоранию органической части молекулы без трех атомов кислорода. Конечным продуктом термолиза комплексного соединения является Nd2O3.
Схема термической деструкции комплексного соединения фталата неодима представлена ниже:
Таким образом, результаты проведенных исследований показывают, что, несмотря на близость химических формул комплексных соединений, они имеют разные структуры и их термическая деструкция происходит по различным схемам.
Сравнение ТГ-кривых комплексных соединений показывает, что во фталатном комплексе лантана 1.5 молекулы воды покидают кристаллическую решетку при низкой температуре 80°C (эндотермический эффект при 102.4°С), и это означает, что вода не входит в координацию центрального атома лантана и располагается в кристаллографических порах. Исходя из этого можно предположить, что в координацию каждого атома лантана входят 3 атома кислорода трех молекул воды и шесть атомов кислорода трех карбоксильных групп по хелатному типу. Таким образом, координационное число каждого атома лантана дополняется до 9, что свойственно лантану.
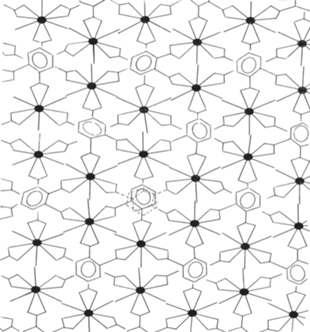
Исходя из вышеизложенного нами дана предполагаемая схематическая структура для комплексного соединения La2(o-C6H4(COO)2)3⋅7H2O (рис. 4). Видно, что комплексное соединение состоит из зигзагообразных полимерных 2D-слоев. Молекулы воды, которые размещаются в кристаллографических порах, образуя как внутримолекулярные, так и межмолекулярные сети водородных связей, сшивают полимерные слои друг с другом, и таким образом образуется 3D-структура – супрамолекула [15, 16].
В случае комплекса неодима все молекулы воды также покидают кристаллическую решетку в 2 этапа, но при высоких температурах, т.е. конец первого эндотермического эффекта есть начало второго. Поэтому можно предположить, что все молекулы воды входят в координацию центральных атомов неодима.
Таким образом, предполагается, что в координацию каждого центрального атома неодима входят 3 атома кислорода трех молекул воды и 6 атомов кислорода трех карбоксильных групп по хелатному типу, в результате чего образуются двумерные зигзагообразные полимерные слои, которые между собой соединены водородными связями, и 2D-структура превращается в 3D-структуру. Поэтому для комплекса Nd2 (o-C6H4(COO)2)3⋅6H2O предполагается схематическая структура, схожая со структурой фталата лантана.
Структурное различие этих двух соединений состоит в том, что в лантанном комплексе полимерные слои между собой связываются водородными связями через молекулы воды, находящиеся в межслоевом пространстве. А в случае комплекса неодима межслоевые сшивки происходят за счет водородных связей между координационными молекулами воды, находящимися в различных слоях. Высокая термическая устойчивость фталата неодима по сравнению с фталатом лантана, вероятно, связана с этим.
Координация каждого центрального атома неодима дополняется до девяти, что также свойственно редкоземельным элементам.
ЗАКЛЮЧЕНИЕ
Комплексом физико-химических исследований установлены состав и химические формулы впервые синтезированных соединений: La2[о-C6H4(COO)2]·(H2O)7 и Nd2[о-C6H4(COO)2]·(H2O)6.
Предполагается, что в комплексе La2[о-C6H4(COO)2]·7H2O полимерные слои, сшиваясь молекулами воды, находящимися в межслоевом пространстве, превращают 2D-структуру в 3D-структуру – супрамолекулу;
в комплексе Nd2[о-C6H4(COO)2]3·6H2O полимерные слои сшиваются водородными связами между координационными молекулами воды в различных слоях, и таким образом 2D-структура комплекса превращается в 3D-супрамолекулу.
Список литературы
Костромина Н.А., Сало Н.И. Проблемы химии и применения ß-дикетонатов. М.: Наука, 1982. С. 31–38.
Золин В.Ф., Коренева Л.Д. Редкоземельный зонд в химии и биологии. М.: Наука, 1980. С. 350.
Лен Ж.-М. Супрамолекулярная химия: Концепции и перспективы. Новосибирск: Наука, 1998. С. 334.
Kido S. Kido J., Okamoto Y. Organolantanide Complexes for Electroluminesent Materials // Chem. Rev. 2002. V. 102. P. 2357. https://doi.org/10.1021/cr010448y
Bin Hu. Photoacoustic and Luminescence Spectra Study on the Effects of Chlorine Substituent on the Energy Transfer of Eu(III)-Chlorobenzoic Acid // Spectrocim. Acta, Part A. 2007. V. 66. P. 273–276.
Pei J., Xiaotian G., Jianbo Y. et al. Synthesis and Fluorescence Studies on Novel Complexes of Tb(III) and Eu(III) with 4-(9H-Carbazol-9-yl) Benzoic Acid // J. Alloys Compd. 2006. V. 426. № 1–2. P. 363–367. https://doi.org/10.1016/j.jallcom.2006.02.030
Seward C., Hu N.-X., Wang S. 1-D Chain and 3-D Grid Green Luminescent Terbium (III) Coordination Polymers: {Tb(O2CPh)3(CH3OH)2(H2O)}n and {Tb(O2CPh)6 (4,4'-bipy}n // J. Chem. Soc., Dalton Trans. 2001. № 2. P. 134–137. https://doi.org/10.1039/B007866M
Eliseeva S.V., Kotova O., Mirzov O. et al. Electroluminescent Properties of the Mixed Liqand Complex of Terbium Salicylate with Triphenylphosphine Oxide // Synth. Met. 2004. V. 141. P. 225–230. https://doi.org/10.1016/S0379-6779(03)00405-3
Panadero S., Gomez D., Perz-Bendito A. Use of Time–Resolved Lant-hanide-Synthezithed Luminescence for the Kinetic Determination of p-Aminobenzoic Acid // Talanta. 1998. V.45. № 5. P. 777–786.
Lin Q., Shi C.Y., Liang Y.J. et al. Green Electroluminescence Generated from the thin Film Based on a Soluble Lanthanide Complex // Synth. Met. 2000. V. 114. P. 373–375. https://doi.org/10.1016/S0379-6779(00)00248-4
Cao G., Wang Z., Rong C. The Structure of Catena – (bis-Naphtaline 1,8-Dicarboxylato, di Dysproziy (III) // Inorg. Chem. Compd. 2013. № 30. P. 163–166.
Михнев В.И. Рентгенометрический определитель минералов. М.: Госгеотехиздат, 1957. 853 с.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 504 с.
Меджидов А.А., Тагиев Д.Б. Физические методы в химии. Баку: Элм, 2021. 196 с.
Стид Дж.В., Этвуд Дж.Л. Супрамолекулярная химия. М.: ИКЦ Академкнига, 2007. Т. 2. С. 558.
Усубалиев Б.Т., Абдурахманова П.С., Муншиева М.К., Ганбаров Д.М. Синтез и кристаллическая структура клатратного соединения Zn(C6H5COO)2⋅ ⋅2H2O⋅2CH3COOH // Координационная химия. 2010. Т. 36. № 11. С. 878–880.
Хиялов М.С., Амирасланов И.Р., Мамедов Х.С., Мовсумов Э.М. Кристаллическая и молекулярная структура n-аминобензоата неодима(III) // Журн. структур. химии. 1981. Т. 22. № 3. С. 113–119.
Хиялов М.С., Амирасланов И.Р., Мамедов Х.С., Мовсумов Э.М. Кристаллическая и молекулярная структура n-аминобензоата диспрозия (III) // Координац. химия. 1981. Т. 7. № 3. С. 445–449.
Ефремова Г.И., Бучкова Р.Т., Лапичкая А.В., Апркес С.Б. Термографическое и ИК-спектроскопическое исследование n-аминобензоатов РЗЭ // Координац. химия. 1977. Т. 22. № 4. С. 948–953.
Гостинцев В.В., Вальцев В.К., Балашевский Г.Ф. Синтез и исследование основных бензоатов редкоземельных элементов // Журн. неорган. химии. 1976. Т. 21. № 8. С. 2030–2034.
Беллами Л. Новые данные по ИК-спектрам сложных молекул. М.: Мир, 1971. 505 с.
Ройтерштейн Д.М., Пунтус Л.Н., Вараксина Е.А., Тайдаков И.В., Лысенко К.А. Координационные полимеры редкоземельных элементов на основе дициамидноголиганда // Координац. химия. 2020. Т. 46. № 1. С. 17–25.
Калиновская И.В. Люминесцентные свойства п-метилбензоатов неодима (III) // Журн. физ. химии. 2022. Т. 96. № 6. С. 866–870.
Царюк В.И., Журавлев К.П. Роль состояний переноса заряда “лиганд-металл” в процессах возбуждения люминесценции индолкарбок-силатов европия // Оптика и спектроскопия. 2022. Т. 130. № 1. С. 121–129.
Петроченкова Н.В., Емелина Т.Б., Мирочник А.Г. Механизм люминесцентного хемосенсорного отклика в хелатах европия (III) // Оптика и спектроскопия. 2022. Т. 130. № 3. С. 428–432.
de Bettencourt-Dias A. Luminescence of Lanthanide Ions in Coordination Compounds and Nanomaterials. Hoboken: Wiley, 2014. Ch. 1. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы