Неорганические материалы, 2022, T. 58, № 11, стр. 1163-1169
Гидрирование магния в присутствии интерметаллического соединения Mg2Ni
В. Н. Фокин 1, *, П. В. Фурсиков 1, Э. Э. Фокина 1, Б. П. Тарасов 1
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. Академика Семенова, 1, Россия
* E-mail: fvn@icp.ac.ru
Поступила в редакцию 20.04.2022
После доработки 05.06.2022
Принята к публикации 06.06.2022
- EDN: BBVOPF
- DOI: 10.31857/S0002337X22110033
Аннотация
Как один из вероятных путей оптимизации условий гидрирования магния – перспективного материала для систем хранения водорода – исследована возможность взаимодействия с высокочистым водородом под давлением 30–35 атм механической смеси 200-микронных порошков магния с 10–50 мас. % интерметаллического соединения Mg2Ni при различных температурах (300–390°C) без предварительной активации смеси высокоэнергетической обработкой. Установлено, что при добавке к магнию 20 мас. % Mg2Ni его гидрирование осуществляется при температуре 370–380°C на 95–96%. Экспериментально показано, что такая смесь при использовании в качестве рабочего вещества в высокотемпературных металлогидридных аккумуляторах водорода многократного действия выделяет при температурах 220–450°C более 6.5 мас. % водорода высокой чистоты для использования в мелкомасштабных и лабораторных работах.
ВВЕДЕНИЕ
Гидрид магния MgH2 вследствие высокого содержания водорода (7.6 мас. %, 120 кг/м3) является перспективным материалом для использования в системах хранения водорода [1–3]. Однако необходимость использования высоких температур для гидрирования магния и разложения его гидрида создает серьезные проблемы для практического применения MgH2 в аккумуляторах водорода. Решение этой и других имеющихся проблем актуально и в настоящее время, что подтверждается многочисленными публикациями отечественных и зарубежных ученых и технологов [3–10]. Как правило, большинство работ связано с легированием, катализом, модификацией поверхности, исследованием наноразмерности зерен или частиц магния.
Одним из способов достижения более мягких условий гидрирования магния и устранения других недостатков практического использования его гидрида является осуществление реакции с водородом в присутствии металлических катализаторов – интерметаллических соединений (LaNi5 [11], TiFe [12, 13], TiAl [12, 13], Ti2Ni [12], ZrNi5 [14], TiMn2 [12, 15], Al3Ti [16], Mg2Ni [17–20] и др.).
В работе [12] систематически исследовано влияние добавок интерметаллидов на основе титана (TiAl, Ti3Al, TiNi, TiFe, TiNb, TiMn2, TiVMn) на водородпоглощающие и десорбирующие свойства Mg/MgH2 при использовании термогравиметрического анализа. Отмечено положительное влияние титансодержащих интерметаллидов на кинетику реакций гидрирования/дегидрирования.
Подобные результаты [15] получены при исследовании бинарного нанокомпозита состава MgH2 + 10 мас. % TiMn2, приготовленного высокоэнергетическим помолом в шаровой мельнице при давлении водорода 70 атм за 50 ч. Такой композит в виде таблеток, приготовленных методом холодного прессования, обладал высокой скоростью реакций гидрирования/дегидрирования и успешно использовался в протонообменном топливном элементе для получения постоянного потока водорода.
Композиты составов MgH2 + LaNi5 (5, 15 и 35 мас. %), приготовленные длительным механическим помолом в шаровой мельнице смеси исходных компонентов, показали увеличение скорости реакции гидрирования с повышением количества интерметаллида, но водородоемкость системы при этом уменьшалась [11]. Десорбция водорода проходила с приемлемой скоростью при 245°C: за 1 ч выделялось около 90% водорода (5.3 и 4.1 мас. %) композитами, содержащими 15 и 35 мас. % интерметаллида соответственно.
Приготовленные также при использовании шаровой мельницы композиты состава MgH2 + + 10 мас. % ZrNi5 десорбировали при 275°C 5.3 мас. % водорода за 10 мин (на абсорбцию требовалась 1 мин) [14]. Кроме того, композит показал высокую стабильность при циклировании: при 275°C за 600 полных циклов (568 ч) состав композита не менялся, кинетика реакций гидрирования/дегидрирования сохранялась, водородоемкость падала незначительно (до 4.97 мас. %) по сравнению с исходным композитом (5.3 мас. %). Энергия активации системы составляла 110.1 кДж/моль [14].
Интересный синэнергетический эффект обнаружен при исследовании состава MgH2 + 10 мас. % (Mg(AlH4)2 + 0.5TiF4), подвергнутого высокоэнергетическому измельчению под давлением водорода 60 атм в течение 12 ч [16]. Во время измельчения происходит химическая реакция между Mg(AlH4)2 и TiF4 с образованием интерметаллида Al3Ti, соли MgF2 и Al, которые совместно вызывают снижение температуры дегидрирования MgH2 более чем на 100°С. При 275°С “легированный” MgH2 быстро выделяет 6.3 мас. % H2 в течение 10 мин в изотермическом эксперименте.
Значительное количество работ по улучшению условий гидрирования магния в присутствии интерметаллидов посвящено использованию широко исследованного интерметаллического соединения Mg2Ni [17–20], обладающего высокой водородоемкостью его гидрида состава Mg2NiH4, достигающей 3.6 мас. % [21]. Этот интерметаллид, образующийся по перитектической реакции при 760°C, кристаллизуется в гексагональной структуре с периодами кристаллической решетки a = 0.519–0.521 нм, c = 1.321–1.325 нм [22]. Mg2Ni, механически измельченный до частиц с размером ~200 мкм и дегазированный в течение 1 ч при 250°C, обратимо взаимодействует с водородом под давлением 10–50 атм при температурах 150–200°C без диспропорционирования с образованием гидрида состава Mg2NiH4 [23]. По данным рентгенографического анализа последний кристаллизуется (при низкой температуре) в моноклинной сингонии с параметрами решетки a = 1.32 нм, b = 0.64 нм, c = 0.65 нм, β = 93.25°. Высокотемпературная модификация фазы Mg2NiH4 кристаллизуется в кубической сингонии с параметром решетки a = 0.65 нм, причем в литературе (например, [24]) сообщается, что получение истинной низкотемпературной кристаллической фазы Mg2NiH4 с моноклинной структурой сопряжено с большими экспериментальными затруднениями, вызванными в т.ч. и тем, что фазовый переход высокотемпературного тетрагидрида с кубической структурой в моноклинную фазу происходит в диапазоне температур 210–245°C [25] довольно медленно.
Гидрид Mg2NiH4 разлагается в инертной атмосфере при 255°C с выделением водорода и сохранением металлической матрицы. В работе [26] отмечено снижение температуры разложения (на 50–60°C) гидрида, находящегося в нанометрическом состоянии. Известны и другие способы получения тетрагидрида интерметаллида (например [27–29]), влияющие на температуру его разложения.
При исследовании гидрирования двухфазного эвтектического сплава состава Mg + Mg2Ni (89 ат. % Mg + 11 ат. % Ni) с размером частиц 200 мкм установлена максимальная водородоемкость системы (5.5 мас. %), достигаемая при 350°C и четырехкратном повторении циклов гидрирования/дегидрирования с образованием гидридных фаз MgH2 и Mg2NiH4 [17]. При гидрировании сплава как водородом, так и аммиаком установлено, что образование MgH2 при использовании аммиака как гидрирующего агента происходит при значительно более низкой температуре, чем в реакции сплава с водородом – 200 и 350°C соответственно.
Исследована кинетика реакций гидрировании/дегидрирования композитов Mg + Mg2Ni с содержанием Ni 4.4, 11.3 (эвтектика) и 16.3 ат. %, полученных индукционной плавкой с последующим механическим размолом образцов [20]. При определении циклической устойчивости прогидрированных композитов обнаружено падение водородной емкости композита эвтектического состава на ~7% после 100 циклов, в то время как композит, содержащий 16.3% Ni, потерял ~4.5%, что свидетельствует о возможности его практического применения.
Авторы работы [30] разработали эффективную синергетическую стратегию получения гидридов системы Mg–Ni специальным синтезом в твердом состоянии (hydriding combustion synthesis). Полученные гидриды MgH2 и Mg2NiH4 + Mg2NiH0.3 образуют многофазную гидридную систему, из которой весь водород выделяется при более низкой температуре по сравнению с Mg2NiH4 (210–240°С). Температура десорбции MgH2 в такой многофазной гидридной системе снижается на 173°С. Предложенный авторами синергетический механизм одновременной десорбции многофазных гидридов основан на межфазном строении системы и катализирующем эффекте Mg2Ni.
Таким образом, как и отмечалось ранее [31], присутствие интерметаллида в реакции магния с водородом понижает температуру гидрирования металла и повышает скорость реакции, сокращая время гидрирования. Но следует отметить, что во всех известных работах (за исключением [17]) для приготовления композитов применялся, как правило, длительный, высокоэнергетический помол в шаровых мельницах в атмосфере водорода, размер частиц композитов после которого находился в нанометровом диапазоне. Такая методика требует специальной аппаратуры и энергозатрат, трудоемка и, как правило, не приводит к 100%-ному выходу. При анализе таких работ возникает предположение о возможности отказа от предварительной высокоэнергетической обработки для подготовки исходных компонентов в пользу применения для исследования гидрирования/дегидрирования механических смесей металла с интерметаллическим соединением.
Цель настоящей работы – определение возможности гидрирования смеси крупнокристаллических порошков магния с интерметаллидом Mg2Ni без предварительной высокоэнергетической активации и нахождение оптимальных параметров проведения этого процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные соединения. В работе использовали порошок магния чистотой 99.95 мас. % с размером частиц 200 мкм.
Интерметаллическое соединение Mg2Ni получали сплавлением шихты металлов (никель чистотой 99.99% и магний 99.95%) в вакуумно-индукционной печи под флюсом из эвтектического расплава LiCl–KCl. Состав сплава контролировали химическим и рентгенофазовым анализами. По данным элементного химического анализа, сплав соответствовал составу Mg1.95Ni, содержание хлора меньше 0.5 мас. %. По данным рентгенофазового анализа (РФА), образец был однофазным – на дифрактограмме присутствовали только отражения, соответствующие гексагональной структуре с периодами кристаллической решетки a = 5.215 Å, c = 13.25 Å, хорошо согласующимися с результатами [22]. Непосредственно перед исследованием сплав измельчали в атмосфере аргона механическим способом и отсеивали порошок с размером частиц 200 мкм.
Гидрирование смеси металлических фаз осуществляли высокочистым водородом (99.999 мас. %), выделяемым при нагревании металлогидридного аккумулятора на основе интерметаллического соединения LaNi5.
Образцы для исследования готовили в сухом боксе фирмы MBRAUN в атмосфере аргона при содержании воды и кислорода не более 0.0001%, в котором навески порошков магния и интерметаллида, соответствующие определенному количественному составу смеси, перемешивали механически, растирали в титановой ступке и помещали в кварцевую пробирку.
Методика эксперимента. Гидрирование смеси порошков осуществляли в кварцевой пробирке, помещенной в реактор-автоклав металлической лабораторной установки высокого давления типа Сивертса емкостью 60 мл.
Перед гидрированием 3 г смеси дегазировали вакуумированием (10–3 мм рт. ст.) при 300–390°C в течение 1 ч. Затем автоклав при температуре дегазации заполняли водородом до давления 30–35 атм. Поглощение водорода начиналось без индукционного периода, процесс продолжали при той же температуре в течение 1 ч, затем нагревание прекращали. После окончания гидрирования, определяемого прекращением падения давления в системе, реактор снова нагревали до температуры синтеза, выдерживали 2 ч, охлаждали до комнатной температуры и процесс повторяли. После окончания синтеза водород из реактора сбрасывали в аккумулятор, продукт выгружали в сухом боксе и анализировали.
Методы анализа. РФА образцов проводили при комнатной температуре на дифрактометре АДП-1 (CuKα-излучение). Погрешность определения параметров кристаллической решетки не превышала 0.0005 Å.
Количество водорода в образующихся продуктах гидрирования определяли волюмометрически в установке и на CHNS/O-элементном анализаторе Vario Micro cube Elementar GmbH.
Термическую устойчивость продуктов реакций исследовали на установке синхронного термического анализа STA 409 Luxx фирмы Netzsch. Регистрацию кривых потерь веса (ТГ) и дифференциальную сканирующую калориметрию (ДСК) проводили при программируемом нагреве со скоростью 10°С/мин в потоке аргона.
Давление водорода измеряли образцовым манометром МО класса точности 0.4.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выбор интерметаллического соединения Mg2Ni как катализатора гидрирования магния объясняется его доступностью (легкостью получения), возможностью полного обратимого гидрирования без распада, невысокой температурой разложения тетрагидрида с сохранением металлической матрицы и высокой чистотой и активностью выделяемого водорода.
Экспериментально показано, что в процессе гидрирования в течение 1 ч (непосредственно после окончания дегазации) происходит поглощение водорода интерметаллическим соединением с образованием тетрагидрида Mg2NiH4. При этом магний практически не гидрируется, что объясняет необходимость дальнейшего нагревания реакционной смеси в режиме цикличности. При циклировании, описанном выше, при разогревании смеси происходит постепенное выделение из тетрагидрида интерметаллида активного водорода, способствующего началу гидрирования металла. Этот процесс со временем как бы “затухает”, но повторяется с началом нового цикла, т.е. тетрагидрид работает как насос, выполняя роль поставщика активного водорода для гидрирования магния. Экспериментальное исследование других факторов (соотношения количеств магния и Mg2Ni в гидрируемой смеси, температуры проведения синтеза и его продолжительности и др.), определяющих процесс гидрирования, позволило сделать определенные выводы о приемлемости и оптимальных условиях использования смеси Mg + Mg2Ni в системах хранения водорода.
При температурах 300–390°C под давлением водорода 30–35 атм исследовано гидрирование смесей Mg + Mg2Ni различного состава (50 : 50, 60 : 40, 70 : 30, 80 : 20 и 90 : 10 мас. %), т.е. исследовано гидрирование магния в присутствии 50–10 мас. % интерметаллида Mg2Ni. Условия и результаты гидрирования приведены в табл. 1.
Таблица 1.
Условия и результаты гидрирования смесей Mg + Mg2Ni
| Образец | Mg : Mg2Ni, мас. % |
Условия гидрирования | Продукты гидрирования | |||||
|---|---|---|---|---|---|---|---|---|
| содержание водорода, мас. % | параметры решетки, Å | |||||||
| t, °С | τ, ч | MgH2 | Mg2NiH4 | |||||
| найдено | вычислено | a | c | a | ||||
| 1 | 80 : 20 | 390 | 5 | 6.32 | 6.80 | 4.5178 | 3.0198 | 6.5241 |
| 2 | 90 : 10 | 380 | 5 | 6.70 | 7.20 | 4.5180 | 3.0200 | 6.5240 |
| 3 | 80 : 20 | 380 | 5 | 6.53 | 6.80 | 4.5183 | 3.0204 | 6.5243 |
| 4 | 70 : 30 | 380 | 5 | 6.14 | 6.40 | 4.5181 | 3.0200 | 6.5240 |
| 5 | 60 : 40 | 380 | 5 | 5.70 | 6.00 | 4.5182 | 3.0202 | 6.5244 |
| 6 | 50 : 50 | 380 | 5 | 5.32 | 5.60 | 4.5180 | 3.0201 | 6.5241 |
| 7 | 90 : 10 | 370 | 5 | 6.62 | 7.20 | 4.5179 | 3.0200 | 6.5242 |
| 8 | 80 : 20 | 370 | 5 | 6.39 | 6.80 | 4.5180 | 3.0202 | 6.5241 |
| 9 | 70 : 30 | 360 | 7 | 6.02 | 6.40 | 4.5181 | 3.0202 | 6.5241 |
| 10 | 70 : 30 | 350 | 7 | 6.02 | 6.40 | 4.5181 | 3.0201 | 6.5242 |
| 11 | 70 : 30 | 300 | 9 | 5.89 | 6.40 | 4.5180 | 3.0200 | 6.5240 |
Оказалось, что при температуре гидрирования 390°C, наиболее соответствующей условиям получения дигидрида магния, при давлении водорода 35 атм начинается разложение образовавшихся на начальных этапах поглощения гидридов и металла, и интерметаллида (образец 1). Содержание водорода в продуктах гидрирования этой смеси составляет 6.32 мас. %, что соответствует 93%-ному общему поглощению водорода. Поэтому все дальнейшие исследования проводились при температуре 380°C и ниже.
При температуре 380°C исследовано гидрирование смесей, содержащих 10, 20, 30, 40 и 50 мас. % интерметаллида, для выяснения влияния его количества (образцы 2–6) на полноту превращения исходных компонентов в смесь гидридов. Установлено, что при пятичасовой продолжительности синтеза превращение исходной смеси для образцов 3–6 происходит на 95–96% вне зависимости от состава, но с понижением общего содержания водорода за счет уменьшения количества магния в смеси. Смесь, содержащая 10 мас. % Mg2Ni (образец 2), гидрировалась только на 93%. Повышение продолжительности взаимодействия смеси Mg + Mg2Ni с водородом до 7–8 ч практически не влияет на степень превращения и, соответственно, не увеличивает общее содержание водорода в продуктах гидрирования. Таким образом, добавки 20 мас. % Mg2Ni (образец 3) вполне достаточно для практически полного процесса гидрирования магния. Содержание водорода в этом образце составило 6.53 мас. %, что соответствовало 96% превращения.
На дифрактограмме образца (рис. 1), полученного гидрированием смеси порошков Mg + Mg2Ni состава 80 : 20 мас. % (образец 3) при 380°C, присутствуют отражения, соответствующие тетрагональной фазе дигидрида магния MgH2 (a = 4.5183, c = 3.0204 Å). Два пика при углах дифракции около 23.5 ° и 39° хорошо соответствуют наиболее интенсивным рефлексам (111 и 220) псевдовысокотемпературного гидрида Mg2NiH4 с разупорядоченной кубической структурой [24], который, как также отмечалось в нашей работе [32], присутствует (при комнатной температуре) в образцах композитов полностью прогидрированного эвтектического сплава Mg89Ni11. Этот результат согласуется с уже упомянутыми выше данными [24] о трудностях получения истинной моноклинной фазы Mg2NiH4.
Рис. 1.
Дифрактограмма образца, полученного гидрированием смеси порошков Mg + Mg2Ni состава 80 : 20 мас. % (образец 3).
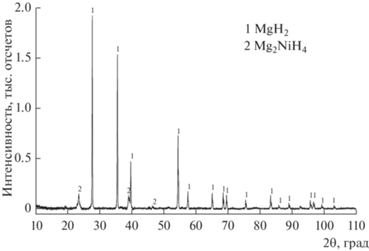
Гидрирование смесей, содержащих 10 и 20 мас. % интерметаллида (образцы 7–8), при 370°C происходит на 92–94%, т.е. не приводит к полному превращению смесей в соответствующие гидриды.
На примере взаимодействия с водородом смесей состава 70 : 30 мас. % (образцы 4, 9–11) исследовано влияние температуры на полноту гидрирования. Установлено, что снижение температуры от 380°C (образец 4) до 350°C (образец 10) даже при увеличении продолжительности взаимодействия (до 7 ч) также снижает степень гидрирования (94%), а процесс, проведенный при 300°C (образец 11), отличается еще большей длительностью (до 13 ч) и характеризуется 92%-ной полнотой превращения. Для образца 9, полученного гидрирированием смеси 70 : 30 мас. % при 360°C в течение 7 ч, характерно образование твердого раствора водорода в интерметаллиде состава Mg2NiH0.3 (гексагональная сингония, a = 5.2310, c = 13.401 Å) как промежуточной фазы для тетрагидрида интерметаллида. Следует отметить, что появление на дифрактограммах пиков, характерных для фазы Mg2NiH0.3 (образующейся в незначительных количествах) наблюдалось для продуктов гидрирования, полученных при температурах 350–360°C.
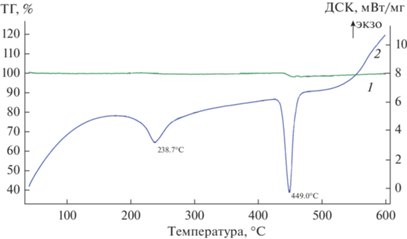
Фазовый состав продуктов взаимодействия смесей Mg + Mg2Ni с водородом подтвержден данными РФА и дифференциального термического анализа. В качестве примера на рис. 2 приведены результаты для продуктов гидрирования исходной смеси состава 60 : 40 мас. % при 380°C (образец 5). На кривой ДСК проявляются два эндотермических пика – при 238.7 и 449.0°C, соответствующих температурам разложения тетрагидрида интерметаллида и дигидрида магния соответственно.
Рис. 2.
Результаты термического анализа продуктов гидрирования смеси состава 60 : 40 мас. % (образец 5) при 380°C: 1 – ТГ, 2 – ДСК.
Приведенные значения периодов кристаллических решеток полученных гидридных фаз соответствуют данным [7, 33, 34].
Механизм гидрирования в системах металл–интерметаллид и, в частности, в рассматриваемой системе Mg + Mg2Ni основан на каталитической роли интерметаллических соединений, на поверхности которых сформированы каталитические центры (например, атомы Ni). На таких центрах происходит диссоциация молекул H2 на атомы H с их последующей диффузией в глубь металлической матрицы. Таким образом получаются каналы транспорта водорода к фазе магния через межфазную границу раздела Mg2Ni/Mg. Кроме того, вследствие экзотермичности реакции гидрирования происходит быстрый разогрев окрестности зерна интерметаллида. Такое повышение температуры в сочетании с наличием каналов транспорта активного атомарного водорода способствует быстрому гидрированию металла.
Таким образом, смесь 80 мас. % Mg с 20 мас. % Mg2Ni гидрируется высокочистым водородом при 370–380°C на 95–96% с образованием соответствующих гидридов, содержащих >6.5 мас. % водорода и выделяющих его при 220–450°C. Практическое применение полученных результатов по гидрированию магния в присутствии интерметаллического соединения Mg2Ni связано с перспективностью использования магния в системах хранения водорода. Смесь Mg + Mg2Ni используется как рабочее вещество в высокотемпературных металлогидридных аккумуляторах водорода многократного действия. Такие аккумуляторы в виде водородных баллонов повышенного давления с внешним обогревом электропечью применяются в качестве источника высокочистого (99.999 мас. %) и высокоактивного водорода в лабораторных или мелкомасштабных работах.
ЗАКЛЮЧЕНИЕ
При исследовании процесса взаимодействия крупнокристаллического порошка магния с высокоактивным водородом в присутствии интерметаллического соединения Mg2Ni установлено практически полное гидрирование (до 96%) порошкообразной смеси Mg + 20 мас. % Mg2Ni при 370–380°C без предварительной высокоэнергетической активации и, соответственно, без применения специальной аппаратуры и энергетических затрат.
Металлогидридные аккумуляторы водорода, использующие такую смесь как рабочее вещество и снабженные электропечью для внешнего нагревания, можно применять в качестве источника высокоактивного водорода в мелкомасштабных и лабораторных работах.
Список литературы
Hirscher M., Yartys V.A., Baricco M. et al. Materials for Hydrogen-Based Energy Storage – Past, Recent Progress and Future Outlook // J. Alloys Compd. 2020. V. 827. Article 153548. https://doi.org/10.1016/j.jallcom.2019.153548
Baran A., Polański M. Magnesium-Based Materials for Hydrogen Storage – A Scope Review // Materials. 2020. V. 13. № 18. Article 3993. https://doi.org/10.3390/ma13183993
Hitam C.N.C., Aziz M.A.A., Ruhaimi A.H., Taib M.R. Magnesium-Based Alloys for Solid-State Hydrogen Storage Applications: A Review // Int. J. Hydrogen Energy. V. 46. P. 31067–31083. https://doi.org/10.1016/j.ijhydene.2021.03.153
Yartys V.A., Lototskyy M.V., Akiba E. et al. Magnesium Based Materials for Hydrogen Based Energy Storage: Past, Present and Future // Int. J. Hydrogen Energy. 2019. V. 44. № 15. P. 7809–7859. https://doi.org/10.1016/j.ijhydene.2018.12.212
Ouyang L., Chen K., Jiang J. et al. Hydrogen Storage in Light-Metal Based Systems: A Review // J. Alloys Compd. 2020. V. 829. Article 154597. https://doi.org/10.1016/j.jallcom.2020.154597
Ouyang L., Liu F., Wang H. et al. Magnesium-Based Hydrogen Storage Compounds: A Review // J. Alloys Compd. 2020. V. 832. Article 154865. https://doi.org/10.1016/j.jallcom.2020.154865
Sun Y., Shen C., Lai Q. et al. Tailoring Magnesium Based Materials for Hydrogen Storage through Synthesis: Current State of the Art // Energy Storage Mater. 2018. V. 10. P. 168–198. https://doi.org/10.1016/j.ensm.2017.01.010
Тарасов Б.П., Можжухин С.А., Арбузов А.А. и др. Особенности гидрирования магния с Ni-графеновым покрытием // Журн. физ. химии. 2020. Т. 94. № 5. С. 772–777. https://doi.org/10.31857/S0044453720050234
Tarasov B.P., Arbuzov A.A., Mozhzhuhin S.A. et al. Hydrogen Storage Behavior of Magnesium Catalyzed by Nickel-Graphene Nanocomposites // Int. J. Hydrogen Energy. 2019. V. 44. № 55. P. 29212–29223. https://doi.org/doi 10.1016/j.ijhydene.2019.02.033
Надольский Д.С., Зиннатуллина Л.Р., Медведева Н.А. Водородаккумулирующие материалы // Вестн. Пермского ун-та. Сер. Химия. 2019. Т. 9. Вып. 2. С. 106–125. https://doi.org/10.17072/2223-1838-2019-2-106-125
Fu Y., Groll M., Mertz R., Kulenovic R. Effect of LaNi5 and Additional Catalysts on Hydrogen Storage Properties of Mg // J. Alloys Compd. 2008. V. 460. P. 607–613. https://doi.org/10.1016/j.jallcom.2007.06.008
Zhou C., Fang Z.Z., Ren C. et al. Effect of Ti Intermetallic Catalysts on Hydrogen Storage Properties of Magnesium Hydride // J. Phys. Chem. C. 2013. V. 117. P. 12973–12980. https://doi.org/10.1021/jp402770p
Antiqueira F.J., Leiva D.R., Zepon G., Botta W.J. Room Temperature Conversion of Mg to MgH2 Assisted by Low Fractions of Additives // Int. J. Hydrogen Energy. 2022. V. 47. № 1. P. 470–489. https://doi.org/10.1016/j.ijhydene.2021.10.047
El-Eskandarany M.S., Shaban E., Al-Matrouk H. et al. Structure, Morphology and Hydrogen Storage Kinetics of Nanocomposite MgH2/10 wt % ZrNi5 Powders // Mater. Today Energy. 2017. V. 3. P. 60–71. https://doi.org/10.1016/j.mtener.2016.12.002
El-Eskandarany M.S., Al-Ajmi F., Banyan M., Al-Duweesh A. Synergetic Effect of Reactive Ball Milling and Cold Pressing on Enhancing the Hydrogen Storage Behavior of Nanocomposite MgH2/10 wt % TiMn2 Binary System // Int. J. Hydrogen Energy. 2019. V. 44. P. 26428–26443. https://doi.org/10.1016/j.ijhydene.2019.08.093
Pang Y., Yuan T., Yang J. et al. In situ Formation of Al3Ti, MgF2 and Al and Their Superior Synergetic Effects on Reversible Hydrogen Storage of MgH2// Catal. Today. 2018. V. 318. P. 107–112. https://doi.org/10.1016/j.cattod.2017.10.035
Фокин В.Н., Фокина Э.Э., Можжухин С.А., Тарасов Б.П. Водородное и аммиачное гидрирование эвтектического сплава системы Mg–Ni // Междунар. научн. журн. “Альтернативная энергетика и экология”. 2016. № 09–10. С. 58–65. https://doi.org/10.15518/isjaee.2016.09-10.058-065
Chen Y., Dai J., Song Y. Stability and Hydrogen Adsorption Properties of Mg/Mg2Ni Interface: A First Principles Study // Int. J. Hydrogen Energy. 2018. V. 43. № 34. P. 16598–16608. https://doi.org/10.1016/j.ijhydene.2018.07.031
Бузанов Г.А., Симоненко Н.П., Мальцева Н.Н. и др. Получение и свойства механокомпозитов MgH2 с двухфазной смесью Mg2NiH0.3 + Mg2NiH4–δ // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1517–1521. https://doi.org/10.1134/S0044457X181005X
Fadonougbo J.O., Kim H.-J., Suh B.-C. et al. Kinetics and Thermodynamics of Near Eutectic Mg–Mg2Ni Composites Produced by Casting Process // Int. J. Hydrogen Energy. 2020. V. 45. № 53. P. 29009–29022. https://doi.org/10.1016/j.ijhydene.2020.07.181
Клямкин С.Н. Металлогидридные композиции на основе магния как материалы для аккумулирования водорода // Рос. хим. журн. 2006. Т. L. № 6. С. 49–55.
Диаграммы состояния двойных металлических систем: Справочник / Под общ. ред. Лякишева Н.П. Т. 3. Кн. 1. М.: Машиностроение, 2001. 872 с.
Song M.Y., Park H.R. Pressure–Composition Isotherms in the Mg2Ni–H2 System // J. Alloys Compd. 1998. V. 270. P. 164–167.
Blomqvist H., Noréus D. Mechanically Reversible Conductor-Insulator Transition in Mg2NiH4 // J. Appl. Phys. 2002. V. 91. № 8. P. 5141–5148. https://doi.org/10.1063/1.1461069
Hayashi Sh., Hayamizu K., Yamamoto O. The Relation between the Hydrogen Motion and the Phase Transition in the β Phase of the Mg2NiHx System // J. Chem. Phys. 1983. V. 79. № 11. P. 5572–5578. https://doi.org/10.1063/1.445677
Zaluska A., Zaluki L., Strőm-Olsen J.O. Structure, Catalysis and Atomic Reactions on the Nano-Scale: A Systematic Approach to Metal Hydrides for Hydrogen Storage // Appl. Phys. A. 2001. V. 72. P. 157–165. https://doi.org/10.1007/s003390100783
Montone A., Grbovic Novakovic J., Vittori Antisari M. et al. Nano-Micro MgH2–Mg2NiH4 Composites: Tayloring a Multichannel System with Selected Hydrogen Sorption Properties // Int. J. Hydrogen Energy. 2007. V. 32. P. 2926–2934. https://doi.org/10.1016/j.ijhydene.2006.12.021
Tarasov B.P. Metal-Hydride Accumulators and Generators of Hydrogen for Feeding Fuel Cells // Int. J. Hydrogen Energy. 2011. V. 36. № 1. P. 1196–1199. https://doi.org/10.1016/j.ijhydene.2010.07.002
Фокин В.Н., Фокина Э.Э., Тарасов Б.П. Гидрирование Mg2Ni аммиаком // Неорган. материалы. 2009. Т. 45. № 8. С. 926–929.
Zhang J., Yao L., Zhu Y. et al. An Exciting Synergistic Effect: Realizing Large-Sized MgH2 Dehydrogenation at Lowered Temperatures by Locally Assembling a Heterophase Composite // Mater. Today Energy. 2019. V. 14. Article 100345. https://doi.org/10.1016/j.mtener.2019.100345
Фокин В.Н., Фокина Э.Э., Тарасов Б.П. Исследование взаимодействия титана и его сплавов с железом с водородом и аммиаком // Журн. прикл. химии. 2019. Т. 92. № 1. С. 39–48. https://doi.org/10.1134/S0044461819010055
Фурсиков П.В., Слепцова А.М., Можжухин С.А. и др. Фазовый состав и микроструктура сорбирующих водород композитов эвтектического сплава Mg–Ni с графеноподобным материалом // Журн. физ. химии. 2020. Т. 94. № 5. С. 789–795. https://doi.org/10.31857/S0044453720050076
Genossar J., Rudman P.S. Structural Transformation in Mg2NiH4 // J. Phys. Chem. Solids. 1981. V. 42. № 7. P. 611–616. https://doi.org/10.1016/0022-3697(81)90111-6
Noréus D., Werner P.-E. Structural Studies of Hexagonal Mg2NiHx // Acta Chem. Scand. A. 1982. V. 36. P. 847–851.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


