Неорганические материалы, 2022, T. 58, № 12, стр. 1303-1311
Влияние природы щелочного агента на микроструктуру и свойства оксида цинка, полученного методом осаждения
А. В. Сивцева 1, *, Н. Б. Кондрашова 1, А. С. Аверкина 1, В. А. Вальцифер 1, Д. Стопар 2
1 Институт технической химии Уральского отделения Российской академии наук – филиал
Пермского федерального исследовательского центра Уральского отделения Российской
академии наук
614013 Пермь, ул. Академика Королева, 3, Россия
2 Университет Любляны
1000 Любляна, Ямникарьева ул., 101, Словения
* E-mail: nasthasivtseva@mail.ru
Поступила в редакцию 30.05.2022
После доработки 14.10.2022
Принята к публикации 17.10.2022
- EDN: WJGOUY
- DOI: 10.31857/S0002337X22120132
Аннотация
Исследовано влияние природы щелочного агента (NH4OH, NaOH, (NH4)2CO3 и Na2CO3) на удельную поверхность, размер и форму частиц оксида цинка, полученного методом осаждения нитрата цинка в водной и полимерных средах с последующей термодеструкцией осадков. Установлено, что процесс осаждения с использованием NH4OH и NaOH в среде полиакриламидов способствует формированию крупных частиц в форме шестигранников, причем более крупных (до 1500 нм) в случае применения NH4OH. Показано, что самую высокую удельную поверхность (до 98 м2/г) и малый размер частиц (~20 нм) имеет образец, полученный методом термического разложения продуктов взаимодействия нитрата цинка с карбонатом аммония.
ВВЕДЕНИЕ
Известно, что оксид цинка является многофункциональным соединением. Благодаря своим электрическим, оптическим, каталитическим и фотокаталитическим свойствам, а также низкой токсичности он находит применение в различных областях, в т.ч. в медицине и биотехнологии [1–7], и может использоваться в качестве антибактериального агента. При этом оксид цинка проявляет значительную антимикробную активность, когда размер частиц уменьшается до нанометрового диапазона [8]. Считается, что антибактериальная активность наночастиц (НЧ) ZnO обусловлена образованием активных форм кислорода и высвобождением ионов Zn2+ [9, 10].
Размер и морфология НЧ ZnO влияют на их свойства. Данные параметры можно контролировать, изменяя условия синтеза (время реакции, температуру, pH и др.) [11, 12]. В настоящее время НЧ различных размеров и форм оксида цинка могут быть получены физическими и химическими методами, среди которых наиболее распространенными являются: золь–гель-синтез [13–15], гидротермальный [16, 17], микроэмульсионный [18] способы, а также осаждение из растворов [19–21].
Целью данной работы является исследование влияния природы осадителя и состава реакционной среды в процессе получения оксида цинка на его текстурно-структурные свойства: удельную поверхность, размер и форму частиц, а также на процессы растворимости и ионообразования в водных средах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез оксида цинка осуществляли путем осаждения гидратированных соединений цинка с их последующей термодеструкцией. В качестве цинкоксидного прекурсора использовали 6-водный нитрат цинка (Zn(NO3)2·6H2O, “ч.”, АО “Вектон”), выбранный в связи с его хорошей растворимостью и низкой температурой разложения. В качестве осадителей применяли: гидроксид натрия (NaOH, “ч.д.а.”, АО “ЭКОС–1”), раствор аммиака (NH4OH, “ч.д.а.”, ООО “Сигма Тек”), карбонат натрия (Na2CO3, АО “Вектон”) и карбонат аммония ((NH4)2CO3, “ч.”, АО “Вектон”).
С целью дальнейшего создания бактерицидных пленок и гелей в работе также рассматривали способ получения ZnO непосредственно в полимерной среде, для чего использовали растворы анионогенного и катионогенного полиакриламидов (ПАА) марок “Праестол 2530” и “Праестол 857 BS” соответственно (ЗАО “Соленис Технолоджис МСП”).
Синтез оксида цинка осуществляли следующими способами:
1) термическим разложением продуктов взаимодействия нитрата цинка с NH4OH и с NaOH (метод 1, образцы 1.1 и 1.2);
2) термическим разложением продуктов взаимодействия нитрата цинка с NH4OH и с NaOH в среде анионного (метод 2, образцы 2.1, 2.2) и катионного ПАА (метод 2, образцы 2.3, 2.4);
3) термическим разложением продуктов взаимодействия нитрата цинка с (NH4)2CO3 и с Na2CO3 (метод 3, образцы 3.1 и 3.2).
Мольные соотношения нитрата цинка и осадителей NaOH и NH4OH при получении ZnO методами 1 и 2 составляли [Zn2+]/[OH–] = 1/2. Мольные соотношения нитрата цинка и осадителей Na2CO3 и (NH4)2CO3 при получении ZnO методом 3 соответствовали пропорции [Zn2+]/[${\text{CO}}_{3}^{{2 - }}$] = 1/1. Мольные соотношения соли цинка и воды во всех случаях составляли [H2O]/[Zn2+] = 100. При получении ZnO методом 2 использовали 0.4%-ные растворы ПАА.
Синтез оксида цинка методами 1 и 3 проводили по следующей схеме: в водный раствор нитрата цинка 0.5 М добавляли в зависимости от метода синтеза предварительно растворенные в воде осадители: NaOH, NH4OH, Na2CO3 либо (NH4)2CO3. Синтез образцов оксида цинка методом 2 осуществляли аналогично методам 1 и 3, но рассчитанное количество нитрата цинка добавляли в заранее приготовленные растворы ПАА. Реакционную смесь во всех случаях перемешивали при температуре 25°С в течение 1 ч на магнитной мешалке со скоростью 600 об./мин. Осадки отфильтровывали, промывали дистиллированной водой, сушили при температуре 80°С, а затем прокаливали. Температуры прокаливания образцов определены методом термогравиметрического анализа (ТГА) на анализаторе TGA/DSC 1 (METTLER-TOLEDO, Швейцария) в атмосфере воздуха при скорости нагревания 10°С/мин в интервале температур 25–1000°С.
Свойства синтезированных образцов исследовали с применением различных физико-химических методов анализа.
Структура синтезированных образцов оксида цинка исследовалась методом рентгенофазового анализа (РФА) на дифрактометре XRD-7000 (Shimadzu, Япония) при использовании CuKα-излучения (λср = 1.54 Å) в интервале 2θ = 1.4°–10° и 10°–80° с шагом 0.01°–0.005°. Идентификация осуществлялась с использованием картотеки JSPDS. Средний размер кристаллитов вычисляли по формуле Селякова–Шеррера: dРФА = Kλ/(β cos θ), где K = 0.89, λ = 1.54056 Å, β – полуширина рефлекса 100, рад, θ – дифракционный угол рефлекса.
Текстурные характеристики ZnO исследовали методом низкотемпературной сорбции азота на приборе ASAP 2020 (Micromeritics, США) после дегазации исследуемого материала в вакууме при температуре 350°С в течение 3 ч. Удельную поверхность образцов (SБЭТ) и общий объем пор (Vtot) определяли методом БЭТ, распределение пор по размерам (dпор) – по изотермам десорбции, используя метод BJH, в интервале размеров пор 1.7–300 нм.
Морфологические особенности частиц оксида цинка – средний размер (dСЭМ) и форму – исследовали методом сканирующей электронной микроскопии (СЭМ) на приборе FEI Quanta FEG650 (Thermo Fisher Scientific, Нидерланды).
Потенциальное использование полученных образцов оксида цинка при создании бактерицидных пленок и гелей оценивали по содержанию ионов цинка после выдержки ZnO в дистиллированной воде при комнатной температуре в течение 48 ч. Количественный анализ остаточных ионов Zn2+ осуществляли методом атомно-адсорбционной спектроскопии на приборе iCE 3500 (Thermo Fisher Scientific, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
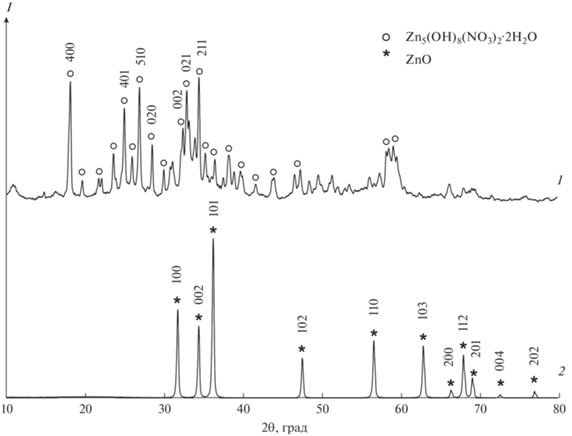
Из результатов термического анализа (рис. 1) видно, что при использовании в качестве осадителя раствора аммиака (образцы 1.1, 2.1, 2.3), независимо от реакционной среды (водной или растворов ПАА), полная термодеструкция продуктов осаждения и компонентов реакционной среды проходит при температуре ~450°C. Процесс разложения осадков в этом случае является многоступенчатым и протекает в интервале температур 120–270°C. Скорее всего, это связано с формированием и поэтапным разложением гидратированного нитрата цинка Zn5(OH)8(NO3)2·2Н2O [22], существование которого доказано методом РФА (рис. 2), по схеме:
(I)
$\begin{gathered} {\text{Z}}{{{\text{n}}}_{{\text{5}}}}{{\left( {{\text{OH}}} \right)}_{{\text{8}}}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}}{\kern 1pt} \cdot {\kern 1pt} {\text{2}}{{{\text{Н}}}_{{\text{2}}}}{\text{O}} \to \\ \to {\text{Z}}{{{\text{n}}}_{{\text{5}}}}{{\left( {{\text{OH}}} \right)}_{{\text{8}}}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{\text{ + 2}}{{{\text{Н}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(II)
$\begin{gathered} {\text{Z}}{{{\text{n}}}_{{\text{5}}}}{{\left( {{\text{OH}}} \right)}_{{\text{8}}}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}\xrightarrow{{{\text{130}} - {\text{170\;}}^\circ {\text{С}}}} \\ \to \,\,{\text{Z}}{{{\text{n}}}_{{\text{3}}}}{{\left( {{\text{OH}}} \right)}_{{\text{4}}}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{\text{ + 2ZnO + 2}}{{{\text{Н}}}_{{\text{2}}}}{\text{O}} \\ \end{gathered} $(III)
$\begin{gathered} {\text{4Z}}{{{\text{n}}}_{{\text{3}}}}{{\left( {{\text{OH}}} \right)}_{{\text{4}}}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}\xrightarrow{{{\text{170}} - {\text{220\;}}^\circ {\text{С}}}}{\text{9ZnO + }} \\ {\text{ + }}\,\,{\text{3Zn}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}}{\text{ + 7}}{{{\text{Н}}}_{{\text{2}}}}{\text{O + 2HN}}{{{\text{O}}}_{{\text{3}}}}, \\ \end{gathered} $(IV)
$\begin{gathered} {\text{Zn}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}}\xrightarrow{{{\text{220}} - {\text{270\;}}^\circ {\text{С}}}}{\text{ZnO + }} \\ {\text{ + }}\,\,{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{ + NO + }}{{{\text{O}}}_{{\text{2}}}}. \\ \end{gathered} $Рис. 1.
Термодеструкция продуктов взаимодействия нитрата цинка с NH4OH: а – в водной среде, б – в среде анионного ПАА, в – в среде катионного ПАА.
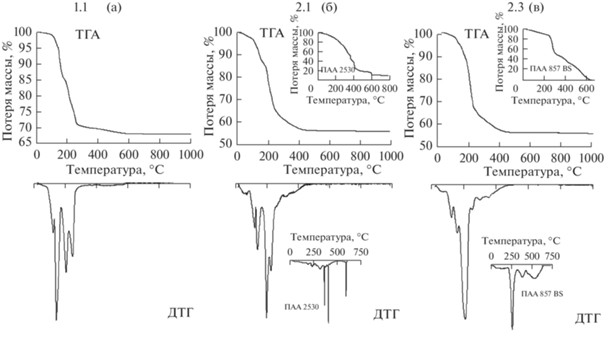
Размер кристаллитов в соединении Zn5(OH)8(NO3)2·2Н2O до термодеструкции составлял 24 нм, тогда как после прокаливания в образце 1.1 (ZnO, цинкит) – 35 нм (табл. 1).
Таблица 1.
Текстурно-структурные свойства образцов оксида цинка
| Метод получения ZnO |
Образец | SБЭТ, м2/г | Vtot, см3/г | dпор, нм | Размер частиц dСЭМ, нм |
dРФА, нм |
|---|---|---|---|---|---|---|
| 1 | 1.1 | 7.0 | 0.023 | 21.6 | 70–100 | 34.9 |
| 1.2 | 4.7 | 0.012 | 17.1 | 200–250 | 46.0 | |
| 2 | 2.1 | 8.6 | 0.001 | 5.6 | 250–1500 | 30.5 |
| 2.2 | 6.3 | 0.014 | 10.7 | 100–400 | 38.0 | |
| 2.3 | 8.7 | 0.015 | 8.6 | 200–300 | 28.2 | |
| 2.4 | 10.9 | 0.028 | 11.9 | 75–200 | 43.5 | |
| 3 | 3.1 | 97.7 | 0.369 | 13.0 | 20–25 | 17.1 |
| 3.2 | 32.3 | 0.117 | 14.2 | 40–50 | 21.7 |
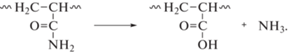
Термодеструкция образцов 2.1 и 2.3, полученных осаждением нитрата цинка раствором аммиака в среде ПАА различных марок, протекает аналогично образцу 1.1. Процессы в диапазоне температур 270–450°С в этих образцах связаны с разложением продуктов гидролиза ПАА. Стоит отметить, что полная термодеструкция в образцах 2.1 и 2.3 завершается при температуре 450°С, в то время как термолиз исходных ПАА протекает в диапазоне температур 250–750°С (рис. 1б, 1в). Связано это с тем, что ПАА легко гидролизуются в аммиачной среде, в результате чего происходит частичное превращение амидных групп в карбоксилатные:
Поэтому при прокаливании образцов 2.1 и 2.3 можно наблюдать термодеструкцию продуктов гидролиза ПАА и удаление аммиака. Прокаленные образцы 2.1 и 2.3, по данным РФА, имеют структуру цинкита с размерами кристаллитов ~30 нм (табл. 1).
Процесс осаждения нитрата цинка раствором NaOH в выбранных мольных соотношениях ([Zn2+]/[OH–] = 1/2) несколько отличается от его взаимодействия с раствором аммиака (рис. 3). В образце 1.2, полученном в водной среде, результатом взаимодействия гексагидрата нитрата цинка и щелочи, по данным РФА, является непосредственно оксид цинка (P63mc) с размером кристаллитов 25.6 нм. Потеря массы при прокаливании до 1000°С в этом случае составляет всего ~8% и связана с удалением сорбированной и кристаллизационной воды, а также с терморазложением примесей гидроксонитратов цинка (рис. 3, образец 1.2). Рентгенограммы образца 1.2 как до прокаливания, так и после него аналогичны данным РФА образца 1.1 (рис. 2) и соответствуют структуре цинкита, но размер кристаллитов в образце 1.2 после его выдержки при температуре 600°C значительно увеличивается по сравнению с первоначальным и составляет ~46 нм.
Рис. 3.
Термодеструкция продуктов взаимодействия нитрата цинка с NаOH: а – в водной среде, б – в среде анионного ПАА, в – в среде катионного ПАА.
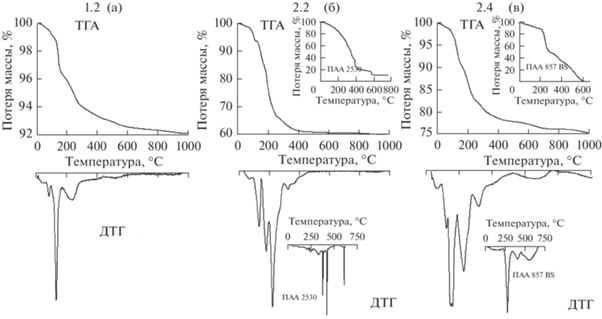
При использовании в качестве осадителя NaOH в образцах 2.2 и 2.4, получение которых осуществлялось в растворах анионного и катионного ПАА, помимо фазы оксида цинка, формируется нестабильная фаза Zn5(OH)8(NO3)2·2Н2O (рис. 4), ступенчатое разложение которой начинается при температуре 95°С (рис. 3).
Рис. 4.
Рентгенограммы образца 2.4, полученного в среде катионного ПАА, до (1) и после (2) термодеструкции.
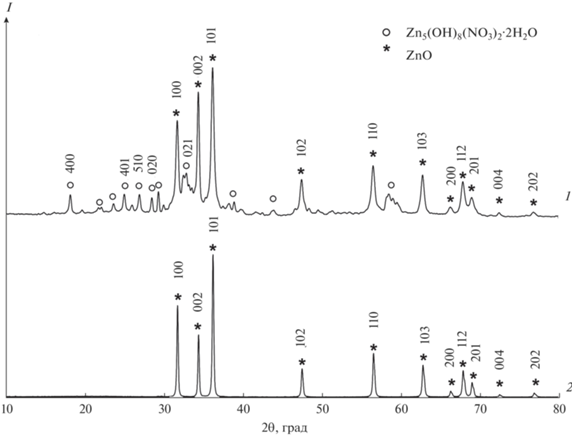
Несмотря на общую схожесть процессов, протекающих в присутствии NaOH при формировании образцов в среде как анионогенного (образец 2.2), так и катионогенного ПАА (образец 2.4), термодеструкция промежуточных соединений с образованием оксида цинка протекает при различных температурах. В случае использования анионогенного ПАА (рис. 3б) температура разложения промежуточного продукта ниже (~450°C), чем при использовании катионогенного (рис. 3в, ~750°C). Размер кристаллитов в образцах 2.2 и 2.4 – 38 и 43.5 нм (табл. 1).
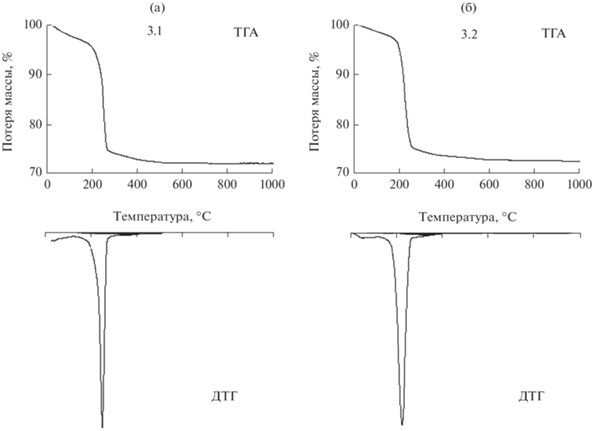
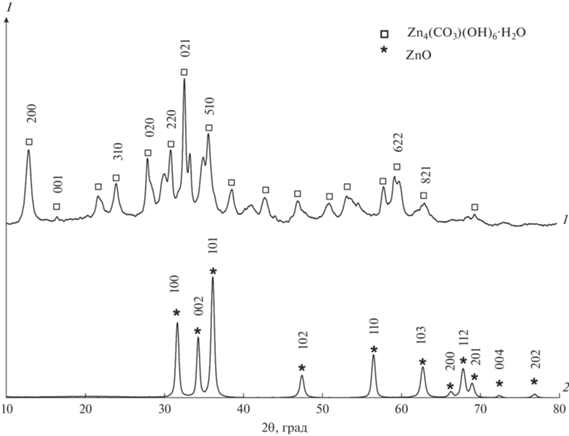
При получении образцов ZnO c использованием в качестве осадителей карбонатов натрия и аммония (3.1, 3.2) промежуточным соединением является гидроксокарбонат цинка Zn4CO3(OH)6·H2O. Термолиз этого соединения протекает одностадийно и сопровождается эндоэффектом (рис. 5):
После прокаливания при температуре 450°С определяется фаза цинкита. Размер кристаллитов промежуточного соединения Zn4CO3(OH)6·H2O при использовании в качестве осадителя карбоната аммония составляет ~20 нм, конечного продукта (ZnO) – ~17 нм. При использовании в качестве осадителя карбоната натрия размер кристаллитов промежуточного и конечного продуктов несколько выше ~24 и 22 нм. Данные РФА представлены на рис. 6 на примере образца 3.1.
С помощью СЭМ определено, что образцы ZnO, полученные методом 1, состоят преимущественно из частиц сферической или овальной формы. При использовании в качестве осадителя NH4OH их размер составляет 70–100 нм, а при осаждении с помощью NaOH – 100–400 нм (рис. 7, образцы 1.1 и 1.2).
Частицы оксида цинка, синтезированные в среде ПАА, имеют форму крупных многогранников (рис. 7, образцы 2.1–2.4), особенно в образце 2.1, полученном в среде анионогенного ПАА при использовании в качестве осадителя раствора аммиака. Самые крупные частицы ZnO (образец 2.1) с размерами ~250–1500 нм имеют форму усеченных шестигранников благодаря процессу аммиачного гидролиза, в результате которого происходит увеличение вязкости растворов вследствие электростатических отталкиваний одноименных зарядов, при этом усиливаются флоккулирующие и структурирующие свойства полимеров [23].
Наиболее дисперсный ZnO синтезирован методом осаждения с применением карбонатов аммония и натрия. Образцы содержат сферические частицы размером до 50 нм (рис. 7, образцы 3.1, 3.2), при этом образец 3.1 состоит преимущественно из частиц диаметром 20–25 нм, имеет удельную поверхность ~98 м2/г и размер кристаллитов ~17 нм (табл. 1).
Для определения влияния размера частиц ZnO на высвобождение Zn2+ в водной среде выбраны два образца – с наименьшим (3.1) и наибольшим (2.1) размером частиц. По результатам исследования определено, что концентрация ионов цинка в фильтрате образца 3.1 с размером частиц ~20 нм составляет 14.1 мг/л, что более чем в 6 раз превышает концентрацию ионов цинка в фильтрате образца 2.1 с размером частиц 250–1500 нм, где концентрация Zn2+ составила 2.2–2.3 мг/л.
ЗАКЛЮЧЕНИЕ
В работе проанализировано влияние природы щелочного агента – NH4OH, NaOH, (NH4)2CO3 и Na2CO3 – на текстурно-структурные свойства образцов оксида цинка, полученных методом осаждения нитрата цинка в водной и полимерных средах с последующей термодеструкцией осадков.
Определено, что при использовании раствора аммиака в качестве осадителя как в водной, так и в полимерных средах продуктом осаждения нитрата цинка является гидратированный нитрат цинка Zn5(OH)8(NO3)2·2Н2O. Показано, что процесс осаждения в среде как анионогенного, так и катионогенного ПАА способствует формированию крупных частиц ZnO шестигранной формы размером до 1500 и 300 нм соответственно. Тогда как при осаждении нитрата цинка аммиаком в водной среде размер частиц после прокаливания промежуточного продукта составил не более 100 нм.
Определено, что при взаимодействии Zn(NO3)2·6H2O с раствором NaOH в водной среде фаза оксида цинка со структурой цинкита определяется уже непосредственно в продукте осаждения. При получении оксида цинка в среде ПАА обеих марок с использованием NaOH в продуктах осаждения наряду с фазой цинкита присутствует Zn5(OH)8(NO3)2·2Н2O. Частицы оксида цинка при получении его в растворах ПАА с использованием NaOH также имеют форму шестигранников размерами 200–400 нм, причем более крупных в случае применения ПАА марки “Праестол 2530”.
Показано, что наилучшие текстурные свойства – высокую удельную поверхность (до 98 м2/г), наименьший размер кристаллитов (~17 нм) и малый размер частиц (~20 нм) – имеет образец, полученный методом термического разложения продуктов взаимодействия нитрата цинка с карбонатом аммония. Установлено, что концентрация ионов цинка при выдержке нитрата цинка в дистиллированной воде более чем в 6 раз превышает концентрацию Zn2+ в фильтрате образца с наибольшим размером частиц, полученного в среде анионного ПАА с использованием раствора аммиака.
Список литературы
Akshaykranth A., Jayarambabu N., Venkatappa Rao T., Rakesh Kumar R., Srinivasa Rao L. Antibacterial Activity Study of ZnO Incorporated Biodegradable Poly (lactic acid) Films for Food Packaging Applications // Polym. Bull. 2022. https://doi.org/10.1007/s00289-022-04126-0
Donga S., Chanda S. Caesalpinia crista Seeds Mediated Green Synthesis of Zinc Oxide Nanoparticles for Antibacterial, Antioxidant, and Anticancer Activities // BioNanoScience. 2022. V. 12. P. 451–462. https://doi.org/10.1007/s12668-022-00952-8
Harini B., Rajeshkumar S., Roy A. Biomedical Application of Chitosan and Piper Longum-Assisted Nano Zinc Oxide-Based Dental Varnish // Appl. Biochem. Biotechnol. 2022. V. 194. № 3. P. 1303–1309. https://doi.org/10.1007/s12010-021-03712-8
Sharma P., Urfan M., Anand R., Sangral M., Hakla H.R., Sharma S., Das R., Pal S., Bhagat M. Green Synthesis of Zinc Oxide Nanoparticles Using Eucalyptus lanceolata Leaf Litter: Characterization, Antimicrobial and Agricultural Efficacy in Maize // Physiol. Mol. Biol. Plants. 2022. V. 26. https://doi.org/10.1007/s12298-022-01136-0
Tabassam L., Khan M.J., Hussain S., Khattak S.A., Shah S.K., Bhatti A.S. Structural, Optical and Antimicrobial Characteristics of ZnO Green Nanoparticles // J. Sol-Gel Sci. Technol. 2022. V. 101. № 2. P. 401–410. https://doi.org/10.1007/s10971-022-05726-y
Kalaiyarasi C., Poonkothai M., Abirami S., Alaguprathana M., Marraiki N., Zaghloul N.S.S. Zinc Oxide Nanoparticles Fabrication Using Moringa oleifera Lam. Seed Extract – Impact on Phytotoxic, Photocatalytic, and Antimicrobial Activities // Appl. Nanosci. 2022. https://doi.org/10.1007/s13204-021-02113-x
Bedi P.S., Kaur A. An Overview on Uses of Zinc Oxide Nanoparticles // World J. Pharm. Pharm. Sci. 2015. V. 4. № 12. P. 1177–1196.
Sirelkhatim A., Mahmud S., Seeni A., Kaus N.H.M., Ann L.C., Bakhori S.K.M., Hasan H., Mohamad D. Review on Zinc Oxide Nanoparticles: Antibacterial Activity and Toxicity Mechanism // Nanomicro Lett. 2015. V. 7. № 3. P. 219–242. https://doi.org/10.1007/s40820-015-0040-x
Vaishnavi A., Sasanka K., Anjali A.K. Comparative Evaluation of Antimicrobial Effects of Silver Nanoparticles with Antimicrobial Properties of Copper and Zinc // Ann. Romanian Soc. Cell Biol. 2021. V. 25. № 3. P. 5915–5928.
Thati V., Roy A.S., Ambika Prasad M.V.N., Shivannavar C.T., Gaddad S.M. Nanostructured Zinc Oxide Enhances the Activity of Antibiotics Against Staphylococcus aureus // J. Biosci. Technol. 2010. V. 1. № 2. P. 64–69.
Mousavi S.M., Behbudi G., Gholami A., Hashemi S.A., Nejad Z.M., Bahrani S., Chiang W.H., Wei L.C., Omidifar N. Shape-Controlled Synthesis of Zinc Nanostructures Mediating Macromolecules for Biomedical Applications // Biomater. Res. 2022. V. 26. https://doi.org/10.1186/s40824-022-00252-y
Mahamuni P.P., Patil P.M., Dhanavade M.J., Badiger M.V., Shadija P.G., Lokhande A.C., Bohara R.A. Synthesis and Characterization of Zinc Oxide Nanoparticles by Using Polyol Chemistry for Their Antimicrobial and Antibiofilm Activity // Biochem. Biophys. Rep. 2019. V. 17. P. 71–80. https://doi.org/10.1016/j.bbrep.2018.11.007
Hasnidawani J.N., Azlina H., Norita H., Bonnia N.N., Ratim S., Ali E.S. Synthesis of ZnO Nanostructures Using Sol-Gel Method // Procedia Chem. 2016. V. 19. P. 211–216. https://doi.org/10.1016/j.proche.2016.03.095
Al Abdullah K., Awad S., Zaraket J., Salame C. Synthesis of ZnO Nanopowders by Using Sol-Gel and Studying Their Structural and Electrical Properties at Different Temperature // Energy Procedia. 2017. V. 119. P. 565–570. https://doi.org/10.1016/j.egypro.2017.07.080
Kumar A. Sol Gel Synthesis of Zinc Oxide Nanoparticles and Their Application as Nano-Composite Electrode Material for Supercapacitor // J. Mol. Struct. 2020. V. 1220. № 128654. https://doi.org/10.1016/j.molstruc.2020.128654
Gerbreders V., Krasovska M., Sledevskis E., Gerbreders A., Mihailova I., Tamanis E., Ogurcovs A. Hydrothermal Synthesis of ZnO Nanostructures with Controllable Morphology Change // CrystEngComm. 2020. V. 22. № 8. P. 1346–1358. https://doi.org/10.1039/c9ce01556f
Djurisic A.B., Chen X.Y., Leung Y.H. Recent Progress in Hydrothermal Synthesis of Zinc Oxide Nanomaterials // Recent Pat. Nanotechnol. 2012. V. 6. № 2. P. 124–134. https://doi.org/10.2174/187221012800270180
Bumajdad A., Madkour M. In situ Growth of ZnO Nanoparticles in Precursor-Insensitive Water-in-Oil Microemulsion as Soft Nanoreactors // Nanoscale Res. Lett. 2015. V. 10. № 1. P. 1–5. https://doi.org/10.1186/s11671-015-0730-9
Akir S., Barras A., Coffinier Y., Bououdina M., Boukherroub R., Omrani A.D. Eco-Friendly Synthesis of ZnO Nanoparticles with Different Morphologies and Their Visible Light Photocatalytic Performance for the Degradation of Rhodamine B // Ceram. Int. 2016. V. 42. № 8. P. 10259–10265. https://doi.org/10.1016/j.ceramint.2016.03.153
Lanje A.S., Sharma S.J., Ningthoujam R., Ahn J., Pode R. Low Temperature Dielectric Studies of Zinc Oxide (ZnO) Nanoparticles Prepared by Precipitation Method // Adv. Powder Technol. 2013. V. 24. № 1. P. 331–335. https://doi.org/10.1016/j.apt.2012.08.005
Pudukudy M., Yaakob Z. Simple Chemical Synthesis of Novel ZnO Nanostructures: Role of Counter Ions // Solid State Sci. 2014. V. 30. P. 78–88. https://doi.org/10.1016/j.solidstatesciences.2014.02.008
Biswick T., Jones W., Pacula A., Serwicka E., Podobinski J. The Role of Anhydrous Zinc Nitrate in the Thermal Decomposition of the Zinc Hydroxy Nitrates Zn5(OH)8(NO3)2·2H2O and ZnOHNO3·H2O // J. Solid State Chem. 2007. V. 180. P. 1171–1179. https://doi.org/10.1016/j.jssc.2007.01.012
Peng Y., Xu A.-W., Deng B., Antonietti M., Cölfen H. Polymer-Controlled Crystallization of Zinc Oxide Hexagonal Nanorings and Disks // J. Phys. Chem. B. 2006. V. 110. № 7. P. 2988–2993. https://doi.org/10.1021/jp056246d
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы