Неорганические материалы, 2022, T. 58, № 2, стр. 200-208
Новый метод синтеза нанокомпозита NbC/C
Е. Г. Ильин 1, *, А. С. Паршаков 1, Е. В. Фатюшина 1, Л. Д. Исхакова 2, Д. Ю. Грызлов 3, Ф. О. Милович 2, 4
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Институт общей физики им. А.М. Прохорова Российской академии наук, Научный центр волоконной оптики
им. Е.М. Дианова
119333 Москва, ул. Вавилова, 38, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119991 Москва, Ленинский пр., 31, стр. 4, Россия
4 Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский пр., 4, Россия
* E-mail: eg_ilin@mail.ru
Поступила в редакцию 23.11.2021
После доработки 06.12.2021
Принята к публикации 07.12.2021
- EDN: IUKOKO
- DOI: 10.31857/S0002337X22020063
Аннотация
Разработан новый метод синтеза нанокомпозита – карбид ниобия в матрице тонкодисперсного углерода (NbC/C) – путем термического разложения твердых продуктов реакции NbCl5 с С2Н2 в органическом растворителе. Прекурсор и нанокомпозит NbС/С изучены методами РФА, СЭМ, ПЭМ и рамановской спектроскопии. Полученный нанокомпозит содержит NbC с размерами кристаллитов до 8 нм в матрице мелкодисперсного углерода, состоящей из аморфной (D) и графитизированной (G) фаз, ID/IG = 1.76. Методом адсорбции/десорбции азота определены средний размер пор композита (3.8 нм), средний объем пор (0.54 см3/г) и удельная поверхность (128 м2/г). Методом РФА изучены промежуточные продукты, образующиеся на стадиях термического разложения при 500, 600, 700, 800 и 900°С.
ВВЕДЕНИЕ
Карбиды dо-переходных металлов IV–VI групп используются в составе высокопрочных тугоплавких материалов и покрытий [1], функциональных материалов и катализаторов [2–8]. Композит на основе наноразмерного карбида молибдена Mo2C и углеродных нанотрубок Mo2C/CNT является катализатором переработки природных масел в смесь жидких углеводородов с высоким октановым числом и низкой температурой замерзания [2], используемых для повышения качества дизельного топлива. Как материал катода Mo2C/CNT повышает эффективность перезаряжаемых Li-аккумуляторных батарей, перспективных для связывания CO2-парникового газа [3]. Нанокомпозиты NbC/C и TaC/C различного состава и морфологии (пленки, нанопроволоки, нановолокна и др.) применяются в различных областях: для создания высокопористых термостойких керамических материалов [1, 4], электродов высокоэнергоемких аккумуляторных батарей и суперконденсаторов [5, 6], в электро- [7] и фотокатализе [8], в солнечной энергетике [9] и фототермической терапии в медицине [6].
Для получения нанокомпозита NbC/C используется ряд методов: золь–гель-синтез [1], карботермический синтез в автоклаве [8, 9], метод электропрядения (electrospinning) ультратонких нитей [5, 10], плазменные методы и лазерная абляция [6, 11]. Путем термического разложения в вакууме продуктов реакции MoCl5 с С2H2 в бензоле – наноразмерных металлорганических кластеров низших хлоридов молибдена в углеводородной матрице [12] – получен нанокомпозит Мо2С/С [13]. Мы полагали, что для синтеза нанокомпозита NbC/C прекурсорами могут быть продукты взаимодействия NbCl5 с С2H2. Ранее [14, 15] они изучались как гетерогенные катализаторы циклотримеризации С2H2 и замещенных алкинов RC≡CR' (R, R' = H, R). Это нестехиометрические мелкодисперсные вещества темно-синего цвета, не растворимые в обычных органических растворителях, легко гидролизующиеся и разлагающиеся при нагревании [15]. Катализатор NbCl2 ± 0.1(Cn ± 1Hn ± 1) (n = 10–12), по данным рентгеновской фотоэлектронной спектроскопии (РФЭС) [16], представляет собой металлорганические комплексы низших хлоридов ниобия в углеводородной матрице. Методом LDI TOF масс-спектрометрии изучить каталитически активные комплексы не удалось, но были идентифицированы не известные ранее кластеры оксохлоридов ниобия [17], образующиеся в результате гидролиза мелкодисперсного образца за время пробоподготовки.
Цель настоящей работы – исследование морфологии продуктов реакции NbCl5 с С2H2 в бензоле, процесса их термического разложения и свойств полученного нанокомпозита NbC/С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы исследования. В качестве исходного компонента использовали NbCl5 “ос. ч.” (LANXIT). С2H2 особой чистоты (марка “А”) пропускали через олеум и склянку Тищенко с Р2О5. Бензол предварительно осушали перегонкой над металлическим Na. Все операции проводили в атмосфере аргона.
Термическое разложение проводили в трубчатой печи, в кварцевом сосуде, под вакуумом 1.33 Па (10–2 мм рт. ст.), в интервале температур 70–1100°C, при нагревании со скоростью 5°С/мин.
Морфологию и состав поверхности изучали на сканирующем электронном микроскопе (СЭМ) NVision40 (Carl Zeiss), имеющем приставку для энергодисперсионного анализа EDX Oxford Instruments (ЦКП ИОНХ РАН), и на просвечивающем электронном микроскопе (ПЭМ) JEM-2010 (JEOL).
Элементный CHNS-анализ выполняли на анализаторе Euro Vector EA 3000 instrument (ЦКП ИОНХ РАН), снабженном металлической хроматографической колонкой длиной 2 м, температура колонки 115°С.
Ниобий определяли в форме Nb2O5 [18].
Рентгенофазовый анализ (РФА) выполнен на рентгеновском дифрактометре Bruker D2 PHASER (CuKα-излучение). Обработку и анализ результатов РФА выполняли, используя программный комплекс DIFFRACplus (EVA и TOPAS 4.2.0.2) (ЦКП НЦВО РАН).
Рамановские спектры снимали при комнатной температуре в геометрии обратного рассеяния на спектрометре Brucker Senterra micro-Raman System (ЦКП ИПТМ РАН). Возбуждение осуществлялось твердотельным лазером (длина волны излучения λexc = 532.0 нм), мощность в точке образца 1 мВ, длительность 2.3 с. Точность определения частоты фононной линии 0.15 см–1.
Удельную поверхность образцов определяли методом низкотемпературной адсорбции/десорбции азота на автоматическом анализаторе Quantachrome Quadrasorb SI (ЦКП ИПХФ РАН), изотермы снимали при температуре жидкого азота (77 К). Образцы нанокомпозита NbC/C дегазировались при 473°C в токе гелия непосредственно перед измерениями. Образцы прекурсора не подвергались дегазации из-за термической нестойкости. На основании полученных данных рассчитывали удельную поверхность по модели Бранауэра–Эммета–Теллера (БЭТ) пятиточечным методом в диапазоне парциальных давлений 0.05–0.25.
Синтез исходного композита. Реакцию NbCl5 с С2Н2 проводили аналогично [16]. NbCl5 растворяли в бензоле при нагревании в атмосфере аргона. Раствор охлаждали до комнатной температуры, отфильтровывали от осадка NbCl5 и пропускали С2H2 со скоростью ~3 л/ч. Через несколько минут исходный красный раствор становился зеленым, что указывало на восстановление ниобия до Nb4+, и наблюдалось выделение HCl. По мере дальнейшего пропускания С2H2 в растворе образовывались темно-синие частицы – комплексы ниобия Nb3+ [15] в виде мелкодисперсной взвеси – и раствор приобретал темно-синий цвет, разогревался и превращался в гель. Температура геля не снижалась, пока продолжалось пропускание С2H2, и, следовательно, темно-синее вещество – катализатор экзотермической реакции циклотримеризации С2H2. Пропускание С2H2 проводили до прекращения выделения HCl. При охлаждении наблюдалось осаждение продуктов реакции. Осадок отделяли от бесцветного маточного раствора, в котором ниобий не был обнаружен, промывали бензолом и высушивали под вакуумом до постоянного веса.
Химический анализ продукта (мaс. %): C – 45.1, Nb – 27.9, H – 3.9, Cl – 21.5. Валовый состав отвечает формуле NbCl2.1C13.4H13.9.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение продуктов реакции NbCl5 с С2Н2 методами РФА, СЭМ и ПЭМ. Согласно результатам СЭМ и ПЭМ, продукты реакции представляют собой нанопорошок агломератов сфероидальных частиц среднего размера 100 нм (рис. 1а, 1б). На поверхности видны белые кристаллы оксохлоридов ниобия, образующиеся вследствие взаимодействия с кислородом и влагой воздуха при подготовке образца. Дифрактограмма (рис. 1в) и электронограмма (вставка на рис. 1б), снятая с плотных участков образца, свидетельствуют об аморфности вещества.
Рис. 1.
Изображения СЭМ (а), ПЭМ (б, д); рентгенограмма (в), рентгеновский эмиссионный спектр (г) исходного нанокомпозита (присутствие линий меди обусловлено тем, что образец помещен на медную сеточку).
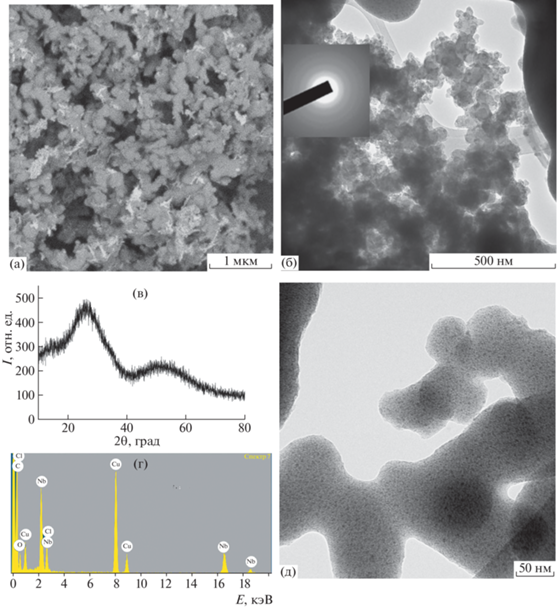
На рентгеновских эмиссионных спектрах (рис. 1г) кроме линий Nb, Cl и C присутствует линия кислорода, количество которого на разных участках образца варьируется от 3 до 9 ат. %.
На ПЭМ-снимке (рис. 1д) темные частицы размером до 3 нм мы отнесли к каталитически-активным металлорганическим комплексам ниобия [16, 19], равномерно распределенным в светлой углеводородной матрице.
Процесс термического разложения исходного продукта. При нагревании прекурсора до 200°C давление в системе не изменялось и, следовательно, газообразные продукты не выделялись (рис. 2).
Рис. 2.
Кривая изменения давления в системе в процессе нагревания исходного нанокомпозита в вакууме 1.33 Па (10–2 мм рт. ст.).
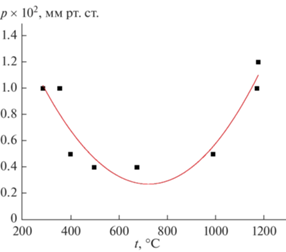
В диапазоне температур 200–500°C вакуум резко падал, что указывало на выделение газообразных продуктов термической деструкции. При нагревании в интервале 500–700°C давление почти не изменялось, что свидетельствовало о продолжении выделения летучих продуктов. Выше 800°C вакуум возрастал, что указывало на замедление и завершение процесса термического разложения.
Методом РФА проведен анализ продуктов, образующихся в ходе процесса термического разложения нескольких исходных образцов при 500, 600, 700, 800, 900 и 1000°С. Результаты для образца 1 приведены на рис. 3.
Рис. 3.
Рентгенограммы твердых продуктов термического разложения исходного нанокомпозита при отжиге от 500 до 1000°С (стрелкой помечена линия NbO2).
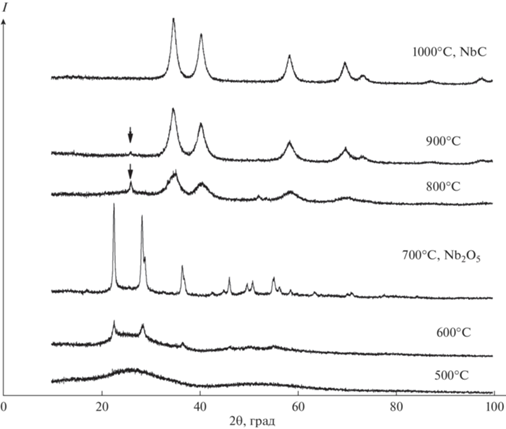
Можно видеть, что до 500°С образец остается рентгеноаморфным. При 600°С начинается образование кристаллического Nb2O5, т.е. наряду с карбонизацией частично протекает гидролиз вследствие попадания следов влаги воздуха на стадиях синтеза и выделения продукта. Образец при 700°С содержит в качестве кристаллической фазы ромбическую модификацию Nb2O5 с уточненными параметрами элементарной ячейки, равными: а = = 6.166(4) Å, b = 29.28(2) Å, c = 3.920(3) Å (пр. гр. Pbam), и является нанопорошком с размерами кристаллитов 28(1) нм.
Повышение температуры до 800°С приводит к почти полной карбидизации Nb2O5 с образованием кубического NbC с параметром элементарной ячейки а = 4.449(4) Å. Размеры кристаллитов NbC в порошке составляют 4(1) нм. Промежуточной фазой образования NbC из Nb2O5 является NbO2 (рис. 3).
При 900°С остаются лишь следовые количества NbO2. Полученный при 1000°С образец представляет собой однофазный нанокристаллический NbC с уточненным параметром кубической ячейки a = = 4.467 (2) Å в смеси с аморфной углеродной фазой. Параметры элементарной ячейки образцов, полученных при 900 и 1000°оС, равны в пределах трехкратной погрешности, размеры кристаллитов – 6(1) и 8(1) нм соответственно.
Сравнение результатов РФА промежуточных продуктов разложения трех исходных образцов показало, что они имеют при тепловой обработке одинаковый состав промежуточных фаз. Различия наблюдались лишь в относительном содержании NbO2 при 700 и 800°C (рис. 4), зависящем от степени гидролиза исходного продукта.
Рис. 4.
Сравнение дифрактограмм промежуточных продуктов термического разложения образцов 1 и 2 при 700°С.
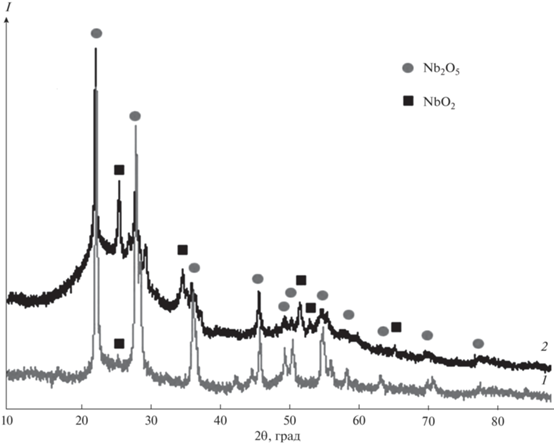
Во всех экспериментах при температуре 1000°С был получен нанокомпозит, содержащий только карбид ниобия и углерод – NbC/C. Частичное образование Nb2O5 при термическом разложении не затрудняет процесс карбонизации прекурсора, поскольку карбонизация Nb2O5 практически завершается при 900°С.
Изучение нанокомпозита NbC/С методами СЭМ, ПЭМ, РФА и рамановской спектроскопии. На рис. 5а, 5б представлены СЭМ-снимки конечного продукта термического разложения при нагревании до 1000°С и выдержке в течение часа. Видно, что образец является гомогенным и состоит из агломератов сфероидальных наночастиц среднего диаметра ~70 нм (рис. 5б), в которых равномерно распределены нанокристаллические частицы с размерами до 10 нм (рис. 5в). Встречались отдельные более крупные нанокристаллические частицы размером до 50 нм. Межплоскостные расстояния, проявляющиеся на электронограмме (рис. 5г), доказывают, что это NbC.
Рис. 5.
СЭМ- (а, б) и ПЭМ- (в) снимки поверхности нанокомпозита NbC/С; г – электронограмма нанокристалла NbC.

Согласно результатам химического анализа, полученный нанокомпозит NbC/С содержит 51.5(±1) мас. % стехиометрического карбида ниобия NbC, а содержание свободного углерода составляет 48.5(±1)%. Для сравнения, в полученном при нагреве до 1500°С нановолокнистом композите NbC/C содержание свободного углерода составляет 20(±1) мас. % [7].
Таким образом, по данным РФА (рис. 6), конечный продукт термического разложения содержит карбид ниобия NbС, кристаллы которого принадлежат к кубической сингонии (пр. гр. F23) Z = 4.
Рис. 6.
Дифрактограммы продукта термического разложения после нагревания в вакууме до 1000°С и выдержке в течение 1 ч и эталонного образца NbC (PDF, Card 38-1364).
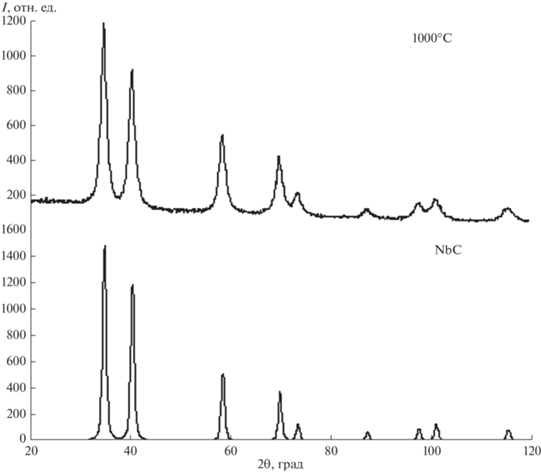
Уточненные параметры элементарных ячеек NbC и средний размер кристаллитов, оцененные по данным РФА, для трех опытов термического разложения исходного нанокомпозита, приведены в табл. 1. Величины размеров кристаллитов NbC рассчитаны по уравнению Шеррера.
Таблица 1.
Рентгенометрические характеристики нанокристаллов NbC в образцах NbC/C
| Образец | Температура термообработки, °C | а, Å | Размер кристаллитов, нм |
|---|---|---|---|
| 1 | 1000 | 4.470(2) | 8(1) |
| 2 | 1000 | 4.440(1) | 15(1) |
| 3 | 1000 | 4.4534(4) | 17(1) |
| 1 | 900 | 4.461(1) | 6(1) |
| 2 | 900 | 4.432(2) | 14(1) |
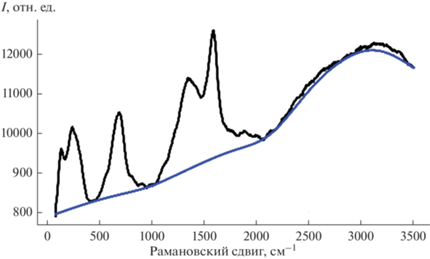
В рамановском спектре полученного нанокомпозита NbC/C (рис. 7) наблюдались четыре интенсивных линии. Две ярко выраженные полосы в интервалах 150–240 и 560–670 см–1 отнесены к акустической (стоксовской) и оптической (антистоксовской) частям фононного спектра [20]. Две перекрывающиеся линии с максимумами при 1380 и 1580 см–1 отвечают аморфному углероду – D-фазе и графитизированному – G-фазе соответственно. D-полоса связана с кристаллическим беспорядком и структурными дефектами графита [21], а G-полоса соответствует валентным колебаниям углерод-углеродных связей в базисной плоскости графита [22]. Соотношение интенсивности линий ID/IG = 1.7 показывает, что относительное содержание аморфной фазы выше, чем кристаллической. Таким образом, на основании данных РФА и рамановской спектроскопии можно заключить, что продукт, полученный в результате термического разложения нового прекурсора, является композитом наноразмерного карбида ниобия в матрице мелкодисперсного углерода NbC/C.
Рис. 7.
Рамановский спектр продукта термического разложения, полученного при нагревании в вакууме до 1000°С и выдержке в течение 1 ч.
Пористость и удельная поверхность нанокомпозита NbC/C. Изотерма адсорбции/десорбции азота полученного NbC/C (рис. 8а) имеет характерный тип изотерм IVa [23].
Рис. 8.
Изотерма адсорбции/десорбции азота при 77 К (а); гистограмма распределения пор по размерам (б); график расчета удельной поверхности полученного нанокомпозита NbC/C (в).
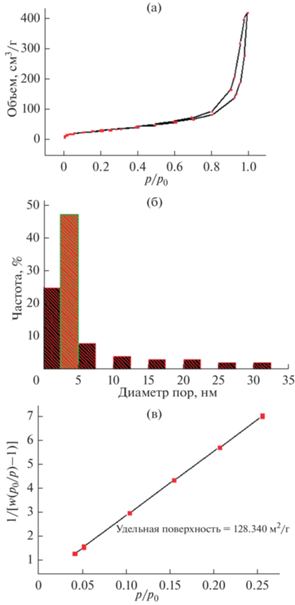
Согласно классификации IUPAC, тип петли гистерезиса H3, поскольку на кривой нет выраженного плато при высоких значениях p/p0, что может быть обусловлено нежесткой природой адсорбента и дестабилизацией конденсата при значении p/p0, близком к единице [24]. Это указывает на полимолекулярную адсорбцию пористого адсорбента с преимущественным преобладанием мезопор (рис. 8б) со средним размером 3.8 нм. Средний объем пор 0.54 см3/г, удельная поверхность SБЭТ составляет 128 м2/г.
ЗАКЛЮЧЕНИЕ
Разработан новый малостадийный метод синтеза нанокомпозита NbC/C с использованием в качестве прекурсора продуктов реакции NbCl5 с С2Н2 в бензоле или другом органическом растворителе. Способ исключает многостадийные процессы золь–гель-синтеза промежуточного оксида ниобия, ступенчатого высушивания, дополнительного введения источников углерода – органических полимеров или фенолформальдегидных смол, он менее энергоемкий благодаря снижению температуры пиролиза до 1000°С. Содержание NbC в полученном нанокомпозите NbC/C – 51.5(±1) мас. %, свободного углерода – 48.5(±1)%. Размер кристаллитов NbC составляет 8(±1) нм. Углеродная матрица композита содержит аморфную и кристаллическую фазы в соотношении ID/IG = 1.7. Средний объем пор нанокомпозита составляет 0.54 cм3/г с преимущественным преобладанием микро- (25%) и мезопор (46%), средний размер пор 3.8 нм, удельная поверхность составляет 128 м2/г.
Характеристики полученного композита NbC/C предполагают возможность его использования как компонента высокопористых теплостойких керамических материалов и покрытий, тонких пленок при создании сенсоров, в катализе и синтезе высоконанопористого углерода для высокомощных суперконденсаторов путем удаления ниобия методом высокотемпературного хлорирования.
Список литературы
Симонов-Емельянов И.Д., Шембель Н.Л., Никишина Е.Е., Лебедева Е.Н., Никитина А.В., Дробот Д.В., Симоненко Е.П., Симоненко Н.П., Севастьянов В.Г., Кузнецов Н.Т. Получение высокопористой керамики NbxTa1 – xC из полимерных композиционных материалов на основе фенолформальдегидного связующего и маловодного гидроксида ниобия-тантала // Неорган. материалы. 2015. Т. 51. № 10. С. 1148–1154. https://doi.org/10.7868/S0002337X15100140
Qin Y., Chen P., Duan J., Han J., Lou H., Zheng X., Hong H. Carbon Nanofibers Supported Molybdenum Carbide Catalysts for Hydrodeoxygenation of Vegetable Oils // RSC Adv. 2013. V. 3. P. 17485–17491. https://doi.org/10.1039/C3RA42434K
Hou Y., Wang J., Liu L., Liu Y., Chou S., Shi D., Liu H., Wu Y., Zhang W., Chen J. Mo2C/CNT: An Efficient Catalyst for Rechargeable Li-CO2 Batteries // Adv. Funct. Mater. 2017. V. 27. P. 1700564(1–8). https://doi.org/10.1002/adfm.201700564
Simonenko E.P., Simonenko N.P., Nagornov I.A. et al. Dependence of the Reactivity of the Finely Divided System Ta2O5–HfO2–C on the Xerogel Carbonization Temperature // Russ. J. Inorg. Chem. 2021. V. 66. № 5. P. 747–754. https://doi.org/10.1134/S003602362105020X
Tolosa A., Kruner B., Fleischman S., Jackel N., Zeiger M., Aslan M., Grobelsek I., Presser V. Niobium Carbide Nanofibers as a Versatile Precursor for High Power Supercapacitor and High Energy Battery Electrodes // J. Mater. Chem. A. 2016. V. 4. № 41. P. 16003–16016. https://doi.org/10.1039/c6ta06224e
Zhang H.M., Liu J., Tian Z.F., Ye Y.X., Cai Y.Y., Liang C.H., Terabe K.A. General Strategy Toward Transition Metal Carbide/Carbon Core/Shell Nanospheres and Their Application for Supercapacitor Electrode // Carbon. 2016. V. 100. P. 590–599. https://doi.org/10.1016/j.carbon.2016.01.047
Nabil Y., Cavaliere S., Harkness I.A., Sharman J.D.B., Jones I.J., Roziere J. Novel Niobium Carbide/Carbon Porous Nanotube Electrocatalyst Supports for Proton Exchange Membrane Fuel Cell Cathodes // J. Power Sources. 2017. V. 363. P. 20–26. https://doi.org/10.1016/j.jpowsour.2017.07.058
Gupta A., Mittal M., Singh M.K., Suib S.L., Pandey O.P. Low Temperature Synthesis of NbC/C Nano-Composites as Visible Light Photoactive Catalyst // Sci. Rep. 2018. V. 8. № 1. P. 13597(1–17). https://doi.org/10.1038/s41598-018-31989-z
Gupta A., Pandey O.P. NbC/C Heterojunction for Efficient Photodegradation of Methylene Blue Under Visible Irradiation // Solar Energy. 2019. V. 183. P. 398–409. https://doi.org/10.1016/j.solener.2019.03.040
Atchison J., Zeiger M., Tolosa A., Funke L.M., Jaeckel N., Presser V. Electrospinning of Ultrafine Metal Oxide/Carbon and Metal Carbide/Carbon Nanocomposite Fibers // RSC Adv. 2015. V. 5. P. 35683–35692. https://doi.org/10.1039/c5ra05409e
Won H.I., Hayk N., Won C.W., Lee H.H. Simple Synthesis of Nano-Sized Refractory Metal Carbides by Combustion Process // J. Mater. Sci. 2011. V. 46. P. 6000–6006. https://doi.org/10.1007/s10853-011-5562-0
Ильин Е.Г., Паршаков А.С., Буряк А.К., Кочубей Д.И., Дробот Д.В., Нефёдов В.И. Наноразмерные кластеры хлоридов молибдена – активные центры в каталитических процессах олигомеризации ацетилена // Докл. РАН. 2009. Т. 427. № 5. С. 641–645.
Ильин Е.Г., Паршаков А.С., Исхакова Л.Д., Бу-ряк А.К., Джавад Оглы А.А. Термическая стабильность и продукты разложения композита MoCl1.9 ± 0.1(C30 ± 1H30 ± 1) // Неорган. материалы. 2014. Т. 51. № 6. С. 681–685. https://doi.org/10.7868/S0002337X14060086
Lachmann G., Plessis J.A.K., Toit C.J. The Role of Niobium(V) Chloride in the Catalytic Cyclotrimerization of Phenylacetylene // J. Mol. Catal. 1987. V. 42. P. 151–159. https://doi.org/10.1016/0304-5102(87)85021-6
Dandliker G. Katalytische Cyclisierung von Acetylen und Substituiertem Acetylen zu Aromatischen Kohlenwasserstoffen // Helv. Chim. Acta. 1969. V. 52. № 6. P. 1482–1487. https://doi.org/10.1002/hlca.19690520608
Ильин Е.Г., Паршаков А.С., Тетерин А.Ю., Маслаков К.И., Тетерин Ю.А. Исследование катализатора циклотримеризации ацетилена NbCl2(CnHn) (n = 10–12) методом рентгеновской фотоэлектронной спектроскопии // Журн. неорган. химии. 2011. Т. 56. № 11. С. 1871–1876.
Ильин Е.Г., Яржемский В.Г., Паршаков А.С., Буряк А.К. Оксохлориды ниобия в газовой фазе. Квантово-химические расчеты структурных параметров и относительной устойчивости изомеров // Журн. неорган. химии. 2013. Т. 58. № 1. С. 41–48. https://doi.org/10.7868/S0044457X1301008X
Гибало И.М. Аналитическая химия ниобия и тантала. М.: Наука, 1967. С. 51.
Cotton F.A., Hall W.T. Reactions of Niobium(III) and Tantalum(III) Compounds with Acetylenes. 4. Polymerization of Internal Acetylenes // Macromolecules. 1981. V. 14. № 2. P. 233–236. https://doi.org/10.1021/ma50003a001
Spengler W., Kaiser R. First and Second Order Raman Scattering in Transition Metal Compounds // Solid State Commun. 1976. V. 18. P. 881–884. https://doi.org/10.1016/0038-1098(76)90228-3
Knight D.S., White W.B. Characterization of Diamond Films by Raman Spectroscopy // J. Mater. Res. 1989. V. 4. P. 385–393. https://doi.org/10.1557/JMR.1989.0385
Nemanich R.J., Solin S.A. First- and Second-Order Raman Scattering from Finite-Size Crystals of Graphite // Phys. Rev. B. 1979. V. 20. № 2. P. 392–401. https://doi.org/10.1103/PhysRevB.20.392
Thommes M., Kaneko K., Neimark A.V., Olivier J.P., Rodriguez-Reinoso F., Rouquerol J., Sing K.S.W. Physisorption of Gases, with Special Reference to the Evaluation of Surface Area and Pore Size Distribution (IUPAC Technical Report) // Pure Appl. Chem. 2015. V. 87. P. 9–10. https://doi.org/10.1515/pac-2014-1117
Sing K.S.W., Williams R.T. Physisorption Hysteresis Loops and the Characterization of Nanoporous Materials // Adsorpt. Sci. Technol. 2004. V. 22. P. 773–782. https://doi.org/10.1260/0263617053499032
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


