Неорганические материалы, 2022, T. 58, № 2, стр. 150-154
Процессы сорбции/десорбции катионов Cu2+ и Ni2+ на аморфных фосфатотитановых сорбентах
Р. И. Корнейков 1, *, В. И. Иваненко 1, С. В. Аксенова 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального исследовательского центра “Кольский научный центр Российской академии наук”
184209 Мурманская обл., Апатиты, Академгородок, 26а, Россия
* E-mail: r.korneikov@ksc.ru
Поступила в редакцию 22.09.2021
После доработки 08.11.2021
Принята к публикации 09.11.2021
- EDN: UXXHWZ
- DOI: 10.31857/S0002337X22020075
Аннотация
На основании полученных результатов сделано предположение о возможном применении гидрофосфатов оксотитана(IV) при сорбционном извлечении из растворов катионов ценных металлов с последующей их десорбцией и концентрированием, одновременной регенерацией фосфатотитанового материала для дальнейшего использования. Изучены и определены условия эффективного протекания процессов десорбции (концентрация десорбирующего реагента, время). Установлено, что при многостадийном применении сорбента происходит снижение эффективности процессов сорбции/десорбции в результате его дегидратации вследствие возникновения стерических затруднений. По мере снижения сорбционных свойств сорбент может быть использован для извлечения микроколичеств катионов высокотоксичных металлов с последующим захоронением.
ВВЕДЕНИЕ
Сорбционные процессы находят широкое применение для решения технологических задач в различных областях промышленности. Так, эти методы применимы для очистки от радионуклидов цезия, стронция, кобальта и других жидких радиоактивных отходов, образующихся на объектах, эксплуатирующих атомные энергетические установки [1–4], для выделения из промышленных стоков высокотоксичных катионов металлов, ценных компонентов, водоподготовки [5–9] и т.д. В качестве сорбентов рекомендованы и используются в настоящее время органические и неорганические матрицы, представленные широким классом соединений [10–12]. Среди предложенных образцов большой практический интерес представляют сорбционные материалы на основе аморфных гидратированных оксогидроксофосфатов титана(IV) с мольным соотношением фосфора к титану ≤1. Такие соединения обладают повышенной устойчивостью в водных средах, узким гранулометрическим составом, обеспечивающим снятие кинетических ограничений в процессе сорбции, высокими емкостными характеристиками, повышенной избирательностью к крупным тяжелым катионам металлов на фоне высоких концентраций более легких и способны обеспечивать надежную иммобилизацию высокотоксичного сорбата в течение длительного времени [13–15]. Несмотря на большое внимание к данным материалaм, в литературе отсутствуют сведения о регенерации отработанного фосфатотитанового соединения после извлечении из растворов ценных компонентов для дальнейшего его использования.
Цель работы заключалась в изучении возможности восстановления отработанного сорбента на основе оксогидроксофосфатов титана(IV) после сорбции ценных катионов металлов, в частности меди и никеля, оптимизации условий регенерации, определении возможной цикличности применения указанных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления рабочих растворов использовали реактивы: TiOSO4·2Н2О “ч.” (ТУ 6-09-01-279-85), Н3РО4 “х. ч.” (ГОСТ 6552-80), CuCl2· · 2Н2О “ч.” (ГОСТ 4167-74), NiCl2·6Н2О “ч.” (ГОСТ 4038-79), LiOH·Н2О имп., HCl “х. ч.” (ГОСТ 3118-77).
Синтез сорбционного фосфатотитанового материала проводили поэтапно. Сначала получали обводненный прекурсор оксогидроксид титана(IV) (TiO(OH)2·nH2O) из раствора сульфата оксотитана(IV) осаждением раствором гидроксида натрия. Далее после отмывки дистиллированной водой и отделения от маточного раствора прекурсор обрабатывали ортофосфорной кислотой с целью замещения ОН--групп TiO(OH)2·nH2O на ${\text{НРО}}_{4}^{{2 - }}.$ Последующая сушка при комнатной температуре фосфатзамещенного образца приводит к формированию рентгеноаморфного целевого продукта [15]. Содержание фосфора в составе синтезированного сорбента определяли фотоколориметрически с молибдатом аммония (фотоэлектроколориметр Leki-1107), титана – атомно-абсорбционным и фотоколориметрическим (с пероксидом водорода) методами.
Соотношение аквалигандов (координационная вода), гидрофосфатных групп (конституционная вода) в исходных, а также в отработанных и регенерированных образцах определяли, сопоставляя данные химического, дифференциального термического (ДТА) и термогравиметрического (ТГА) методов анализа. Для ДТА твердых фаз использовали низкочастотный термографический регистратор НТР-70 с программным нагревательным устройством ПРТ-1000М (эталоном выступал прокаленный оксид алюминия). ТГА проводили с помощью тензорных весов ВТ-1000. Температуру измеряли платина-платинородиевыми термопарами в комплекте с потенциометром ПП-63. Скорость нагрева составляла 10°С/мин в атмосфере воздуха.
Удельную поверхность (Sуд), средний диаметр (d) и объем пор (V) воздушно-сухого исходного, отработанного и регенерированного сорбента определяли методом термической десорбции азота на электронном измерителе удельной поверхности TriStar II 3020 фирмы Micrometritics.
Содержание катионов тяжелых металлов в растворах определяли методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС) на приборе ELAN 9000 DRC-e фирмы Perkin Elmer. Погрешность измерений не превышала 4%.
Процесс сорбции/десорбции на функциональных группах синтезированного материала проводили в статических условиях. Замещение протонов гидрофосфатных групп на катионы меди и никеля осуществляли при значении рН ниже осадкообразования соответствующих металлов [16]. Значения рН контролировали рН-метром “Анион 7000”. Индикаторным электродом служил селективный по отношению к протонам электрод марки ЭСЛ-43-07, вспомогательным – хлорсеребряный электрод Ag/AgCl марки ЭВЛ-1М3.
Рабочего значения рН сорбции катионов металлов достигали введением раствора LiOH. Выбор раствора LiOH обусловлен тем, что катионы Li+ обладают несколько меньшими размерами ионного радиуса (r) по сравнению с радиусами катионов цветных металлов (r (Å) по Полингу): Li+ – 0.60, Cu2+ – 0.70, Ni2+ – 0.69 [16]. Разница в r должна была снизить при сорбции конкуренцию со стороны катионов лития к катионам цветных металлов.
Процессы сорбции и десорбции проводили при интенсивном перемешивании. Степень извлечения катионов тяжелых металлов из растворов (R) рассчитывали согласно уравнению: R = = (Vх/Vисх) × 100%, где Vх – количество извлеченного фосфатотитановой матрицей катиона металла, Vисх – исходное количество катиона металла в аликвоте.
Степень десорбции катионов металлов из отработанного сорбента (F) рассчитывали по уравнению: F = (Адес/Асорб) × 100%, где Адес – количество металла, десорбированного из сорбента в раствор, Асорб – количество металла, сорбированного из исходного раствора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определен химический состав сорбционного образца (мас. %): TiO2 – 34.01, P2O5 – 30.25, H2O – 35.74, которому соответствует полученная при сопоставлении результатов химического анализа, ДТА и ТГА формула TiOНPO4·4.16Н2О. Синтезированный материал подвергали размолу и пропусканию через сито с размером ячеи 0.04 мм. Были определены следующие параметры: Sуд – 13.89 м2/г, d – 19.41 нм, V – 0.06 см3/г.
В работе проведены исследования по десорбции поглощенных сорбентом катионов меди и никеля в зависимости от концентрации десорбирующего реагента в одну стадию, в качестве которого применяли соляную кислоту как протонсодержащий реагент (табл. 1). Предварительно проводили процесс сорбции катионов цветных металлов при их совместном присутствии в растворе на сорбенте состава TiOHPO4⋅4.16H2O при рН ~ 5 в течение 1 ч и отношении жидкой и твердой фаз (Ж : Т), равном 100, который можно описать уравнением
(1)
$S{\text{Н}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{M}}}^{{2 + }}} \leftrightarrow {{{\text{Н}}}^{ + }} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{M}}S,$Таблица 1.
Влияние концентрации НCl на эффективность протекания процесса десорбции Cu2+ и Ni2+ из сорбента (Ж : Т = 100)
| СНCl, моль/л |
Содержание М2+ в растворе, г/л | F, % | ||
|---|---|---|---|---|
| Cu2+ | Ni2+ | Cu2+ | Ni2+ | |
| 0.1 | 0.1380 | 0.1455 | 84.50 | 93.63 |
| 0.3 | 0.1409 | 0.1464 | 86.28 | 94.21 |
| 0.5 | 0.1456 | 0.1481 | 89.16 | 95.30 |
| 0.8 | 0.1509 | 0.1532 | 92.41 | 98.6 |
Из табл. 1 видно, что с повышением концентрации соляной кислоты степень десорбции из сорбционного материала увеличивается, что связано с усилением конкурентной способности ионов водорода в отношении катионов металла, смещая уравнение реакции
(2)
${1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{M}}S + {{{\text{Н}}}^{ + }} \leftrightarrow S{\text{Н}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{M}}}^{2}}^{ + }$в сторону регенерации фосфатотитанового материала. Более полно процесс десорбции идет в случае катионов никеля по сравнению с медью, что может быть обусловлено разницей в r: ионный радиус Ni2+ несколько меньше по сравнению с Cu2+. Фосфатотитановые сорбенты на основе гидрофосфатов титана обладают бóльшим сродством к более крупным катионам металлов, образуя более прочную химическую связь.
Оптимальной является соляная кислота с полумолярной концентрацией. В таких условиях достигается достаточно высокая степень десорбции по обоим катионам металлов и создается менее кислотная агрессивная среда, в которой фосфатотитановые сорбенты очень устойчивы [13].
На рис. 1 представлены результаты изучения процесса десорбции катионов меди и никеля из титанофосфатной матрицы во времени. Видно, что характер кривых идентичен, но на начальном этапе процесса десорбция никеля протекает интенсивнее, чем меди, что, возможно, обусловлено несколько пониженным сродством матрицы к катионам Ni2+ вследствие их меньшего радиуса. Тем не менее, в течение получаса степень десорбции по обоим катионам превышает 90%.
Рис. 1.
Десорбция во времени катионов меди и никеля из фосфатотитанового сорбента в 0.5 М НСl при Ж : Т = 100.
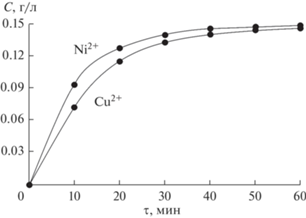
Для оценки возможного многократного использования сорбентов на основе гидрофосфатов оксотитана при извлечении из растворов ценных компонентов в работе исследованы многостадийные процессы сорбции и десорбции катионов меди и никеля на указанных материалах. Для этого, как и в предыдущем эксперименте, после каждой стадии сорбции отработанный насыщенный катионами цветных металлов сорбент отделяли от раствора фильтрованием (фильтрат анализировали на остаточное содержание металлов), промывали на фильтре дистиллированной водой и количественно переводили в 0.5 М раствор HCl. После проведения процесса десорбции регенерированный образец также отделяли фильтрованием, промывали на фильтре и сушили при комнатной температуре. Фильтрат анализировали на количественное содержание катионов металлов. После сушки образец помещали в исходный раствор, содержащий катионы цветных металлов, и повторяли операции (табл. 2).
Таблица 2.
Ионообменная активность сорбента на основе гидрофосфата оксотитана(IV) в отношении Cu2+ и Ni2+ в зависимости от цикличности использования
| Стадия | Процесс | Содержание М2+ в растворе, г/л | R, % | F, % | |||
|---|---|---|---|---|---|---|---|
| Cu2+ | Ni2+ | Cu2+ | Ni2+ | Cu2+ | Ni2+ | ||
| 1 | Сорбция | 0.000065 | 0.0061 | 99.96 | 96.22 | – | – |
| Десорбция | 0.1456 | 0.1481 | – | – | 89.16 | 95.30 | |
| 2 | Сорбция | 0.0188 | 0.0271 | 88.49 | 83.22 | – | – |
| Десорбция | 0.1203 | 0.1220 | – | – | 83.20 | 90.77 | |
| 3 | Сорбция | 0.0392 | 0.0444 | 76.00 | 72.50 | – | – |
| Десорбция | 0.0943 | 0.0981 | – | – | 75.93 | 83.77 | |
Из табл. 2 видно, что на первой стадии эффективно протекают процессы сорбции и десорбции по обоим катионам металлов. Однако на последующих стадиях эффективность сорбции суммарно снижается на ~24%, десорбции – на 11–13%. На 2- и 3-й стадиях большее сродство матрицы к катионам меди по сравнению с катионами никеля сохраняется.
Для определения причины снижения эффективности протекания процессов сорбции и десорбции в работе проводили оценку “обводненности” (содержания координационной воды) воздушно-сухого отработанного образца после каждого цикла сорбции/десорбции (табл. 3), т. к. наблюдалось снижение сорбционных характеристик сорбентов на основе гидрофосфатов оксотитана(IV) при их дегидратации [17]. Видно, что после каждого цикла происходит дегидратация (потеря координационной воды) сорбционного материала, результатом чего, вероятно, и является снижение на последующих стадиях интенсивности процессов сорбции и десорбции. Полученные результаты позволяют сделать заключение о том, что дегидратация сорбента приводит к уменьшению размера пор, о чем свидетельствуют определенные после третьего цикла физические параметры: V = 0.045 см3/г, Sуд = = 16.89 м2/г и d = 15.26 нм, и вследствие этого нарушению процесса катионного замещения, связанного с изоляцией отдельных сорбционных центров. В результате при диффузии катионов металла в глубь сорбента возникают стерические затруднения. Кроме того, в снижение эффективности процессов сорбции/десорбции, хоть и несущественно, вносят вклад недесорбированные из образца катионы металлов, занимающие вакантные места в функциональных группах.
Таблица 3.
Дегидратация фосфатотитанового сорбента при цикличности использования в процессе сорбции/десорбции катионов Cu2+ и Ni2+
| Стадия | 0 | 1 | 2 | 3 | |
|---|---|---|---|---|---|
| Н2О в составе сорбента | мас. % | 35.74 | 32.85 | 29.14 | 24.59 |
| моли | 4.16 | 3.82 | 3.39 | 2.86 | |
Таким образом, показана возможность использования сорбционных материалов на основе гидрофосфатов оксотитана(IV) для извлечения из технологических растворов ценных компонентов с последующим их концентрированием при десорбции и одновременной регенерацией рабочего материала.
ЗАКЛЮЧЕНИЕ
Эксперименты по возможному применению материалов на основе гидрофосфатов оксотитана(IV) для сорбционного извлечения из промышленных растворов катионов ценных металлов с последующей их десорбцией и концентрированием показали, что процесс десорбции катионов металлов из отработанной сорбционной матрицы протекает достаточно интенсивно. Определена оптимальная и эффективная концентрация десорбирующего реагента, в качестве которого использовали 0.5 М HCl.
Показано, что с каждым последующим циклом происходит некоторое снижение эффективности процессов сорбции и десорбции, что обусловлено дегидратацией сорбционной матрицы, в результате чего возникают стерические затруднения при диффузии катионов металлов в глубь сорбента. По мере “истощения” (существенного снижения) ионообменных свойств сорбента в процессе извлечения из растворов ценных компонентов с последующим их концентрированием при десорбции регенерированный материал можно использовать для сорбционного выделения микроколичеств катионов высокотоксичных металлов с последующим захоронением отработанной ионообменной матрицы после термической обработки.
БЛАГОДАРНОСТЬ
Исследования выполнены при финансовой поддержке Российского научного фонда (РНФ) в рамках научного проекта № 17-19-01522-П.
Список литературы
Abdel-Karima A.M., Zaki A.A., Elwana W., El-Naggar M.R., Gouda M.M. Experimental and Modeling Investigations of Cesium and Strontium Adsorption onto Clay of Radioactive Waste Disposal // Appl. Clay Sci. 2016. № 132–133. P. 391–401.
Mansy M.S., Hassana R.S., Selima Y.T., Kenawy S.H. Evaluation of Synthetic Aluminum Silicate modified by Magnesia for the Removal of 137Cs, 60Co and 152+154Eu from Low-Level Radioactive Waste // Appl. Radiat. Isot. 2017. № 130. P. 198–205.
Чувелева Э.А., Харитонов О.В., Фирсова Л.А. Сорбция РЗЭ и ТПЭ на сильнокислотном сульфокатионите КУ-2 из азотнокислых сред // Радиохимия. 1994. Т. 36. № 5. С. 410–413.
Омельчук В.В., Стахив М.Р., Савкин А.Е., Федеров Д.А., Корнев В.И. Разработка технологии и переработка кубовых остатков на Кольской АЭС // Безопасность окружающей среды. 2007. № 3. С. 34–37.
Moyo M., Chikazaza L., Nyamunda B.C., Guyo U. Adsorption Batch Studies on the Removal of Pb(II) Using Maize Tassel Based activated Carbon // J. Chem. 2013. V. 2013. P. 508934. https://doi.org/10.1155/2013/508934
Qian J., Zeng Z., Xue W., Guo Q. Lead Removal from Aqueous Solutions by 732 Cation-Exchange Resin // Can. J. Chem. Eng. 2016. V. 94. № 1. P. 142–150. https://doi.org/10.1002/cjce.22363
Jain M., Garg V., Kadirvelu K., Sillanpää M. Adsorption of Heavy Metals from Multimetal Aqueous Solution by Sunflower Plant Biomass-Based Carbons // Int. J. Environ. Sci. Technol. 2016. V. 13. № 2. P. 493–500. https://doi.org/10.1007/s13762-015-0875-1
Lakherwal D. Adsorption of Heavy Metals: a Review // Int. J. Environ. Res. Dev. 2014. V.4. № 1. P. 41–48.
Тимофеев К.Л., Набойченко С.С., Лебедь А.Б., Акулич Л.Ф. Сорбционная технология извлечения цветных металлов из шахтных вод // Металлургия цветных металлов. 2012. № 6. С. 7–10.
Тростянская Е.Б. Ионообменные смолы (иониты) // Ионный обмен и его применение. М. 1959. С. 11–83.
Ярославцев А.Б. Ионный обмен на неорганических сорбентах // Успехи химии. 1997. Т. 66. № 7. С. 641–660.
Бобкова Л.А., Козик В.В., Одностронцева Т.В., Петрова В.В. Избирательность сорбции ионов кобальта(II), никеля(II), меди(II) макросетчатым карбоксильным катионитом КБ-2Э из водно-солевых растворов щелочных металлов // Журн. прикл. химии. 2012. Т. 85. № 7. С. 1084–1089.
Корнейков Р.И., Аксенова С.В., Иваненко В.И., Локшин Э.П. Устойчивость оксогидрофосфатов титана(IV) в водных средах // Неорган. материалы. 2018. Т. 54. № 7. С. 727–732. https://doi.org/10.7868/S0002337X18070126
Корнейков Р.И., Иваненко В.И. Извлечение катионов цезия и стронция из растворов ионитами на основе фосфатов титана(IV) // Неорган. материалы. 2020. Т. 56. № 5. С. 528–532. https://doi.org/10.31857/S0002337X20050085
Иваненко В.И., Корнейков Р.И., Локшин Э.П. Иммобилизация катионов металлов титанофосфатными сорбентами // Радиохимия. 2016. Т. 58. № 2. С. 140–146.
Краткий справочник по химии / Под ред. Куриленко О.Д. Киев: Наукова думка, 1965. 835 с.
Корнейков Р.И. Синтез и свойства сорбционных материалов на основе оксогидроксофосфатов титана(IV): Автореф. дис. … канд. техн. наук. Апатиты, 2009. 23 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


