Неорганические материалы, 2022, T. 58, № 3, стр. 264-270
Кинетика фазового перехода α → γ в железе различного изотопного состава
Ю. С. Белозеров 1, *, А. Д. Плехович 1, О. Ю. Трошин 1, А. Д. Буланов 1, А. М. Кутьин 1, Ю. П. Кириллов 1
1 Институт химии высокочистых веществ им. Г.Г. Девятых Российской академии наук
603951 Нижний Новгород, ул. Тропинина, 49, БОКС-75, Россия
* E-mail: belozerov@ihps-nnov.ru
Поступила в редакцию 27.11.2021
После доработки 09.01.2022
Принята к публикации 10.01.2022
- EDN: GWVFMZ
- DOI: 10.31857/S0002337X22030022
Аннотация
Для образцов железа природного изотопного состава (natFe) и обогащенного по изотопам 56Fe, 57Fe методом дифференциальной сканирующей калориметрии установлено влияние изотопного состава на температуру и кинетику фазового перехода α → γ, найдены количественные зависимости кинетических параметров фазового перехода от параметра изотопического беспорядка. Представлена температурно-временная зависимость доли образующейся γ-фазы при α → γ-переходе.
ВВЕДЕНИЕ
В материалах, состоящих из различных изотопов одного и того же элемента, наблюдаются изотопные эффекты, связанные с различием физических и физико-химических свойств и обусловленные различием масс изотопов. Например, различие в удельных зарядах ионов, в давлениях насыщенного пара, в коэффициентах диффузии и термодиффузии, теплоемкости, теплопроводности, теплотах испарения и плавления, температурах кипения, плавления, фазовых переходов обусловливает термодинамический изотопный эффект; различие в скоростях протекания химических реакций изотопных соединений приводит к кинетическому изотопному эффекту. Железо природного изотопного состава содержит 5.845% изотопа 54Fe, 91.754% 56Fe, 2.119% 57Fe, 0.282% 58Fe. Методом газового центрифугирования получены все стабильные изотопы железа с изотопной чистотой не менее 99.9% [1]. По сравнению с легкими элементами – водородом и гелием, для которых изотопные эффекты проявляются наиболее ярко, относительное различие изотопов железа мало, тем не менее изотопные эффекты можно заметить.
Физические свойства твердых веществ в той или иной степени зависят от изотопного состава. Вследствие случайного распределения различных изотопов в кристаллической решетке вещества образуются дефекты, приводящие к изотопическому беспорядку [2, 3], который количественно характеризуется параметром изотопического беспорядка
(1)
$g = \sum\limits_i {{{с}_{i}}} {{\left( {\frac{{\Delta {{M}_{i}}}}{{{{M}_{{{\text{ср}}}}}}}} \right)}^{2}},$В литературе найдены немногочисленные сведения о различии свойств изотопов железа, несмотря на то что железо и его сплавы являются самыми распространенными металлическими конструкционными материалами. В [10] изучались процессы окисления образцов железа естественного изотопного состава и обогащенного изотопом 57Fe (95.1%). Содержание кислорода на поверхности 57Fe оказалось ниже предела обнаружения метода, в то время как в образцах природного железа оно составило 10–13%. Вероятной причиной различий процессов окисления авторы [10] связывают с различием спинов магнитных моментов ядер изотопов 56Fe и 57Fe [11].
В железе природного изотопного состава при нагревании происходит фазовый α → γ-переход, при котором изменяется тип кристаллической решетки с объемноцентрированного кубического (ОЦК, α-фаза) на гранецентрированный кубический (ГЦК, γ-фаза). Фазовый переход происходит при температуре 910–917°С [12]. В зависимости от скорости нагрева образование γ-фазы происходит по-разному [13].
Фазовый α → γ-переход в обычном железе, содержащем 99.89 мас. % основного вещества, изучался методом дифференциальной сканирующей калориметрии (ДСК) [14, 15]. Получены значения начала и окончания пика α → γ-перехода, равные 894.6°С (884.1°С) и 917.8°С соответственно.
Цель настоящей работы – установить и количественно охарактеризовать проявления изотопии железа при фазовом α → γ-переходе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходного материала для изготовления образцов изотопно обогащенного 56Fe использовали порошок железа производства ПО “Электрохимический завод” (г. Зеленогорск). Образцы железа природного изотопного состава изготавливались из карбонильного железа марки ВК (восстановленное карбонильное) производства ООО “Синтез-ПКЖ” (г. Дзержинск). Образцы железа, обогащенные по изотопу 57Fe, предоставлены Всероссийским научно-исследовательским институтом метрологической службы.
Из порошков natFe и 56Fe прессовали таблетки диаметром 10, толщиной 5 мм со средней плотностью 5.6 г/см3. Таблетки natFe и 56Fe переплавляли в вакуумной электродуговой печи С-3443 производства Опытного завода ГИРЕДМЕТ (Россия). Из полученных слитков методом электроэрозионной резки изготовляли компактные образцы заданной формы, которые затем подвергали отжигу в токе сухого водорода марки “Б” (чистота 99.9999%).
Содержание примесей в образцах после отжига контролировалось методом лазерной масс-спектрометрии с использованием установки ЭМАЛ-2 (табл. 1).
Таблица 1.
Содержание примесей элементов в образцах железа natFe, 56Fe и 57Fe после отжига
| Элемент | С, мас. % | Элемент | С, мас. % | ||||
|---|---|---|---|---|---|---|---|
| natFe | 56Fe | 57Fe | natFe | 56Fe | 57Fe | ||
| C | ≤5 × 10–2 | 8 × 10–3 | 2 × 10–3 | K | <1 × 10–4 | <1 × 10–3 | 2 × 10–4 |
| N | ≤1 × 10–2 | – | – | Ca | 3 × 10–4 | 7 × 10–3 | 4 × 10–4 |
| O | 0.3 | 0.2 | 2 × 10–2 | Ti | <4 × 10–4 | <2 × 10–4 | 1 × 10–3 |
| Mg | 2 × 10–4 | <4 × 10–4 | <3 × 10–4 | Cr | 1 × 10–3 | <1 × 10–3 | 2 × 10–3 |
| Al | – | 2 × 10–4 | 1 × 10–4 | Mn | <2 × 10–4 | <1 × 10–3 | <2 × 10–4 |
| Si | 0.5 | 3 × 10–3 | 1.5 × 10–3 | Co | <1 × 10–4 | 8 × 10–4 | <2 × 10–4 |
| P | 4 × 10–2 | 1 × 10–2 | <3 × 10–4 | Ni | 5 × 10–2 | 6 × 10–2 | 8 × 10–4 |
| S | – | 1 × 10–3 | 1 × 10–3 | Cu | 5 × 10–3 | 1.3 | 2 × 10–2 |
| Cl | 2 × 10–4 | 3 × 10–4 | <8 × 10–4 | Zn | 5 × 10–3 | <1 × 10–3 | 2 × 10–3 |
Отметим, что примеси кислорода, кремния и меди сконцентрированы преимущественно на поверхности образцов и не могут оказывать влияние на температуру фазового превращения.
В табл. 2 приведены данные об изотопном составе образцов по результатам масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС), а также рассчитанные средние молярные массы и параметры изотопического беспорядка.
Таблица 2.
Изотопный состав образцов железа, использованных в измерениях
| Изотоп | ci, % | Mср | g | |||
|---|---|---|---|---|---|---|
| 54Fe | 56Fe | 57Fe | 58Fe | |||
| natFe | 5.845 | 91.754 | 2.119 | 0.282 | 55.910 | 8.258 × 10–5 |
| 56Fe | 0.004 | 99.945 | 0.040 | 0.011 | 56.001 | 3.188 × 10–7 |
| 57Fe | 0.010 | 3.632 | 90.954 | 5.404 | 57.017 | 2.797 × 10–5 |
Из отожженных образцов железа при помощи вальцовочного оборудования была изготовлена фольга толщиной 0.3 мм для определения температуры фазового α → γ-перехода. При анализе использовались предварительно отожженные корундовые тигли как достаточно термостойкие и химически инертные к металлическому железу.
Термический анализ выполнялся на синхронном термоанализаторе STA 409 PCLuxx фирмы Netzsch при скоростях нагревания 15, 10 и 5 К/мин в потоке аргона 80 мл/мин. Регистрация пиков фазового перехода α → γ проводилась не менее трех раз для образца каждого изотопного состава. Полученные ДСК-кривые были обработаны при помощи программного обеспечения Netzsch Proteus Analysis. Калибровку прибора по температуре проводили по образцу железа природного изотопного состава, опираясь на приведенное в [16] значение температуры фазового перехода 911°С.
МЕТОДИКА ОБРАБОТКИ ДСК-ПИКОВ ФАЗОВОГО ПЕРЕХОДА
Сигнал в приборах “ДСК теплового потока” принимается [17] пропорциональным удельному тепловому потоку $\frac{{d{{Q}_{m}}}}{{dt}}{\text{:}}$
где Qm – удельная теплота (Дж/кг), С – калибровочный коэффициент (В с/Дж), t – время (с). При фазовом переходе α → γ текущая теплота m0Qm, идущая на нагревание (охлаждение) исследуемого образца массой m0 (кг), равна текущей энтальпии процесса фазового перехода, взятой с обратным знакомЕсли фазовый переход α → γ представить как квазихимическую реакцию A → A*, где А – начальная α-фаза, А* – конечная γ-фаза, то текущую энтальпию квазихимического процесса можно выразить через текущую молярную координату ξ (моли) и энтальпию образования γ-фазы (Дж/моль) [18]:
Для α → γ-перехода молярная координата ξ = = χn0 = χm0/M, где n0 – количество вещества в начальной α-фазе (моли), χ – мольная доля новой образующейся фазы, M – молярная масса образца (кг/моль). С учетом приведенных соотношений сигнал ДСК-прибора (2) будет равен
где QrM = –ΔrH/M.Температурно-временная зависимость степени превращения одной фазы в другую представлена в модели Джонсона–Мейла–Аврами – упрощенной теории Колмогорова–Джонсона–Мейла [19–21]:
где τ = kt, k = Aexp(–Ea/(RT)) – константа скорости фазового перехода в аррениусовской форме, A – предэкспоненциальный множитель, Ea – энергия активации, n – параметр Аврами. В дифференциальной форме выражение (6) записывается какАвторами [22, 23] показано, что точность полуэмпирической модели кристаллизации Ерофеева [24] для обработки ДСК-пиков выше в сравнении с моделью Джонсона–Мейла–Аврами, особенно на участке пика, отвечающего за заключительную стадию процесса. В дифференциальном виде соотношение для этой модели записывается как
Однако, поскольку уравнение (8) не имеет аналитически выраженного решения χ(t, Т), численная обработка результатов эксперимента и учет неизотермичности ДСК-измерений затруднены, в связи с чем предсказательные возможности этой модели весьма ограничены. Помимо этого, неявный физический смысл параметров a и b, а также характер эффективной константы скорости kэф значительно усложняют теоретически обоснованное описание механизма процесса.
При разложении в ряд множителя в (7), отвечающего за начальную стадию процесса (χ < 0.5), имеем
Используя (9) и введя в последний сомножитель (8) параметр p, отвечающий за описание заключительной стадии процесса, получим
(10)
$\frac{{d\chi }}{{dt}} = kn{{\chi }^{{1 - {{n}^{{ - 1}}}}}}{{(1 - {{\chi }^{{{{p}^{{ - 1}}}}}})}^{{1 + p{{n}^{{ - 1}}}}}}.$Дифференциальное уравнение (10) имеет аналитическое решение:
(11)
$\chi (t,T) = \frac{1}{{{{{\left( {1 + {1 \mathord{\left/ {\vphantom {1 {{{\tau }^{{{\text{n}}{{{\text{p}}}^{{ - 1}}}}}}}}} \right. \kern-0em} {{{\tau }^{{{\text{n}}{{{\text{p}}}^{{ - 1}}}}}}}}} \right)}}^{p}}}}.$Сопоставляя формулы (6) и (11), отметим, что определение температурно-временной зависимости χ (t, Т) только через произведение τ = kt с входящими в k параметрами уравнения Аррениуса позволяет сохранить важность параметра n при установлении механизма кристаллизации. Выражение (10) раскрывает смысл параметров a и b модели (8), эффективной константы скорости kэф = kn, а параметр p в сравнении с моделью Джонсона–Мейла–Аврами [21] позволяет более корректно обрабатывать окончание ДСК-пика.
Уравнение (11) описывает кинетику изотермического процесса. В ДСК-приборах температура образца обычно меняется линейно в зависимости от времени t:
где T0 – температура начала проявления пика фазового перехода на кривой ДСК (К), β – скорость изменения температуры (К/с). Продифференцировав выражение (11), с учетом (12) получим(13)
$\frac{{d\chi }}{{dt}} = \chi _{\tau }^{'}\tau _{t}^{'} = \chi _{\tau }^{'}k\left( {1 + \frac{{(T - {{T}_{0}})\theta }}{{{{T}^{2}}}}} \right),$Единственное отличие выражения (13) от (10) заключается в сомножителе в скобках. Обозначив
получим выражение, аналогичное (10):
(15)
$\frac{{d\chi }}{{dt}} = \bar {k}n{{\chi }^{{1 - {{n}^{{ - 1}}}}}}{{\left( {1 - {{\chi }^{{{{p}^{{ - 1}}}}}}} \right)}^{{1 + p{{n}^{{ - 1}}}}}}.$Выражение (14) позволяет выразить т. н. неизотермическую константу скорости ͞k через ее изотермический аналог k. Это дает возможность определять кинетические параметры фазового перехода, входящие в уравнение Аррениуса: энергию активации и предэкспоненциальный множитель.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены экспериментальные и теоретические ДСК-кривые α → γ-перехода железа природного изотопного состава и изотопно-обогащенных 56Fe и 57Fe. В интервале 900–920°С наблюдаются пики, соответствующие фазовому переходу ОЦК–ГЦК. Можно отметить, что пики, полученные для образцов 56Fe и 57Fe, заметно смещены влево относительно пика natFe. Температуру фазового перехода определяли пересечением касательной переднего фронта пика с линией основания пика. Стандартная обработка пиков осуществлялась с помощью программы Netzsch Software Proteus. Результаты представлены в табл. 3.
Рис. 1.
Данные ДСК-сигнала (значки) для железа различного изотопного состава: natFe (а), 56Fe (б), 57Fe (в) при разных скоростях нагревания и рассчитанные по уравнениям (2), (11), (14), (15) соответствующие кривые фазовых переходов.
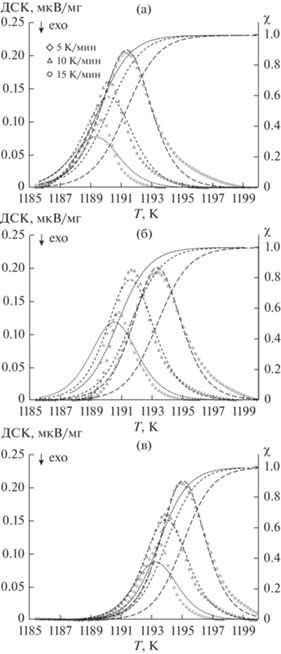
Таблица 3.
Температура фазового перехода α → γ для образцов железа различного изотопного состава при разных скоростях нагревания
| Образец | Температура фазового перехода, К | ||
|---|---|---|---|
| 5 K/мин | 10 K/мин | 15 K/мин | |
| 56Fe | 907.1 ± 0.7 | 907.0 ± 0.5 | 906.9 ± 0.5 |
| 57Fe | 909.5 ± 0.6 | 908.9 ± 0.6 | 909.2 ± 0.7 |
| natFe | 910.6 ± 0.2 | 910.8 ± 0.7 | 911.7 ± 0.8 |
При теоретических расчетах использовались значения вспомогательных (Т0, CQm) и модельных (Ea, A, n, p) параметров. Значения кинетических параметров находились нелинейной регрессией со стандартными процедурами минимизации среднеквадратичного отклонения расчетных и экспериментальных данных. Вычисленные значения параметров приведены в табл. 4.
Таблица 4.
Кинетические параметры модели фазового перехода α → γ для образцов железа различного изотопного состава
| Образец | Ea, кДж/моль |
s = lnA [с–1] | n | p | Т0, К | CQm*, мкВ с/мг | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 5 К/мин | 10 К/мин | 15 К/мин | 5 К/мин | 10 К/мин | 15 К/мин | |||||
| 56Fe | 4564.6 | 454.02 | 2.14 | 0.86 | 1039.3 | 974.0 | 985.5 | 3.96 | 3.55 | 3.60 |
| 57Fe | 5396.1 | 537.39 | 2.11 | 1.00 | 1002.2 | 960.2 | 1037.7 | 5.80 | 4.49 | 3.29 |
| natFe | 6294.0 | 626.79 | 1.95 | 1.00 | 1029.1 | 965.8 | 1004.0 | 4.02 | 3.49 | 3.23 |
Используя найденные значения кинетических параметров (табл. 4) и значения параметра изотопического беспорядка g (табл. 2) для железа различного изотопного состава, можно построить зависимости этих параметров от величины параметра изотопического беспорядка (рис. 2) и дать соответствующие интерполяционные формулы:
Рис. 2.
Зависимости кинетических параметров фазового перехода α → γ в железе от величины изотопического беспорядка g.
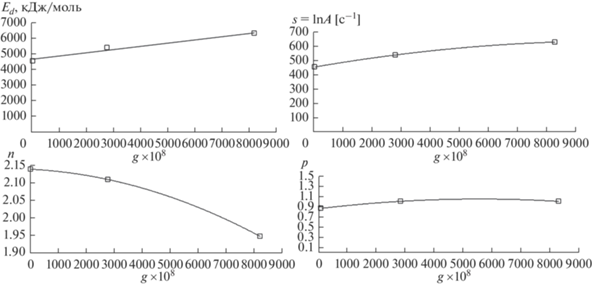
В наибольшей степени влияние изотопного состава проявляется в изменении энергии активации и предэкспоненциального множителя константы скорости, которые в совокупности определяют температуру интенсивного зародышеобразования. В несколько меньшей степени от величины изотопического беспорядка зависят степенные параметры n и p, поскольку даже более значимый из них параметр n характеризует лишь соотношение возникающих и уже существующих зародышей роста.
Поскольку в предложенной методике учитывается зависимость степени превращения α-фазы в γ-фазу не только от времени, но и от температуры, то, используя кинетические параметры фазового перехода, полученные по данной методике, можно получить температурно-временную зависимость степени превращения χ(t, T) и рассчитать изотермическую константу скорости k.
Изотермические константы скорости определяли по формуле k = Aexp(–Ea/(RT)). Они соответствуют сечению ТТТ-диаграммы (рис. 3) поверхностью постоянной температуры. На рис. 4 приводится зависимость константы скорости фазового перехода железа от величины изотопического беспорядка при средних температурах протекания процесса.
Рис. 3.
ТТТ (Time-Temperature-Transition)-диаграмма фазового перехода α → γ для образца железа, обогащенного по изотопу 56Fe.
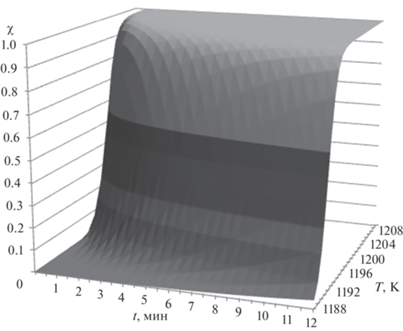
Рис. 4.
Зависимость изотермической константы скорости фазового перехода от параметра изотопического беспорядка при Т = 1194.5 К.
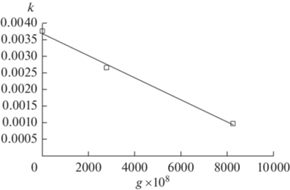
Из рис. 4 видно, что скорость процесса снижается с уменьшением однородности изотопного состава. Предположительно, это связано с тем, что случайное распределение различных изотопов в решетке отрицательно сказывается на однородности кристаллической структуры, что в свою очередь препятствует распространению температурного поля по объему образца.
ЗАКЛЮЧЕНИЕ
Аналогия механизмов фазового перехода и кристаллизации позволяет использовать известные модели процессов кристаллизации для получения новых дополнительных данных по кинетике фазовых переходов.
Методом ДСК экспериментально установлена зависимость температуры фазового α → γ-перехода железа от изотопного состава. С помощью оригинальной методики обработки ДСК-пиков найдена зависимость кинетических параметров и константы скорости фазового перехода от изотопного состава железа.
Таким образом, изотопное поведение температуры фазового перехода подтверждается кинетическим проявлением изотопии (кинетический изотопный эффект) в зависимости от параметра изотопического беспорядка.
Список литературы
http://www.ecp.ru Сайт ПО ЭХЗ (дата обращения: 18.11.2021).
Изотопы / Под ред. Баранова В.Ю. М.: Физматлит, 2005. Т. 2. 728 с.
Жернов А.П., Инюшкин А.В. Влияние композиции изотопов на фононные моды. Статические атомные смещения в кристаллах // Успехи физ. наук. 2001. Т. 171. № 8. С. 827–854. https://doi.org/10.3367/UFNr.0171.200108b.0827
Geballe T.H., Hull G.W. Isotopic and Other Types of Thermal Resistance in Germanium // Phys. Rev. 1958. V. 110. № 3. P. 773–775. https://doi.org/10.1103/PhysRev.110.773
Bigeleisen J., Lee M.W., Mandel F. Equilibrium Isotope Effects // Annu. Rev. Phys. Chem. 1973. V. 24. P. 407–440. https://doi.org/10.1146/annurev.pc.24.100173.002203
Schnelle W., Gmelin E. Heat Capacity of Germanium Crystals with Various Isotopic Composition // J. Phys.: Condens. Matter. 2001. V. 13. № 27. P. 6087–6094. https://doi.org/10.1088/0953-8984/13/27/303
Жернов А.П. Влияние изотопического беспорядка на теплопроводность германия в области максимума // Физика твердого тела. 1999. Т. 41. № 7. С. 1185–1189.
Инюшкин А.В., Талденков А.В., Гусев А.В., Гибин А.М., Гавва В.А., Козырев Е.А. Теплопроводность моноизотопного монокристаллического 29Si в интервале температур 2.4–410 К // Физика твердого тела. 2013. Т. 55. № 1. С. 202–206.
Bulatov A.S., Kovtun G.P., Klochko V.S., Korniets A.V., Solopikhin D.A., Shcherban’ A.P. Longitudal Ultrasound Velocity and Attenuation in Isotopically Enriched Cadmium // Metallophys. Adv. Technol. 2018. V. 40. № 11. P. 1465–1473. https://doi.org/10.15407/mfint.40.11.1465
Балдохин Ю.В., Перфильев Ю.Д., Куликов Л.А., Бурназян М.А. Окисление железа с разным содержанием изотопов // Вестн. МГУ. Сер. 2. Химия. 2015. Т. 56. № 2. С. 91–97.
Ludwig G.W., Woodbury H.H. Magnetic Moment of 57Fe // Phys. Rev. 1960. V. 117. № 5. P. 1286–1287. https://doi.org/10.1103/PhysRev.117.1286
Жеребцов Д.А., Арчугов С.А., Михайлов Г.Г. Фазовые переходы железа // Изв. Челябинского науч. центра. 2000. Т. 1. № 6. С. 17–19.
Хомская И.В. Фазовые и структурные превращения в сплавах на основе железа и меди при интенсивных ударно-волновых и деформационных воздействиях: Дис. … докт. техн. наук. Екатеринбург, 2014. 296 с.
Žaludová M., Smetana B., Zlá S., Dobrovská J. Study of Temperatures of Phase Transformations of Fe-based Metallic Systems in the Temperature Range below 1000°C // Proc. of 19th Int. Conf. on Metallurgy and Materials. Roznov nad Radhostem. 2010. P. 86–92.
Miettinen J. Solidification Analysis Package for Steels-User’s Manual of DOS version. Laboratory of Metallurgy. Helsinki University of Technology. 1999.
Chase M.W., Jr. NIST-JANAF Themochemical Tables. Fourth Edition // J. Phys. Chem. Ref. Data. 1998. № 9. P. 1–1951.
Borchardt H.J., Daniels F. The Application of Differential Thermal Analysis to the Study of Reaction Kinetics // J. Am. Chem. Soc. 1957. P. 79. https://doi.org/10.1021/ja01558a009
Пригожин И.Р., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур; пер. с англ. Данилова Ю.А. и Белого В.В. М.: Мир, 2002. 461 с.
Колмогоров А.Н. К статистической теории кристаллизации металлов // Изв. АН СССР. Сер. математическая. 1937. Т. 1. № 3. С. 355–359.
Johnson W.A., Mehl R.F. Reaction Kinetics in Processes of Nucleation and Growth // Trans. AIME. 1939. V. 135. P. 416.
Беленький В.З. Геометрико-вероятностные модели кристаллизации. М.: Наука, 1980. 88 с.
Šesták. J., Berggren G. The Study of the Kinetics of Mechanism of Solid-State Reactions at Increasing Temperature // Thermochim. Acta. 1971. V. 3. № 1. P. 1–12. https://doi.org/10.1016/0040-6031(71)85051-7
Málek J., Zmrhalová Z., Barták J., Honcová P. A Novel Method to Study Crystallization of Glasses // Thermochim. Acta. 2010. V. 511. № 1–2. P. 67–73. https://doi.org/10.1016/j.tca.2010.07.026
Янг Д. Кинетика разложения твердых веществ; пер. с англ. Печерской К.А. / Под ред. Ерофеева Б.В. М.: Мир, 1969. 264 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


